九年级下册实验活动8粗盐中难溶性杂质的去除同步练习(含解析答案)
文档属性
| 名称 | 九年级下册实验活动8粗盐中难溶性杂质的去除同步练习(含解析答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 44.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-08 00:00:00 | ||
图片预览




文档简介
实验活动8 粗盐中难溶性杂质的去除
一、单选题
1.???小吴在“粗盐提纯”实验考核时,完成了系列操作,如下几步操作中老师只给了一步正确的分,这一步是( )
?过滤时玻璃棒靠在单层滤纸的一边????????????????????????????????????????
B.?过滤时用玻璃棒对漏斗中液体搅拌????????????????????????????????????????
C.?蒸发时对蒸发皿中的液体搅拌????????????????????????????????????????
D.?蒸发时等到全部水蒸发完后再停止加热
2.???关于海水晒盐原理的分析,正确的是( )
A.?利用阳光照射使海水升温得到食盐????????????????????????????????????????
B.?利用阳光和风力将水分蒸发得到食盐????????????????????????????????????????
C.?利用机械动力搅拌得到食盐????????????????????????????????????????
D.?利用海水在阳光下发生分解反应制得食盐
3.???食盐的主要成分是NaCl,是重要的调味品,同学们熟悉的“配制一定质量分数的NaCl溶液”和“粗盐中难溶性杂质去除”这两个与NaCl有关的实验中均不需用到的玻璃仪器是( )
A.?玻璃棒???????????????????????B.?烧杯???????????????????????C.?漏斗??????????????????????D.?试管
4.???下列有关物质的除杂、鉴别所用的操作方法不正确的是( )
选项
实验目的
操作方法
A
除去粗盐中的泥沙
加水溶解、过滤、洗涤、干燥
B
除去氧气中少量的水蒸气
通过盛有浓硫酸的洗气瓶
C
鉴别空气、氧气、二氧化碳
分别伸入燃着的小木条
D
鉴别氮肥(NH4Cl)和钾肥(KCl)
加熟石灰混合、研磨、闻气味
A.?A????????????????????????B.?B???????????????????????C.?C???????????????????????D.?D
5.???下列依据实验目的设计的实验方法错误的是( )
选项
实验目的
实验方法
A
鉴别氮气和二氧化碳
滴加澄清石灰水,观察现象
B
鉴别羊毛和腈纶
在空气中灼烧,观察现象,闻气味
C
除去铜粉中少量的铁粉
加入适量的稀硫酸,过滤
D
除去粗盐中的难溶性杂质
将粗盐研碎、溶解、蒸发
A.?A???????????????????????B.?B???????????????????????C.?C???????????????????????D.?D
6.???在“一定质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中,下列说法错误的是( )
A.?溶液配制步骤包括计算、称量、溶解、装瓶贴签
B.?两个实验中都需要玻璃仪器有烧杯、玻璃棒
C.?在粗盐提纯中蒸发时,有大量固体析出时就停止加热,用余热蒸干
D.?配制溶液时,量取水时仰视读数会导致溶质的质量分数偏大
7.???分离、提纯除杂、鉴别是化学实验的重要手段,下列实验设计不能达到实验目的的是( )
选项
实验目的
实验设计
A
将粗盐中混有的泥沙分离
溶解、过滤、蒸发
B
鉴别硬水和软水
用肥皂水
C
除去MgCl2溶液中的少量MgSO4
加过量的BaCl2溶液,过滤
D
鉴别CaCO3、NaOH、NaCl、NHNO3四种固体
加水,观察
A.?A???????????????????????B.?B???????????????????????C.?C???????????????????????D.?D
8.???在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途错误的是( )
A.?溶解时搅拌,加速散热????????????????????????????????????????
B.?过滤时引流,防液滴飞溅????????????????????????????????????????
C.?蒸发时搅拌,防止因局部温度过高,造成液滴飞溅????????????????????????????????????????
D.?为计算产率,称量精盐前,把精盐固体转移到纸上
二、填空题
9.???在粗盐提纯中,要多次用到的玻璃仪器是______;将氯化钠溶液蒸发至有较多量固体析出后,应______,并用玻棒不断搅拌,利用余热将余下溶液蒸发至干。
10.???为除去粗盐水中MgCl2、CaCl2、Na2SO4可溶性杂质,依次加入的物质(过量)是NaOH、BaCl2、Na2CO3等溶液,过滤后滤液中的溶质为______;其中加入氢氧化钠溶液的作用是______。
11.???除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作是①加过量的Na2CO3溶液:②向滤液中加适量的稀盐酸;③过滤;④加过量的Ba(OH)2溶液。
(1)以上操作合理的先后顺序为______(数字序号不能重复使用)。
(2)上述操作中涉及的复分解反应共有______个。
(3)加入过量Na2CO3溶液的目的是除去溶液中的______(写物质化学式)。
三、简答题
12.???过滤是除去液体中混有固体物质的一种方法。
(1)准备过滤器时,先取一张圆形滤纸______。
A.直接轻轻地压入漏斗内
B.对折一次后放入漏斗内
C.对折两次后放入漏斗内
(2)过滤是粗盐提纯实验中的操作步骤之一,在各操作步骤中,都要使用的仪器是______。
13.???我市某学校科学实验考查操作。请回答此实验操作相关问题:
(1)粗盐提纯的过程是______、过滤、蒸发。
(2)实验室要配制100克溶质质量分数为15%的硝酸钾溶液,会导致所得溶液溶质质量分数偏小的选项有哪些?______。
A.硝酸钾中有杂质
B.称量时使用了生锈的砝码
C.用量筒量取水时,仰视读数
D.配制完成后移取液体时有部分溅出。
四、探究题
14.???通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐。粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
20℃时,一些物质的溶解度
OH-
CO32-
Na+
溶
溶
Ca2+
微
不
Mg2+
不
微
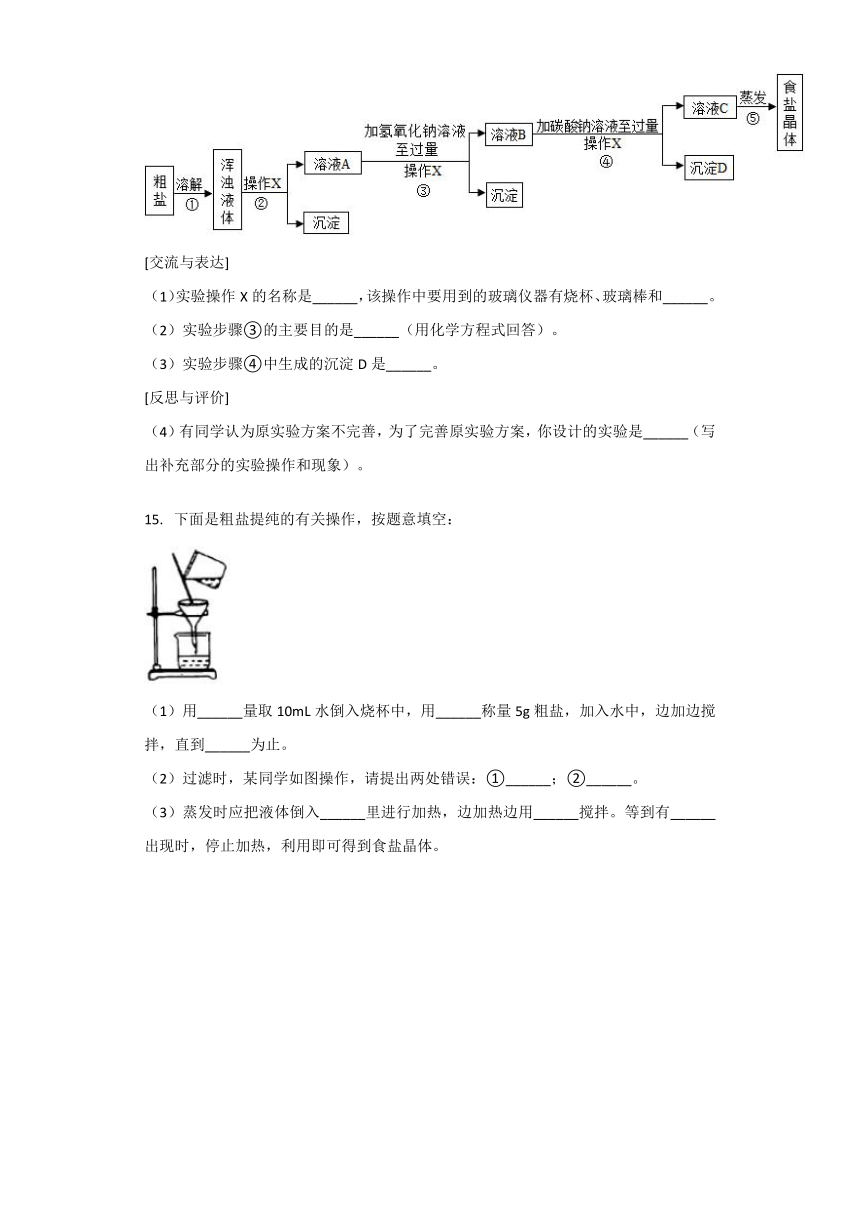
[实验方案]某同学为了提纯粗盐,设计了如图所示实验方案并进行实验。
[交流与表达]
(1)实验操作X的名称是______,该操作中要用到的玻璃仪器有烧杯、玻璃棒和______。
(2)实验步骤③的主要目的是______(用化学方程式回答)。
(3)实验步骤④中生成的沉淀D是______。
[反思与评价]
(4)有同学认为原实验方案不完善,为了完善原实验方案,你设计的实验是______(写出补充部分的实验操作和现象)。
???下面是粗盐提纯的有关操作,按题意填空:
(1)用______量取10mL水倒入烧杯中,用______称量5g粗盐,加入水中,边加边搅拌,直到______为止。
(2)过滤时,某同学如图操作,请提出两处错误:①______;②______。
(3)蒸发时应把液体倒入______里进行加热,边加热边用______搅拌。等到有______出现时,停止加热,利用即可得到食盐晶体。
实验活动8 粗盐中难溶性杂质的去除
【答案】
1.??C???????2.??B???????3.??D???????4.??A???????5.??D???????
6.??D???????7.??C???????8.??A???????
9.??玻璃棒? 停止加热???????
10.??氯化钠、氢氧化钠、碳酸钠? 除去溶液中的氯化镁???????
11.??④①③②? 6? CaCl2、BaCl2、Ba(OH)2???????
12.??C? 玻璃棒???????
13.??溶解? AC???????
14.??过滤? 漏斗? MgCl2+2NaOH═Mg(OH)2↓+2NaCl? 碳酸钙? 向溶液C中加入足量稀盐酸,产生气泡???????
15.??10mL的量筒? 托盘天平? 食盐不再继续溶解? 滤纸超过了漏斗的边缘? 漏斗下端没有轻靠在烧杯内壁上? 蒸发皿? 玻璃棒? 较多固体???????
【解析】
1.??
解:A.过滤时玻璃棒靠在三层滤纸的一边,故错误;
B.过滤时,应沿着玻璃棒倒入待过滤的液体,不能用玻璃棒对漏斗中液体搅拌,故错误;
C.蒸发时对蒸发皿中的液体搅拌使液体受热均匀,防止局部受热过高造成液滴飞溅,故正确;
D.蒸发时等到蒸发皿中出现较多量晶体时即可停止加热,依靠蒸发皿的余热即可将水分蒸干,故错误。
故选:C。
根据过滤操作的注意事项以及蒸发结晶的注意事项来分析。
要想解答好这类题目,首先,要理解和熟记氯化钠与粗盐提纯等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。
2.??
解:A、氯化钠的溶解度受温度变化影响不大,且随温度升高而变大,升温不会使食盐析出,所以A错。
B、一般来说,对于任何溶质,蒸发溶剂的方法都能使溶质析出,所以B对。
C、搅拌不会影响氯化钠的溶解性,与食盐是否析出无关,所以C错。
D、海水是混合物,食盐从中析出不是化学变化,不是分解反应,所以D错。
故选:B。
根据食盐的溶解度受温度影响的情况去分析,通过对比得出合理答案.
正确理解溶解度的含义以及其影响因素,了解结晶的常见方法,是解题的关键.溶解度知识是溶液部分的重点,也是重要考点.
3.??
解:粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),溶解中所需仪器是烧杯、玻璃棒,过滤操作所需仪器是烧杯、玻璃棒、漏斗、铁架台,蒸发操作所需仪器是蒸发皿、烧杯、玻璃棒、酒精灯。
配制一定质量分数的NaCl溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒。
这两个与NaCl有关的实验中均不需用到的玻璃仪器是试管。
故选:D。
根据粗盐提纯的原理、配制一定质量分数的NaCl溶液的实验步骤,进行分析判断。
本题难度不大,掌握粗盐提纯的原理与配制一定溶质质量分数的溶液的实验步骤、所需的仪器是正确解答本题的关键。
4.??
解:A、粗盐的主要成分是氯化钠,除去粗盐中的泥沙利用的原理是:氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,不用洗涤、干燥,故选项所采取的方法错误,故符合题意;
B、浓硫酸有吸水性,且不与氧气反应,因此,用于除去氧气中少量的水蒸气,故选项所采取的方法正确,故不符合题意;
C、将燃烧的小木条伸入瓶中,木条燃烧无明显变化的气体为空气;木条燃烧更旺的气体为氧气;木条熄灭的气体为二氧化碳气体,现象明显,选项鉴别方案可行,故不符合题意;
D、NH4Cl加熟石灰研磨后产生有刺激性气味的气体,KCl加熟石灰研磨后无明显气味,用加熟石灰研磨后闻气味的方法可以鉴别,故不符合题意,故选:A。
A、氯化钠易溶于水,泥沙不溶于酸;
B、浓硫酸能够吸收水蒸气;
C、氧气能够支持燃烧解,二氧化碳不支持燃烧;
D、氢氧化钙和氯化铵反应生成氯化钙、水和氨气,氨气有刺激性气味。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
5.??
解:A、二氧化碳能使澄清石灰水变浑浊,氮气不能,可以鉴别,故选项实验目的设计的实验方法正确。
B、在空气中灼烧,产生烧焦羽毛气味的是羊毛,产生特殊气味的是腈纶;羊毛纤维燃烧后灰烬较多,羊毛纤维接近火焰时先蜷缩,燃烧灰烬为带有光泽的硬块,用手指轻轻挤压就变成粉末;而腈纶接近火焰时迅速蜷缩,燃烧比较缓慢,趁热可拉成丝,灰烬为灰褐色玻璃球状,不易破碎;故选项实验目的设计的实验方法正确。
C、铁粉能与稀硫酸反应生成硫酸亚铁溶液和氢气,铜粉不能与稀硫酸反应,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验目的设计的实验方法正确。
D、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),故选项实验目的设计的实验方法错误。
故选:D。
除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
6.??
解:A、配制一定质量分数的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶贴签,故选项说法正确。
B、“一定质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中均有溶解操作,都需要玻璃仪器有烧杯、玻璃棒,故选项说法正确。
C、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故选项说法正确。
D、用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项说法错误。
故选:D。
A、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
B、根据两个实验所需的仪器,进行分析判断。
C、根据蒸发操作中停止加热的时机,进行分析判断。
D、用量筒量取水时,仰视液面,读数比实际液体体积小,进行分析判断。
本题难度不大,明确粗盐提纯的实验步骤、配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、注意事项是正确解答本题的关键。
7.??
解:A、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,故选项实验设计能达到实验目的。
B、区分硬水和软水,通常用肥皂水鉴别。取等量的样品,加等量的肥皂水,振荡,观察现象,产生泡沫较多,则是软水,若产生泡沫较少,则是硬水,故选项实验设计能达到实验目的。
C、MgSO4能与过量的BaCl2溶液反应生成硫酸钡沉淀和氯化镁,能除去杂质但引入了新的杂质BaCl2(过量的),不符合除杂原则,故选项实验设计不能达到实验目的。
D、碳酸钙难溶于水,氢氧化钠溶于水放热,使温度升高,硝酸铵溶于水吸热,使温度降低,氯化钠溶于水温度几乎无变化,可以鉴别,故选项实验设计能达到实验目的。
故选:C。
A、根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析判断。
B、根据硬水和软水的区别在于所含的钙镁离子的多少,进行分析判断。
C、除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
D、鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
8.??
解:A、溶解时搅拌,加快溶解速率,故选项说法错误。
B、过滤时玻璃棒的作用是引流,防止液滴飞溅,故选项说法正确。
C、蒸发时玻璃棒的作用是搅拌,防止因局部温度过高,造成液滴飞溅,故选项说法正确。
D、为计算产率,称量精盐前,把精盐固体转移到纸上,玻璃棒的作用是转移,故选项说法正确。
故选:A。
根据溶解、过滤、蒸发、转移中玻璃棒的作用,进行分析判断。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、玻璃棒的作用是正确解答本题的关键。
9.??
解:粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒起到搅拌,加快粗盐的溶解速率的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒的作用搅拌,防止局部温度过高,造成液滴飞溅。
将氯化钠溶液蒸发至有较多量固体析出后,应停止加热,利用余热将剩余液体蒸干
故答案为:
玻璃棒;停止加热。
根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析解答。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器、注意事项等是正确解答本题的关键。
10.??
解:氯化钡和硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,氢氧化钠和氯化镁溶液反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,过滤后滤液中的溶质为氯化钠、氢氧化钠、碳酸钠。
其中加入氢氧化钠溶液的作用是除去溶液中的氯化镁。
故答案为:
氯化钠、氢氧化钠、碳酸钠;除去溶液中的氯化镁。
氢氧化钠和氯化镁溶液反应生成氢氧化镁沉淀和氯化钠,氯化钡和硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
11.??
解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,所以正确的顺序为:④①③②。
(2)Ba(OH)2溶液和硫酸钠溶液反应生成硫酸钡沉淀和氢氧化钠,Ba(OH)2溶液和氯化镁溶液反应生成氢氧化镁沉淀和氯化钡,碳酸钠和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,所发生的复分解反应共有6个。
(3)加入过量Na2CO3溶液的目的是除去溶液中的CaCl2、BaCl2、Ba(OH)2。
故答案为:
(1)④①③②;
(2)6;
(3)CaCl2、BaCl2、Ba(OH)2。
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
12.??
解:(1)过滤液体时,注意“一贴、二低、三靠”的原则,准备过滤器时,先取一张圆形滤纸对折两次后放入漏斗内。
(2)在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒起到搅拌,加快粗盐的溶解速率的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒的作用搅拌,防止局部温度过高,造成液滴飞溅。
故答案为:
(1)C;
(2)玻璃棒。
(1)根据过滤液体时,注意“一贴、二低、三靠”的原则,进行分析解答。
(2)根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析解答。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器是正确解答本题的关键。
13.??
解:(1)粗盐提纯的步骤是溶解、过滤、蒸发;
(2)A、硝酸钾中有杂质,会导致称量的硝酸钾的质量偏小,则使溶质质量分数偏小,故选项正确;
B、称量时使用了生锈的砝码,会影响溶质的质量,使溶质质量变大,因此使溶质质量分数变大,故选项错误;
C、用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确;
D、溶液具有均一性,配制完成后移取液体时有部分溅出,溶质质量分数不变,故选项错误;
故答案为:(1)溶解;(2)AC。
(1)根据粗盐提纯的步骤进行解答;
(2)溶质质量分数变小,则可能是溶质质量偏小或溶剂质量偏大,可以分析出可能造成这两个方面错误的原因进行分析解答。
本题有一定难度,明确配制一定溶质质量分数的溶液实验步骤、导致溶质质量分数变小的因素(可能是溶质质量偏小或溶剂质量偏大)是正确解答本题的关键。
14.??
解:(1)实验操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
故填:过滤;漏斗。
(2)实验步骤③的主要目的是除去氯化镁,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl。
故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl。
(3)实验步骤④中生成的沉淀D是氯化钙和碳酸钠反应生成的碳酸钙。
故填:碳酸钙。
(4)设计的实验:向溶液C中加入足量稀盐酸,产生气泡,是因为加入稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。
故填:向溶液C中加入足量稀盐酸,产生气泡。
(1)过滤能够除去不溶于水的物质,过滤时要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(2)氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠。
(3)氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠。
(4)稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。
合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础。
15.??
解:(1)用10mL的量筒量取10mL水倒入烧杯中,用托盘天平称量5g粗盐,加入水中,边加边搅拌,直到食盐不再继续溶解为止。
(2)过滤液体时,注意“一贴、二低、三靠”的原则,图中滤纸超过了漏斗的边缘、漏斗下端没有轻靠在烧杯内壁上。
(3)蒸发时应把液体倒入蒸发皿里进行加热,边加热边用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅;待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干。
故答案为:
(1)10mL的量筒;托盘天平;食盐不再继续溶解;
(2)①滤纸超过了漏斗的边缘;②漏斗下端没有轻靠在烧杯内壁上;
(3)蒸发皿;玻璃棒;较多固体。
(1)根据量取一定量液体的方法、称量药品的方法,进行分析解答。
(2)过滤液体时,注意“一贴、二低、三靠”的原则,进行分析解答。
(3)根据蒸发操作的方法、注意事项进行分析解答。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器、注意事项是正确解答本题的关键。
一、单选题
1.???小吴在“粗盐提纯”实验考核时,完成了系列操作,如下几步操作中老师只给了一步正确的分,这一步是( )
?过滤时玻璃棒靠在单层滤纸的一边????????????????????????????????????????
B.?过滤时用玻璃棒对漏斗中液体搅拌????????????????????????????????????????
C.?蒸发时对蒸发皿中的液体搅拌????????????????????????????????????????
D.?蒸发时等到全部水蒸发完后再停止加热
2.???关于海水晒盐原理的分析,正确的是( )
A.?利用阳光照射使海水升温得到食盐????????????????????????????????????????
B.?利用阳光和风力将水分蒸发得到食盐????????????????????????????????????????
C.?利用机械动力搅拌得到食盐????????????????????????????????????????
D.?利用海水在阳光下发生分解反应制得食盐
3.???食盐的主要成分是NaCl,是重要的调味品,同学们熟悉的“配制一定质量分数的NaCl溶液”和“粗盐中难溶性杂质去除”这两个与NaCl有关的实验中均不需用到的玻璃仪器是( )
A.?玻璃棒???????????????????????B.?烧杯???????????????????????C.?漏斗??????????????????????D.?试管
4.???下列有关物质的除杂、鉴别所用的操作方法不正确的是( )
选项
实验目的
操作方法
A
除去粗盐中的泥沙
加水溶解、过滤、洗涤、干燥
B
除去氧气中少量的水蒸气
通过盛有浓硫酸的洗气瓶
C
鉴别空气、氧气、二氧化碳
分别伸入燃着的小木条
D
鉴别氮肥(NH4Cl)和钾肥(KCl)
加熟石灰混合、研磨、闻气味
A.?A????????????????????????B.?B???????????????????????C.?C???????????????????????D.?D
5.???下列依据实验目的设计的实验方法错误的是( )
选项
实验目的
实验方法
A
鉴别氮气和二氧化碳
滴加澄清石灰水,观察现象
B
鉴别羊毛和腈纶
在空气中灼烧,观察现象,闻气味
C
除去铜粉中少量的铁粉
加入适量的稀硫酸,过滤
D
除去粗盐中的难溶性杂质
将粗盐研碎、溶解、蒸发
A.?A???????????????????????B.?B???????????????????????C.?C???????????????????????D.?D
6.???在“一定质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中,下列说法错误的是( )
A.?溶液配制步骤包括计算、称量、溶解、装瓶贴签
B.?两个实验中都需要玻璃仪器有烧杯、玻璃棒
C.?在粗盐提纯中蒸发时,有大量固体析出时就停止加热,用余热蒸干
D.?配制溶液时,量取水时仰视读数会导致溶质的质量分数偏大
7.???分离、提纯除杂、鉴别是化学实验的重要手段,下列实验设计不能达到实验目的的是( )
选项
实验目的
实验设计
A
将粗盐中混有的泥沙分离
溶解、过滤、蒸发
B
鉴别硬水和软水
用肥皂水
C
除去MgCl2溶液中的少量MgSO4
加过量的BaCl2溶液,过滤
D
鉴别CaCO3、NaOH、NaCl、NHNO3四种固体
加水,观察
A.?A???????????????????????B.?B???????????????????????C.?C???????????????????????D.?D
8.???在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途错误的是( )
A.?溶解时搅拌,加速散热????????????????????????????????????????
B.?过滤时引流,防液滴飞溅????????????????????????????????????????
C.?蒸发时搅拌,防止因局部温度过高,造成液滴飞溅????????????????????????????????????????
D.?为计算产率,称量精盐前,把精盐固体转移到纸上
二、填空题
9.???在粗盐提纯中,要多次用到的玻璃仪器是______;将氯化钠溶液蒸发至有较多量固体析出后,应______,并用玻棒不断搅拌,利用余热将余下溶液蒸发至干。
10.???为除去粗盐水中MgCl2、CaCl2、Na2SO4可溶性杂质,依次加入的物质(过量)是NaOH、BaCl2、Na2CO3等溶液,过滤后滤液中的溶质为______;其中加入氢氧化钠溶液的作用是______。
11.???除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作是①加过量的Na2CO3溶液:②向滤液中加适量的稀盐酸;③过滤;④加过量的Ba(OH)2溶液。
(1)以上操作合理的先后顺序为______(数字序号不能重复使用)。
(2)上述操作中涉及的复分解反应共有______个。
(3)加入过量Na2CO3溶液的目的是除去溶液中的______(写物质化学式)。
三、简答题
12.???过滤是除去液体中混有固体物质的一种方法。
(1)准备过滤器时,先取一张圆形滤纸______。
A.直接轻轻地压入漏斗内
B.对折一次后放入漏斗内
C.对折两次后放入漏斗内
(2)过滤是粗盐提纯实验中的操作步骤之一,在各操作步骤中,都要使用的仪器是______。
13.???我市某学校科学实验考查操作。请回答此实验操作相关问题:
(1)粗盐提纯的过程是______、过滤、蒸发。
(2)实验室要配制100克溶质质量分数为15%的硝酸钾溶液,会导致所得溶液溶质质量分数偏小的选项有哪些?______。
A.硝酸钾中有杂质
B.称量时使用了生锈的砝码
C.用量筒量取水时,仰视读数
D.配制完成后移取液体时有部分溅出。
四、探究题
14.???通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐。粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
20℃时,一些物质的溶解度
OH-
CO32-
Na+
溶
溶
Ca2+
微
不
Mg2+
不
微
[实验方案]某同学为了提纯粗盐,设计了如图所示实验方案并进行实验。
[交流与表达]
(1)实验操作X的名称是______,该操作中要用到的玻璃仪器有烧杯、玻璃棒和______。
(2)实验步骤③的主要目的是______(用化学方程式回答)。
(3)实验步骤④中生成的沉淀D是______。
[反思与评价]
(4)有同学认为原实验方案不完善,为了完善原实验方案,你设计的实验是______(写出补充部分的实验操作和现象)。
???下面是粗盐提纯的有关操作,按题意填空:
(1)用______量取10mL水倒入烧杯中,用______称量5g粗盐,加入水中,边加边搅拌,直到______为止。
(2)过滤时,某同学如图操作,请提出两处错误:①______;②______。
(3)蒸发时应把液体倒入______里进行加热,边加热边用______搅拌。等到有______出现时,停止加热,利用即可得到食盐晶体。
实验活动8 粗盐中难溶性杂质的去除
【答案】
1.??C???????2.??B???????3.??D???????4.??A???????5.??D???????
6.??D???????7.??C???????8.??A???????
9.??玻璃棒? 停止加热???????
10.??氯化钠、氢氧化钠、碳酸钠? 除去溶液中的氯化镁???????
11.??④①③②? 6? CaCl2、BaCl2、Ba(OH)2???????
12.??C? 玻璃棒???????
13.??溶解? AC???????
14.??过滤? 漏斗? MgCl2+2NaOH═Mg(OH)2↓+2NaCl? 碳酸钙? 向溶液C中加入足量稀盐酸,产生气泡???????
15.??10mL的量筒? 托盘天平? 食盐不再继续溶解? 滤纸超过了漏斗的边缘? 漏斗下端没有轻靠在烧杯内壁上? 蒸发皿? 玻璃棒? 较多固体???????
【解析】
1.??
解:A.过滤时玻璃棒靠在三层滤纸的一边,故错误;
B.过滤时,应沿着玻璃棒倒入待过滤的液体,不能用玻璃棒对漏斗中液体搅拌,故错误;
C.蒸发时对蒸发皿中的液体搅拌使液体受热均匀,防止局部受热过高造成液滴飞溅,故正确;
D.蒸发时等到蒸发皿中出现较多量晶体时即可停止加热,依靠蒸发皿的余热即可将水分蒸干,故错误。
故选:C。
根据过滤操作的注意事项以及蒸发结晶的注意事项来分析。
要想解答好这类题目,首先,要理解和熟记氯化钠与粗盐提纯等相关知识。然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可。
2.??
解:A、氯化钠的溶解度受温度变化影响不大,且随温度升高而变大,升温不会使食盐析出,所以A错。
B、一般来说,对于任何溶质,蒸发溶剂的方法都能使溶质析出,所以B对。
C、搅拌不会影响氯化钠的溶解性,与食盐是否析出无关,所以C错。
D、海水是混合物,食盐从中析出不是化学变化,不是分解反应,所以D错。
故选:B。
根据食盐的溶解度受温度影响的情况去分析,通过对比得出合理答案.
正确理解溶解度的含义以及其影响因素,了解结晶的常见方法,是解题的关键.溶解度知识是溶液部分的重点,也是重要考点.
3.??
解:粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),溶解中所需仪器是烧杯、玻璃棒,过滤操作所需仪器是烧杯、玻璃棒、漏斗、铁架台,蒸发操作所需仪器是蒸发皿、烧杯、玻璃棒、酒精灯。
配制一定质量分数的NaCl溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒。
这两个与NaCl有关的实验中均不需用到的玻璃仪器是试管。
故选:D。
根据粗盐提纯的原理、配制一定质量分数的NaCl溶液的实验步骤,进行分析判断。
本题难度不大,掌握粗盐提纯的原理与配制一定溶质质量分数的溶液的实验步骤、所需的仪器是正确解答本题的关键。
4.??
解:A、粗盐的主要成分是氯化钠,除去粗盐中的泥沙利用的原理是:氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,不用洗涤、干燥,故选项所采取的方法错误,故符合题意;
B、浓硫酸有吸水性,且不与氧气反应,因此,用于除去氧气中少量的水蒸气,故选项所采取的方法正确,故不符合题意;
C、将燃烧的小木条伸入瓶中,木条燃烧无明显变化的气体为空气;木条燃烧更旺的气体为氧气;木条熄灭的气体为二氧化碳气体,现象明显,选项鉴别方案可行,故不符合题意;
D、NH4Cl加熟石灰研磨后产生有刺激性气味的气体,KCl加熟石灰研磨后无明显气味,用加熟石灰研磨后闻气味的方法可以鉴别,故不符合题意,故选:A。
A、氯化钠易溶于水,泥沙不溶于酸;
B、浓硫酸能够吸收水蒸气;
C、氧气能够支持燃烧解,二氧化碳不支持燃烧;
D、氢氧化钙和氯化铵反应生成氯化钙、水和氨气,氨气有刺激性气味。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
5.??
解:A、二氧化碳能使澄清石灰水变浑浊,氮气不能,可以鉴别,故选项实验目的设计的实验方法正确。
B、在空气中灼烧,产生烧焦羽毛气味的是羊毛,产生特殊气味的是腈纶;羊毛纤维燃烧后灰烬较多,羊毛纤维接近火焰时先蜷缩,燃烧灰烬为带有光泽的硬块,用手指轻轻挤压就变成粉末;而腈纶接近火焰时迅速蜷缩,燃烧比较缓慢,趁热可拉成丝,灰烬为灰褐色玻璃球状,不易破碎;故选项实验目的设计的实验方法正确。
C、铁粉能与稀硫酸反应生成硫酸亚铁溶液和氢气,铜粉不能与稀硫酸反应,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验目的设计的实验方法正确。
D、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐的过程),故选项实验目的设计的实验方法错误。
故选:D。
除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
6.??
解:A、配制一定质量分数的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶贴签,故选项说法正确。
B、“一定质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中均有溶解操作,都需要玻璃仪器有烧杯、玻璃棒,故选项说法正确。
C、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故选项说法正确。
D、用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项说法错误。
故选:D。
A、根据配制溶质质量分数一定的溶液的基本步骤,进行分析判断。
B、根据两个实验所需的仪器,进行分析判断。
C、根据蒸发操作中停止加热的时机,进行分析判断。
D、用量筒量取水时,仰视液面,读数比实际液体体积小,进行分析判断。
本题难度不大,明确粗盐提纯的实验步骤、配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、注意事项是正确解答本题的关键。
7.??
解:A、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,故选项实验设计能达到实验目的。
B、区分硬水和软水,通常用肥皂水鉴别。取等量的样品,加等量的肥皂水,振荡,观察现象,产生泡沫较多,则是软水,若产生泡沫较少,则是硬水,故选项实验设计能达到实验目的。
C、MgSO4能与过量的BaCl2溶液反应生成硫酸钡沉淀和氯化镁,能除去杂质但引入了新的杂质BaCl2(过量的),不符合除杂原则,故选项实验设计不能达到实验目的。
D、碳酸钙难溶于水,氢氧化钠溶于水放热,使温度升高,硝酸铵溶于水吸热,使温度降低,氯化钠溶于水温度几乎无变化,可以鉴别,故选项实验设计能达到实验目的。
故选:C。
A、根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析判断。
B、根据硬水和软水的区别在于所含的钙镁离子的多少,进行分析判断。
C、除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
D、鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
8.??
解:A、溶解时搅拌,加快溶解速率,故选项说法错误。
B、过滤时玻璃棒的作用是引流,防止液滴飞溅,故选项说法正确。
C、蒸发时玻璃棒的作用是搅拌,防止因局部温度过高,造成液滴飞溅,故选项说法正确。
D、为计算产率,称量精盐前,把精盐固体转移到纸上,玻璃棒的作用是转移,故选项说法正确。
故选:A。
根据溶解、过滤、蒸发、转移中玻璃棒的作用,进行分析判断。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、玻璃棒的作用是正确解答本题的关键。
9.??
解:粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒起到搅拌,加快粗盐的溶解速率的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒的作用搅拌,防止局部温度过高,造成液滴飞溅。
将氯化钠溶液蒸发至有较多量固体析出后,应停止加热,利用余热将剩余液体蒸干
故答案为:
玻璃棒;停止加热。
根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析解答。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器、注意事项等是正确解答本题的关键。
10.??
解:氯化钡和硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,氢氧化钠和氯化镁溶液反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,过滤后滤液中的溶质为氯化钠、氢氧化钠、碳酸钠。
其中加入氢氧化钠溶液的作用是除去溶液中的氯化镁。
故答案为:
氯化钠、氢氧化钠、碳酸钠;除去溶液中的氯化镁。
氢氧化钠和氯化镁溶液反应生成氢氧化镁沉淀和氯化钠,氯化钡和硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
11.??
解:(1)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,所以正确的顺序为:④①③②。
(2)Ba(OH)2溶液和硫酸钠溶液反应生成硫酸钡沉淀和氢氧化钠,Ba(OH)2溶液和氯化镁溶液反应生成氢氧化镁沉淀和氯化钡,碳酸钠和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,所发生的复分解反应共有6个。
(3)加入过量Na2CO3溶液的目的是除去溶液中的CaCl2、BaCl2、Ba(OH)2。
故答案为:
(1)④①③②;
(2)6;
(3)CaCl2、BaCl2、Ba(OH)2。
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
12.??
解:(1)过滤液体时,注意“一贴、二低、三靠”的原则,准备过滤器时,先取一张圆形滤纸对折两次后放入漏斗内。
(2)在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒起到搅拌,加快粗盐的溶解速率的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒的作用搅拌,防止局部温度过高,造成液滴飞溅。
故答案为:
(1)C;
(2)玻璃棒。
(1)根据过滤液体时,注意“一贴、二低、三靠”的原则,进行分析解答。
(2)根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析解答。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器是正确解答本题的关键。
13.??
解:(1)粗盐提纯的步骤是溶解、过滤、蒸发;
(2)A、硝酸钾中有杂质,会导致称量的硝酸钾的质量偏小,则使溶质质量分数偏小,故选项正确;
B、称量时使用了生锈的砝码,会影响溶质的质量,使溶质质量变大,因此使溶质质量分数变大,故选项错误;
C、用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确;
D、溶液具有均一性,配制完成后移取液体时有部分溅出,溶质质量分数不变,故选项错误;
故答案为:(1)溶解;(2)AC。
(1)根据粗盐提纯的步骤进行解答;
(2)溶质质量分数变小,则可能是溶质质量偏小或溶剂质量偏大,可以分析出可能造成这两个方面错误的原因进行分析解答。
本题有一定难度,明确配制一定溶质质量分数的溶液实验步骤、导致溶质质量分数变小的因素(可能是溶质质量偏小或溶剂质量偏大)是正确解答本题的关键。
14.??
解:(1)实验操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
故填:过滤;漏斗。
(2)实验步骤③的主要目的是除去氯化镁,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl。
故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl。
(3)实验步骤④中生成的沉淀D是氯化钙和碳酸钠反应生成的碳酸钙。
故填:碳酸钙。
(4)设计的实验:向溶液C中加入足量稀盐酸,产生气泡,是因为加入稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。
故填:向溶液C中加入足量稀盐酸,产生气泡。
(1)过滤能够除去不溶于水的物质,过滤时要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(2)氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠。
(3)氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠。
(4)稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。
合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础。
15.??
解:(1)用10mL的量筒量取10mL水倒入烧杯中,用托盘天平称量5g粗盐,加入水中,边加边搅拌,直到食盐不再继续溶解为止。
(2)过滤液体时,注意“一贴、二低、三靠”的原则,图中滤纸超过了漏斗的边缘、漏斗下端没有轻靠在烧杯内壁上。
(3)蒸发时应把液体倒入蒸发皿里进行加热,边加热边用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅;待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干。
故答案为:
(1)10mL的量筒;托盘天平;食盐不再继续溶解;
(2)①滤纸超过了漏斗的边缘;②漏斗下端没有轻靠在烧杯内壁上;
(3)蒸发皿;玻璃棒;较多固体。
(1)根据量取一定量液体的方法、称量药品的方法,进行分析解答。
(2)过滤液体时,注意“一贴、二低、三靠”的原则,进行分析解答。
(3)根据蒸发操作的方法、注意事项进行分析解答。
本题难度不大,掌握粗盐提纯的原理、实验步骤(溶解、过滤、蒸发)、所需的仪器、注意事项是正确解答本题的关键。
同课章节目录
