九年级下册第九单元溶液课题2溶解度同步练习(含解析)
文档属性
| 名称 | 九年级下册第九单元溶液课题2溶解度同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 102.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-08 00:00:00 | ||
图片预览



文档简介
课题2 溶解度
一、单选题
1.???甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法错误的是( )
A.?t1℃时,甲的溶解度为30g
B.?降温可使丙的饱和溶液变成不饱和溶液
C.?t1℃时,甲和丙各40g分别加入100g水中,形成溶液的溶质质量分数相等
D.?t2℃时,将甲、乙两物质的饱和溶液降温到t1℃时,所得晶体质量甲一定大于乙
2.???分析推理是化学学习常用的方法,下列推理正确的是( )
A.?氮气可以作保护气,说明氮气不与任何物质反应
B.?水和过氧化氢组成元素相同,所以化学性质也相同
C.?蔗糖的饱和溶液不能再溶解蔗糖,也一定不能再溶解其他物质
D.?某物质燃烧生成CO2和H2O,则该物质的组成中一定含有碳、氢元素
???甲、乙两种固体物质的溶解度曲线如图所示。下列叙述正确的是( )
A.?甲和乙的溶解度相等
B.?t2℃时,甲物质的溶解度为40
C.?用降温的方法一定能使甲的不饱和溶液变成饱和溶液
D.?t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量
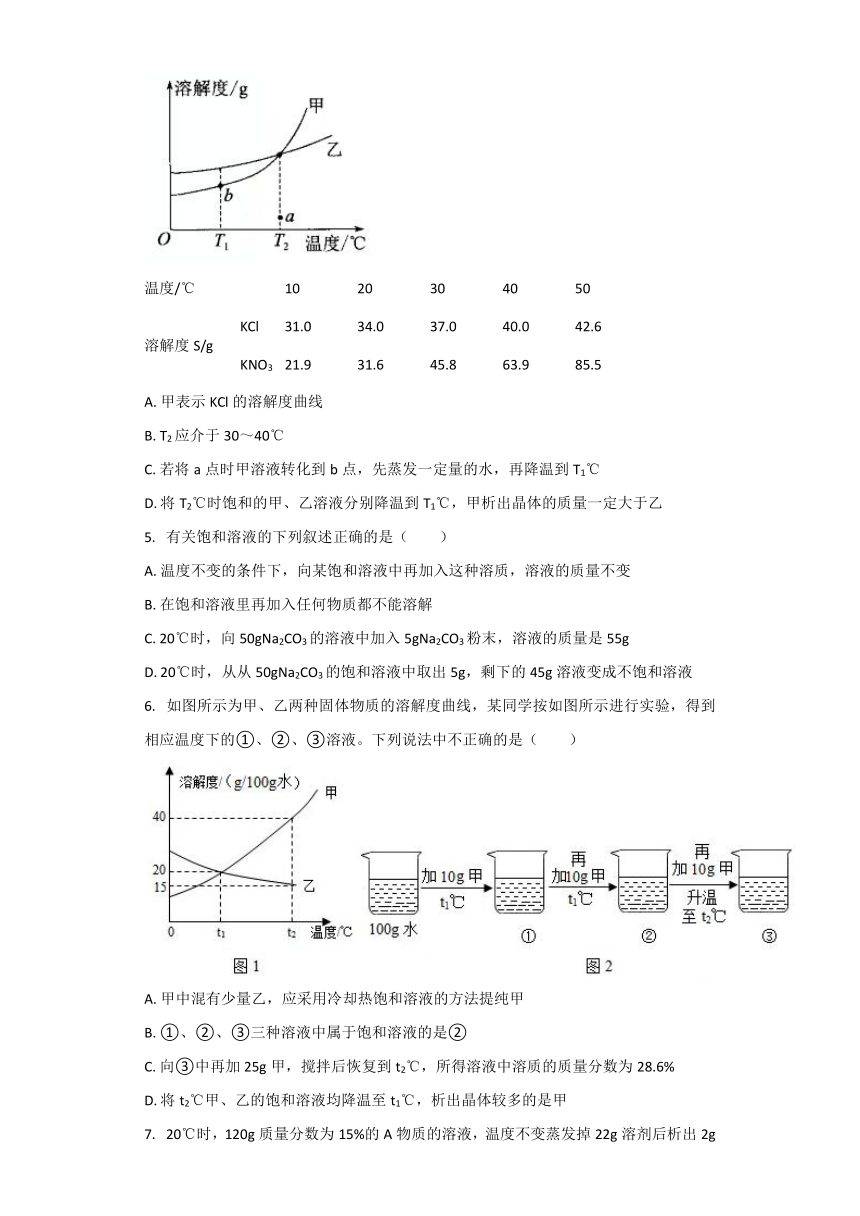
???KCl和KNO3的溶解度表及溶解度曲线如图。下列说法正确的是( )
温度/℃
10
20
30
40
50
溶解度S/g
KCl
31.0
34.0
37.0
40.0
42.6
KNO3
21.9
31.6
45.8
63.9
85.5
A.?甲表示KCl的溶解度曲线
B.?T2应介于30~40℃
C.?若将a点时甲溶液转化到b点,先蒸发一定量的水,再降温到T1℃
D.?将T2℃时饱和的甲、乙溶液分别降温到T1℃,甲析出晶体的质量一定大于乙
5.???有关饱和溶液的下列叙述正确的是( )
A.?温度不变的条件下,向某饱和溶液中再加入这种溶质,溶液的质量不变
B.?在饱和溶液里再加入任何物质都不能溶解
C.?20℃时,向50gNa2CO3的溶液中加入5gNa2CO3粉末,溶液的质量是55g
D.?20℃时,从从50gNa2CO3的饱和溶液中取出5g,剩下的45g溶液变成不饱和溶液
6.???如图所示为甲、乙两种固体物质的溶解度曲线,某同学按如图所示进行实验,得到相应温度下的①、②、③溶液。下列说法中不正确的是( )
A.?甲中混有少量乙,应采用冷却热饱和溶液的方法提纯甲
B.?①、②、③三种溶液中属于饱和溶液的是②
C.?向③中再加25g甲,搅拌后恢复到t2℃,所得溶液中溶质的质量分数为28.6%
D.?将t2℃甲、乙的饱和溶液均降温至t1℃,析出晶体较多的是甲
7.???20℃时,120g质量分数为15%的A物质的溶液,温度不变蒸发掉22g溶剂后析出2g溶质,则A物质在20℃的溶解度是( )
A.?20g?????????????????????????B.?9g?????????????????????????C.?78g?????????????????????????D.?16g
8.???下列说法正确的是( )
A.?有的物质的饱和溶液是稀溶液,但浓溶液一定是饱和溶液
B.?同一种物质的饱和溶液,一定比不饱和溶液所含的溶质多
C.?20℃时100g水最多溶解36g食盐,则20℃时食盐的溶解度为36g
D.?溶液达到饱和时,溶解就停止了
9.???下列说法中正确的是( )
A.?饱和溶液一定是浓溶液????????????????????????????????????????
B.?稀溶液一定是不饱和溶液????????????????????????????????????????
C.?饱和溶液升高温度一定会变成不饱和溶液????????????????????????????????????????
D.?不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液
10.???通常情况下,下列哪些方法能够加快固体物质的溶解速率( )
①溶解时不断搅拌;
②把大颗粒的固体碾成粉末;
③增加水的用量;
④溶解时给物质加热;
⑤减少水的用量;
⑥静置。
A.?①②③⑥?????????????????B.?①②④???????????????C.?①③④⑤⑥?????????????D.?①②③④
二、填空题
11.???甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题:
(1)甲、乙、丙三种固体物质溶解度受温度影响最大的是______。
(2)欲将t1℃时乙物质的不饱和溶液转化为该温度下的饱和溶液,可采取的方法是______(任填一种)。
(3)若甲中含有少量乙,提纯甲的方法是______。
(4)下列说法正确的是______。
A.t1℃甲、乙两物质溶液的溶质质量分数相等
B.t2℃配制300g甲的饱和溶液,需要固体甲的质量为100g
C.t2℃甲、乙、丙三种饱和溶液降温到t1℃,甲析出晶体的质量比乙多
D.t1℃等质量的甲、乙、丙三种固体配制成该温度下的饱和溶液,所得溶液的质量大小:丙>甲=乙。
12.???海洋与人类密切相关,如何更好地利用和保护海洋成为科学家研究的课题。在海底热液中溶有一些矿物质冷却热液,这些矿物质就会不断结晶析出。由此可知,这些矿物质的溶解度随着温度的降低而______。
三、简答题
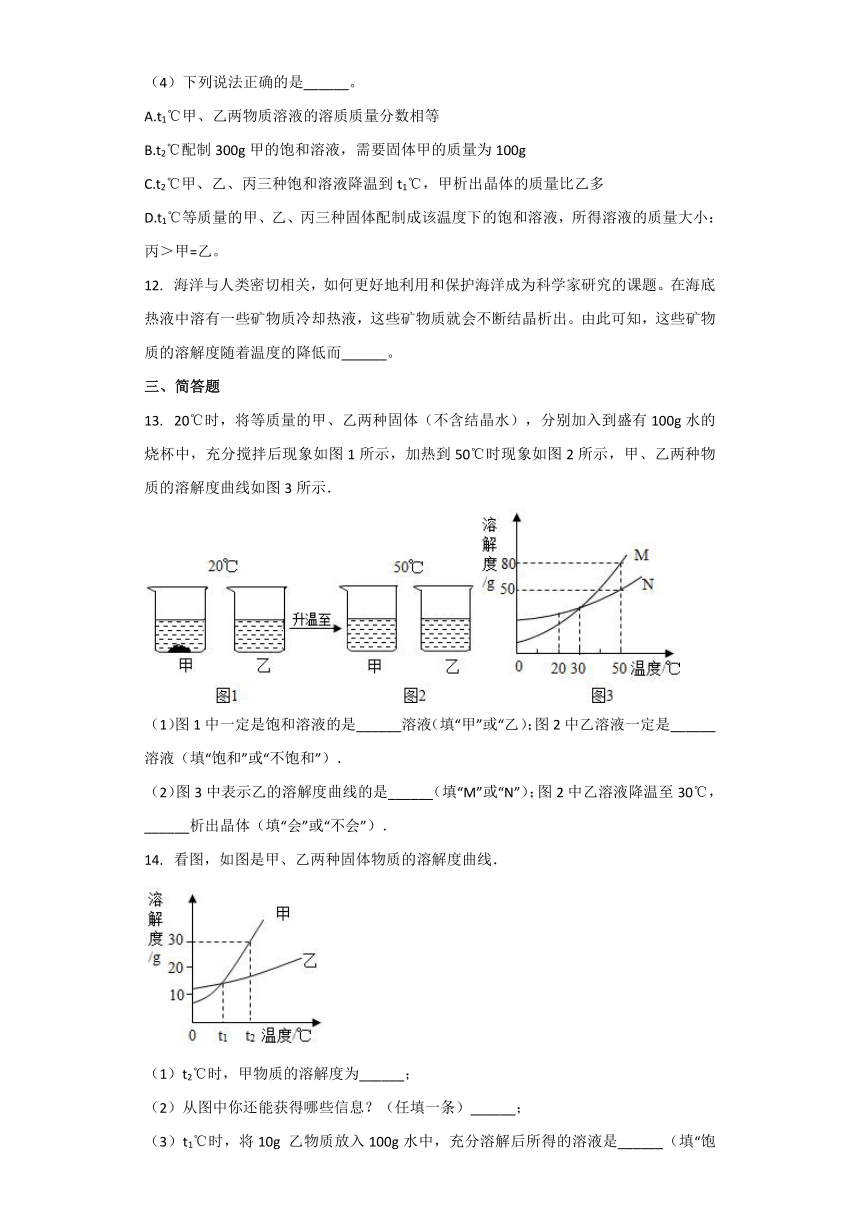
13.???20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示.
(1)图1中一定是饱和溶液的是______溶液(填“甲”或“乙);图2中乙溶液一定是______溶液(填“饱和”或“不饱和”).
(2)图3中表示乙的溶解度曲线的是______(填“M”或“N”);图2中乙溶液降温至30℃,______析出晶体(填“会”或“不会”).
???看图,如图是甲、乙两种固体物质的溶解度曲线.
(1)t2℃时,甲物质的溶解度为______;
(2)从图中你还能获得哪些信息?(任填一条)______;
(3)t1℃时,将10g 乙物质放入100g水中,充分溶解后所得的溶液是______(填“饱和”或“不饱和”)溶液.欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法______(任填一种方法).
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是______.
15.???根据下表回答问题。
温度/℃
20
40
50
60
80
溶解度/g
NaCl
36.0
36.6
37.0
37.3
38.4
KNO3
31.6
63.9
85.5
110
169
(1)20℃时,溶解度较大的物质是______;
(2)40℃时,使近饱和的KNO3溶液变饱和的方法有______;
(3)60℃时,将100gKNO3饱和溶液和100gNaCl饱和溶液分别蒸发10g水,温度降到60℃时,过滤,得到的KNO3固体质量______(选填“>”、“<”或“=”)NaCl固体质量。
16.???根据下表数据,回答下列问题。
温度/℃
10
20
30
40
50
60
70
80
90
溶解度/g
KCl
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
(1)KCl和KNO3中,溶解度受温度影响较小的是______;
(2)40℃时,将40gKNO3加入100g水中,充分溶解,得到______溶液(选填“饱和”或“不饱和”);
(3)要使KCl从其饱和溶液中全部结晶析出,可选择______(选填“蒸发结晶”或“降温结晶”)。
课题2 溶解度
【答案】
1.??D???????2.??D???????3.??D???????4.??C???????5.??A???????
6.??D???????7.??A???????8.??C???????9.??D???????10.??B???????
11.??甲? 加溶质或蒸发溶剂? 降温结晶? BD???????
12.??减小???????
13.??甲? 不饱和? N? 不会???????
14.??30g? 甲物质的溶解度受温度变化影响较大? 不饱和? 升高温度、增加溶剂? 降温结晶???????
15.??NaCl? 加入硝酸钾、蒸发溶剂、降低温度? >???????
16.??KCl? 不饱和? 蒸发结晶???????
【解析】
1.??
解:A、通过分析溶解度曲线可知,t1℃时,甲的溶解度为30g,故A正确;
B、丙物质的溶解度随温度升高而减小,所以降温可使丙的饱和溶液变成不饱和溶液,故B正确;
C、t1℃时,甲和丙的溶解度都为30g,40g甲和丙分别加入100g水中都只能溶解30g形成饱和溶液,它们溶液的溶质质量分数相等,故C正确;
D、t2℃时,将甲、乙两物质的饱和溶液降温到t1℃时,析出晶体的质量还与饱和溶液的质量有关,饱和溶液的质量不能确定,所以析出的晶体质量也不能确定,故D错误。
故选:D.
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断通过温度改变后,析出的晶体质量.
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
2.??
解:A、氮气可以作保护气,氮气的化学性质不活泼,不能说明氮气不与任何物质反应,故选项推理错误。
B、水和过氧化氢组成元素相同,但它们分子的构成不同,不同种的分子化学性质不同,故选项推理错误。
C、蔗糖的饱和溶液不能再溶解蔗糖,但还能再溶解其他物质,故选项推理错误。
D、某物质燃烧生成CO2和H2O,CO2和H2O两种物质中含有碳、氢、氧三种元素,根据质量守恒定律,反应前后,元素种类不变,反应物氧气中只含有氧元素,则某化合物中一定含有碳、氢两种元素,可能含有氧元素,故选项推理正确。
故选:D。
A、根据氮气的化学性质不活泼,进行分析判断.
B、根据水和过氧化氢的元素组成,同种的分子性质相同,不同种的分子性质不同,进行分析判断.
C、饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液.
D、根据质量守恒定律,反应前后元素种类不变,进行分析判断.
本题难度不大,掌握饱和溶液的特征、质量守恒定律、分子的基本性质、氮气的化学性质是正确解答本题的关键.
3.??
解:A、甲和乙的溶解度相等错误,因为没有指明温度;故选项错误;
B、t2℃时,甲物质的溶解度为40错误,因为溶解度的单位是克;故选项错误;
C、用降温的方法一定能使甲的不饱和溶液变成饱和溶液错误,不一定变成饱和溶液;故选项错误;
D、t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量正确,因为乙固体需要的水多;故选项正确;
故选:D。
根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化比乙大;A、交点的含义;
B、t2℃时,甲物质的溶解度为40g;
C、饱和溶液与不饱和溶液的相互转化;
D、t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量正确。
本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液与不饱和溶液的相互转化,本考点主要出现在选择题和填空题中.
4.??
解:A、甲溶解度受温度变化影响较大,乙溶解度受温度变化影响较小,甲表示的是硝酸钾溶解度曲线,该选项说法不正确;
B、30~40℃时,硝酸钾的溶解度大于氯化钾的溶解度,该选项说法不正确;
C、a是甲的不饱和溶液,溶液中溶质质量分数小于b,因此将a转化到b,可以先蒸发一定量的水,使溶质质量分数和b相等,再降温至T1℃,变成甲的饱和溶液,该选项说法正确;
D、由于不知道溶液质量,不能比较析出晶体质量大小,该选项说法不正确。
故选:C。
根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量;
饱和溶液和不饱和溶液之间可以相互转化;
饱和溶液的溶质质量分数=溶解度/(100+溶解度)×100%;
溶液中溶质质量分数=溶质质量/溶液质量×100%;
根据物质的溶解度曲线、溶液质量可以判断温度变化时析出固体质量的大小。
溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
5.??
解:A、温度不变的条件下,向某饱和溶液中再加入这种溶质,不能继续溶解,溶液的质量不变,故选项说法正确。
B、在饱和溶液里再加入其它的溶质,能继续溶解,故选项说法错误。
C、20℃时,向50gNa2CO3的溶液中加入5gNa2CO3粉末,不能确定是否能继续溶解,即使能溶解,也也不能确定溶解的质量,无法确定溶液的质量,故选项说法错误。
D、溶液具有均一性,20℃时,从从50gNa2CO3的饱和溶液中取出5g,剩下的45g溶液仍为饱和溶液,故选项说法错误。
故选:A。
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液;还能继续溶解这种溶质的溶液,叫做不饱和溶液。
本题难度不大,是对饱和溶液概念的理解,理解饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液是解题的关键.
6.??
解:A、甲物质的溶解度受温度变化影响较大,所以甲中混有少量乙,应采用冷却热饱和溶液的方法提纯甲,故A正确;
B、t1℃时,甲物质的溶解度20g,t2℃时,甲物质的溶解度是40g,①t1℃时,100g水中加入10g,形成不饱和溶液,②t1℃时,100g水中加入20g,形成饱和溶液,③t2℃时,100g水中加入30g,形成不饱和溶液,所以①、②、③三种溶液中属于饱和溶液的是②,故B正确;
C、向③中再加25?g甲,搅拌后恢复到t2℃,形成饱和溶液,所得溶液中溶质的质量分数为溶解度/(溶解度+100)×100%=28.6%,故C正确;
D、将t2℃甲、乙的饱和溶液均降温至t1℃,甲、乙饱和溶液的质量不能确定,所以析出晶体的质量也不能确定,故D错误。
故选:D。
根据固体的溶解度曲线可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
7.??
解:120g质量分数为15%的A物质的溶液,温度不变蒸发掉22g水后析出2g溶质,所得溶液为饱和溶液。
饱和溶液中溶质的质量为:120g×15%-2g=16g。
饱和溶液中溶剂的质量为:120g-22g-2g-16g=80g。
所以A物质在20℃时的溶解度为:16g/80g×100g=20g。
故选:A。
溶解度是指在一定温度下,某固体物质在100g水中达到饱和状态下,所溶解的溶质的质量.所以我们根据所得饱和溶液中的数据,可以计算出溶解度.
溶解度是指一定温度下,100g溶剂中所溶解的溶质的最大质量,所以溶解度有单位,单位为克.在计算时必须写清楚单位.
8.??
解:A、溶液是否饱和与溶液的浓稀没有必然联系,有的物质的饱和溶液是稀溶液,浓溶液不一定是饱和溶液,故选项说法错误。
B、选项说法没有指明温度、溶质的质量,同一种物质的饱和溶液,不一定比不饱和溶液所含的溶质多,故选项说法错误。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,20℃时100g水最多溶解36g食盐,则20℃时食盐的溶解度为36g,故选项说法正确。
D、溶液达到饱和时,溶解不一定就停止了,还能溶解其它的溶质,故选项说法错误。
故选:C。
A、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系。
B、根据选项说法没有指明温度、溶质的质量,进行分析判断。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
D、根据饱和溶液的特征,进行分析判断。
本题难度不大,掌握饱和溶液的特征、溶解度的含义、溶液是否饱和与溶液的浓稀没有必然联系等是正确解答本题的关键。
9.??
解:A、饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,如氢氧化钙的饱和溶液就是稀溶液,故A错误;
B、饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,如氢氧化钙的饱和溶液就是稀溶液,故B错误;
C、当温度升高时,饱和溶液不一定能变成不饱和溶液,例如氢氧化钙的溶解度随温度的升高而减小,故氢氧化钙的饱和溶液温度升高后还是饱和溶液,故C错误;
D、在一定温度下,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,故D正确。
故选:D。
A、根据饱和溶液的含义进行解答;
B、根据饱和溶液的含义进行解答;
C、根据当温度升高时,饱和溶液不一定能变成不饱和溶液进行解答;
D、根据不饱和溶液的含义进行解答
明确饱和溶液与浓稀溶液的关系是解答本题关健,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。
10.??
解:①溶解时不断搅拌,能加快分子运动速度,能加快固体与水的接触机会,从而加快了食盐的速率速率。
②把大颗粒的固体碾成粉末,增加了固体与水的接触面积,加快了固体的溶解速率。
③增加水的用量,实际上是影响溶解溶质的量的多少,与溶解速率无关。
④溶解时给物质加热,升高温度能加快分子运动速度,能加快固体与水的接触机会,从而加快了固体的溶解速率。
⑤减少水的用量,实际上是影响溶解溶质的量的多少,与溶解速率无关。
⑥静置,能使不溶物沉淀,不能加快固体物质的溶解速率。
故①②④能够加快固体物质的溶解速率。
故选:B。
只要能改变固体与水的接触机会就能改变固体的溶解速率;加快固体物质溶解速率的方法主要有:搅拌、加热、磨成粉末等,其中研成粉末状是为了增加溶质溶剂的接触面积。
本题难度不大,考查了影响物质溶解速度的因素,了解影响物质溶解速率的因素(搅拌、加热、研磨等)即可正确解答本题。
11.??
解:(1)甲物质的溶解度曲线较陡,所以甲、乙、丙三种固体物质溶解度受温度影响最大的是甲;
(2)欲将t1℃时乙物质的不饱和溶液转化为该温度下的饱和溶液,可采取的方法是加溶质或蒸发溶剂;
(3)甲物质的溶解度受温度变化影响较大,所以若甲中含有少量乙,提纯甲的方法是降温结晶;
(4)A、t1℃时,甲、乙两物质的溶解度相等,但是溶液的整体不能确定,所以溶质质量分数不一定相等,故A错误;
B、t2℃,甲物质的溶解度是50g,所以配制300g甲的饱和溶液,需要固体甲的质量为100g,故B正确;
C、t2℃甲、乙、丙三种饱和溶液降温到t1℃,饱和溶液的质量不能确定,所以析出晶体的质量也不能确定,故C错误;
D、t1℃时,甲、乙物质的溶解度相等,丙物质的溶解度最小,所以等质量的甲、乙、丙三种固体配制成该温度下的饱和溶液,所得溶液的质量大小:丙>甲=乙,故D正确。
故选:BD。
故答案为:(1)甲;
(2)加溶质或蒸发溶剂(或者加入乙,蒸发水);
(3)降温结晶;
(4)BD。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定配制饱和溶液需要的固体质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯固体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
12.??
解:在海底热液中溶有一些矿物质冷却热液,这些矿物质就会不断结晶析出,说明温度降低,有晶体析出,说明这些矿物质的溶解度随着温度的降低而减小。
故答案为:
减小。
根据题意,在海底热液中溶有一些矿物质冷却热液,这些矿物质就会不断结晶析出,进行分析解答。
本题难度不大,明确冷却热液不断结晶析出矿物质是正确解答本题的关键。
13.??
解:(1)图1中甲烧杯底部有不溶解的晶体存在,说明在该温度下甲溶液饱和,而乙溶液可能饱和也可能不饱和;因为两种物质的溶解度均随着温度的升高而增大,所以升温后所得图2中的乙一定不饱和;
(2)根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,所以N表示的是乙物质的溶解度曲线;因为乙在20℃时没有晶体存在,所以降温至30℃也不会出现晶体。
故答案为:(1)甲;不饱和;
(2)N;不会。
(1)根据烧杯底部是否有不溶解的固体存在以及温度升高后,溶解度的变化情况进行分析;
(2)根据图1中20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g水的烧杯中,甲有固体剩余,说明甲的溶解度小于乙,结合图3进行分析。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
14.??
解:(1)通过分析溶解度曲线可知,t2℃时,甲物质的溶解度为30g;
(2)甲物质的溶解度曲线较陡,所以从图中获得的信息有:甲物质的溶解度受温度变化影响较大;
(3)t1℃时,乙物质的溶解度大于10g,所以将10g乙物质放入100g水中,充分溶解后所得的溶液是不饱和溶液;欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法是:升高温度、增加溶剂;
(4)甲物质的溶解度受温度变化影响较大,所以若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是降温结晶.
故答案为:(1)30g;
(2)甲物质的溶解度受温度变化影响较大;
(3)不饱和;升高温度、增加溶剂;
(4)降温结晶.
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成溶液的状态;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
15.??
解:(1)由表格数据可知,20℃时,溶解度较大的物质是NaCl。
(2)硝酸钾的溶解度随温度升高而增大,40℃时,使近饱和的KNO3溶液变饱和的方法有加入硝酸钾、蒸发溶剂、降低温度等方法。
(3)60℃时,将100gKNO3饱和溶液和100gNaCl饱和溶液分别蒸发10g水,温度降到60℃时,由于60℃,硝酸钾的溶解度大于氯化钠的溶解度,析出硝酸钾的质量多,过滤,得到的KNO3固体质量大于NaCl固体质量。
故答案为:
(1)NaCl;
(2)加入硝酸钾、蒸发溶剂、降低温度;
(3)>。
(1)根据20℃时,两种物质的溶解度大小,进行分析解答。
(2)根据不饱和溶液转化为饱和溶液的方法,进行分析解答。
(3)根据60℃,硝酸钾的溶解度大于氯化钠的溶解度,进行分析解答。
本题难度不大,掌握大多数物质不饱和溶液变成饱和溶液的方法、溶解度受温度影响的变化趋势是正确解答本题的关键。
16.??
解:(1)由KCl和KNO3的溶解度数据,溶解度受温度影响较小的是KCl。
(2)40℃时,硝酸钾的溶解度为63.9g,含义是40℃时,100g水中最多溶解硝酸钾63.9g,溶液达到饱和状态,则40℃时,将40gKNO3加入100g水中,充分溶解,形成不饱和溶液。
(3)要使KCl从其饱和溶液中全部结晶析出,可用蒸发结晶的方法。
故答案为:(1)KCl;
(2)不饱和;
(3)蒸发结晶。
(1)根据KCl和KNO3的溶解度数据,进行分析解答。
(2)根据40℃时,硝酸钾的溶解度为63.9g,进行分析解答。
(3)从溶液中结晶的方法有两种:蒸发结晶和降温结晶。
本题难度不大,掌握固体物质的溶解度受温度影响的变化趋势、溶解度的含义等是正确解答本题的关键。
一、单选题
1.???甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法错误的是( )
A.?t1℃时,甲的溶解度为30g
B.?降温可使丙的饱和溶液变成不饱和溶液
C.?t1℃时,甲和丙各40g分别加入100g水中,形成溶液的溶质质量分数相等
D.?t2℃时,将甲、乙两物质的饱和溶液降温到t1℃时,所得晶体质量甲一定大于乙
2.???分析推理是化学学习常用的方法,下列推理正确的是( )
A.?氮气可以作保护气,说明氮气不与任何物质反应
B.?水和过氧化氢组成元素相同,所以化学性质也相同
C.?蔗糖的饱和溶液不能再溶解蔗糖,也一定不能再溶解其他物质
D.?某物质燃烧生成CO2和H2O,则该物质的组成中一定含有碳、氢元素
???甲、乙两种固体物质的溶解度曲线如图所示。下列叙述正确的是( )
A.?甲和乙的溶解度相等
B.?t2℃时,甲物质的溶解度为40
C.?用降温的方法一定能使甲的不饱和溶液变成饱和溶液
D.?t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量
???KCl和KNO3的溶解度表及溶解度曲线如图。下列说法正确的是( )
温度/℃
10
20
30
40
50
溶解度S/g
KCl
31.0
34.0
37.0
40.0
42.6
KNO3
21.9
31.6
45.8
63.9
85.5
A.?甲表示KCl的溶解度曲线
B.?T2应介于30~40℃
C.?若将a点时甲溶液转化到b点,先蒸发一定量的水,再降温到T1℃
D.?将T2℃时饱和的甲、乙溶液分别降温到T1℃,甲析出晶体的质量一定大于乙
5.???有关饱和溶液的下列叙述正确的是( )
A.?温度不变的条件下,向某饱和溶液中再加入这种溶质,溶液的质量不变
B.?在饱和溶液里再加入任何物质都不能溶解
C.?20℃时,向50gNa2CO3的溶液中加入5gNa2CO3粉末,溶液的质量是55g
D.?20℃时,从从50gNa2CO3的饱和溶液中取出5g,剩下的45g溶液变成不饱和溶液
6.???如图所示为甲、乙两种固体物质的溶解度曲线,某同学按如图所示进行实验,得到相应温度下的①、②、③溶液。下列说法中不正确的是( )
A.?甲中混有少量乙,应采用冷却热饱和溶液的方法提纯甲
B.?①、②、③三种溶液中属于饱和溶液的是②
C.?向③中再加25g甲,搅拌后恢复到t2℃,所得溶液中溶质的质量分数为28.6%
D.?将t2℃甲、乙的饱和溶液均降温至t1℃,析出晶体较多的是甲
7.???20℃时,120g质量分数为15%的A物质的溶液,温度不变蒸发掉22g溶剂后析出2g溶质,则A物质在20℃的溶解度是( )
A.?20g?????????????????????????B.?9g?????????????????????????C.?78g?????????????????????????D.?16g
8.???下列说法正确的是( )
A.?有的物质的饱和溶液是稀溶液,但浓溶液一定是饱和溶液
B.?同一种物质的饱和溶液,一定比不饱和溶液所含的溶质多
C.?20℃时100g水最多溶解36g食盐,则20℃时食盐的溶解度为36g
D.?溶液达到饱和时,溶解就停止了
9.???下列说法中正确的是( )
A.?饱和溶液一定是浓溶液????????????????????????????????????????
B.?稀溶液一定是不饱和溶液????????????????????????????????????????
C.?饱和溶液升高温度一定会变成不饱和溶液????????????????????????????????????????
D.?不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液
10.???通常情况下,下列哪些方法能够加快固体物质的溶解速率( )
①溶解时不断搅拌;
②把大颗粒的固体碾成粉末;
③增加水的用量;
④溶解时给物质加热;
⑤减少水的用量;
⑥静置。
A.?①②③⑥?????????????????B.?①②④???????????????C.?①③④⑤⑥?????????????D.?①②③④
二、填空题
11.???甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题:
(1)甲、乙、丙三种固体物质溶解度受温度影响最大的是______。
(2)欲将t1℃时乙物质的不饱和溶液转化为该温度下的饱和溶液,可采取的方法是______(任填一种)。
(3)若甲中含有少量乙,提纯甲的方法是______。
(4)下列说法正确的是______。
A.t1℃甲、乙两物质溶液的溶质质量分数相等
B.t2℃配制300g甲的饱和溶液,需要固体甲的质量为100g
C.t2℃甲、乙、丙三种饱和溶液降温到t1℃,甲析出晶体的质量比乙多
D.t1℃等质量的甲、乙、丙三种固体配制成该温度下的饱和溶液,所得溶液的质量大小:丙>甲=乙。
12.???海洋与人类密切相关,如何更好地利用和保护海洋成为科学家研究的课题。在海底热液中溶有一些矿物质冷却热液,这些矿物质就会不断结晶析出。由此可知,这些矿物质的溶解度随着温度的降低而______。
三、简答题
13.???20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1所示,加热到50℃时现象如图2所示,甲、乙两种物质的溶解度曲线如图3所示.
(1)图1中一定是饱和溶液的是______溶液(填“甲”或“乙);图2中乙溶液一定是______溶液(填“饱和”或“不饱和”).
(2)图3中表示乙的溶解度曲线的是______(填“M”或“N”);图2中乙溶液降温至30℃,______析出晶体(填“会”或“不会”).
???看图,如图是甲、乙两种固体物质的溶解度曲线.
(1)t2℃时,甲物质的溶解度为______;
(2)从图中你还能获得哪些信息?(任填一条)______;
(3)t1℃时,将10g 乙物质放入100g水中,充分溶解后所得的溶液是______(填“饱和”或“不饱和”)溶液.欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法______(任填一种方法).
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是______.
15.???根据下表回答问题。
温度/℃
20
40
50
60
80
溶解度/g
NaCl
36.0
36.6
37.0
37.3
38.4
KNO3
31.6
63.9
85.5
110
169
(1)20℃时,溶解度较大的物质是______;
(2)40℃时,使近饱和的KNO3溶液变饱和的方法有______;
(3)60℃时,将100gKNO3饱和溶液和100gNaCl饱和溶液分别蒸发10g水,温度降到60℃时,过滤,得到的KNO3固体质量______(选填“>”、“<”或“=”)NaCl固体质量。
16.???根据下表数据,回答下列问题。
温度/℃
10
20
30
40
50
60
70
80
90
溶解度/g
KCl
31.0
34.0
37.0
40.0
42.6
45.5
48.3
51.1
54.0
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
(1)KCl和KNO3中,溶解度受温度影响较小的是______;
(2)40℃时,将40gKNO3加入100g水中,充分溶解,得到______溶液(选填“饱和”或“不饱和”);
(3)要使KCl从其饱和溶液中全部结晶析出,可选择______(选填“蒸发结晶”或“降温结晶”)。
课题2 溶解度
【答案】
1.??D???????2.??D???????3.??D???????4.??C???????5.??A???????
6.??D???????7.??A???????8.??C???????9.??D???????10.??B???????
11.??甲? 加溶质或蒸发溶剂? 降温结晶? BD???????
12.??减小???????
13.??甲? 不饱和? N? 不会???????
14.??30g? 甲物质的溶解度受温度变化影响较大? 不饱和? 升高温度、增加溶剂? 降温结晶???????
15.??NaCl? 加入硝酸钾、蒸发溶剂、降低温度? >???????
16.??KCl? 不饱和? 蒸发结晶???????
【解析】
1.??
解:A、通过分析溶解度曲线可知,t1℃时,甲的溶解度为30g,故A正确;
B、丙物质的溶解度随温度升高而减小,所以降温可使丙的饱和溶液变成不饱和溶液,故B正确;
C、t1℃时,甲和丙的溶解度都为30g,40g甲和丙分别加入100g水中都只能溶解30g形成饱和溶液,它们溶液的溶质质量分数相等,故C正确;
D、t2℃时,将甲、乙两物质的饱和溶液降温到t1℃时,析出晶体的质量还与饱和溶液的质量有关,饱和溶液的质量不能确定,所以析出的晶体质量也不能确定,故D错误。
故选:D.
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断通过温度改变后,析出的晶体质量.
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
2.??
解:A、氮气可以作保护气,氮气的化学性质不活泼,不能说明氮气不与任何物质反应,故选项推理错误。
B、水和过氧化氢组成元素相同,但它们分子的构成不同,不同种的分子化学性质不同,故选项推理错误。
C、蔗糖的饱和溶液不能再溶解蔗糖,但还能再溶解其他物质,故选项推理错误。
D、某物质燃烧生成CO2和H2O,CO2和H2O两种物质中含有碳、氢、氧三种元素,根据质量守恒定律,反应前后,元素种类不变,反应物氧气中只含有氧元素,则某化合物中一定含有碳、氢两种元素,可能含有氧元素,故选项推理正确。
故选:D。
A、根据氮气的化学性质不活泼,进行分析判断.
B、根据水和过氧化氢的元素组成,同种的分子性质相同,不同种的分子性质不同,进行分析判断.
C、饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液.
D、根据质量守恒定律,反应前后元素种类不变,进行分析判断.
本题难度不大,掌握饱和溶液的特征、质量守恒定律、分子的基本性质、氮气的化学性质是正确解答本题的关键.
3.??
解:A、甲和乙的溶解度相等错误,因为没有指明温度;故选项错误;
B、t2℃时,甲物质的溶解度为40错误,因为溶解度的单位是克;故选项错误;
C、用降温的方法一定能使甲的不饱和溶液变成饱和溶液错误,不一定变成饱和溶液;故选项错误;
D、t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量正确,因为乙固体需要的水多;故选项正确;
故选:D。
根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化比乙大;A、交点的含义;
B、t2℃时,甲物质的溶解度为40g;
C、饱和溶液与不饱和溶液的相互转化;
D、t2℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量正确。
本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液与不饱和溶液的相互转化,本考点主要出现在选择题和填空题中.
4.??
解:A、甲溶解度受温度变化影响较大,乙溶解度受温度变化影响较小,甲表示的是硝酸钾溶解度曲线,该选项说法不正确;
B、30~40℃时,硝酸钾的溶解度大于氯化钾的溶解度,该选项说法不正确;
C、a是甲的不饱和溶液,溶液中溶质质量分数小于b,因此将a转化到b,可以先蒸发一定量的水,使溶质质量分数和b相等,再降温至T1℃,变成甲的饱和溶液,该选项说法正确;
D、由于不知道溶液质量,不能比较析出晶体质量大小,该选项说法不正确。
故选:C。
根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
根据物质的溶解度曲线、溶质质量、溶剂质量可以判断配制的溶液质量;
饱和溶液和不饱和溶液之间可以相互转化;
饱和溶液的溶质质量分数=溶解度/(100+溶解度)×100%;
溶液中溶质质量分数=溶质质量/溶液质量×100%;
根据物质的溶解度曲线、溶液质量可以判断温度变化时析出固体质量的大小。
溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
5.??
解:A、温度不变的条件下,向某饱和溶液中再加入这种溶质,不能继续溶解,溶液的质量不变,故选项说法正确。
B、在饱和溶液里再加入其它的溶质,能继续溶解,故选项说法错误。
C、20℃时,向50gNa2CO3的溶液中加入5gNa2CO3粉末,不能确定是否能继续溶解,即使能溶解,也也不能确定溶解的质量,无法确定溶液的质量,故选项说法错误。
D、溶液具有均一性,20℃时,从从50gNa2CO3的饱和溶液中取出5g,剩下的45g溶液仍为饱和溶液,故选项说法错误。
故选:A。
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液;还能继续溶解这种溶质的溶液,叫做不饱和溶液。
本题难度不大,是对饱和溶液概念的理解,理解饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液是解题的关键.
6.??
解:A、甲物质的溶解度受温度变化影响较大,所以甲中混有少量乙,应采用冷却热饱和溶液的方法提纯甲,故A正确;
B、t1℃时,甲物质的溶解度20g,t2℃时,甲物质的溶解度是40g,①t1℃时,100g水中加入10g,形成不饱和溶液,②t1℃时,100g水中加入20g,形成饱和溶液,③t2℃时,100g水中加入30g,形成不饱和溶液,所以①、②、③三种溶液中属于饱和溶液的是②,故B正确;
C、向③中再加25?g甲,搅拌后恢复到t2℃,形成饱和溶液,所得溶液中溶质的质量分数为溶解度/(溶解度+100)×100%=28.6%,故C正确;
D、将t2℃甲、乙的饱和溶液均降温至t1℃,甲、乙饱和溶液的质量不能确定,所以析出晶体的质量也不能确定,故D错误。
故选:D。
根据固体的溶解度曲线可以查出某物质在一定温度下的溶解度,从而确定物质的溶解性;比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
7.??
解:120g质量分数为15%的A物质的溶液,温度不变蒸发掉22g水后析出2g溶质,所得溶液为饱和溶液。
饱和溶液中溶质的质量为:120g×15%-2g=16g。
饱和溶液中溶剂的质量为:120g-22g-2g-16g=80g。
所以A物质在20℃时的溶解度为:16g/80g×100g=20g。
故选:A。
溶解度是指在一定温度下,某固体物质在100g水中达到饱和状态下,所溶解的溶质的质量.所以我们根据所得饱和溶液中的数据,可以计算出溶解度.
溶解度是指一定温度下,100g溶剂中所溶解的溶质的最大质量,所以溶解度有单位,单位为克.在计算时必须写清楚单位.
8.??
解:A、溶液是否饱和与溶液的浓稀没有必然联系,有的物质的饱和溶液是稀溶液,浓溶液不一定是饱和溶液,故选项说法错误。
B、选项说法没有指明温度、溶质的质量,同一种物质的饱和溶液,不一定比不饱和溶液所含的溶质多,故选项说法错误。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,20℃时100g水最多溶解36g食盐,则20℃时食盐的溶解度为36g,故选项说法正确。
D、溶液达到饱和时,溶解不一定就停止了,还能溶解其它的溶质,故选项说法错误。
故选:C。
A、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系。
B、根据选项说法没有指明温度、溶质的质量,进行分析判断。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
D、根据饱和溶液的特征,进行分析判断。
本题难度不大,掌握饱和溶液的特征、溶解度的含义、溶液是否饱和与溶液的浓稀没有必然联系等是正确解答本题的关键。
9.??
解:A、饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,如氢氧化钙的饱和溶液就是稀溶液,故A错误;
B、饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,如氢氧化钙的饱和溶液就是稀溶液,故B错误;
C、当温度升高时,饱和溶液不一定能变成不饱和溶液,例如氢氧化钙的溶解度随温度的升高而减小,故氢氧化钙的饱和溶液温度升高后还是饱和溶液,故C错误;
D、在一定温度下,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,故D正确。
故选:D。
A、根据饱和溶液的含义进行解答;
B、根据饱和溶液的含义进行解答;
C、根据当温度升高时,饱和溶液不一定能变成不饱和溶液进行解答;
D、根据不饱和溶液的含义进行解答
明确饱和溶液与浓稀溶液的关系是解答本题关健,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。
10.??
解:①溶解时不断搅拌,能加快分子运动速度,能加快固体与水的接触机会,从而加快了食盐的速率速率。
②把大颗粒的固体碾成粉末,增加了固体与水的接触面积,加快了固体的溶解速率。
③增加水的用量,实际上是影响溶解溶质的量的多少,与溶解速率无关。
④溶解时给物质加热,升高温度能加快分子运动速度,能加快固体与水的接触机会,从而加快了固体的溶解速率。
⑤减少水的用量,实际上是影响溶解溶质的量的多少,与溶解速率无关。
⑥静置,能使不溶物沉淀,不能加快固体物质的溶解速率。
故①②④能够加快固体物质的溶解速率。
故选:B。
只要能改变固体与水的接触机会就能改变固体的溶解速率;加快固体物质溶解速率的方法主要有:搅拌、加热、磨成粉末等,其中研成粉末状是为了增加溶质溶剂的接触面积。
本题难度不大,考查了影响物质溶解速度的因素,了解影响物质溶解速率的因素(搅拌、加热、研磨等)即可正确解答本题。
11.??
解:(1)甲物质的溶解度曲线较陡,所以甲、乙、丙三种固体物质溶解度受温度影响最大的是甲;
(2)欲将t1℃时乙物质的不饱和溶液转化为该温度下的饱和溶液,可采取的方法是加溶质或蒸发溶剂;
(3)甲物质的溶解度受温度变化影响较大,所以若甲中含有少量乙,提纯甲的方法是降温结晶;
(4)A、t1℃时,甲、乙两物质的溶解度相等,但是溶液的整体不能确定,所以溶质质量分数不一定相等,故A错误;
B、t2℃,甲物质的溶解度是50g,所以配制300g甲的饱和溶液,需要固体甲的质量为100g,故B正确;
C、t2℃甲、乙、丙三种饱和溶液降温到t1℃,饱和溶液的质量不能确定,所以析出晶体的质量也不能确定,故C错误;
D、t1℃时,甲、乙物质的溶解度相等,丙物质的溶解度最小,所以等质量的甲、乙、丙三种固体配制成该温度下的饱和溶液,所得溶液的质量大小:丙>甲=乙,故D正确。
故选:BD。
故答案为:(1)甲;
(2)加溶质或蒸发溶剂(或者加入乙,蒸发水);
(3)降温结晶;
(4)BD。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定配制饱和溶液需要的固体质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯固体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
12.??
解:在海底热液中溶有一些矿物质冷却热液,这些矿物质就会不断结晶析出,说明温度降低,有晶体析出,说明这些矿物质的溶解度随着温度的降低而减小。
故答案为:
减小。
根据题意,在海底热液中溶有一些矿物质冷却热液,这些矿物质就会不断结晶析出,进行分析解答。
本题难度不大,明确冷却热液不断结晶析出矿物质是正确解答本题的关键。
13.??
解:(1)图1中甲烧杯底部有不溶解的晶体存在,说明在该温度下甲溶液饱和,而乙溶液可能饱和也可能不饱和;因为两种物质的溶解度均随着温度的升高而增大,所以升温后所得图2中的乙一定不饱和;
(2)根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,所以N表示的是乙物质的溶解度曲线;因为乙在20℃时没有晶体存在,所以降温至30℃也不会出现晶体。
故答案为:(1)甲;不饱和;
(2)N;不会。
(1)根据烧杯底部是否有不溶解的固体存在以及温度升高后,溶解度的变化情况进行分析;
(2)根据图1中20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g水的烧杯中,甲有固体剩余,说明甲的溶解度小于乙,结合图3进行分析。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
14.??
解:(1)通过分析溶解度曲线可知,t2℃时,甲物质的溶解度为30g;
(2)甲物质的溶解度曲线较陡,所以从图中获得的信息有:甲物质的溶解度受温度变化影响较大;
(3)t1℃时,乙物质的溶解度大于10g,所以将10g乙物质放入100g水中,充分溶解后所得的溶液是不饱和溶液;欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法是:升高温度、增加溶剂;
(4)甲物质的溶解度受温度变化影响较大,所以若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是降温结晶.
故答案为:(1)30g;
(2)甲物质的溶解度受温度变化影响较大;
(3)不饱和;升高温度、增加溶剂;
(4)降温结晶.
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成溶液的状态;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
15.??
解:(1)由表格数据可知,20℃时,溶解度较大的物质是NaCl。
(2)硝酸钾的溶解度随温度升高而增大,40℃时,使近饱和的KNO3溶液变饱和的方法有加入硝酸钾、蒸发溶剂、降低温度等方法。
(3)60℃时,将100gKNO3饱和溶液和100gNaCl饱和溶液分别蒸发10g水,温度降到60℃时,由于60℃,硝酸钾的溶解度大于氯化钠的溶解度,析出硝酸钾的质量多,过滤,得到的KNO3固体质量大于NaCl固体质量。
故答案为:
(1)NaCl;
(2)加入硝酸钾、蒸发溶剂、降低温度;
(3)>。
(1)根据20℃时,两种物质的溶解度大小,进行分析解答。
(2)根据不饱和溶液转化为饱和溶液的方法,进行分析解答。
(3)根据60℃,硝酸钾的溶解度大于氯化钠的溶解度,进行分析解答。
本题难度不大,掌握大多数物质不饱和溶液变成饱和溶液的方法、溶解度受温度影响的变化趋势是正确解答本题的关键。
16.??
解:(1)由KCl和KNO3的溶解度数据,溶解度受温度影响较小的是KCl。
(2)40℃时,硝酸钾的溶解度为63.9g,含义是40℃时,100g水中最多溶解硝酸钾63.9g,溶液达到饱和状态,则40℃时,将40gKNO3加入100g水中,充分溶解,形成不饱和溶液。
(3)要使KCl从其饱和溶液中全部结晶析出,可用蒸发结晶的方法。
故答案为:(1)KCl;
(2)不饱和;
(3)蒸发结晶。
(1)根据KCl和KNO3的溶解度数据,进行分析解答。
(2)根据40℃时,硝酸钾的溶解度为63.9g,进行分析解答。
(3)从溶液中结晶的方法有两种:蒸发结晶和降温结晶。
本题难度不大,掌握固体物质的溶解度受温度影响的变化趋势、溶解度的含义等是正确解答本题的关键。
同课章节目录
