10-11高中化学课时讲练通课件:1.2.4 化学计量在实验中的应用(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:1.2.4 化学计量在实验中的应用(人教版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 12:04:02 | ||
图片预览





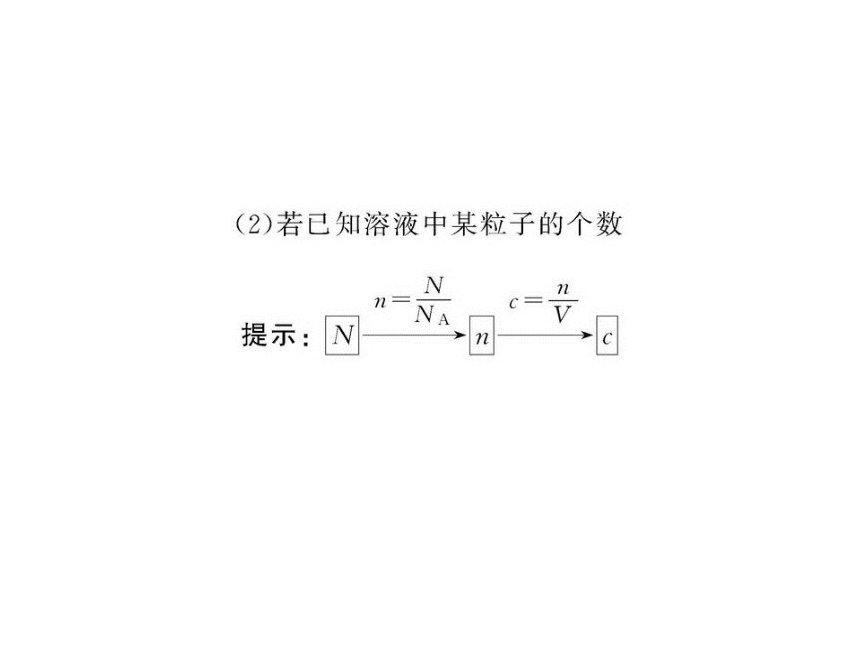
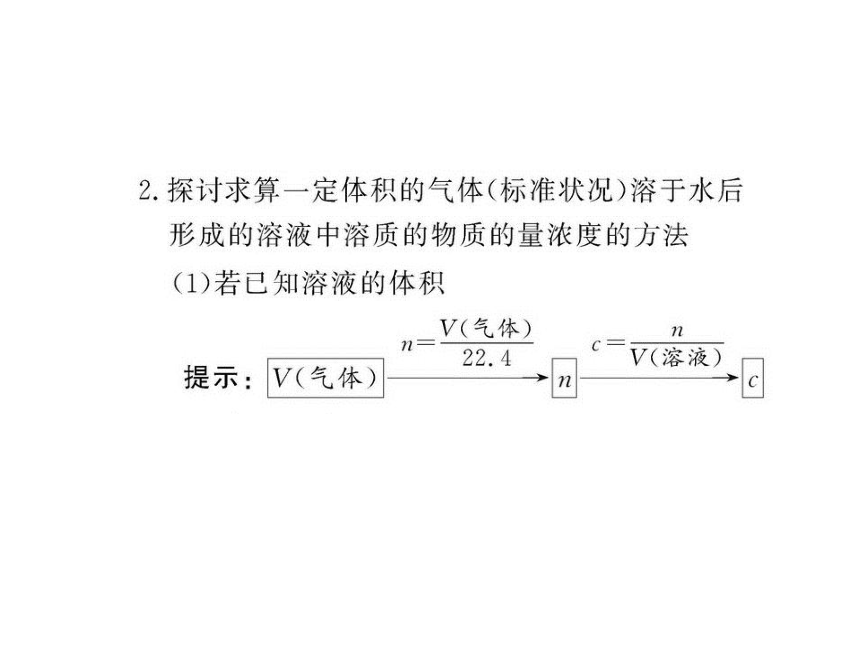





文档简介
(共60张PPT)
【典例1】若V L Fe2(SO4)3溶液中含Fe3+m g,则此溶液中SO42-的物质的量浓度是
A.56/V mol/L B.3m/56V mol/L
C.m/56V mol/L D. 3m/112V mol/L
【思路点拨】计算物质的量浓度时,要利用基本公式cB=nB/V来计算,
(1)先求出溶质的物质的量,
(2)再求出溶液的体积,
(3)最后再进行浓度计算。
【自主解答】选D。Fe3+的物质的量为m g÷56 g/mol
=m/56 mol,Fe3+的物质的量浓度为m/56mol÷V L=
m/56V mol/L,SO42-的物质的量浓度是Fe3+的物质的量浓度的1.5倍,SO42-的物质的量浓度是m/56V mol/L
×1.5=3m/112V mol/L。
【典例2】(2010·南昌高一检测)要把12 mol/L的盐酸(密度1.19 g/cm3)50 mL稀释成6 mol/L 的盐酸(密度1.10 g/cm3),需加水
A.50 mL B.50.5 mL C.55 mL D.59.5 mL
【思路点拨】本题考查了溶液稀释的有关计算,根据公式:c(浓)·V(浓)=c(稀) ·V(稀)来计算。
【自主解答】选B。稀释前后溶质的物质的量不变,
12 mol/L×50 mL=6 mol/L×V(稀),V(稀)=
100 mL,稀释前溶液的质量为1.19 g/cm3×50 mL
=59.5 g,稀释后溶液的质量为1.10 g/cm3×100 mL
=110 g,二者的质量差即为加入水的质量110 g-
59.5 g=50.5 g,水的密度为1 g/cm3,故其体积为
50.5 mL。
【典例3】(2010·柳州高一检测)质量分数为98%的浓硫酸,密度为1.84 g/mL,则这种硫酸的物质的量浓度为
A.1.84 mol/L B.9.2 mol/L
C.36.8 mol/L D.18.4 mol/L
思路点拨:依据n=cBV=m(溶质)/M,m溶液=ρV,m溶质=
m溶液·w%推出c与ρ、w%的关系。
【自主解答】选D。设浓硫酸的体积为1 L,其质量为1.84 g/mL×1 L=1 840 g,所含有的溶质硫酸的质量为1 840 g×98%=18.4×98 g,其物质的量为18.4×
98 g÷98 g/mol=18.4 mol,物质的量浓度为18.4 mol
÷1 L=18.4 mol/L。
知识点一:物质的量浓度的简单计算
1.500 mL 1 mol/L的溶液含某化合物20 g,该化合物的相对分子质量为( )
A.50 B.40 C.80 D.20
【解析】选B。该溶液中化合物的物质的量为500 mL
×1 mol/L=0.5 mol,其摩尔质量为20 g÷0.5 mol
=40 g/mol,摩尔质量与相对分子质量在数值上相等,所以其相对分子质量为40。
2.1 mol/L的FeCl3溶液与1 mol/L的KCl溶液中Cl-的物质的量浓度之比为( )
A.1∶1 B.2∶1 C.3∶1 D.1∶3
【解析】选C。1 mol/L的FeCl3溶液中Cl-的物质的量浓度为3 mol/L,1 mol/L的KCl溶液中Cl-的物质的量浓度为1 mol/L,其比值为3∶1。
知识点二:溶液的稀释或混合计算
3.将100 mL 0.1 mol/L的BaCl2溶液与50 mL 0.2 mol/L
的NaCl溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是( )
A.0.2 mol/L B.0.01 mol/L
C.0.1 mol/L D.0.02 mol/L
解题提示:不考虑溶液混合时体积的变化,混合溶液的体积等于两溶液体积之和。
【解析】选A。混合前后溶质的物质的量不变,混合
溶液氯离子浓度为(100 mL×2×0.1 mol/L+50 mL
×0.2 mol/L)÷(100 mL+50 mL)=0.2 mol/L。
4.欲将0.1 mol/L的NaOH溶液和0.6 mol/L的NaOH溶液混合成0.2 mol/L的NaOH溶液,求这两种溶液的体积比为(忽略混合时的体积变化)( )
A.1∶1 B.2∶1 C.3∶1 D.4∶1
【解析】选D。设所需0.1 mol/L的NaOH溶液和0.6mo l/L
的NaOH溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变可得:0.1 mol/L×V1+0.6 mol/L
×V2=0.2 mol/L×(V1+V2),解得:V1∶V2=4∶1。
知识点三:物质的量浓度与溶质的质量分数之间的换算
5.50 mL物质的量浓度为4.4 mol/L,密度为1 240 g/L的稀硫酸的质量分数为( )
A.35% B.70% C.17.5% D.0.035%
解题提示:ρ的单位为g/L,此类题目也可直接套用公式:c=ρw/M求解。
【解析】选A。硫酸的物质的量为4.4 mol/L×50 mL
×10-3 L/mL=0.22 mol,其质量为98 g/mol×0.22 mol
=21.56 g,硫酸溶液的质量为1 240 g/L×50 mL×
10-3 L/mL=62 g,质量分数为21.56 g÷62 g×100%
=35%。
6.(2010·上海高一检测)下图为某市售盐酸试剂瓶上的部分数据。
该市售盐酸的物质的量浓度为______。
解题提示:此类题目也可直接套用公式:
c=1 000ρw/M求解。
【解析】设盐酸的体积为1 L,其质量为1.18 g/cm3
×1 L=1 180 g,所含有的溶质HCl的质量为1 180 g
×36.5%=11.8×36.5 g,其物质的量为11.8×36.5 g
÷36.5 g/mol=11.8 mol,物质的量浓度为11.8 mol
÷1 L=11.8 mol/L。
答案:11.8 mol/L
一、选择题(本题包括5个小题,每小题4分,共20分)
1.如果1 L硫酸溶液中含有6.02×1023个H+,则该硫酸的浓度是( )
A.2 mol/L B.1.5 mol/L
C.1 mol/L D.0.5 mol/L
【解析】选D。6.02×1023个H+是1 mol H+,因1 mol H2SO4含H+ 2 mol,所以H2SO4物质的量是0.5 mol,浓度是0.5 mol÷1 L=0.5 mol/L。
2.(2010·柳州高一检测)将5 mol/L的Mg(NO3)2溶液
a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度
为( )
【解析】选B。稀释前后溶质的物质的量不变,
5 mol/L×a mL=c(稀)×b mL,c(稀)=
5a/b mol/L,NO3-的物质的量浓度是Mg(NO3)2
浓度的2倍,c(NO3-)=5a/b mol/L×2=
10a/b mol/L。
3.现需5 mol/L的盐酸200 mL,下列方法一定可以实现的是( )
A.将22.4 L HCl气体溶于水稀释至200 mL
B.将36.5 g HCl气体溶于200 mL水中
C.取10 mol/L的盐酸100 mL加水100 mL
D.取10 mol/L的盐酸100 mL加水稀释至200 mL
【解析】选D。200 mL 5 mol/L的盐酸中所含溶质的
物质的量为200 mL×5 mol/L=1 mol。 A项未指明气
体所处的状况是标准状况,故22.4 L HCl气体不一定
为1 mol,A错误;B项HCl的物质的量为36.5 g÷
36.5 g/mol=1 mol,但200 mL不是溶液的体积,而是
溶剂的体积,B错误;C、D两项中溶质的物质的量均
为10 mol/L×100 mL=1 mol,但C中溶液的体积不等
于两体积之和200 mL,C错误,D正确。
4.(2010·湛江高一检测)100 mL 0.30 mol/L Na2SO4溶液和50 mL 0.20 mol/L Al2(SO4)3溶液混合后(忽略混合时体积的变化),在相同温度下溶液中SO42-的物质的量浓度为( )
A.0.20 mol/L B.0.25 mol/L
C.0.40 mol/L D.0.50 mol/L
【解析】选C。0.30 mol/L Na2SO4溶液中SO42-的物质的量浓度为0.30 mol/L,0.20 mol/L Al2(SO4)3溶液中SO42-的物质的量浓度为0.60 mol/L,混合后SO42-的物质的量浓度为(0.30 mol/L×0.1 L+0.60 mol/L
×0.05 L)÷(0.1 L+ 0.05 L) =0.40 mol/L。
5.下列溶液中Cl-的物质的量与100 mL 1 mol/L MgCl2溶液中Cl-的物质的量相同的是( )
A.50 mL 2 mol/L CaCl2溶液
B.50 mL 2 mol/L KCl溶液
C.50 mL 4 mol/L BaCl2溶液
D.100 mL 4 mol/L NaCl溶液
【解析】选A。100 mL 1 mol/L MgCl2溶液中Cl-的物质的量为:100 mL×1 mol/L×2=0.2 mol;各选项中Cl-的物质的量分别为:A中50 mL×2 mol/L×2=
0.2 mol;B中50 mL×2 mol/L=0.1 mol;C中50 mL
×4 mol/L×2=0.4 mol;D中100 mL×4 mol/L=
0.4 mol,故选A。
二、非选择题(本题包括1个小题,共10分)
6.用20 g烧碱配制成500 mL溶液,其物质的量浓度为____mol/L;从中取出1 mL,其物质的量浓度为____mol/L,含溶质____g。若将这1 mL溶液用水稀释到100 mL,所得溶液中溶质的物质的量浓度为____mol/L,其中含Na+ ____个。
【解析】20 g烧碱配制成500 mL溶液,其物质的量
浓度为20 g÷40 g/mol÷0.5 L=1 mol/L;从中取出
的溶液浓度不变,溶质的物质的量为1 mol/L×
0.001 L=0.001 mol,其质量为0.001 mol×40 g/mol
=0.04 g;根据稀释时溶质不变,1 mL×1 mol/L=
c(稀)×100 mL,c(稀)=0.01 mol/L;Na+的物
质的量为0.001 mol,其个数为0.001 mol×
6.02×1023/mol=6.02×1020(或0.001NA)个。
答案:1 1 0.04 0.01
6.02×1020(或0.001NA)
1.(5分)(2010·雅安高一检测)V mL Al2(SO4)3溶液中含有Al3+ a g,取V/4 mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.125a/9V mol/L B.125a/18V mol/L
C.125a/36V mol/L D.125a/54V mol/L
【解析】选C。a g Al3+的物质的量为a g÷27 g/mol
=a/27 mol,Al3+的物质的量浓度为a/27 mol÷V mL=
1 000a/27V mol/L,c(SO42-)∶c(Al3+)=3∶2,
所以c(SO42-)=1 000a/27V mol/L×3/2=
3 000a/54V mol/L,稀释前后溶质的物质的量不变,
3 000a/54V mol/L×V/4 mL=c(稀)×4V mL,
c(稀)=3 000a/54V mol/L÷16=125a/36V mol/L。
2.(15分)(2010·南昌高一检测)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O(相对分子质量为250),恰好达到饱和,该溶液密度为1.21 g/cm3,求:
(1)该溶液中Cu2+、SO42-的总物质的量。
(2)该溶液中CuSO4的物质的量浓度。(保留2位有效数字)
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少mL?
【解析】12.5 g CuSO4·5H2O的物质的量为12.5 g
÷250 g/mol=0.05 mol,该溶液中离子的总物质的量
为n(Cu2+)+n (SO42-)=0.05 mol+0.05 mol=0.1 mol;
溶液的质量为27.5 g+12.5 g=40 g,溶液的体积为
40 g÷1 210 g/L=0.033 L,CuSO4的物质的量浓度
c(CuSO4)=0.05 mol÷0.033 L=1.5 mol/L;
20.0 mL×1.5 mol/L=V(稀溶液)×1.00 mol/L,
V(稀溶液)=30 mL。
答案:(1)0.1 mol
(2)1.5 mol/L
(3)30 mL
【典例1】若V L Fe2(SO4)3溶液中含Fe3+m g,则此溶液中SO42-的物质的量浓度是
A.56/V mol/L B.3m/56V mol/L
C.m/56V mol/L D. 3m/112V mol/L
【思路点拨】计算物质的量浓度时,要利用基本公式cB=nB/V来计算,
(1)先求出溶质的物质的量,
(2)再求出溶液的体积,
(3)最后再进行浓度计算。
【自主解答】选D。Fe3+的物质的量为m g÷56 g/mol
=m/56 mol,Fe3+的物质的量浓度为m/56mol÷V L=
m/56V mol/L,SO42-的物质的量浓度是Fe3+的物质的量浓度的1.5倍,SO42-的物质的量浓度是m/56V mol/L
×1.5=3m/112V mol/L。
【典例2】(2010·南昌高一检测)要把12 mol/L的盐酸(密度1.19 g/cm3)50 mL稀释成6 mol/L 的盐酸(密度1.10 g/cm3),需加水
A.50 mL B.50.5 mL C.55 mL D.59.5 mL
【思路点拨】本题考查了溶液稀释的有关计算,根据公式:c(浓)·V(浓)=c(稀) ·V(稀)来计算。
【自主解答】选B。稀释前后溶质的物质的量不变,
12 mol/L×50 mL=6 mol/L×V(稀),V(稀)=
100 mL,稀释前溶液的质量为1.19 g/cm3×50 mL
=59.5 g,稀释后溶液的质量为1.10 g/cm3×100 mL
=110 g,二者的质量差即为加入水的质量110 g-
59.5 g=50.5 g,水的密度为1 g/cm3,故其体积为
50.5 mL。
【典例3】(2010·柳州高一检测)质量分数为98%的浓硫酸,密度为1.84 g/mL,则这种硫酸的物质的量浓度为
A.1.84 mol/L B.9.2 mol/L
C.36.8 mol/L D.18.4 mol/L
思路点拨:依据n=cBV=m(溶质)/M,m溶液=ρV,m溶质=
m溶液·w%推出c与ρ、w%的关系。
【自主解答】选D。设浓硫酸的体积为1 L,其质量为1.84 g/mL×1 L=1 840 g,所含有的溶质硫酸的质量为1 840 g×98%=18.4×98 g,其物质的量为18.4×
98 g÷98 g/mol=18.4 mol,物质的量浓度为18.4 mol
÷1 L=18.4 mol/L。
知识点一:物质的量浓度的简单计算
1.500 mL 1 mol/L的溶液含某化合物20 g,该化合物的相对分子质量为( )
A.50 B.40 C.80 D.20
【解析】选B。该溶液中化合物的物质的量为500 mL
×1 mol/L=0.5 mol,其摩尔质量为20 g÷0.5 mol
=40 g/mol,摩尔质量与相对分子质量在数值上相等,所以其相对分子质量为40。
2.1 mol/L的FeCl3溶液与1 mol/L的KCl溶液中Cl-的物质的量浓度之比为( )
A.1∶1 B.2∶1 C.3∶1 D.1∶3
【解析】选C。1 mol/L的FeCl3溶液中Cl-的物质的量浓度为3 mol/L,1 mol/L的KCl溶液中Cl-的物质的量浓度为1 mol/L,其比值为3∶1。
知识点二:溶液的稀释或混合计算
3.将100 mL 0.1 mol/L的BaCl2溶液与50 mL 0.2 mol/L
的NaCl溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是( )
A.0.2 mol/L B.0.01 mol/L
C.0.1 mol/L D.0.02 mol/L
解题提示:不考虑溶液混合时体积的变化,混合溶液的体积等于两溶液体积之和。
【解析】选A。混合前后溶质的物质的量不变,混合
溶液氯离子浓度为(100 mL×2×0.1 mol/L+50 mL
×0.2 mol/L)÷(100 mL+50 mL)=0.2 mol/L。
4.欲将0.1 mol/L的NaOH溶液和0.6 mol/L的NaOH溶液混合成0.2 mol/L的NaOH溶液,求这两种溶液的体积比为(忽略混合时的体积变化)( )
A.1∶1 B.2∶1 C.3∶1 D.4∶1
【解析】选D。设所需0.1 mol/L的NaOH溶液和0.6mo l/L
的NaOH溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变可得:0.1 mol/L×V1+0.6 mol/L
×V2=0.2 mol/L×(V1+V2),解得:V1∶V2=4∶1。
知识点三:物质的量浓度与溶质的质量分数之间的换算
5.50 mL物质的量浓度为4.4 mol/L,密度为1 240 g/L的稀硫酸的质量分数为( )
A.35% B.70% C.17.5% D.0.035%
解题提示:ρ的单位为g/L,此类题目也可直接套用公式:c=ρw/M求解。
【解析】选A。硫酸的物质的量为4.4 mol/L×50 mL
×10-3 L/mL=0.22 mol,其质量为98 g/mol×0.22 mol
=21.56 g,硫酸溶液的质量为1 240 g/L×50 mL×
10-3 L/mL=62 g,质量分数为21.56 g÷62 g×100%
=35%。
6.(2010·上海高一检测)下图为某市售盐酸试剂瓶上的部分数据。
该市售盐酸的物质的量浓度为______。
解题提示:此类题目也可直接套用公式:
c=1 000ρw/M求解。
【解析】设盐酸的体积为1 L,其质量为1.18 g/cm3
×1 L=1 180 g,所含有的溶质HCl的质量为1 180 g
×36.5%=11.8×36.5 g,其物质的量为11.8×36.5 g
÷36.5 g/mol=11.8 mol,物质的量浓度为11.8 mol
÷1 L=11.8 mol/L。
答案:11.8 mol/L
一、选择题(本题包括5个小题,每小题4分,共20分)
1.如果1 L硫酸溶液中含有6.02×1023个H+,则该硫酸的浓度是( )
A.2 mol/L B.1.5 mol/L
C.1 mol/L D.0.5 mol/L
【解析】选D。6.02×1023个H+是1 mol H+,因1 mol H2SO4含H+ 2 mol,所以H2SO4物质的量是0.5 mol,浓度是0.5 mol÷1 L=0.5 mol/L。
2.(2010·柳州高一检测)将5 mol/L的Mg(NO3)2溶液
a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度
为( )
【解析】选B。稀释前后溶质的物质的量不变,
5 mol/L×a mL=c(稀)×b mL,c(稀)=
5a/b mol/L,NO3-的物质的量浓度是Mg(NO3)2
浓度的2倍,c(NO3-)=5a/b mol/L×2=
10a/b mol/L。
3.现需5 mol/L的盐酸200 mL,下列方法一定可以实现的是( )
A.将22.4 L HCl气体溶于水稀释至200 mL
B.将36.5 g HCl气体溶于200 mL水中
C.取10 mol/L的盐酸100 mL加水100 mL
D.取10 mol/L的盐酸100 mL加水稀释至200 mL
【解析】选D。200 mL 5 mol/L的盐酸中所含溶质的
物质的量为200 mL×5 mol/L=1 mol。 A项未指明气
体所处的状况是标准状况,故22.4 L HCl气体不一定
为1 mol,A错误;B项HCl的物质的量为36.5 g÷
36.5 g/mol=1 mol,但200 mL不是溶液的体积,而是
溶剂的体积,B错误;C、D两项中溶质的物质的量均
为10 mol/L×100 mL=1 mol,但C中溶液的体积不等
于两体积之和200 mL,C错误,D正确。
4.(2010·湛江高一检测)100 mL 0.30 mol/L Na2SO4溶液和50 mL 0.20 mol/L Al2(SO4)3溶液混合后(忽略混合时体积的变化),在相同温度下溶液中SO42-的物质的量浓度为( )
A.0.20 mol/L B.0.25 mol/L
C.0.40 mol/L D.0.50 mol/L
【解析】选C。0.30 mol/L Na2SO4溶液中SO42-的物质的量浓度为0.30 mol/L,0.20 mol/L Al2(SO4)3溶液中SO42-的物质的量浓度为0.60 mol/L,混合后SO42-的物质的量浓度为(0.30 mol/L×0.1 L+0.60 mol/L
×0.05 L)÷(0.1 L+ 0.05 L) =0.40 mol/L。
5.下列溶液中Cl-的物质的量与100 mL 1 mol/L MgCl2溶液中Cl-的物质的量相同的是( )
A.50 mL 2 mol/L CaCl2溶液
B.50 mL 2 mol/L KCl溶液
C.50 mL 4 mol/L BaCl2溶液
D.100 mL 4 mol/L NaCl溶液
【解析】选A。100 mL 1 mol/L MgCl2溶液中Cl-的物质的量为:100 mL×1 mol/L×2=0.2 mol;各选项中Cl-的物质的量分别为:A中50 mL×2 mol/L×2=
0.2 mol;B中50 mL×2 mol/L=0.1 mol;C中50 mL
×4 mol/L×2=0.4 mol;D中100 mL×4 mol/L=
0.4 mol,故选A。
二、非选择题(本题包括1个小题,共10分)
6.用20 g烧碱配制成500 mL溶液,其物质的量浓度为____mol/L;从中取出1 mL,其物质的量浓度为____mol/L,含溶质____g。若将这1 mL溶液用水稀释到100 mL,所得溶液中溶质的物质的量浓度为____mol/L,其中含Na+ ____个。
【解析】20 g烧碱配制成500 mL溶液,其物质的量
浓度为20 g÷40 g/mol÷0.5 L=1 mol/L;从中取出
的溶液浓度不变,溶质的物质的量为1 mol/L×
0.001 L=0.001 mol,其质量为0.001 mol×40 g/mol
=0.04 g;根据稀释时溶质不变,1 mL×1 mol/L=
c(稀)×100 mL,c(稀)=0.01 mol/L;Na+的物
质的量为0.001 mol,其个数为0.001 mol×
6.02×1023/mol=6.02×1020(或0.001NA)个。
答案:1 1 0.04 0.01
6.02×1020(或0.001NA)
1.(5分)(2010·雅安高一检测)V mL Al2(SO4)3溶液中含有Al3+ a g,取V/4 mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
A.125a/9V mol/L B.125a/18V mol/L
C.125a/36V mol/L D.125a/54V mol/L
【解析】选C。a g Al3+的物质的量为a g÷27 g/mol
=a/27 mol,Al3+的物质的量浓度为a/27 mol÷V mL=
1 000a/27V mol/L,c(SO42-)∶c(Al3+)=3∶2,
所以c(SO42-)=1 000a/27V mol/L×3/2=
3 000a/54V mol/L,稀释前后溶质的物质的量不变,
3 000a/54V mol/L×V/4 mL=c(稀)×4V mL,
c(稀)=3 000a/54V mol/L÷16=125a/36V mol/L。
2.(15分)(2010·南昌高一检测)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O(相对分子质量为250),恰好达到饱和,该溶液密度为1.21 g/cm3,求:
(1)该溶液中Cu2+、SO42-的总物质的量。
(2)该溶液中CuSO4的物质的量浓度。(保留2位有效数字)
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少mL?
【解析】12.5 g CuSO4·5H2O的物质的量为12.5 g
÷250 g/mol=0.05 mol,该溶液中离子的总物质的量
为n(Cu2+)+n (SO42-)=0.05 mol+0.05 mol=0.1 mol;
溶液的质量为27.5 g+12.5 g=40 g,溶液的体积为
40 g÷1 210 g/L=0.033 L,CuSO4的物质的量浓度
c(CuSO4)=0.05 mol÷0.033 L=1.5 mol/L;
20.0 mL×1.5 mol/L=V(稀溶液)×1.00 mol/L,
V(稀溶液)=30 mL。
答案:(1)0.1 mol
(2)1.5 mol/L
(3)30 mL
