10-11高中化学课时讲练通课件:2.2.1 离子反应(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:2.2.1 离子反应(人教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 00:00:00 | ||
图片预览











文档简介
(共48张PPT)
【典例1】今有10种物质:①铝线;②石墨;③纯碱;④CO2;⑤纯硫酸;⑥烧碱;⑦食盐水;⑧酒精;⑨熔融的KNO3;⑩NH3。其中:
(1)能导电的是______(填序号,下同);
(2)属于电解质的是______;
(3)属于非电解质的是______;
(4)既不是电解质又不是非电解质的是______。
【思路点拨】熟记电解质和非电解质的类别,明确电解质导电的条件是关键!
【自主解答】铝线、石墨能导电,是单质,不是电解质,也不是非电解质;酸、碱、盐属于电解质,故纯硫酸、烧碱(NaOH)、纯碱(Na2CO3)是电解质,但都没电离,所以不导电;食盐水能导电,属于混合物,但不是电解质,也不是非电解质;酒精、NH3、CO2是非电解质,不导电;熔融的KNO3发生了电离,有自由移动的离子,能导电,是电解质。
答案:(1)①②⑦⑨ (2)③⑤⑥⑨ (3)④⑧⑩ (4)①②⑦
【典例2】(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:_______________________________;
②KHSO4: ________________________________;
③HNO3: ________________________________ ;
④Na2CO3: _______________________________;
(2)按酸、碱、盐分类,其中,属于酸的是____(填序号,下同),属于碱的是____,属于盐的是____。
【思路点拨】书写电离方程式时注意质量守恒和电荷守恒。
【自主解答】根据酸、碱、盐的定义,结合(1)问中的电离方程式中的离子种类,即能解答。
答案:(1)①Ba(OH)2====Ba2++2OH-
②KHSO4====K++H++SO42-
③HNO3====H++NO3-
④Na2CO3====2Na++CO32-
(2)③ ① ②④
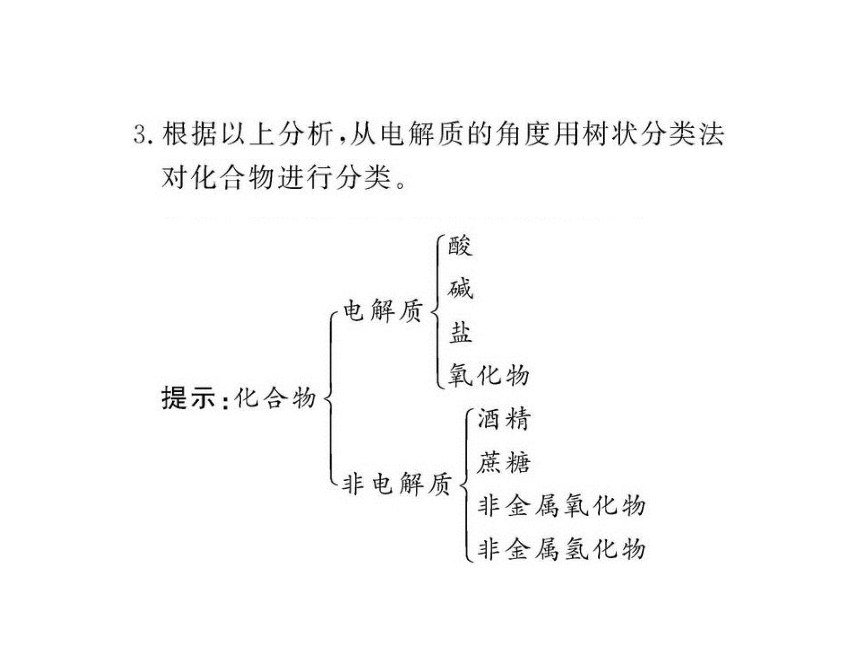
知识点一:电解质和非电解质
1.下列物质中,属于电解质的是( )
A.二氧化碳 B.蔗糖 C.铜 D.硝酸钾
【解析】选D。从物质类别上说,酸、碱、盐和水属于电解质。
2.下列物质属于非电解质的是( )
A.NH3 B.(NH4)2SO4 C.Cl2 D.CH3COOH
【解析】选A。A项,NH3溶于水可以导电,但不是NH3发生了电离,而是NH3·H2O电离出了离子,所以NH3不属于电解质,而是非电解质;B项的(NH4)2SO4是盐,属于电解质;C项Cl2为单质,不是化合物,既不属于电解质,也不属于非电解质;D项CH3COOH是酸,属于电解质。
3.电解质不仅在工农业生产中占有重要地位,而且在各种生命活动中也起着重要作用,则下列有关电解质的叙述正确的是( )
A.化合物都是电解质
B.电解质一定是化合物
C.SO3溶于水形成的溶液能导电,所以SO3是电解质
D.NaCl固体不导电,所以NaCl不是电解质
解题提示:非金属氧化物是非电解质,不论它是否溶于水,溶于水后是否导电。
【解析】选B。化合物不全是电解质,也有非电解质,所以A错;电解质和非电解质都必须是化合物,B正确;SO3溶于水发生反应:SO3+H2O====H2SO4,H2SO4====2H++SO42-,所以H2SO4是电解质而SO3是非电解质,C错;NaCl在水溶液或熔融状态下都能导电,所以是电解质,D错。
知识点二:电解质的电离
4.(2010·上海高一检测)下列状态的物质,既能导电又属于电解质的是( )
A.氯化镁晶体 B.氯化钠溶液
C.液态氯化氢 D.熔融氢氧化钾
解题提示:只要是溶液,均为混合物,均既不是电解质,也不是非电解质。
【解析】选D。电解质导电所需的条件是在水溶液中或熔融状态下,氯化镁晶体为固态,不导电,是电解质;氯化钠溶液导电,但为混合物,不是电解质;液态氯化氢不导电,是电解质,只有溶于水才导电;熔融氢氧化钾能导电,也是电解质。
5.下列都是错误的电离方程式,请指出错误之处并改正。
(1)K2CO3====K2++CO32-
____应改为____ 。
(2)CaCl2====Ca2++Cl2-
____应改为____ 。
(3)FeCl3====Fe2++3Cl-
____应改为____ 。
(4)Ba(OH)2====Ba2++(OH)2-
____应改为____ 。
【解析】注意阴、阳离子所带的电荷数及阴、阳离子前面的化学计量数。
答案:(1)K2+ 2K+
(2)Cl2- 2Cl-
(3)Fe2+ Fe3+
(4)(OH)2- 2OH-
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列有关电解质的叙述正确的是( )
A.电解质是在溶于水和熔融状态下均导电的化合物
B.电解质与非电解质的本质区别是在一定条件下本身能否电离
C.某物质不是电解质就是非电解质
D.电解质是可溶性盐类
【解析】选B。电解质就是在溶于水或熔融状态下能导电的化合物,注意是“或”而不是“和”,二者具备其一即可,A错误;电解质导电即本身发生电离,故B正确;物质包括单质、化合物,也包括混合物,不是电解质的物质,也不一定是非电解质,如单质或混合物既不是电解质也不是非电解质,C错误;酸、碱、盐均为电解质,电解质不仅仅包括可溶性盐类,D错误。
2.(2010·上海高一检测)下列物质在一定条件下能够导电,但不是电解质的是( )
A.铝 B.氯化钠 C.硫酸 D.蔗糖
【解析】选A。铝为金属单质,导电,但不是电解质;氯化钠、硫酸溶于水能够导电,均为电解质;蔗糖是非电解质,不导电
3.下列物质在水溶液中的电离方程式书写错误的
是( )
A.K2CO3====2K++CO32-
B.Ca(OH)2====Ca2++2OH-
C.H2SO4====2H++SO42-
D.KClO3====K++Cl5++3O2-
【解析】选D。氯酸根(ClO3-)是原子团,是一个整体,不能拆分,其正确的电离方程式应为KClO3====K++ClO3-。
4.下列物质中,含有自由移动的Cl-的是( )
A.NaClO3溶液 B.CaCl2溶液
C.KCl晶体 D.液态氯化氢
【解析】选B。A中电离出Na+和ClO3-;B中电离出Ca2+和Cl-;C中KCl晶体不电离;D中HCl为液态不是溶液,不电离。
5.(2010·天津五校联考)化学兴趣小组在家中进行化学实验,按照如图左连接好线路发现灯泡不亮,按照如图右连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中,水电离出大量的离子
【解析】选C。本题主要考查对电解质概念的理解和电解质溶液导电的实质。固体NaCl不导电,但它的水溶液却能导电,故NaCl为电解质。NaCl在水溶液中能导电是由于其在溶液中电离出自由移动的离子。
二、非选择题(本题包括1个小题,共10分)
6.以下10种为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥酒精 ⑦CaCO3 ⑧BaSO4 ⑨NaOH ⑩Cu(OH)2
请按下列分类标准回答问题。
(1)属于电解质的是____。
(2)能电离出H+的是____ ,属于酸的是____ 。
(3)属于碱的是____ 。
(4)属于难溶盐的是____ 。
【解析】酸、碱、盐均为电解质,电离产生的阳离子全为H+的为酸,产生的阴离子全为OH-的为碱,要记住常见酸、碱、盐的溶解性。
答案:(1)②③⑤⑦⑧⑨⑩ (2)③⑤ ⑤
(3)⑨⑩ (4)⑦⑧
1.(5分)下列叙述正确的是( )
A.NaCl溶液在电流作用下电离成Na+和Cl-
B.NaCl是电解质,故NaCl晶体能导电
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
【解析】选C。电解质电离的条件是溶于水或受热熔融,不是通电,NaCl虽是电解质,但其晶体没有电离出自由移动的离子,液态氯化氢由分子组成不导电,溶于水时,电离出自由移动的离子,故能导电,溶液的导电性主要与单位体积内自由移动的离子的数目多少及离子所带电荷多少有关。
2.(15分)(2010·深圳高一检测)现有以下物质:
①NaCl晶体 ②液态SO3 ③液态氯化氢 ④汞
⑤BaSO4固体 ⑥纯蔗糖 ⑦酒精 ⑧熔化的KNO3。
请回答下列问题:
(1)以上物质能导电的是____。
(2)以上物质中属于电解质的是____ 。
(3)以上物质中属于非电解质的是____ 。
(4)以上物质溶于水后形成的水溶液能导电的是____。
【解析】酸、碱、盐均为电解质,电解质只有溶于水或在熔融状态下才能导电。NaCl晶体不导电,溶于水后可导电,是电解质;液态SO3不导电,是非电解质,SO3溶于水发生反应:SO3+H2O====H2SO4,H2SO4是电解质,H2SO4====2H++SO42-,故SO3溶于水后可导电;液态的氯化氢不导电,是电解质,溶于水后形成盐酸,可导电;汞为金属,导电,但不是电解质也不是非电解质;BaSO4固体不导电,是电解质,不溶于水,故水溶液不导电;纯蔗糖和酒精均为非电解质,不导电,溶
于水也不导电;熔化的KNO3即熔融状态的KNO3,导电,溶于水形成KNO3溶液,也导电。
答案:(1)④⑧ (2)①③⑤⑧
(3)②⑥⑦ (4)①②③⑧
【典例1】今有10种物质:①铝线;②石墨;③纯碱;④CO2;⑤纯硫酸;⑥烧碱;⑦食盐水;⑧酒精;⑨熔融的KNO3;⑩NH3。其中:
(1)能导电的是______(填序号,下同);
(2)属于电解质的是______;
(3)属于非电解质的是______;
(4)既不是电解质又不是非电解质的是______。
【思路点拨】熟记电解质和非电解质的类别,明确电解质导电的条件是关键!
【自主解答】铝线、石墨能导电,是单质,不是电解质,也不是非电解质;酸、碱、盐属于电解质,故纯硫酸、烧碱(NaOH)、纯碱(Na2CO3)是电解质,但都没电离,所以不导电;食盐水能导电,属于混合物,但不是电解质,也不是非电解质;酒精、NH3、CO2是非电解质,不导电;熔融的KNO3发生了电离,有自由移动的离子,能导电,是电解质。
答案:(1)①②⑦⑨ (2)③⑤⑥⑨ (3)④⑧⑩ (4)①②⑦
【典例2】(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:_______________________________;
②KHSO4: ________________________________;
③HNO3: ________________________________ ;
④Na2CO3: _______________________________;
(2)按酸、碱、盐分类,其中,属于酸的是____(填序号,下同),属于碱的是____,属于盐的是____。
【思路点拨】书写电离方程式时注意质量守恒和电荷守恒。
【自主解答】根据酸、碱、盐的定义,结合(1)问中的电离方程式中的离子种类,即能解答。
答案:(1)①Ba(OH)2====Ba2++2OH-
②KHSO4====K++H++SO42-
③HNO3====H++NO3-
④Na2CO3====2Na++CO32-
(2)③ ① ②④
知识点一:电解质和非电解质
1.下列物质中,属于电解质的是( )
A.二氧化碳 B.蔗糖 C.铜 D.硝酸钾
【解析】选D。从物质类别上说,酸、碱、盐和水属于电解质。
2.下列物质属于非电解质的是( )
A.NH3 B.(NH4)2SO4 C.Cl2 D.CH3COOH
【解析】选A。A项,NH3溶于水可以导电,但不是NH3发生了电离,而是NH3·H2O电离出了离子,所以NH3不属于电解质,而是非电解质;B项的(NH4)2SO4是盐,属于电解质;C项Cl2为单质,不是化合物,既不属于电解质,也不属于非电解质;D项CH3COOH是酸,属于电解质。
3.电解质不仅在工农业生产中占有重要地位,而且在各种生命活动中也起着重要作用,则下列有关电解质的叙述正确的是( )
A.化合物都是电解质
B.电解质一定是化合物
C.SO3溶于水形成的溶液能导电,所以SO3是电解质
D.NaCl固体不导电,所以NaCl不是电解质
解题提示:非金属氧化物是非电解质,不论它是否溶于水,溶于水后是否导电。
【解析】选B。化合物不全是电解质,也有非电解质,所以A错;电解质和非电解质都必须是化合物,B正确;SO3溶于水发生反应:SO3+H2O====H2SO4,H2SO4====2H++SO42-,所以H2SO4是电解质而SO3是非电解质,C错;NaCl在水溶液或熔融状态下都能导电,所以是电解质,D错。
知识点二:电解质的电离
4.(2010·上海高一检测)下列状态的物质,既能导电又属于电解质的是( )
A.氯化镁晶体 B.氯化钠溶液
C.液态氯化氢 D.熔融氢氧化钾
解题提示:只要是溶液,均为混合物,均既不是电解质,也不是非电解质。
【解析】选D。电解质导电所需的条件是在水溶液中或熔融状态下,氯化镁晶体为固态,不导电,是电解质;氯化钠溶液导电,但为混合物,不是电解质;液态氯化氢不导电,是电解质,只有溶于水才导电;熔融氢氧化钾能导电,也是电解质。
5.下列都是错误的电离方程式,请指出错误之处并改正。
(1)K2CO3====K2++CO32-
____应改为____ 。
(2)CaCl2====Ca2++Cl2-
____应改为____ 。
(3)FeCl3====Fe2++3Cl-
____应改为____ 。
(4)Ba(OH)2====Ba2++(OH)2-
____应改为____ 。
【解析】注意阴、阳离子所带的电荷数及阴、阳离子前面的化学计量数。
答案:(1)K2+ 2K+
(2)Cl2- 2Cl-
(3)Fe2+ Fe3+
(4)(OH)2- 2OH-
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列有关电解质的叙述正确的是( )
A.电解质是在溶于水和熔融状态下均导电的化合物
B.电解质与非电解质的本质区别是在一定条件下本身能否电离
C.某物质不是电解质就是非电解质
D.电解质是可溶性盐类
【解析】选B。电解质就是在溶于水或熔融状态下能导电的化合物,注意是“或”而不是“和”,二者具备其一即可,A错误;电解质导电即本身发生电离,故B正确;物质包括单质、化合物,也包括混合物,不是电解质的物质,也不一定是非电解质,如单质或混合物既不是电解质也不是非电解质,C错误;酸、碱、盐均为电解质,电解质不仅仅包括可溶性盐类,D错误。
2.(2010·上海高一检测)下列物质在一定条件下能够导电,但不是电解质的是( )
A.铝 B.氯化钠 C.硫酸 D.蔗糖
【解析】选A。铝为金属单质,导电,但不是电解质;氯化钠、硫酸溶于水能够导电,均为电解质;蔗糖是非电解质,不导电
3.下列物质在水溶液中的电离方程式书写错误的
是( )
A.K2CO3====2K++CO32-
B.Ca(OH)2====Ca2++2OH-
C.H2SO4====2H++SO42-
D.KClO3====K++Cl5++3O2-
【解析】选D。氯酸根(ClO3-)是原子团,是一个整体,不能拆分,其正确的电离方程式应为KClO3====K++ClO3-。
4.下列物质中,含有自由移动的Cl-的是( )
A.NaClO3溶液 B.CaCl2溶液
C.KCl晶体 D.液态氯化氢
【解析】选B。A中电离出Na+和ClO3-;B中电离出Ca2+和Cl-;C中KCl晶体不电离;D中HCl为液态不是溶液,不电离。
5.(2010·天津五校联考)化学兴趣小组在家中进行化学实验,按照如图左连接好线路发现灯泡不亮,按照如图右连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中,水电离出大量的离子
【解析】选C。本题主要考查对电解质概念的理解和电解质溶液导电的实质。固体NaCl不导电,但它的水溶液却能导电,故NaCl为电解质。NaCl在水溶液中能导电是由于其在溶液中电离出自由移动的离子。
二、非选择题(本题包括1个小题,共10分)
6.以下10种为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥酒精 ⑦CaCO3 ⑧BaSO4 ⑨NaOH ⑩Cu(OH)2
请按下列分类标准回答问题。
(1)属于电解质的是____。
(2)能电离出H+的是____ ,属于酸的是____ 。
(3)属于碱的是____ 。
(4)属于难溶盐的是____ 。
【解析】酸、碱、盐均为电解质,电离产生的阳离子全为H+的为酸,产生的阴离子全为OH-的为碱,要记住常见酸、碱、盐的溶解性。
答案:(1)②③⑤⑦⑧⑨⑩ (2)③⑤ ⑤
(3)⑨⑩ (4)⑦⑧
1.(5分)下列叙述正确的是( )
A.NaCl溶液在电流作用下电离成Na+和Cl-
B.NaCl是电解质,故NaCl晶体能导电
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
【解析】选C。电解质电离的条件是溶于水或受热熔融,不是通电,NaCl虽是电解质,但其晶体没有电离出自由移动的离子,液态氯化氢由分子组成不导电,溶于水时,电离出自由移动的离子,故能导电,溶液的导电性主要与单位体积内自由移动的离子的数目多少及离子所带电荷多少有关。
2.(15分)(2010·深圳高一检测)现有以下物质:
①NaCl晶体 ②液态SO3 ③液态氯化氢 ④汞
⑤BaSO4固体 ⑥纯蔗糖 ⑦酒精 ⑧熔化的KNO3。
请回答下列问题:
(1)以上物质能导电的是____。
(2)以上物质中属于电解质的是____ 。
(3)以上物质中属于非电解质的是____ 。
(4)以上物质溶于水后形成的水溶液能导电的是____。
【解析】酸、碱、盐均为电解质,电解质只有溶于水或在熔融状态下才能导电。NaCl晶体不导电,溶于水后可导电,是电解质;液态SO3不导电,是非电解质,SO3溶于水发生反应:SO3+H2O====H2SO4,H2SO4是电解质,H2SO4====2H++SO42-,故SO3溶于水后可导电;液态的氯化氢不导电,是电解质,溶于水后形成盐酸,可导电;汞为金属,导电,但不是电解质也不是非电解质;BaSO4固体不导电,是电解质,不溶于水,故水溶液不导电;纯蔗糖和酒精均为非电解质,不导电,溶
于水也不导电;熔化的KNO3即熔融状态的KNO3,导电,溶于水形成KNO3溶液,也导电。
答案:(1)④⑧ (2)①③⑤⑧
(3)②⑥⑦ (4)①②③⑧
