10-11高中化学课时讲练通课件:2.3.1 氧化还原反应(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:2.3.1 氧化还原反应(人教版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 12:04:02 | ||
图片预览








文档简介
(共60张PPT)
【典例】下列关于氧化还原反应的说法中正确的
是_____。
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.氧化还原反应中,反应前后一定有电子转移
D.氧化还原反应的特征是电子转移
E.没有氧元素参加的反应一定不是氧化还原反应
F.有氧元素参加的反应一定是氧化还原反应
G.复分解反应一定不是氧化还原反应
【思路点拨】判断反应是否为氧化还原反应的依据是反应中是否有元素化合价的变化。
【自主解答】元素化合价的变化是由于电子的得失
(活泼非金属或活泼金属)或电子的偏移(活泼性弱的
金属元素或非金属元素)。故A、C正确。氧化还原反
应可以有氧的得失也可以没有氧的得失。如H2+Cl2
2HCl,就与氧无关,所以B、E错。氧化还原反
应的实质是电子转移,所以D错。CaO+H2O====Ca(OH)2的反应是有氧元素参加的反应,但不是氧化还原反
应,所以F错。复分解反应无化合价的变化,一定不是
氧化还原反应,G正确。
答案:A、C、G
点燃
====
知识点一:氧化还原反应的概念
1.下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl====CaCl2+H2O+CO2↑
B.2NaHCO3 Na2CO3+H2O+CO2↑
C.Cl2+2NaOH ==== NaCl+NaClO+H2O
D.NaBr+AgNO3 ==== AgBr↓+NaNO3
△
====
【解析】选C。C中Cl元素从0价变为-1价和+1价,属于氧化还原反应。其他三个选项中所有元素均无化合价的变化,不是氧化还原反应。
2.(2010·秦皇岛高一检测)2FeBr2+3Cl2====
2FeCl3+2Br2的反应中,被氧化的元素是( )
A.Fe B.Fe和Br C.Br D.Cl
解题提示:在氧化还原反应中,得到电子或失去电子的元素不一定只有一种,在分析时,要把所有变价的元素找准,才能保证答题的准确性。
【解析】选B。Fe元素的化合价从+2价变为+3价,化合价升高,被氧化;Br元素的化合价从-1价变为0价,化合价升高,被氧化,Cl元素的化合价从0价变为-1价,化合价降低,被还原。
3.下列关于氧化还原反应实质的说法中正确的
是( )
A.是否有元素的电子转移
B.是否有元素的化合价变化
C.是否有氧元素参加
D.是否有原子的重新组合
【解析】选A。氧化还原反应的本质为在反应中有电子转移,特征为反应中有元素的化合价变化,是否有氧元素参加仅是氧化还原反应的一个方面,是否有原子的重新组合是化学反应的本质,故选A。
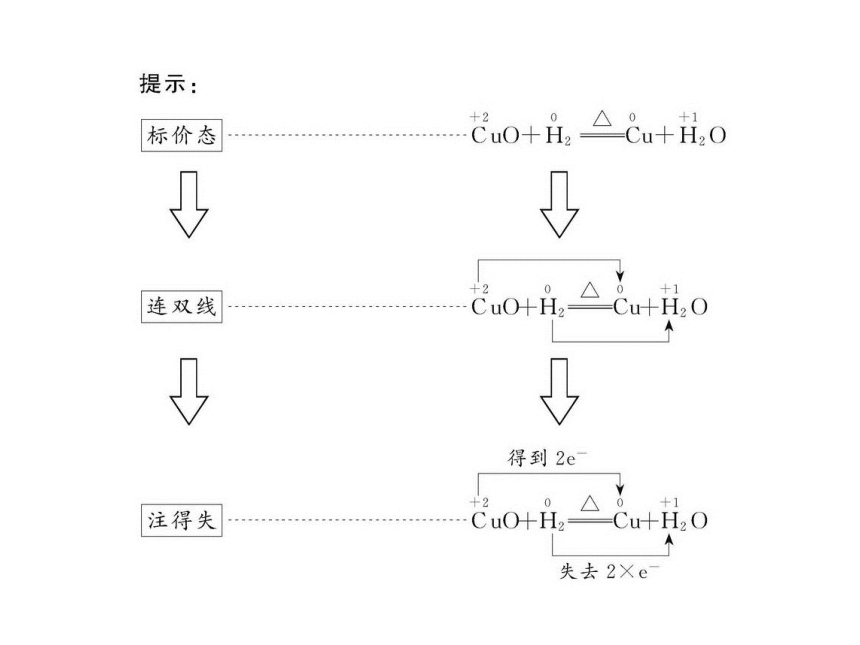
知识点二:氧化还原反应的表示方法——双线桥法
4.下列式子中不正确的是( )
解题提示:化合价是分析一切氧化还原反应的前提和基础,正确标出元素的化合价是分析正误的关键和突破口。
【解析】选D。D选项反应中“得”、“失”标反,“被氧化”、“被还原”标反;其电子转移的方向和数目正确的表示方法为:
5.(1)A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:
H2+CuO Cu+H2O所属的区域。
△
====
(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表示。
其中Ⅰ为化合反应,则Ⅱ为______反应。
写出有水生成的符合反应类型Ⅲ的一个化学方程式:____________________________________。
写出有水参加的符合反应类型Ⅳ的一个化学方程式___________________________________,其中水发生______反应。
【解析】(1)根据四种基本反应类型与氧化还原反应的关系知,置换反应一定是氧化还原反应。所以反应
H2+CuO Cu+H2O应全部在大圆之内。
(2)由反应类型Ⅲ是非氧化还原反应知,反应Ⅲ是复分解反应;反应类型Ⅳ是置换反应。
△
====
答案:(1)
(2)分解 NaOH+HCl====NaCl+H2O
H2O+C H2+CO 还原(其他合理答案也可)
高温
====
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是( )
A.化合反应一定是氧化还原反应
B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
【解析】选C。有单质参加的化合反应一定是氧化还
原反应,而CaO+H2O====Ca(OH)2为非氧化还原反应,所以化合反应不一定是氧化还原反应,A错误;有单质生成的分解反应一定是氧化还原反应,而
CaCO3 CaO+CO2↑为非氧化还原反应,所以分解反应不一定是氧化还原反应,B错误;置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,C正确,D错误。
高温
====
2.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜器出现铜绿[Cu2(OH)2CO3]
B.铁制菜刀生锈
C.大理石雕像被酸雨腐蚀毁坏
D.铝锅表面生成致密的薄膜
【解析】选C。A、B、D三项均是由金属单质生成化合物,所以A、B、D三项都是氧化还原反应;C项中发生反应为CaCO3+2H+====Ca2++CO2↑+H2O,是复分解反应。
3.(双选)属于氧化还原反应的离子方程式的
是( )
A.CaCO3+2H+====Ca2++CO2↑+H2O
B.2Fe2++Cl2====2Fe3++2Cl-
C.HCO3-+H+====CO2↑+H2O
D.2Na+2H2O2====Na++2OH-+H2↑
【解析】选B、D。对于离子反应,只要有元素化合价的变化,就是氧化还原反应。A、C中无元素化合价的变化,不是氧化还原反应;B、D中Fe与Cl、Na与H化合价发生了变化,属于氧化还原反应。
4.氧化反应和还原反应发生在同种元素之间的
是( )
A.Zn+2HCl====ZnCl2+H2↑
B.2H2S+SO2====3S↓+2H2O
C.H2+CuO Cu+H2O
D.2H2O 2H2↑+O2↑
电解
====
△
====
【解析】选B。A中发生氧化反应和发生还原反应的元素分别是Zn和H,不是同种元素;B中发生氧化反应和发生还原反应的元素均为S,是同种元素;C中发生氧化反应和发生还原反应的元素分别是H和Cu,不是同种元素;D中发生氧化反应和发生还原反应的元素分别是O和H,不是同种元素,故选B。
5.下列反应中,氯元素被氧化的是( )
A.2KClO3 ==== 2KCl+3O2↑
B.2P+5Cl2 2PCl5
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
D.H2+Cl2 2HCl
点燃
====
△
====
点燃
====
MnO2
△
【解析】选C。氯元素被氧化,即反应后氯元素的化合价升高,C中Cl元素从-1价变为0价,化合价升高,故选C。A中Cl元素从+5价变为-1价,化合价降低;B中Cl元素从0价变为-1价,化合价降低;D中Cl元素从0价变为-1价,化合价降低。
二、非选择题(本题包括1个小题,共10分)
6.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是____,被还原的元素是____ ,发生氧化反应的物质是____ ,发生还原反应的物质是____ 。
(2)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
【解析】由方程式可知:Cu元素化合价升高,从0价变为+2价,被氧化;N元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,HNO3发生还原反应。
答案:(1)Cu N Cu HNO3
(2)
1.(5分)(2010·南昌高一检测)关于物质的转化过程:H2→H2O CO→CO2 C→CO2,下列说法不正确的
是( )
A.都能通过化合反应实现
B.都能通过与单质反应实现
C.都能通过置换反应实现
D.反应前后都有元素化合价发生改变
【解析】选C。由H2→H2O CO→CO2 C→CO2的转化可知:反应前后均有元素化合价的变化(化合价升高),
D正确;以下反应可以实现上述转化:
2H2+O2 2H2O 2CO+O2 2CO2 C+O2 CO2,均为化合反应,也是与单质的反应,A、B均正确;H2→H2O C→CO2能通过置换反应:
CuO+H2 Cu+H2O 2CuO+C 2Cu+CO2↑
实现,而CO→CO2不能。
点燃
====
高温
====
△
====
点燃
====
点燃
====
2.(5分)下列反应既属于离子反应,又属于氧化还原反应的是( )
A.Zn与CuSO4溶液的反应
B.分解氯酸钾制氧气
C.NaOH溶液与盐酸中和
D.MgCl2溶液与KOH溶液产生沉淀
【解析】选A。A、C、D均为水溶液中发生的反应,是离子反应,B是固体反应,不属于离子反应;C、D均为复分解反应,不属于氧化还原反应,只有A符合这两个要求。
3.(10分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH====10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,____元素的化合价升高,则该元素的原子____(填“得到”或“失去”)电子;而____元素的化合价降低,则该元素的原子被____(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:10Al+6NaNO3+4NaOH====10NaAlO2+3N2↑+2H2O
【解析】在上述反应中Al元素由0价变为+3价,化合价升高,失去电子,被氧化;N元素由+5价变为0价,化合价降低,得到电子,被还原。
答案:(1)Al 失去 N 还原
(2)
【典例】下列关于氧化还原反应的说法中正确的
是_____。
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.氧化还原反应中,反应前后一定有电子转移
D.氧化还原反应的特征是电子转移
E.没有氧元素参加的反应一定不是氧化还原反应
F.有氧元素参加的反应一定是氧化还原反应
G.复分解反应一定不是氧化还原反应
【思路点拨】判断反应是否为氧化还原反应的依据是反应中是否有元素化合价的变化。
【自主解答】元素化合价的变化是由于电子的得失
(活泼非金属或活泼金属)或电子的偏移(活泼性弱的
金属元素或非金属元素)。故A、C正确。氧化还原反
应可以有氧的得失也可以没有氧的得失。如H2+Cl2
2HCl,就与氧无关,所以B、E错。氧化还原反
应的实质是电子转移,所以D错。CaO+H2O====Ca(OH)2的反应是有氧元素参加的反应,但不是氧化还原反
应,所以F错。复分解反应无化合价的变化,一定不是
氧化还原反应,G正确。
答案:A、C、G
点燃
====
知识点一:氧化还原反应的概念
1.下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl====CaCl2+H2O+CO2↑
B.2NaHCO3 Na2CO3+H2O+CO2↑
C.Cl2+2NaOH ==== NaCl+NaClO+H2O
D.NaBr+AgNO3 ==== AgBr↓+NaNO3
△
====
【解析】选C。C中Cl元素从0价变为-1价和+1价,属于氧化还原反应。其他三个选项中所有元素均无化合价的变化,不是氧化还原反应。
2.(2010·秦皇岛高一检测)2FeBr2+3Cl2====
2FeCl3+2Br2的反应中,被氧化的元素是( )
A.Fe B.Fe和Br C.Br D.Cl
解题提示:在氧化还原反应中,得到电子或失去电子的元素不一定只有一种,在分析时,要把所有变价的元素找准,才能保证答题的准确性。
【解析】选B。Fe元素的化合价从+2价变为+3价,化合价升高,被氧化;Br元素的化合价从-1价变为0价,化合价升高,被氧化,Cl元素的化合价从0价变为-1价,化合价降低,被还原。
3.下列关于氧化还原反应实质的说法中正确的
是( )
A.是否有元素的电子转移
B.是否有元素的化合价变化
C.是否有氧元素参加
D.是否有原子的重新组合
【解析】选A。氧化还原反应的本质为在反应中有电子转移,特征为反应中有元素的化合价变化,是否有氧元素参加仅是氧化还原反应的一个方面,是否有原子的重新组合是化学反应的本质,故选A。
知识点二:氧化还原反应的表示方法——双线桥法
4.下列式子中不正确的是( )
解题提示:化合价是分析一切氧化还原反应的前提和基础,正确标出元素的化合价是分析正误的关键和突破口。
【解析】选D。D选项反应中“得”、“失”标反,“被氧化”、“被还原”标反;其电子转移的方向和数目正确的表示方法为:
5.(1)A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:
H2+CuO Cu+H2O所属的区域。
△
====
(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表示。
其中Ⅰ为化合反应,则Ⅱ为______反应。
写出有水生成的符合反应类型Ⅲ的一个化学方程式:____________________________________。
写出有水参加的符合反应类型Ⅳ的一个化学方程式___________________________________,其中水发生______反应。
【解析】(1)根据四种基本反应类型与氧化还原反应的关系知,置换反应一定是氧化还原反应。所以反应
H2+CuO Cu+H2O应全部在大圆之内。
(2)由反应类型Ⅲ是非氧化还原反应知,反应Ⅲ是复分解反应;反应类型Ⅳ是置换反应。
△
====
答案:(1)
(2)分解 NaOH+HCl====NaCl+H2O
H2O+C H2+CO 还原(其他合理答案也可)
高温
====
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是( )
A.化合反应一定是氧化还原反应
B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
【解析】选C。有单质参加的化合反应一定是氧化还
原反应,而CaO+H2O====Ca(OH)2为非氧化还原反应,所以化合反应不一定是氧化还原反应,A错误;有单质生成的分解反应一定是氧化还原反应,而
CaCO3 CaO+CO2↑为非氧化还原反应,所以分解反应不一定是氧化还原反应,B错误;置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,C正确,D错误。
高温
====
2.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜器出现铜绿[Cu2(OH)2CO3]
B.铁制菜刀生锈
C.大理石雕像被酸雨腐蚀毁坏
D.铝锅表面生成致密的薄膜
【解析】选C。A、B、D三项均是由金属单质生成化合物,所以A、B、D三项都是氧化还原反应;C项中发生反应为CaCO3+2H+====Ca2++CO2↑+H2O,是复分解反应。
3.(双选)属于氧化还原反应的离子方程式的
是( )
A.CaCO3+2H+====Ca2++CO2↑+H2O
B.2Fe2++Cl2====2Fe3++2Cl-
C.HCO3-+H+====CO2↑+H2O
D.2Na+2H2O2====Na++2OH-+H2↑
【解析】选B、D。对于离子反应,只要有元素化合价的变化,就是氧化还原反应。A、C中无元素化合价的变化,不是氧化还原反应;B、D中Fe与Cl、Na与H化合价发生了变化,属于氧化还原反应。
4.氧化反应和还原反应发生在同种元素之间的
是( )
A.Zn+2HCl====ZnCl2+H2↑
B.2H2S+SO2====3S↓+2H2O
C.H2+CuO Cu+H2O
D.2H2O 2H2↑+O2↑
电解
====
△
====
【解析】选B。A中发生氧化反应和发生还原反应的元素分别是Zn和H,不是同种元素;B中发生氧化反应和发生还原反应的元素均为S,是同种元素;C中发生氧化反应和发生还原反应的元素分别是H和Cu,不是同种元素;D中发生氧化反应和发生还原反应的元素分别是O和H,不是同种元素,故选B。
5.下列反应中,氯元素被氧化的是( )
A.2KClO3 ==== 2KCl+3O2↑
B.2P+5Cl2 2PCl5
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
D.H2+Cl2 2HCl
点燃
====
△
====
点燃
====
MnO2
△
【解析】选C。氯元素被氧化,即反应后氯元素的化合价升高,C中Cl元素从-1价变为0价,化合价升高,故选C。A中Cl元素从+5价变为-1价,化合价降低;B中Cl元素从0价变为-1价,化合价降低;D中Cl元素从0价变为-1价,化合价降低。
二、非选择题(本题包括1个小题,共10分)
6.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是____,被还原的元素是____ ,发生氧化反应的物质是____ ,发生还原反应的物质是____ 。
(2)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
【解析】由方程式可知:Cu元素化合价升高,从0价变为+2价,被氧化;N元素化合价降低,从+5价变为+2价,被还原;故Cu发生氧化反应,HNO3发生还原反应。
答案:(1)Cu N Cu HNO3
(2)
1.(5分)(2010·南昌高一检测)关于物质的转化过程:H2→H2O CO→CO2 C→CO2,下列说法不正确的
是( )
A.都能通过化合反应实现
B.都能通过与单质反应实现
C.都能通过置换反应实现
D.反应前后都有元素化合价发生改变
【解析】选C。由H2→H2O CO→CO2 C→CO2的转化可知:反应前后均有元素化合价的变化(化合价升高),
D正确;以下反应可以实现上述转化:
2H2+O2 2H2O 2CO+O2 2CO2 C+O2 CO2,均为化合反应,也是与单质的反应,A、B均正确;H2→H2O C→CO2能通过置换反应:
CuO+H2 Cu+H2O 2CuO+C 2Cu+CO2↑
实现,而CO→CO2不能。
点燃
====
高温
====
△
====
点燃
====
点燃
====
2.(5分)下列反应既属于离子反应,又属于氧化还原反应的是( )
A.Zn与CuSO4溶液的反应
B.分解氯酸钾制氧气
C.NaOH溶液与盐酸中和
D.MgCl2溶液与KOH溶液产生沉淀
【解析】选A。A、C、D均为水溶液中发生的反应,是离子反应,B是固体反应,不属于离子反应;C、D均为复分解反应,不属于氧化还原反应,只有A符合这两个要求。
3.(10分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH====10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,____元素的化合价升高,则该元素的原子____(填“得到”或“失去”)电子;而____元素的化合价降低,则该元素的原子被____(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:10Al+6NaNO3+4NaOH====10NaAlO2+3N2↑+2H2O
【解析】在上述反应中Al元素由0价变为+3价,化合价升高,失去电子,被氧化;N元素由+5价变为0价,化合价降低,得到电子,被还原。
答案:(1)Al 失去 N 还原
(2)
