10-11高中化学课时讲练通课件:3.1.2 金属的化学性质(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.1.2 金属的化学性质(人教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 00:00:00 | ||
图片预览










文档简介
(共48张PPT)
【典例1】将4.6 g金属钠投入到足量水中,得到a g溶液;将4.8 g金属镁投入到足量盐酸中,得到b g溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为
A.a=b B.a>b C.a【思路点拨】反应前后的质量差为放出H2的质量,根据化学方程式计算出两个反应各放出H2的质量即可判断。
【自主解答】选A。溶液的质量等于金属和水或酸的
质量之和减去放出H2的质量。
2Na+2H2O====2NaOH+H2↑
46 2
4.6 g 0.2 g
a=4.6 g+m(H2O)-0.2 g=4.4 g+m(H2O)
Mg+2HCl====MgCl2+H2↑
24 2
4.8 g 0.4 g
b=4.8 g+m(HCl)-0.4 g=4.4 g+m(HCl)
因为m(H2O)=m(HCl),所以a=b。
【典例2】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成H2的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
【思路点拨】根据两个反应方程式比较铝过量或酸(碱)过量时产生氢气的量,对比判断。
【自主解答】选B。根据反应2Al+3H2SO4====Al2(SO4)3
+3H2↑,2Al+2NaOH+2H2O====2NaAlO2+3H2↑可知,如果
反应掉的铝相等,则生成的气体体积比为1∶1,如果反
应掉的H2SO4与NaOH的物质的量相等,则生成的气体体积
比为2∶3,现已知生成的气体体积比为5∶6,则不难推
出Al和硫酸反应中是铝过量,硫酸反应完,而Al与NaOH
溶液反应中是Al反应完,NaOH溶液过量。
知识点一:金属与酸和水的反应
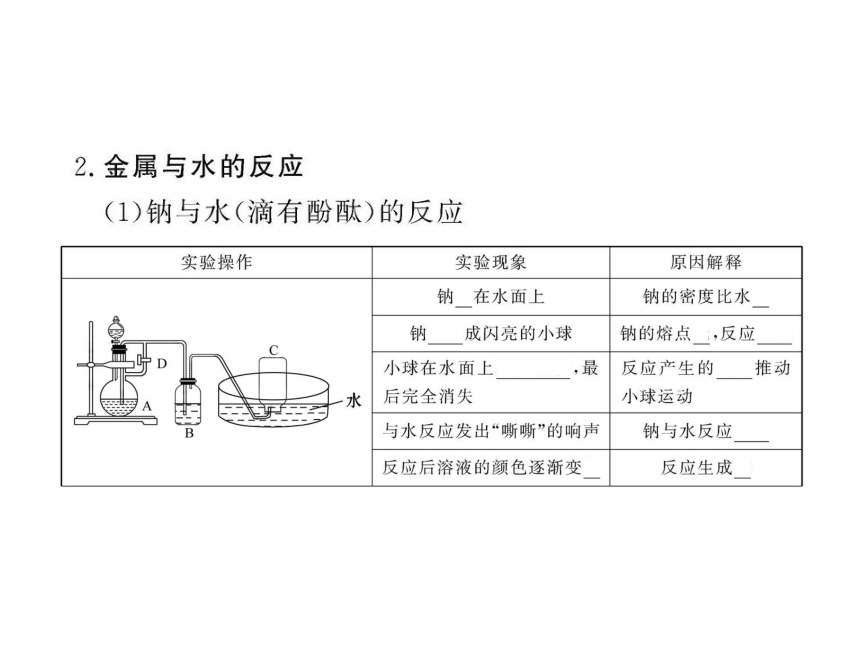
1.钠与水反应的现象与钠的下列性质无关的是( )
A.钠的熔点 B.钠的密度
C.钠的硬度 D.钠的还原性
【解析】选C。把金属钠投入水中,钠会立即和H2O发生
反应产生H2,化学方程式为2Na+2H2O====2NaOH+H2↑,
同时钠浮在水面上四处游动且钠熔化为一个小球,与
A、B、D均有关。
2.将2.3 g金属钠放入100 g水中,完全反应后溶液的
质量分数为( )
A. ×100%
B. ×100%
C. ×100%
D. ×100%
【解析】选D。2Na+2H2O====2NaOH+H2↑
2.3 g钠与100 g水完全反应后生成4 g NaOH,同时放出0.1 g H2,
故反应后溶液的质量为2.3 g+100 g-0.1 g。
故质量分数为w(NaOH)= ×100%。
3.将一小块钠投入FeCl3溶液中,下列对有关实验结果的预测正确的是( )
A.钠溶解,有铁析出,并有气体产生
B.只有气体产生
C.只有沉淀产生
D.既有气体产生,又有沉淀产生
【解析】选D。Na首先与H2O反应,生成的NaOH再与FeCl3反应,有关反应方程式为:2Na+2H2O====2NaOH+H2↑,FeCl3+3NaOH====Fe(OH)3↓+3NaCl,根据发生的上述两个反应即可确定只有D选项中的预测正确。
知识点二:铝与氢氧化钠溶液的反应
4.等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )
A.NaOH溶液 B.稀H2SO4
C.蔗糖溶液 D.NaCl溶液
【解析】选B。Mg与NaOH溶液不反应,A中只有Al与NaOH溶液反应放出H2,而B中二者均可与稀H2SO4反应,Al在足量NaOH和H2SO4中产生的H2是相等的,故B比A中生成的H2多,C、D项中物质均不与Mg、Al反应生成H2,故选B。
5.(2010·六安高一检测)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入如图所示装置倒扣的漏斗中。
(1)按顺序写出该过程中发生反应的离子方程式:
①__________________________________________
___________________________________________;
②__________________________________________
___________________________________________;
(2)反应结束后,用拇指堵住试管口后将试管移出,靠近燃着的酒精灯,松开手指,现象是_________
___________________________________________。
【解析】将包有铝箔的过氧化钠投入水中,Na2O2先和水反应生成NaOH和氧气,然后是Al和NaOH溶液反应生成NaAlO2和氢气,所以试管内收集到的气体是氢气和氧气的混合物,点燃氢气和氧气的混合物会发生爆炸,发出尖锐的爆鸣声。
答案:(1)①2Na2O2+2H2O====4Na++4OH-+O2↑
②2Al+2OH-+2H2O====2AlO2-+3H2↑
(2)听到尖锐的爆鸣声
一、选择题(本题包括4个小题,每小题4分,共16分)
1.下列有关钠的物理性质的叙述中正确的是( )
①银白色金属 ②质软,可以用小刀切割
③熔点低于100 ℃ ④密度比水小
⑤热和电的良导体
A.①②④ B.①②③④
C.①③④ D.①②③④⑤
【解析】选D。由钠的取用方法可知①②正确。由钠与水反应的现象钠浮在水面上可知④正确,熔成光亮的小球,此时水并未沸腾,故③正确,金属都是热和电的良导体,⑤正确。
2.金属钠放在水中浮在水面上,放在煤油中沉在油层下,煤油的密度是0.8 g·cm-3,推测钠的密度(g·cm-3)是( )
A.大于1.0 B.小于0.8
C.介于0.8~1.0之间 D.不能确定
【解析】选C。水的密度为1 g·cm-3,钠浮在水面上,说明其密度比水的小,同样钠沉在煤油下,说明其密度比煤油的密度大,故选C。
3.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出气体的体积之比为2∶3,则两份铝粉的质量比为( )
A.1∶1 B.2∶3
C.3∶2 D.1∶6
【解析】选B。根据铝与酸、碱反应的化学方程式:
2Al+6HCl====2AlCl3+3H2↑
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
可以发现:等量的铝分别与足量的酸、碱反应会产生等量的H2(同温同压下),故题中答案选B。
4.用等质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠放入足量的稀盐酸中
B.将钠放入足量的稀硫酸中
C.将钠放入足量的硫酸铝溶液中
D.将钠用铝箔包好,并刺穿一些小孔,放入足量的水中
【解析】选D。A、B、C中都是钠与酸(或水)反应,它与放出氢气的关系式为2Na~H2;而D中除了Na与水反应放出H2外,铝还会与生成的NaOH反应放出一定量的H2即2Al+2NaOH+2H2O====2NaAlO2+3H2↑,故D中放出的氢气最多。
二、非选择题(本题包括2个小题,共14分)
5.(8分)取18.4 g铝锌合金溶于足量稀硫酸中,完全反应后收集到(标准状况下)氢气11.2 L,则由铝和锌分别产生氢气的体积(标准状况下)各为多少?
【解析】设18.4 g铝、锌合金中含铝的物质的量为x,含锌的物质的量为y。
由2Al+3H2SO4====Al2(SO4)3+3H2↑
2 mol 3 mol
x x
Zn+H2SO4====ZnSO4+H2↑
1 mol 1 mol
y y
则铝产生氢气的体积V(Al)= ×0.2 mol×
22.4 L/mol=6.72 L。
由锌产生氢气的体积V(Zn)=0.2 mol×22.4 L/mol
=4.48 L。
答案:6.72 L 4.48 L
6.(6分)向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布封严罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述实验现象:
(1)罐壁内凹而瘪的原因:__________________,
反应方程式:_______________________________。
(2)罐壁重新鼓起的原因:_________________
__________________________________________,
反应方程式:_______________________________。
【解析】易拉罐中的碱,会吸收其中充有的CO2,从而导致罐内气压减小,罐壁会内凹;Al会与NaOH溶液反应生成H2,罐内压强增大,又会重新鼓起来。
答案:(1)CO2与NaOH溶液反应生成Na2CO3,使得罐内气压小于外界大气压 2NaOH+CO2====Na2CO3+H2O
(2)过量的NaOH与铝罐反应生成H2,使罐内气压等于或大于外界大气压 2Al+2NaOH+2H2O====2NaAlO2+3H2↑
1.(双选)(5分)将金属钠投入到下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.K2SO4
C.CuCl2 D.饱和NaOH溶液
【解析】选C、D。
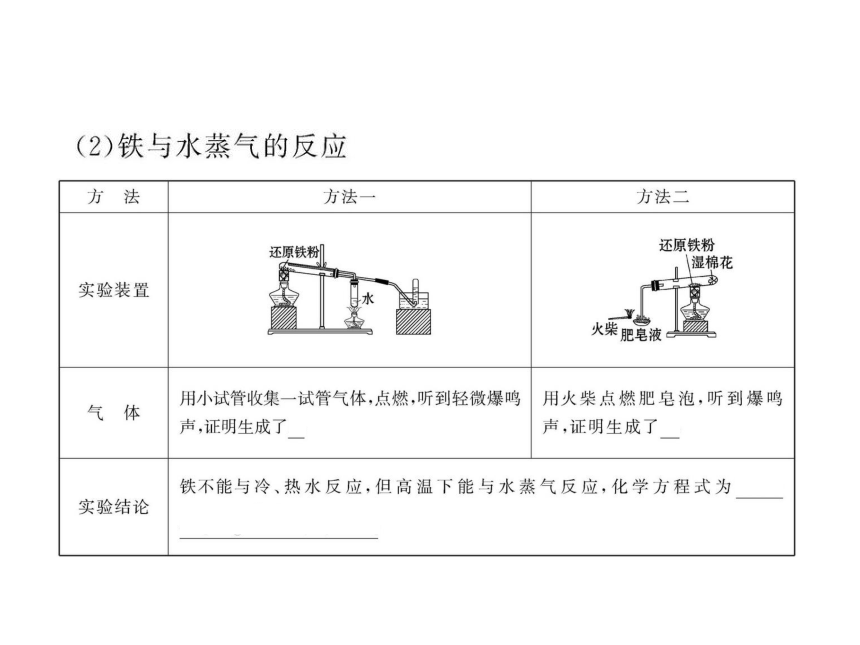
2.(15分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为分析钠和水的反应,他们设计了如图装置。
请回答下列问题:
(1)写出Na与H2O反应的化学方程式:______。
(2)在点燃H2之前必须先进行_____,方法是____
___________________________________________。
(3)实验小组在点燃用装置制得的H2时,却没有成
功。他们分析认为失败的原因是Na与H2O的反应速率
太快,Na的用量太少。于是他们准备增加钠的用量,
可老师说太危险,你认为产生危险的原因是_____
___________________________________________。
(4)实验小组查阅钠、苯、水的密度分别是
0.97 g/mL、0.88 g/mL、1.00 g/mL,并据此对实验
进行了改进(如图)。在改进后的实验中H2的生成速
率减慢。原因是______________________________
____________________________________________。
【解析】(2)对于可燃性气体点燃之前要验纯,其方法是用向下排空气法收集一试管氢气,用拇指堵住试管口,移近火焰,移开拇指点火。若听到轻微的“噗”声,则表明H2纯净。
(3)较多的钠与水反应放出大量的热和H2,易发生爆炸。
(4)由ρ(苯)<ρ(钠)<ρ(水)可知钠会在苯与水的交界处上下跳动,减少Na与水的接触,减缓反应速率。
答案:(1)2Na+2H2O====2NaOH+H2↑
(2)验纯用向下排空气法收集一试管氢气,用拇指堵住管口,移近酒精灯火焰,移开拇指,若听到轻微的“噗”声,则说明H2纯净,若发出尖锐的爆鸣声,则不纯
(3)钠用量过多,放出大量的H2和热量,易发生爆炸
(4)钠的密度小于水而大于苯,在水和苯的界面上跳动,减少钠与水的接触,减缓反应速率
【典例1】将4.6 g金属钠投入到足量水中,得到a g溶液;将4.8 g金属镁投入到足量盐酸中,得到b g溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为
A.a=b B.a>b C.a【思路点拨】反应前后的质量差为放出H2的质量,根据化学方程式计算出两个反应各放出H2的质量即可判断。
【自主解答】选A。溶液的质量等于金属和水或酸的
质量之和减去放出H2的质量。
2Na+2H2O====2NaOH+H2↑
46 2
4.6 g 0.2 g
a=4.6 g+m(H2O)-0.2 g=4.4 g+m(H2O)
Mg+2HCl====MgCl2+H2↑
24 2
4.8 g 0.4 g
b=4.8 g+m(HCl)-0.4 g=4.4 g+m(HCl)
因为m(H2O)=m(HCl),所以a=b。
【典例2】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成H2的体积比为5∶6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
【思路点拨】根据两个反应方程式比较铝过量或酸(碱)过量时产生氢气的量,对比判断。
【自主解答】选B。根据反应2Al+3H2SO4====Al2(SO4)3
+3H2↑,2Al+2NaOH+2H2O====2NaAlO2+3H2↑可知,如果
反应掉的铝相等,则生成的气体体积比为1∶1,如果反
应掉的H2SO4与NaOH的物质的量相等,则生成的气体体积
比为2∶3,现已知生成的气体体积比为5∶6,则不难推
出Al和硫酸反应中是铝过量,硫酸反应完,而Al与NaOH
溶液反应中是Al反应完,NaOH溶液过量。
知识点一:金属与酸和水的反应
1.钠与水反应的现象与钠的下列性质无关的是( )
A.钠的熔点 B.钠的密度
C.钠的硬度 D.钠的还原性
【解析】选C。把金属钠投入水中,钠会立即和H2O发生
反应产生H2,化学方程式为2Na+2H2O====2NaOH+H2↑,
同时钠浮在水面上四处游动且钠熔化为一个小球,与
A、B、D均有关。
2.将2.3 g金属钠放入100 g水中,完全反应后溶液的
质量分数为( )
A. ×100%
B. ×100%
C. ×100%
D. ×100%
【解析】选D。2Na+2H2O====2NaOH+H2↑
2.3 g钠与100 g水完全反应后生成4 g NaOH,同时放出0.1 g H2,
故反应后溶液的质量为2.3 g+100 g-0.1 g。
故质量分数为w(NaOH)= ×100%。
3.将一小块钠投入FeCl3溶液中,下列对有关实验结果的预测正确的是( )
A.钠溶解,有铁析出,并有气体产生
B.只有气体产生
C.只有沉淀产生
D.既有气体产生,又有沉淀产生
【解析】选D。Na首先与H2O反应,生成的NaOH再与FeCl3反应,有关反应方程式为:2Na+2H2O====2NaOH+H2↑,FeCl3+3NaOH====Fe(OH)3↓+3NaCl,根据发生的上述两个反应即可确定只有D选项中的预测正确。
知识点二:铝与氢氧化钠溶液的反应
4.等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )
A.NaOH溶液 B.稀H2SO4
C.蔗糖溶液 D.NaCl溶液
【解析】选B。Mg与NaOH溶液不反应,A中只有Al与NaOH溶液反应放出H2,而B中二者均可与稀H2SO4反应,Al在足量NaOH和H2SO4中产生的H2是相等的,故B比A中生成的H2多,C、D项中物质均不与Mg、Al反应生成H2,故选B。
5.(2010·六安高一检测)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入如图所示装置倒扣的漏斗中。
(1)按顺序写出该过程中发生反应的离子方程式:
①__________________________________________
___________________________________________;
②__________________________________________
___________________________________________;
(2)反应结束后,用拇指堵住试管口后将试管移出,靠近燃着的酒精灯,松开手指,现象是_________
___________________________________________。
【解析】将包有铝箔的过氧化钠投入水中,Na2O2先和水反应生成NaOH和氧气,然后是Al和NaOH溶液反应生成NaAlO2和氢气,所以试管内收集到的气体是氢气和氧气的混合物,点燃氢气和氧气的混合物会发生爆炸,发出尖锐的爆鸣声。
答案:(1)①2Na2O2+2H2O====4Na++4OH-+O2↑
②2Al+2OH-+2H2O====2AlO2-+3H2↑
(2)听到尖锐的爆鸣声
一、选择题(本题包括4个小题,每小题4分,共16分)
1.下列有关钠的物理性质的叙述中正确的是( )
①银白色金属 ②质软,可以用小刀切割
③熔点低于100 ℃ ④密度比水小
⑤热和电的良导体
A.①②④ B.①②③④
C.①③④ D.①②③④⑤
【解析】选D。由钠的取用方法可知①②正确。由钠与水反应的现象钠浮在水面上可知④正确,熔成光亮的小球,此时水并未沸腾,故③正确,金属都是热和电的良导体,⑤正确。
2.金属钠放在水中浮在水面上,放在煤油中沉在油层下,煤油的密度是0.8 g·cm-3,推测钠的密度(g·cm-3)是( )
A.大于1.0 B.小于0.8
C.介于0.8~1.0之间 D.不能确定
【解析】选C。水的密度为1 g·cm-3,钠浮在水面上,说明其密度比水的小,同样钠沉在煤油下,说明其密度比煤油的密度大,故选C。
3.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出气体的体积之比为2∶3,则两份铝粉的质量比为( )
A.1∶1 B.2∶3
C.3∶2 D.1∶6
【解析】选B。根据铝与酸、碱反应的化学方程式:
2Al+6HCl====2AlCl3+3H2↑
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
可以发现:等量的铝分别与足量的酸、碱反应会产生等量的H2(同温同压下),故题中答案选B。
4.用等质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠放入足量的稀盐酸中
B.将钠放入足量的稀硫酸中
C.将钠放入足量的硫酸铝溶液中
D.将钠用铝箔包好,并刺穿一些小孔,放入足量的水中
【解析】选D。A、B、C中都是钠与酸(或水)反应,它与放出氢气的关系式为2Na~H2;而D中除了Na与水反应放出H2外,铝还会与生成的NaOH反应放出一定量的H2即2Al+2NaOH+2H2O====2NaAlO2+3H2↑,故D中放出的氢气最多。
二、非选择题(本题包括2个小题,共14分)
5.(8分)取18.4 g铝锌合金溶于足量稀硫酸中,完全反应后收集到(标准状况下)氢气11.2 L,则由铝和锌分别产生氢气的体积(标准状况下)各为多少?
【解析】设18.4 g铝、锌合金中含铝的物质的量为x,含锌的物质的量为y。
由2Al+3H2SO4====Al2(SO4)3+3H2↑
2 mol 3 mol
x x
Zn+H2SO4====ZnSO4+H2↑
1 mol 1 mol
y y
则铝产生氢气的体积V(Al)= ×0.2 mol×
22.4 L/mol=6.72 L。
由锌产生氢气的体积V(Zn)=0.2 mol×22.4 L/mol
=4.48 L。
答案:6.72 L 4.48 L
6.(6分)向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布封严罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述实验现象:
(1)罐壁内凹而瘪的原因:__________________,
反应方程式:_______________________________。
(2)罐壁重新鼓起的原因:_________________
__________________________________________,
反应方程式:_______________________________。
【解析】易拉罐中的碱,会吸收其中充有的CO2,从而导致罐内气压减小,罐壁会内凹;Al会与NaOH溶液反应生成H2,罐内压强增大,又会重新鼓起来。
答案:(1)CO2与NaOH溶液反应生成Na2CO3,使得罐内气压小于外界大气压 2NaOH+CO2====Na2CO3+H2O
(2)过量的NaOH与铝罐反应生成H2,使罐内气压等于或大于外界大气压 2Al+2NaOH+2H2O====2NaAlO2+3H2↑
1.(双选)(5分)将金属钠投入到下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.K2SO4
C.CuCl2 D.饱和NaOH溶液
【解析】选C、D。
2.(15分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液。为分析钠和水的反应,他们设计了如图装置。
请回答下列问题:
(1)写出Na与H2O反应的化学方程式:______。
(2)在点燃H2之前必须先进行_____,方法是____
___________________________________________。
(3)实验小组在点燃用装置制得的H2时,却没有成
功。他们分析认为失败的原因是Na与H2O的反应速率
太快,Na的用量太少。于是他们准备增加钠的用量,
可老师说太危险,你认为产生危险的原因是_____
___________________________________________。
(4)实验小组查阅钠、苯、水的密度分别是
0.97 g/mL、0.88 g/mL、1.00 g/mL,并据此对实验
进行了改进(如图)。在改进后的实验中H2的生成速
率减慢。原因是______________________________
____________________________________________。
【解析】(2)对于可燃性气体点燃之前要验纯,其方法是用向下排空气法收集一试管氢气,用拇指堵住试管口,移近火焰,移开拇指点火。若听到轻微的“噗”声,则表明H2纯净。
(3)较多的钠与水反应放出大量的热和H2,易发生爆炸。
(4)由ρ(苯)<ρ(钠)<ρ(水)可知钠会在苯与水的交界处上下跳动,减少Na与水的接触,减缓反应速率。
答案:(1)2Na+2H2O====2NaOH+H2↑
(2)验纯用向下排空气法收集一试管氢气,用拇指堵住管口,移近酒精灯火焰,移开拇指,若听到轻微的“噗”声,则说明H2纯净,若发出尖锐的爆鸣声,则不纯
(3)钠用量过多,放出大量的H2和热量,易发生爆炸
(4)钠的密度小于水而大于苯,在水和苯的界面上跳动,减少钠与水的接触,减缓反应速率
