10-11高中化学课时讲练通课件:3.1.3 金属的化学性质(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.1.3 金属的化学性质(人教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 00:00:00 | ||
图片预览











文档简介
(共50张PPT)
【典例1】(1)在400 mL 2 mol·L-1的H2SO4溶液中,溶质的质量是_____。此溶液中的H+的物质的量浓度为______,SO42-的物质的量浓度为_______。
(2)在标准状况下,700 L NH3的物质的量为_____,全部溶解在1 L水中,所得溶液中溶质的质量分数为,
如果该氨水的密度为0.85 g·cm-3,则氨水的体积为_______,NH3的物质的量浓度为_____。
【思路点拨】解答该题要注意以下三点:
(1)H2SO4溶液中H+和SO42-的关系;
(2)以物质的量为中心的各物理量之间的关系;
(3)物质的量浓度与溶质质量分数的换算。
【自主解答】(1)n=cV=2 mol·L-1×0.4 L=0.8 mol
m(H2SO4)=n·M=0.8 mol×98 g·mol-1=78.4 g
c(H+)=2c(H2SO4)=4 mol·L-1
c(SO42-)=c(H2SO4)=2 mol·L-1
(2)n= =31.25 mol
w(NH3)=
×100%=34.7%
V(液)= =1 801 mL≈1.8 L
c(NH3)= =17.36 mol·L-1
答案:(1)78.4 g 4 mol·L-1 2 mol·L-1
(2)31.25 mol 34.7% 1.8 L 17.36 mol·L-1
【典例2】生态农业涉及农家肥料的综合利用,某种肥
料经发酵得到一种含甲烷、二氧化碳、氮气的混合气
体。2.016 L(标准状况)该气体通过盛有红热CuO粉末
的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质
量减轻4.8 g。将反应后产生的气体通过过量的澄清
石灰水中,充分吸收,生成沉淀8.5 g。
△
(1)原混合气体中甲烷的物质的量是_______。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
【思路点拨】(1)混合气体中只有CH4与CuO反应;
(2)CO2一部分源于原混合气体,另一部分是由CH4与CuO反应生成的。
【自主解答】混合气体总的物质的量为:n(混)
=0.09 mol
CH4+4CuO CO2+2H2O+4Cu Δm
1 mol 1 mol 64 g
0.075 mol 0.075 mol 4.8 g
n(CaCO3)= =0.085 mol,则n(CO2)
=0.085 mol
△
因此,原混合气体中含有的CO2为:n(CO2,原)=0.085 mol-0.075 mol=0.01 mol
则原混合气体中含有N2为:n(N2)=n(混)-
n(CH4)-n(CO2,原)=0.09 mol-0.075 mol-
0.01 mol=0.005 mol
故N2的体积分数=
×100%≈5.56%
答案:(1)0.075 mol (2)5.56%(计算过程见解析)
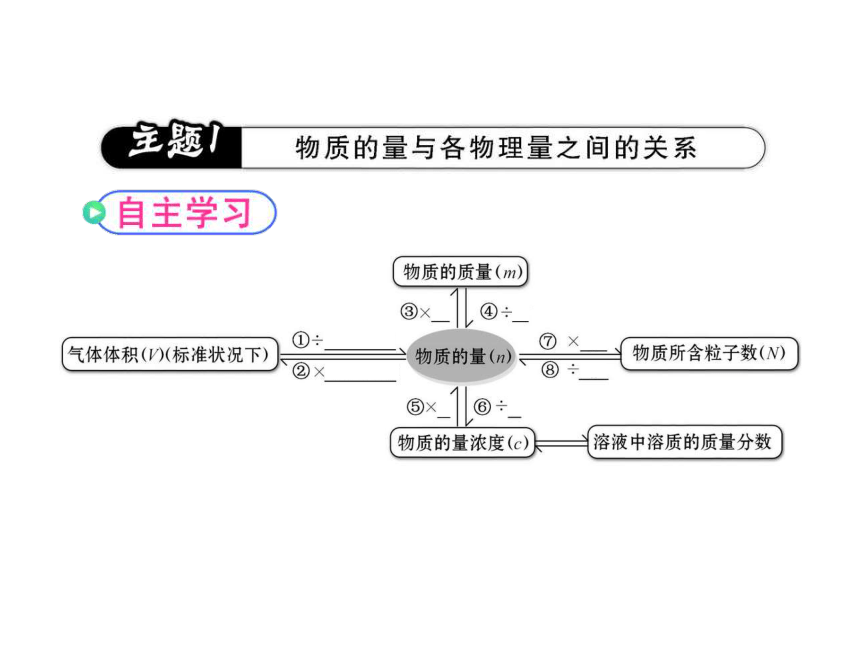
知识点一:物质的量与各物理量之间的关系
1.物质在发生化学反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量之比等于化学方程式中化学计量数之比
D.它们物质的量之比等于化学方程式中化学计量数之比
【解析】选D。物质在发生化学反应时是按照一定比例进行的,而这个比值可以是质量比,也可以是微粒个数比,也可以是物质的量之比,也可以是气体的体积比,而化学方程式中的化学计量数可以表示微粒个数,也可以表示物质的量,但不表示质量。
2.19世纪化学家对氧化锆的化学式争议颇多,后测定锆(Zr)的相对原子质量为91,其氯化物的蒸气对H2的相对密度为116.5,则氧化锆的化学式为( )
A.Zr2O B.ZrO C.Zr2O3 D.ZrO2
解题提示:密度之比等于摩尔质量之比,即:
【解析】选D。设锆的化合价为+x
则其氯化物的化学式为 ZrClx
91+35.5 x=116.5×2
解得 x=4
则氧化锆的化学式为 ZrO2。
知识点二:物质的量在化学方程式计算中的应用
3.0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则
盐酸的物质的量浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.5 mol·L-1 D.1 mol·L-1
【解析】选B。设盐酸的物质的量浓度为x,
HCl + NaOH ==== NaCl + H2O
1 mol 1 mol
0.02 L×x 0.16 g/40 g·mol-1
0.02 L×x= mol解得x=0.2 mol·L-1
4.将质量为100 g的铁棒插入 1 L 0.5 mol/L的CuSO4溶液中,足够长的时间后,铁棒的质量将变为( )
A.102 g B.106 g C.104 g D.110 g
【解析】选C。可用差量法解答此题,首先根据方程式可以判断Fe与CuSO4反应中Fe过量,题目以CuSO4为依据来计算。
设铁棒增重m,则
Fe+ CuSO4====FeSO4+Cu Δm
56 g 1 mol 64 g 8 g
1 L×0.5 mol/L m
m=
故铁棒质量变为100 g+4 g=104 g。
5.1.15 g金属钠跟水反应,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下是多少升?
(2)反应后所得溶液的物质的量浓度是多少?
【解析】设生成标准状况下气体的体积为V,溶液的物质的量浓度为c,根据化学方程式列比例式解方程式:
2Na+2H2O====2NaOH + H2↑
2×23 g 2 mol 22.4 L
1.15 g 0.1 L×cV
c= =0.5 mol·L-1
V= =0.56 L
答案:(1)0.56 L (2)0.5 mol·L-1
一、选择题(本题包括3个小题,每小题4分,共12分)
1.把10 g铜铝合金的粉末放入过量的盐酸中,得到
10.08 L H2(标准状况)。则合金中铝的质量分数
为( )
A.81% B.82.30%
C.78% D.19%
【解析】选A。铜铝合金中只有铝与盐酸反应。
2Al+6HCl====2AlCl3+3H2↑
2 mol 3×22.4 L
n(Al) 10.08 L
n(Al)= =0.3 mol,
w(Al)= ×100%=81%。
2.等质量的Fe、Zn、Al和Na,分别投入足量盐酸中,置换出的氢气由多到少的顺序是( )
A.Fe>Zn>Al>Na
B.Na>Al>Zn>Fe
C.Al>Na>Fe>Zn
D.Na>Al>Zn>Fe
【解析】选C。设金属质量为w,化合价为+n价,金属的相对原子质量为m,放出氢气的质量为x。
2R+2nHCl====2RCln+nH2↑
2m g 2n g
w x
因w是定值,所以x的大小决定于n/m。生成氢气的质
量比为
w(Fe)∶w(Zn)∶w(Al)∶w(Na)
故产生氢气由多到少的顺序为Al>Na>Fe>Zn。
3.把11.5 g Na投入到m1 g过量水中得a g溶液,把
12 g Mg投入到m2 g过量盐酸中得到b g溶液,若m1=m2,则a、b的质量关系是( )
A.a>b B.aC.a=b D.无法确定
【解析】选C。此题目宜用“差量法”求解。
2Na+2H2O====2NaOH+H2↑ Δm(溶液质量增加)
46 g 44 g
11.5 g x
x=11 g。
Mg+2HCl====MgCl2+H2↑ Δm(溶液质量增加)
24 g 22 g
12 g y
y=11 g
由于m1=m2,故a=b。
二、非选择题(本题包括2个小题,共18分)
4.(12分)把5.4 g Al放入足量的氢氧化钠溶液中完全反应。计算:
(1)5.4 g Al的物质的量;
(2)消耗氢氧化钠的质量;
(3)生成的气体的体积(标准状况)。
【解析】(1)Al的摩尔质量是27 g/mol,
n(Al)= =0.2 mol
(2)2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2 mol 80 g 67.2 L
0.2 mol m(NaOH) V(H2)
m(NaOH)=
(3)V(H2)= =6.72 L。
答案:(1)0.2 mol (2)8 g (3)6.72 L
5.(6分)某浓硫酸溶质的质量分数为98%,密度为
1.84 g/cm3。计算该浓硫酸中H2SO4的物质的量浓度。
答案:18.4 mol/L
【解析】
1.(10分)把50 mL 0.1 mol/L CaCl2溶液和50 mL
0.1 mol/L AgNO3溶液混合,设混合后溶液的总体
积不变,则反应后溶液中Cl-的物质的量浓度为
____mol/L;Ca2+的物质的量浓度为_____mol/L。
【解析】CaCl2与AgNO3反应的方程式为
CaCl2+2AgNO3====Ca(NO3)2+2AgCl↓。
0.005 mol 0.005 mol
显然CaCl2过量,n余(Cl-)=(0.005-0.002 5)×2
=0.005 mol。
c(Cl-)= =0.05 mol/L。
反应前后Ca2+的物质的量没变
n(Ca2+)=0.005 mol c(Ca2+)=0.005 mol0.1 L=
0.05 mol/L。
答案:0.05 0.05
2.(10分)将0.65 g Zn加到50 mL 1 mol/L盐酸中,计算:
(1)标准状况下,生成H2的体积。
(2)若反应完后,溶液体积仍为50 mL,这时溶液中的Zn2+和H+的物质的量浓度是多少?
【解析】溶液中的Zn2+来自反应生成物ZnCl2,H+应是
反应后剩余的盐酸电离出的H+。因此,求c(Zn2+)与
c(H+)应先求出c(ZnCl2)及反应后的c(HCl)。
解:Zn + 2HCl ==== ZnCl2 + H2↑
1 mol 2 mol 1 mol 22.4 L
0.05 L×1 mol/L 0.05 L×c(ZnCl2) V(H2)
经分析,盐酸过量,应按不过量的Zn的物质的量来进行计算。
反应消耗盐酸为:n1(HCl)=
剩余盐酸为:n2(HCl)=0.05 L×1 mol/L-0.02 mol
=0.03 mol,
答案:(1)0.224 L
(2)c(Zn2+)=0.2 mol/L,c(H+)=0.6 mol/L。
【典例1】(1)在400 mL 2 mol·L-1的H2SO4溶液中,溶质的质量是_____。此溶液中的H+的物质的量浓度为______,SO42-的物质的量浓度为_______。
(2)在标准状况下,700 L NH3的物质的量为_____,全部溶解在1 L水中,所得溶液中溶质的质量分数为,
如果该氨水的密度为0.85 g·cm-3,则氨水的体积为_______,NH3的物质的量浓度为_____。
【思路点拨】解答该题要注意以下三点:
(1)H2SO4溶液中H+和SO42-的关系;
(2)以物质的量为中心的各物理量之间的关系;
(3)物质的量浓度与溶质质量分数的换算。
【自主解答】(1)n=cV=2 mol·L-1×0.4 L=0.8 mol
m(H2SO4)=n·M=0.8 mol×98 g·mol-1=78.4 g
c(H+)=2c(H2SO4)=4 mol·L-1
c(SO42-)=c(H2SO4)=2 mol·L-1
(2)n= =31.25 mol
w(NH3)=
×100%=34.7%
V(液)= =1 801 mL≈1.8 L
c(NH3)= =17.36 mol·L-1
答案:(1)78.4 g 4 mol·L-1 2 mol·L-1
(2)31.25 mol 34.7% 1.8 L 17.36 mol·L-1
【典例2】生态农业涉及农家肥料的综合利用,某种肥
料经发酵得到一种含甲烷、二氧化碳、氮气的混合气
体。2.016 L(标准状况)该气体通过盛有红热CuO粉末
的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质
量减轻4.8 g。将反应后产生的气体通过过量的澄清
石灰水中,充分吸收,生成沉淀8.5 g。
△
(1)原混合气体中甲烷的物质的量是_______。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
【思路点拨】(1)混合气体中只有CH4与CuO反应;
(2)CO2一部分源于原混合气体,另一部分是由CH4与CuO反应生成的。
【自主解答】混合气体总的物质的量为:n(混)
=0.09 mol
CH4+4CuO CO2+2H2O+4Cu Δm
1 mol 1 mol 64 g
0.075 mol 0.075 mol 4.8 g
n(CaCO3)= =0.085 mol,则n(CO2)
=0.085 mol
△
因此,原混合气体中含有的CO2为:n(CO2,原)=0.085 mol-0.075 mol=0.01 mol
则原混合气体中含有N2为:n(N2)=n(混)-
n(CH4)-n(CO2,原)=0.09 mol-0.075 mol-
0.01 mol=0.005 mol
故N2的体积分数=
×100%≈5.56%
答案:(1)0.075 mol (2)5.56%(计算过程见解析)
知识点一:物质的量与各物理量之间的关系
1.物质在发生化学反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量之比等于化学方程式中化学计量数之比
D.它们物质的量之比等于化学方程式中化学计量数之比
【解析】选D。物质在发生化学反应时是按照一定比例进行的,而这个比值可以是质量比,也可以是微粒个数比,也可以是物质的量之比,也可以是气体的体积比,而化学方程式中的化学计量数可以表示微粒个数,也可以表示物质的量,但不表示质量。
2.19世纪化学家对氧化锆的化学式争议颇多,后测定锆(Zr)的相对原子质量为91,其氯化物的蒸气对H2的相对密度为116.5,则氧化锆的化学式为( )
A.Zr2O B.ZrO C.Zr2O3 D.ZrO2
解题提示:密度之比等于摩尔质量之比,即:
【解析】选D。设锆的化合价为+x
则其氯化物的化学式为 ZrClx
91+35.5 x=116.5×2
解得 x=4
则氧化锆的化学式为 ZrO2。
知识点二:物质的量在化学方程式计算中的应用
3.0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则
盐酸的物质的量浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.5 mol·L-1 D.1 mol·L-1
【解析】选B。设盐酸的物质的量浓度为x,
HCl + NaOH ==== NaCl + H2O
1 mol 1 mol
0.02 L×x 0.16 g/40 g·mol-1
0.02 L×x= mol解得x=0.2 mol·L-1
4.将质量为100 g的铁棒插入 1 L 0.5 mol/L的CuSO4溶液中,足够长的时间后,铁棒的质量将变为( )
A.102 g B.106 g C.104 g D.110 g
【解析】选C。可用差量法解答此题,首先根据方程式可以判断Fe与CuSO4反应中Fe过量,题目以CuSO4为依据来计算。
设铁棒增重m,则
Fe+ CuSO4====FeSO4+Cu Δm
56 g 1 mol 64 g 8 g
1 L×0.5 mol/L m
m=
故铁棒质量变为100 g+4 g=104 g。
5.1.15 g金属钠跟水反应,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下是多少升?
(2)反应后所得溶液的物质的量浓度是多少?
【解析】设生成标准状况下气体的体积为V,溶液的物质的量浓度为c,根据化学方程式列比例式解方程式:
2Na+2H2O====2NaOH + H2↑
2×23 g 2 mol 22.4 L
1.15 g 0.1 L×cV
c= =0.5 mol·L-1
V= =0.56 L
答案:(1)0.56 L (2)0.5 mol·L-1
一、选择题(本题包括3个小题,每小题4分,共12分)
1.把10 g铜铝合金的粉末放入过量的盐酸中,得到
10.08 L H2(标准状况)。则合金中铝的质量分数
为( )
A.81% B.82.30%
C.78% D.19%
【解析】选A。铜铝合金中只有铝与盐酸反应。
2Al+6HCl====2AlCl3+3H2↑
2 mol 3×22.4 L
n(Al) 10.08 L
n(Al)= =0.3 mol,
w(Al)= ×100%=81%。
2.等质量的Fe、Zn、Al和Na,分别投入足量盐酸中,置换出的氢气由多到少的顺序是( )
A.Fe>Zn>Al>Na
B.Na>Al>Zn>Fe
C.Al>Na>Fe>Zn
D.Na>Al>Zn>Fe
【解析】选C。设金属质量为w,化合价为+n价,金属的相对原子质量为m,放出氢气的质量为x。
2R+2nHCl====2RCln+nH2↑
2m g 2n g
w x
因w是定值,所以x的大小决定于n/m。生成氢气的质
量比为
w(Fe)∶w(Zn)∶w(Al)∶w(Na)
故产生氢气由多到少的顺序为Al>Na>Fe>Zn。
3.把11.5 g Na投入到m1 g过量水中得a g溶液,把
12 g Mg投入到m2 g过量盐酸中得到b g溶液,若m1=m2,则a、b的质量关系是( )
A.a>b B.a
【解析】选C。此题目宜用“差量法”求解。
2Na+2H2O====2NaOH+H2↑ Δm(溶液质量增加)
46 g 44 g
11.5 g x
x=11 g。
Mg+2HCl====MgCl2+H2↑ Δm(溶液质量增加)
24 g 22 g
12 g y
y=11 g
由于m1=m2,故a=b。
二、非选择题(本题包括2个小题,共18分)
4.(12分)把5.4 g Al放入足量的氢氧化钠溶液中完全反应。计算:
(1)5.4 g Al的物质的量;
(2)消耗氢氧化钠的质量;
(3)生成的气体的体积(标准状况)。
【解析】(1)Al的摩尔质量是27 g/mol,
n(Al)= =0.2 mol
(2)2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2 mol 80 g 67.2 L
0.2 mol m(NaOH) V(H2)
m(NaOH)=
(3)V(H2)= =6.72 L。
答案:(1)0.2 mol (2)8 g (3)6.72 L
5.(6分)某浓硫酸溶质的质量分数为98%,密度为
1.84 g/cm3。计算该浓硫酸中H2SO4的物质的量浓度。
答案:18.4 mol/L
【解析】
1.(10分)把50 mL 0.1 mol/L CaCl2溶液和50 mL
0.1 mol/L AgNO3溶液混合,设混合后溶液的总体
积不变,则反应后溶液中Cl-的物质的量浓度为
____mol/L;Ca2+的物质的量浓度为_____mol/L。
【解析】CaCl2与AgNO3反应的方程式为
CaCl2+2AgNO3====Ca(NO3)2+2AgCl↓。
0.005 mol 0.005 mol
显然CaCl2过量,n余(Cl-)=(0.005-0.002 5)×2
=0.005 mol。
c(Cl-)= =0.05 mol/L。
反应前后Ca2+的物质的量没变
n(Ca2+)=0.005 mol c(Ca2+)=0.005 mol0.1 L=
0.05 mol/L。
答案:0.05 0.05
2.(10分)将0.65 g Zn加到50 mL 1 mol/L盐酸中,计算:
(1)标准状况下,生成H2的体积。
(2)若反应完后,溶液体积仍为50 mL,这时溶液中的Zn2+和H+的物质的量浓度是多少?
【解析】溶液中的Zn2+来自反应生成物ZnCl2,H+应是
反应后剩余的盐酸电离出的H+。因此,求c(Zn2+)与
c(H+)应先求出c(ZnCl2)及反应后的c(HCl)。
解:Zn + 2HCl ==== ZnCl2 + H2↑
1 mol 2 mol 1 mol 22.4 L
0.05 L×1 mol/L 0.05 L×c(ZnCl2) V(H2)
经分析,盐酸过量,应按不过量的Zn的物质的量来进行计算。
反应消耗盐酸为:n1(HCl)=
剩余盐酸为:n2(HCl)=0.05 L×1 mol/L-0.02 mol
=0.03 mol,
答案:(1)0.224 L
(2)c(Zn2+)=0.2 mol/L,c(H+)=0.6 mol/L。
