10-11高中化学课时讲练通课件:3.2.2 几种重要的金属化合物(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:3.2.2 几种重要的金属化合物(人教版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 12:04:02 | ||
图片预览










文档简介
(共63张PPT)
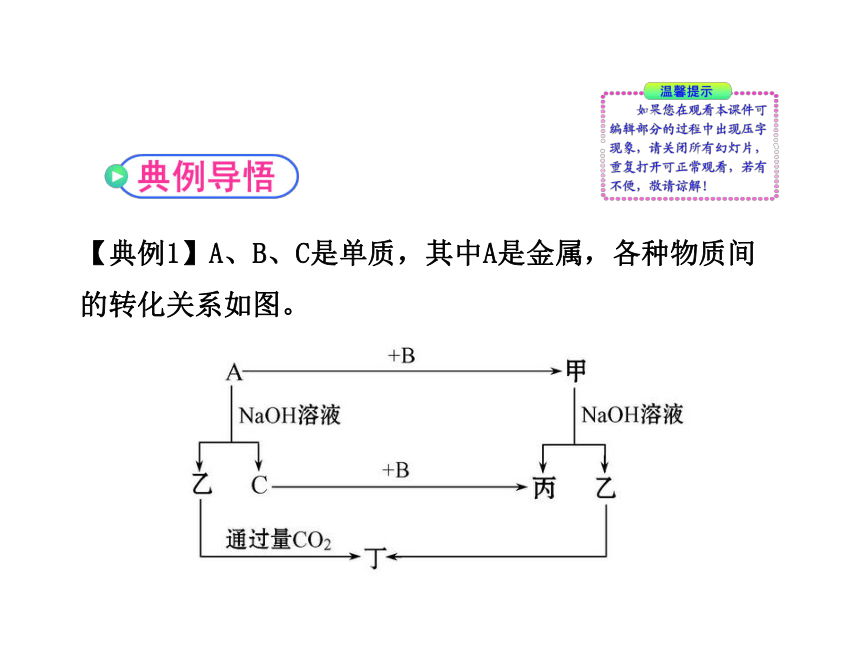
【典例1】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。
根据图示转化关系回答:
(1)写出下列物质的化学式。
A_____,B_____,乙_____,丁_____。
(2)写出下列变化的反应方程式。
①A与NaOH溶液反应的化学方程式______________。
②甲与NaOH溶液反应的离子方程式_____________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为_______,转移电子的物质的量为___________。
【思路点拨】解答此题要注意以下三点:
(1)依据常见金属性质判断物质A;
(2)依据物质性质正确书写化学方程式;
(3)依据化学方程式进行计算。
【自主解答】常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可能是Al2O3,则丙是H2O,B即是O2。根据NaAlO2+CO2+2H2O====NaHCO3+Al(OH)3↓得丁是Al(OH)3。
答案:(1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O====2NaAlO2+3H2↑
②Al2O3+2OH-====2AlO2-+H2O
(3)0.1 mol 0.3 mol
【典例2】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16 g白色沉淀,再向所得浊液中逐滴加入1.00 mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:
(1)A点的沉淀物的化学式为________________,
理由是_________________________________。
(2)写出A点至B点发生反应的离子方程式_____________________________________。
(3)原混合物中MgCl2的质量是______g,AlCl3的质量是_______g,NaOH的质量是________g。
(4)C点所用HCl溶液的体积为_________mL。
【思路点拨】解答此题要注意以下三点:
(1)明确图像横纵坐标代表的意义;
(2)通过图像明确溶液中存在的离子;
(3)明确铝三角间的转化关系。
【自主解答】(1)加入10.0 mL HCl溶液后沉淀才增加,说明原混合物中NaOH过量,故A点的沉淀只有Mg(OH)2。
(2)A→B,AlO2-刚好生成Al(OH)3,
反应式为AlO2-+H2O+H+====Al(OH)3↓。
(3)n(MgCl2)=n[Mg(OH)2]= =0.020 mol,
m(MgCl2)=0.020 mol×95 g·mol-1=1.90 g,
n(AlCl3)=n(AlO2-)=1.00 mol·L-1×(30.0-10.0) mL
×10-3 L·mL-1=0.020 mol,
m(AlCl3)=0.020 mol×133.5 g·mol-1=2.67 g。
n(NaOH)=2n(MgCl2)+4n(AlCl3)+1.00 mol·L-1
×0.010 L=0.130 mol,
m(NaOH)=0.130 mol×40.0 g·mol-1=5.20 g。
(4)从B→C,加入的HCl刚好把Mg(OH)2、Al(OH)3溶解
掉。n(HCl)=0.030 L×1.00 mol·L-1+2n[Mg(OH)2]+3n[Al(OH)3]=0.130 mol,V(HCl溶液)=
=0.130 L=130 mL。
答案:(1)Mg(OH)2 加入10.0 mL盐酸正好中和过
量的NaOH,再加盐酸沉淀增加,说明AlO2-转化为
Al(OH)3,故A点沉淀为Mg(OH)2
(2)AlO2-+H++H2O====Al(OH)3↓
(3)1.90 2.67 5.20 (4)130
知识点一:氧化铝
1.(2010·湛江高一检测)以Al2O3为原料制取氢氧化铝,最好的方法是( )
A.将Al2O3溶于水
B.将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C.将Al2O3先溶于盐酸中,之后滴加氨水
D.将Al2O3先溶于NaOH溶液中,之后滴加盐酸
【解析】选C。氧化铝是两性氧化物,不溶于水,A错;氢氧化铝能溶于NaOH溶液,将其溶于盐酸中,再滴加NaOH溶液,不能确定NaOH是过量还是不足,不能把握准确,不恰当,B错;氢氧化铝不溶于氨水,所以在氯化铝溶液中滴加过量的氨水,可以使铝离子全部生成氢氧化铝沉淀,C可以;氢氧化铝同样可以溶于盐酸,所以这种方法也不恰当,D错,综上所述答案为C。
2.下列关于氧化物的叙述中,正确的是( )
A.酸性氧化物都可以与强碱溶液反应
B.与水反应生成酸的氧化物都是酸性氧化物
C.金属氧化物都是碱性氧化物或两性氧化物
D.不能与酸反应的氧化物一定能与碱反应
【解析】选A。抓住氧化物中的特例,认真分析氧化物的有关性质,加深理解。根据酸性氧化物的概念,可知酸性氧化物都能与碱反应,但与水反应生成酸的氧化物并不一定是酸性氧化物,如3NO2+H2O====2HNO3
+NO,NO2并非酸性氧化物。金属氧化物中的Na2O2既不是碱性氧化物也不是两性氧化物。CO既不与酸反应,也不与碱反应,则正确答案为A。
3.(2010·厦门高一检测)固体混合物A中含有AlCl3、Al2O3和Fe2O3,A在一定条件下可实现如图所示的变化,填写下列空白:
(1)沉淀B为_____(填化学式,下同),沉淀C为_____。
(2)溶液乙中的生成物为_____。
(3)写出反应①的化学方程式_____________。
【解析】依据题意将所给物质溶于水,只有氯化铝能溶于水,其他物质不溶,将沉淀溶于NaOH溶液中,反应的是氧化铝,不反应的是氧化铁;氯化铝溶液中滴加过量的氨水,生成氢氧化铝沉淀和氯化铵溶液。
答案:(1)Fe2O3 Al(OH)3
(2)NH4Cl
(3)Al2O3+2NaOH====2NaAlO2+H2O
知识点二:氢氧化铝
4.实验室需要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2溶液
C.硫酸 D.氨水
【解析】选D。使铝盐全部沉淀的方法是使沉淀剂适当过量,因为氢氧化铝既能溶于酸,又能溶于强碱,所以不能用酸或强碱来制备,只能用铝盐与过量氨水来制备。
5.下列反应方程式中,正确的是( )
A.Al2(SO4)3与过量氨水溶液反应
Al3++4NH3·H2O====AlO2-+4NH4++2H2O
B.氧化铝和过量的烧碱溶液反应
Al2O3+OH-====2AlO2-+H2O
C.氯化铝溶液与少量NaOH溶液反应
Al3++3OH-====Al(OH)3↓
D.铝与醋酸反应
2Al+6H+====2Al3++3H2↑
【解析】选C。A中Al(OH)3只能溶于强碱而不能溶
于氨水这样的弱碱,此反应的离子方程式应为:Al3++3NH3·H2O====Al(OH)3↓+3NH4+,B项中电荷不守恒,D项中醋酸是弱酸,应写成分子形式。
一、选择题(本题包括5个小题,每小题4分,共20分)
1.有NaCl、MgCl2、AlCl3三种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液
C.氨水 D.KSCN溶液
【解析】选B。NaOH与上述三种溶液分别混合时,现象各不相同。NaCl+NaOH:无现象。
MgCl2+NaOH:生成白色沉淀,NaOH过量时沉淀也不消失,MgCl2+2NaOH====Mg(OH)2↓+2NaCl。
AlCl3+NaOH:先出现白色絮状沉淀,当NaOH过量时,沉淀逐渐溶解直至完全消失,AlCl3+3NaOH====Al(OH)3↓+3NaCl,Al(OH)3+NaOH====
NaAlO2+2H2O。
2.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A.KOH和Al2(SO4)3
B.稀H2SO4和NaHCO3
C.CaCl2和Na2CO3
D.Ba(OH)2和NaHSO4
【解析】选A。不用任何试剂鉴别物质的题型,是高
考的热点题型之一,若将KOH溶液滴加到Al2(SO4)3溶液中,边滴边振荡,所发生的现象是先生成沉淀,然后沉淀逐渐溶解,最后沉淀消失。若将Al2(SO4)3溶液滴加到KOH溶液中,边滴边振荡,所发生的现象是起始无沉淀产生,然后沉淀量逐渐增多,继续滴加沉淀不再增多,也不会消失。有关离子方程式为Al3++4OH-====AlO2-+2H2O,Al3++3AlO2-+6H2O====4Al(OH)3↓。
B项不管稀H2SO4滴加到NaHCO3中,还是NaHCO3滴加到稀H2SO4中都只发生:H++HCO3-====CO2↑+H2O,现象都是产生气体。C项不管CaCl2滴加到Na2CO3中还是Na2CO3滴加到CaCl2中,只发生:Ca2++CO32-====CaCO3↓,现象都是产生白色沉淀。D项不管NaHSO4滴加到Ba(OH)2中还是Ba(OH)2滴加到NaHSO4中,发生Ba2++OH-+H++SO42-
====BaSO4↓+H2O或Ba2++2OH-+2H++SO42-====BaSO4↓
+2H2O,现象都是产生白色沉淀。
3.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。在下图中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
【解析】选D。
开始发生反应:MgSO4+2NaOH====Mg(OH)2↓+Na2SO4
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4
表现为图像中沉淀量逐渐增多。沉淀量达最大时,再滴加NaOH溶液发生反应:Al(OH)3+OH-====AlO2-+2H2O表现为图像中沉淀量逐渐减少至某一程度不变,故选D。
4.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
A.Al(OH)3 B.NaCl溶液
C.K2SO4溶液 D.稀H2SO4
【解析】选A。本题考查的是两性物质的性质,既能和酸反应,又能和碱反应,则Al(OH)3属于两性氢氧化物,与盐酸反应产物是AlCl3,与氢氧化钠溶液反应产物是NaAlO2。
5.(双选)向20 mL 1 mol·L-1的Al2(SO4)3溶液中加入30 mL KOH溶液,充分反应得到0.78 g沉淀,则KOH溶液的物质的量浓度可能是( )
A.1 mol·L-1 B.3 mol·L-1
C.5 mol·L-1 D.7 mol·L-1
【解析】选A、C。解本题时要明确:生成的Al(OH)3沉淀可溶于过量的KOH溶液,所以分两种情况(KOH不足或过量)来讨论。从Al3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH的两种情况:①不足量时,n(KOH)=3n[Al(OH)3];
②KOH过量时,n(KOH)=4n(Al3+)-n[Al(OH)3]。解题过程可分以下两步进行。
(1)求Al3+和Al(OH)3沉淀的物质的量:n(Al3+)=0.02 L
×1 mol·L-1×2=0.04 mol,n[Al(OH)3]=0.78 g/
78 g·mol-1=0.01 mol。(2)当KOH不足时:n(KOH)=
3n[Al(OH)3]=0.03 mol,c(KOH)=0.03 mol/0.03 L=
1 mol·L-1;当KOH过量时:n(KOH)=4n(Al3+)-
n[Al(OH)3]=0.16 mol-0.01 mol=0.15 mol,
c(KOH)=0.15 mol/0.03 L=5 mol·L-1。
二、非选择题(本题包括1个小题,共10分)
6.向20 mL某浓度的AlCl3溶液中滴加2 mol/L的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
(1)图中A点的意义_______________________。
(2)最大沉淀量为______g。
(3)B点表示的意义是__________________________
(4)所用AlCl3溶液的物质的量浓度为_______。
(5)当所得沉淀量为0.39 g时,用去NaOH溶液的体积是____________。
【解析】向AlCl3溶液中滴NaOH发生的反应有
AlCl3+3NaOH====Al(OH)3↓+3NaCl ①
Al(OH)3+NaOH====NaAlO2+2H2O ②
故(1)A点的意义表示此时沉淀达最大值。
(2)A点时恰好发生①
n[Al(OH)3]= n(NaOH)= ×2 mol/L
×0.015 L=0.01 mol,
m(Al(OH)3)=0.01 mol×78 g/mol=0.78 g。
(3)B点表示沉淀又完全溶解。
(4)n(AlCl3)=n[Al(OH)3]=0.01 mol,
c(AlCl3)= =0.5 mol/L。
(5)当沉淀量为0.39 g时,由图像可知消耗的NaOH溶液的体积为7.5 mL或17.5 mL。
答案:(1)加入15 mL NaOH溶液时产生沉淀的质量最大
(2)0.78
(3)产生沉淀的量最大后,再加5 mL NaOH溶液时沉淀恰好完全溶解
(4)0.5 mol/L (5)7.5 mL或17.5 mL
1.(5分)向含n mol AlCl3的溶液中加入含m mol
NaOH的溶液,观察到的现象是先有白色沉淀生成,
后沉淀部分溶解,则生成Al(OH)3沉淀的物质的量是
( )
A.(4n-m) mol B.(4m-n) mol
C.(n-3m) mol D.(3m-n) mol
【解析】选A。由观察到的现象可知发生的反应有:
AlCl3+3NaOH====Al(OH)3↓+3NaCl
n mol 3n mol n mol
Al(OH)3 + NaOH====NaAlO2 + 2H2O
(m-3n) mol (m-3n) mol
故剩余Al(OH)3的物质的量为n-(m-3n)=(4n-m) mol。
2.(15分)某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________________________、
____________________________________________、
____________________________________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?____
____________________________________________。
(3)溶液a中存在的离子有______;在溶液a中加入盐酸时需控制盐酸的量,为什么?________________
___________________________________________;
为此,改进方法是___________________________。
【解析】(1)加入足量氢氧化钠溶液,Mg2+可与OH-反应生成Mg(OH)2沉淀,Al3+先与OH-反应生成Al(OH)3,生成的Al(OH)3继续与OH-反应生成NaAlO2和H2O;
(2)氢氧化钠溶液不能用氨水代替,因为Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开;
(3)加入氢氧化钠溶液后除去了Mg2+,但又引入了Na+,同时Al3+转化成了AlO2-;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-
时,需要控制盐酸的量,以防止部分铝转化成Al3+;氢氧化铝只能与强碱或强酸反应,因此可在溶液a中通入过量的二氧化碳气体。
答案:(1)Mg2++2OH-===Mg(OH)2↓
Al3++3OH-====Al(OH)3↓
Al(OH)3+OH-====AlO2-+2H2O
(2)不能,因为Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(3)Cl-、K+、AlO2-、H+、OH-、Na+因为氢氧化铝能与强酸反应,所以在加入盐酸将AlO2-转化为Al(OH)3沉淀时,需要控制盐酸的量,以防止部分铝转化成Al3+通入过量二氧化碳气体
【典例1】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。
根据图示转化关系回答:
(1)写出下列物质的化学式。
A_____,B_____,乙_____,丁_____。
(2)写出下列变化的反应方程式。
①A与NaOH溶液反应的化学方程式______________。
②甲与NaOH溶液反应的离子方程式_____________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为_______,转移电子的物质的量为___________。
【思路点拨】解答此题要注意以下三点:
(1)依据常见金属性质判断物质A;
(2)依据物质性质正确书写化学方程式;
(3)依据化学方程式进行计算。
【自主解答】常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可能是Al2O3,则丙是H2O,B即是O2。根据NaAlO2+CO2+2H2O====NaHCO3+Al(OH)3↓得丁是Al(OH)3。
答案:(1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O====2NaAlO2+3H2↑
②Al2O3+2OH-====2AlO2-+H2O
(3)0.1 mol 0.3 mol
【典例2】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16 g白色沉淀,再向所得浊液中逐滴加入1.00 mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:
(1)A点的沉淀物的化学式为________________,
理由是_________________________________。
(2)写出A点至B点发生反应的离子方程式_____________________________________。
(3)原混合物中MgCl2的质量是______g,AlCl3的质量是_______g,NaOH的质量是________g。
(4)C点所用HCl溶液的体积为_________mL。
【思路点拨】解答此题要注意以下三点:
(1)明确图像横纵坐标代表的意义;
(2)通过图像明确溶液中存在的离子;
(3)明确铝三角间的转化关系。
【自主解答】(1)加入10.0 mL HCl溶液后沉淀才增加,说明原混合物中NaOH过量,故A点的沉淀只有Mg(OH)2。
(2)A→B,AlO2-刚好生成Al(OH)3,
反应式为AlO2-+H2O+H+====Al(OH)3↓。
(3)n(MgCl2)=n[Mg(OH)2]= =0.020 mol,
m(MgCl2)=0.020 mol×95 g·mol-1=1.90 g,
n(AlCl3)=n(AlO2-)=1.00 mol·L-1×(30.0-10.0) mL
×10-3 L·mL-1=0.020 mol,
m(AlCl3)=0.020 mol×133.5 g·mol-1=2.67 g。
n(NaOH)=2n(MgCl2)+4n(AlCl3)+1.00 mol·L-1
×0.010 L=0.130 mol,
m(NaOH)=0.130 mol×40.0 g·mol-1=5.20 g。
(4)从B→C,加入的HCl刚好把Mg(OH)2、Al(OH)3溶解
掉。n(HCl)=0.030 L×1.00 mol·L-1+2n[Mg(OH)2]+3n[Al(OH)3]=0.130 mol,V(HCl溶液)=
=0.130 L=130 mL。
答案:(1)Mg(OH)2 加入10.0 mL盐酸正好中和过
量的NaOH,再加盐酸沉淀增加,说明AlO2-转化为
Al(OH)3,故A点沉淀为Mg(OH)2
(2)AlO2-+H++H2O====Al(OH)3↓
(3)1.90 2.67 5.20 (4)130
知识点一:氧化铝
1.(2010·湛江高一检测)以Al2O3为原料制取氢氧化铝,最好的方法是( )
A.将Al2O3溶于水
B.将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C.将Al2O3先溶于盐酸中,之后滴加氨水
D.将Al2O3先溶于NaOH溶液中,之后滴加盐酸
【解析】选C。氧化铝是两性氧化物,不溶于水,A错;氢氧化铝能溶于NaOH溶液,将其溶于盐酸中,再滴加NaOH溶液,不能确定NaOH是过量还是不足,不能把握准确,不恰当,B错;氢氧化铝不溶于氨水,所以在氯化铝溶液中滴加过量的氨水,可以使铝离子全部生成氢氧化铝沉淀,C可以;氢氧化铝同样可以溶于盐酸,所以这种方法也不恰当,D错,综上所述答案为C。
2.下列关于氧化物的叙述中,正确的是( )
A.酸性氧化物都可以与强碱溶液反应
B.与水反应生成酸的氧化物都是酸性氧化物
C.金属氧化物都是碱性氧化物或两性氧化物
D.不能与酸反应的氧化物一定能与碱反应
【解析】选A。抓住氧化物中的特例,认真分析氧化物的有关性质,加深理解。根据酸性氧化物的概念,可知酸性氧化物都能与碱反应,但与水反应生成酸的氧化物并不一定是酸性氧化物,如3NO2+H2O====2HNO3
+NO,NO2并非酸性氧化物。金属氧化物中的Na2O2既不是碱性氧化物也不是两性氧化物。CO既不与酸反应,也不与碱反应,则正确答案为A。
3.(2010·厦门高一检测)固体混合物A中含有AlCl3、Al2O3和Fe2O3,A在一定条件下可实现如图所示的变化,填写下列空白:
(1)沉淀B为_____(填化学式,下同),沉淀C为_____。
(2)溶液乙中的生成物为_____。
(3)写出反应①的化学方程式_____________。
【解析】依据题意将所给物质溶于水,只有氯化铝能溶于水,其他物质不溶,将沉淀溶于NaOH溶液中,反应的是氧化铝,不反应的是氧化铁;氯化铝溶液中滴加过量的氨水,生成氢氧化铝沉淀和氯化铵溶液。
答案:(1)Fe2O3 Al(OH)3
(2)NH4Cl
(3)Al2O3+2NaOH====2NaAlO2+H2O
知识点二:氢氧化铝
4.实验室需要使AlCl3溶液中的Al3+全部沉淀出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2溶液
C.硫酸 D.氨水
【解析】选D。使铝盐全部沉淀的方法是使沉淀剂适当过量,因为氢氧化铝既能溶于酸,又能溶于强碱,所以不能用酸或强碱来制备,只能用铝盐与过量氨水来制备。
5.下列反应方程式中,正确的是( )
A.Al2(SO4)3与过量氨水溶液反应
Al3++4NH3·H2O====AlO2-+4NH4++2H2O
B.氧化铝和过量的烧碱溶液反应
Al2O3+OH-====2AlO2-+H2O
C.氯化铝溶液与少量NaOH溶液反应
Al3++3OH-====Al(OH)3↓
D.铝与醋酸反应
2Al+6H+====2Al3++3H2↑
【解析】选C。A中Al(OH)3只能溶于强碱而不能溶
于氨水这样的弱碱,此反应的离子方程式应为:Al3++3NH3·H2O====Al(OH)3↓+3NH4+,B项中电荷不守恒,D项中醋酸是弱酸,应写成分子形式。
一、选择题(本题包括5个小题,每小题4分,共20分)
1.有NaCl、MgCl2、AlCl3三种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液
C.氨水 D.KSCN溶液
【解析】选B。NaOH与上述三种溶液分别混合时,现象各不相同。NaCl+NaOH:无现象。
MgCl2+NaOH:生成白色沉淀,NaOH过量时沉淀也不消失,MgCl2+2NaOH====Mg(OH)2↓+2NaCl。
AlCl3+NaOH:先出现白色絮状沉淀,当NaOH过量时,沉淀逐渐溶解直至完全消失,AlCl3+3NaOH====Al(OH)3↓+3NaCl,Al(OH)3+NaOH====
NaAlO2+2H2O。
2.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A.KOH和Al2(SO4)3
B.稀H2SO4和NaHCO3
C.CaCl2和Na2CO3
D.Ba(OH)2和NaHSO4
【解析】选A。不用任何试剂鉴别物质的题型,是高
考的热点题型之一,若将KOH溶液滴加到Al2(SO4)3溶液中,边滴边振荡,所发生的现象是先生成沉淀,然后沉淀逐渐溶解,最后沉淀消失。若将Al2(SO4)3溶液滴加到KOH溶液中,边滴边振荡,所发生的现象是起始无沉淀产生,然后沉淀量逐渐增多,继续滴加沉淀不再增多,也不会消失。有关离子方程式为Al3++4OH-====AlO2-+2H2O,Al3++3AlO2-+6H2O====4Al(OH)3↓。
B项不管稀H2SO4滴加到NaHCO3中,还是NaHCO3滴加到稀H2SO4中都只发生:H++HCO3-====CO2↑+H2O,现象都是产生气体。C项不管CaCl2滴加到Na2CO3中还是Na2CO3滴加到CaCl2中,只发生:Ca2++CO32-====CaCO3↓,现象都是产生白色沉淀。D项不管NaHSO4滴加到Ba(OH)2中还是Ba(OH)2滴加到NaHSO4中,发生Ba2++OH-+H++SO42-
====BaSO4↓+H2O或Ba2++2OH-+2H++SO42-====BaSO4↓
+2H2O,现象都是产生白色沉淀。
3.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。在下图中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
【解析】选D。
开始发生反应:MgSO4+2NaOH====Mg(OH)2↓+Na2SO4
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4
表现为图像中沉淀量逐渐增多。沉淀量达最大时,再滴加NaOH溶液发生反应:Al(OH)3+OH-====AlO2-+2H2O表现为图像中沉淀量逐渐减少至某一程度不变,故选D。
4.下列物质中既能跟盐酸反应,又能跟氢氧化钠溶液反应的是( )
A.Al(OH)3 B.NaCl溶液
C.K2SO4溶液 D.稀H2SO4
【解析】选A。本题考查的是两性物质的性质,既能和酸反应,又能和碱反应,则Al(OH)3属于两性氢氧化物,与盐酸反应产物是AlCl3,与氢氧化钠溶液反应产物是NaAlO2。
5.(双选)向20 mL 1 mol·L-1的Al2(SO4)3溶液中加入30 mL KOH溶液,充分反应得到0.78 g沉淀,则KOH溶液的物质的量浓度可能是( )
A.1 mol·L-1 B.3 mol·L-1
C.5 mol·L-1 D.7 mol·L-1
【解析】选A、C。解本题时要明确:生成的Al(OH)3沉淀可溶于过量的KOH溶液,所以分两种情况(KOH不足或过量)来讨论。从Al3+的物质的量与沉淀Al(OH)3的物质的量比较可推测KOH的两种情况:①不足量时,n(KOH)=3n[Al(OH)3];
②KOH过量时,n(KOH)=4n(Al3+)-n[Al(OH)3]。解题过程可分以下两步进行。
(1)求Al3+和Al(OH)3沉淀的物质的量:n(Al3+)=0.02 L
×1 mol·L-1×2=0.04 mol,n[Al(OH)3]=0.78 g/
78 g·mol-1=0.01 mol。(2)当KOH不足时:n(KOH)=
3n[Al(OH)3]=0.03 mol,c(KOH)=0.03 mol/0.03 L=
1 mol·L-1;当KOH过量时:n(KOH)=4n(Al3+)-
n[Al(OH)3]=0.16 mol-0.01 mol=0.15 mol,
c(KOH)=0.15 mol/0.03 L=5 mol·L-1。
二、非选择题(本题包括1个小题,共10分)
6.向20 mL某浓度的AlCl3溶液中滴加2 mol/L的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
(1)图中A点的意义_______________________。
(2)最大沉淀量为______g。
(3)B点表示的意义是__________________________
(4)所用AlCl3溶液的物质的量浓度为_______。
(5)当所得沉淀量为0.39 g时,用去NaOH溶液的体积是____________。
【解析】向AlCl3溶液中滴NaOH发生的反应有
AlCl3+3NaOH====Al(OH)3↓+3NaCl ①
Al(OH)3+NaOH====NaAlO2+2H2O ②
故(1)A点的意义表示此时沉淀达最大值。
(2)A点时恰好发生①
n[Al(OH)3]= n(NaOH)= ×2 mol/L
×0.015 L=0.01 mol,
m(Al(OH)3)=0.01 mol×78 g/mol=0.78 g。
(3)B点表示沉淀又完全溶解。
(4)n(AlCl3)=n[Al(OH)3]=0.01 mol,
c(AlCl3)= =0.5 mol/L。
(5)当沉淀量为0.39 g时,由图像可知消耗的NaOH溶液的体积为7.5 mL或17.5 mL。
答案:(1)加入15 mL NaOH溶液时产生沉淀的质量最大
(2)0.78
(3)产生沉淀的量最大后,再加5 mL NaOH溶液时沉淀恰好完全溶解
(4)0.5 mol/L (5)7.5 mL或17.5 mL
1.(5分)向含n mol AlCl3的溶液中加入含m mol
NaOH的溶液,观察到的现象是先有白色沉淀生成,
后沉淀部分溶解,则生成Al(OH)3沉淀的物质的量是
( )
A.(4n-m) mol B.(4m-n) mol
C.(n-3m) mol D.(3m-n) mol
【解析】选A。由观察到的现象可知发生的反应有:
AlCl3+3NaOH====Al(OH)3↓+3NaCl
n mol 3n mol n mol
Al(OH)3 + NaOH====NaAlO2 + 2H2O
(m-3n) mol (m-3n) mol
故剩余Al(OH)3的物质的量为n-(m-3n)=(4n-m) mol。
2.(15分)某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:________________________、
____________________________________________、
____________________________________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?____
____________________________________________。
(3)溶液a中存在的离子有______;在溶液a中加入盐酸时需控制盐酸的量,为什么?________________
___________________________________________;
为此,改进方法是___________________________。
【解析】(1)加入足量氢氧化钠溶液,Mg2+可与OH-反应生成Mg(OH)2沉淀,Al3+先与OH-反应生成Al(OH)3,生成的Al(OH)3继续与OH-反应生成NaAlO2和H2O;
(2)氢氧化钠溶液不能用氨水代替,因为Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开;
(3)加入氢氧化钠溶液后除去了Mg2+,但又引入了Na+,同时Al3+转化成了AlO2-;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-
时,需要控制盐酸的量,以防止部分铝转化成Al3+;氢氧化铝只能与强碱或强酸反应,因此可在溶液a中通入过量的二氧化碳气体。
答案:(1)Mg2++2OH-===Mg(OH)2↓
Al3++3OH-====Al(OH)3↓
Al(OH)3+OH-====AlO2-+2H2O
(2)不能,因为Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开
(3)Cl-、K+、AlO2-、H+、OH-、Na+因为氢氧化铝能与强酸反应,所以在加入盐酸将AlO2-转化为Al(OH)3沉淀时,需要控制盐酸的量,以防止部分铝转化成Al3+通入过量二氧化碳气体
