c研究有机化合物基本步骤段
文档属性
| 名称 | c研究有机化合物基本步骤段 |

|
|
| 格式 | rar | ||
| 文件大小 | 525.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-08 00:00:00 | ||
图片预览










文档简介
(共38张PPT)
第一章 认识有机化合物
第四节 研究有机化合物的一
般步骤和方法
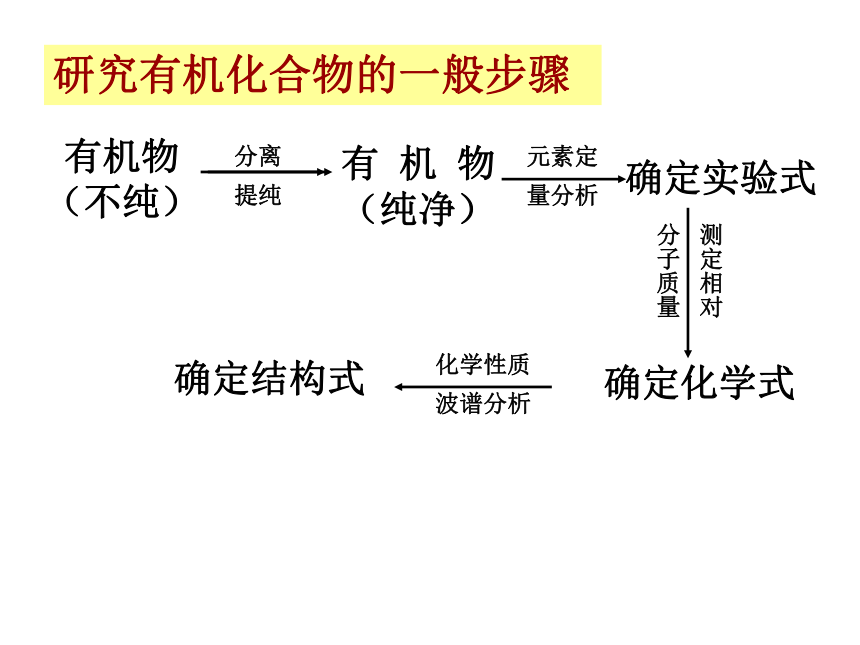
有机物(不纯)
有机物(纯净)
分离 提纯
研究有机化合物的一般步骤
确定实验式
元素定量分析
确定化学式
测定相对
分子质量
确定结构式
化学性质波谱分析
【思考与交流】
1、常用的分离、提纯物质的方法有哪些?
2、下列物质中的杂质(括号中是杂质)可以用什么方法除去。
(1)酒精(水) (2 CO2(HCl) )
(3)KNO3(NaCl ) (4)乙酸乙酯(乙醇)
(5)溴水(水) (6)NaCl(泥沙)
3、归纳分离、提纯物质的总的原则是什么
物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的常用物理方法
蒸馏
重结晶
萃取
分液
化学方法:一般是加入或通过某种试剂进行化学反应。
分离除杂的基本原则:
不增、不减、易分离、易复原
已知工业乙醇中含有甲醇和水,用什么方法分离提纯乙醇?(乙醇沸点78.15℃,甲醇沸点64.7 ℃,水的沸点100 ℃,三者混溶)
【思考与交流】
一、分离和提纯
1、蒸馏
(3)蒸馏条件:
①有机物热稳定性较强
②与杂质的沸点相差较大时(一般约大于30℃ )
(1)原理: 利用混合物中各种成分的沸点不同,除去难挥发或不挥发的杂质
(2)适用范围:分离互溶且沸点不同的液体混合物
(4)仪器和装置:
蒸馏烧瓶
冷凝管
温度计
尾接管
冷水
使用前要检查装置的气密性!
锥形瓶
酒精灯
石棉网
铁架台
阅读课本实验过程,研讨以下问题:
1、请用简单的词语概括乙醇蒸馏试验的操作步骤。
2、该实验中温度计水银球位置?为什么?
3、为什么要加碎瓷片?冷凝水管的流向?
4、得到的三种馏分,乙醇主要在哪个温度范围内?收集到的乙醇馏分是纯净物吗?
【交流研讨】
注意课本上的小注解呦!
(2)工业酒精的蒸馏实验
操作步骤:
倒入工业酒精
添加碎瓷片
冷凝管通水
加热蒸馏
收集馏分
阅读课本实验过程,研讨以下问题:
1、请用简单的词语概括乙醇蒸馏试验的操作步骤。
2、该实验中温度计水银球位置?为什么?
3、为什么要加碎瓷片?冷凝水管的流向?
4、得到的三种馏分,乙醇主要在哪个温度范围内?收集到的乙醇馏分是纯净物吗?
【交流研讨】
注意课本上的小注解呦!
注意事项:
①在蒸馏烧瓶中放少量碎瓷片或沸石,防止液体暴沸。
②温度计水银球支管口处。
④蒸馏烧瓶中所盛放液体不能超过其容积的2/3,不少于1/3.
③冷凝管中冷却水从下口进,从上口出。(与蒸汽流向逆流,热交换充分,有利于气体液化)
⑤蒸馏烧瓶不能直接加热,应垫上石棉网。
含杂工业乙醇
95.6工业乙醇
无水乙醇(99.5%以上)
蒸馏
加CaO
无水酒精的制取
蒸馏
蒸馏常见应用:
酒精提纯
石油分馏
海水的淡化
分馏:多次蒸馏,进行多种混合液体的分离。
已知KNO3在水中的溶解度很容易随温度变化而变化,而NaCl的溶解度却变化不大,据此可用何方法分离出两者混合物中的KNO3并加以提纯?
【思考与交流】
2、重结晶:
(1)原理:利用被提纯物质与杂质在同一溶剂中的溶解度随温度变化不同。
关键:选择适当的溶剂
(3)选择溶剂的条件:
①杂质在溶剂中的溶解度很小或很大
②被提纯的有机物在此溶剂中的溶解度受温度的影响较大。
(2)适用范围:可溶性固体
不同温度下苯甲酸在水中的溶解度
温度 0C
溶解度 g
25
50
95
0.17
0.95
6.8
重结晶
苯甲酸的重结晶实验
加热溶解
趁热过滤
冷却结晶
1、苯甲酸重结晶实验的步骤?
2、为什么要趁热过滤?且加少量蒸馏水?
3、本实验过程用到的仪器?
4、过滤操作要点“一贴、二低、三靠”指的什么?
5、为了得到更多的苯甲酸,是不是温度越低越好?
【交流研讨】
注意课本上的小注解呦!
(4)实验步骤:
加热溶解
趁热过滤
冷却结晶
1、苯甲酸重结晶实验的步骤?
2、为什么要趁热过滤?且加少量蒸馏水?
3、本实验过程用到的仪器?
4、过滤操作要点“一贴、二低、三靠”指的什么?
5、为了得到更多的苯甲酸,是不是温度越低越好?
【交流研讨】
注意课本上的小注解呦!
09山东30(2)由CuSO4溶液获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
冷却结晶
引流
直击高考
3、萃取
(1)原理:利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
(2)仪器:分液漏斗、烧杯、铁架台(含铁圈)
(3)操作过程:
振荡→
静置→
分液
(液液萃取、固液萃取)
(4)萃取剂选择要求:
① 、萃取剂与原溶液溶质溶剂不反应;
② 、与原溶剂不相溶;
③ 、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取碘水中的碘,可用的萃取剂是
①四氯化碳 ②汽油 ③酒精
A 只有① B ①和② C ①和③ D ①②③
○
常见萃取剂:CCl4 、苯、烃
分离和提纯的方法 适用条件
蒸馏
萃取
分液
重结晶
过滤
小结与提升
液液相溶,沸点不同
溶解性不同
液液不溶,密度不同
固固溶解同,而随温度变化不同
固固溶解异,固液分离用过滤
[练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,硝基苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是 A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水
学以致用
练习:
欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出来
科学视野:
层析法也称色谱法,是1906年俄国植物学家Michael Tswett发现并命名的。他将植物叶子的色素通过装填有吸附剂的柱子,各种色素以不同的速率流动后形成不同的色带而被分开,由此得名为“色谱法”(Chromatography) 。
后来无色物质也可利用吸附柱层析分离。
1944年出现纸层析。
以后层析法不断发展,相继出现气相层析、高压液相层析、薄层层析、亲和层析、凝胶层析等。
层析法分离原理是:
使混合物中各组分在两相间进行分配,其中一相是不动的,称为固定相。另一相是携带混合物流过此固定相的流体,称为流动相。当流动相中所含混合物经过固定相时,就会与固定相发生作用。由于各组分在性质和结构上的差异,与固定相发生作用的大小、强弱也有差异,因此在同一推动力作用下,不同组分在固定相中的滞留时间有长有短,从而按先后不同的次序从固定相中流出。
柱色谱:
柱色谱常用的有吸附色谱和分配色谱两类。前者常用氧化铝或硅胶等为吸附剂。后者以硅胶、硅藻土和纤维素为支持剂,以吸收较大量的液体作为固定相。下面以吸附色谱说明。
[练习3]某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质(如下表),确定通过下列步骤回收乙醇和乙酸。
物质丙酮、乙酸乙酯、乙醇、乙酸的沸点(℃)分别是:56.2、77.06、78、117.9
①向废液中加入烧碱溶液,调整溶液的pH=10
②将混和液放入蒸馏器中缓缓加热
③收集温度在70~85℃时的馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧使溶液的pH=10的目的是 ;
(2)在70~85℃时的馏出物的主要成份是 ;
(3)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)______________________________________
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是 。
使乙酸转变成钠盐,使乙酸乙酯在加热时水解成乙酸钠和乙醇
乙醇
2CH3COONa+H2SO4→2CH3COOH+Na2SO4
Na2SO4 H2SO4
分离和提纯的方法 分离的原理 应注意的事项 所需的主要仪器 应用举例
过滤 不溶性固体与水的混合物 一贴、二低、三靠 铁架台,滤纸,烧杯,玻璃棒等 泥沙与水,粗盐的提纯
蒸发 可溶性固体与水的混合物 加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 三脚架,酒精灯,石棉网,烧杯,玻璃棒等 食盐的水溶液中分离NaCl
结晶,重结晶 两种可溶性固体,若它们的溶解度随温度变化明显不同 加热把两种物质配成浓溶液,冷却有晶体析出,再过滤 酒精灯,烧杯,玻璃棒,铁架台,滤纸等 分离KCl和KNO3
萃取 溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 选择的萃取剂应符合下列要求:①和原溶液中的溶剂互不相溶;②和原溶液中的物质互不反应③对溶质的溶解度要远大于原溶剂 试管等 用四氯化碳萃取溴水里的溴,把溴单质与水分离
分液 两种互不相溶的分层液体混合物 打开上端活塞,使下层液体慢慢从下口流出,及时关闭活塞,上层液体由上端倒出 铁架台,分液漏斗,烧杯等 把溴的四氯化碳层与水层分离
蒸馏 两种互相溶解但沸点不同的液体混合物 ①加入沸石或碎瓷片,防止液体暴沸,②湿度计水银球的位置:在烧瓶的支管口附近③冷凝管中水的流向:下口进,上口出,与气体流向相反 铁架台,温度计,烧瓶,酒精灯,冷凝管,弯管,锥形瓶等 石油的蒸馏,自来水中提纯蒸馏水
层析法 若混合物中各成分被某种固体吸附的难易不同 加入合适的溶剂 铁架台,烧杯等 墨水中的染料
第一章 认识有机化合物
第四节 研究有机化合物的一
般步骤和方法
有机物(不纯)
有机物(纯净)
分离 提纯
研究有机化合物的一般步骤
确定实验式
元素定量分析
确定化学式
测定相对
分子质量
确定结构式
化学性质波谱分析
【思考与交流】
1、常用的分离、提纯物质的方法有哪些?
2、下列物质中的杂质(括号中是杂质)可以用什么方法除去。
(1)酒精(水) (2 CO2(HCl) )
(3)KNO3(NaCl ) (4)乙酸乙酯(乙醇)
(5)溴水(水) (6)NaCl(泥沙)
3、归纳分离、提纯物质的总的原则是什么
物理方法:利用有机物与杂质物理性质的差异而将它们分开
有机物分离的常用物理方法
蒸馏
重结晶
萃取
分液
化学方法:一般是加入或通过某种试剂进行化学反应。
分离除杂的基本原则:
不增、不减、易分离、易复原
已知工业乙醇中含有甲醇和水,用什么方法分离提纯乙醇?(乙醇沸点78.15℃,甲醇沸点64.7 ℃,水的沸点100 ℃,三者混溶)
【思考与交流】
一、分离和提纯
1、蒸馏
(3)蒸馏条件:
①有机物热稳定性较强
②与杂质的沸点相差较大时(一般约大于30℃ )
(1)原理: 利用混合物中各种成分的沸点不同,除去难挥发或不挥发的杂质
(2)适用范围:分离互溶且沸点不同的液体混合物
(4)仪器和装置:
蒸馏烧瓶
冷凝管
温度计
尾接管
冷水
使用前要检查装置的气密性!
锥形瓶
酒精灯
石棉网
铁架台
阅读课本实验过程,研讨以下问题:
1、请用简单的词语概括乙醇蒸馏试验的操作步骤。
2、该实验中温度计水银球位置?为什么?
3、为什么要加碎瓷片?冷凝水管的流向?
4、得到的三种馏分,乙醇主要在哪个温度范围内?收集到的乙醇馏分是纯净物吗?
【交流研讨】
注意课本上的小注解呦!
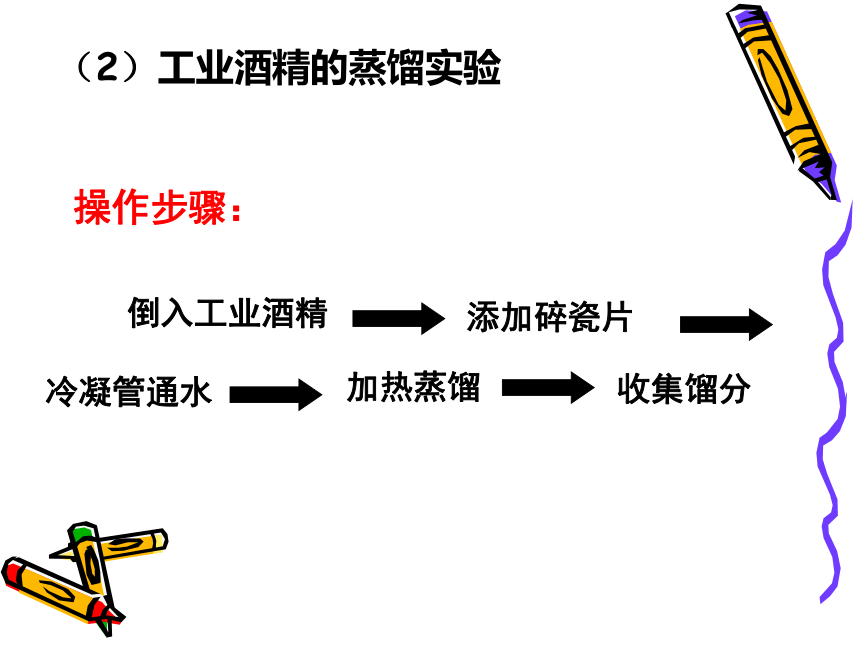
(2)工业酒精的蒸馏实验
操作步骤:
倒入工业酒精
添加碎瓷片
冷凝管通水
加热蒸馏
收集馏分
阅读课本实验过程,研讨以下问题:
1、请用简单的词语概括乙醇蒸馏试验的操作步骤。
2、该实验中温度计水银球位置?为什么?
3、为什么要加碎瓷片?冷凝水管的流向?
4、得到的三种馏分,乙醇主要在哪个温度范围内?收集到的乙醇馏分是纯净物吗?
【交流研讨】
注意课本上的小注解呦!
注意事项:
①在蒸馏烧瓶中放少量碎瓷片或沸石,防止液体暴沸。
②温度计水银球支管口处。
④蒸馏烧瓶中所盛放液体不能超过其容积的2/3,不少于1/3.
③冷凝管中冷却水从下口进,从上口出。(与蒸汽流向逆流,热交换充分,有利于气体液化)
⑤蒸馏烧瓶不能直接加热,应垫上石棉网。
含杂工业乙醇
95.6工业乙醇
无水乙醇(99.5%以上)
蒸馏
加CaO
无水酒精的制取
蒸馏
蒸馏常见应用:
酒精提纯
石油分馏
海水的淡化
分馏:多次蒸馏,进行多种混合液体的分离。
已知KNO3在水中的溶解度很容易随温度变化而变化,而NaCl的溶解度却变化不大,据此可用何方法分离出两者混合物中的KNO3并加以提纯?
【思考与交流】
2、重结晶:
(1)原理:利用被提纯物质与杂质在同一溶剂中的溶解度随温度变化不同。
关键:选择适当的溶剂
(3)选择溶剂的条件:
①杂质在溶剂中的溶解度很小或很大
②被提纯的有机物在此溶剂中的溶解度受温度的影响较大。
(2)适用范围:可溶性固体
不同温度下苯甲酸在水中的溶解度
温度 0C
溶解度 g
25
50
95
0.17
0.95
6.8
重结晶
苯甲酸的重结晶实验
加热溶解
趁热过滤
冷却结晶
1、苯甲酸重结晶实验的步骤?
2、为什么要趁热过滤?且加少量蒸馏水?
3、本实验过程用到的仪器?
4、过滤操作要点“一贴、二低、三靠”指的什么?
5、为了得到更多的苯甲酸,是不是温度越低越好?
【交流研讨】
注意课本上的小注解呦!
(4)实验步骤:
加热溶解
趁热过滤
冷却结晶
1、苯甲酸重结晶实验的步骤?
2、为什么要趁热过滤?且加少量蒸馏水?
3、本实验过程用到的仪器?
4、过滤操作要点“一贴、二低、三靠”指的什么?
5、为了得到更多的苯甲酸,是不是温度越低越好?
【交流研讨】
注意课本上的小注解呦!
09山东30(2)由CuSO4溶液获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
冷却结晶
引流
直击高考
3、萃取
(1)原理:利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
(2)仪器:分液漏斗、烧杯、铁架台(含铁圈)
(3)操作过程:
振荡→
静置→
分液
(液液萃取、固液萃取)
(4)萃取剂选择要求:
① 、萃取剂与原溶液溶质溶剂不反应;
② 、与原溶剂不相溶;
③ 、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
萃取碘水中的碘,可用的萃取剂是
①四氯化碳 ②汽油 ③酒精
A 只有① B ①和② C ①和③ D ①②③
○
常见萃取剂:CCl4 、苯、烃
分离和提纯的方法 适用条件
蒸馏
萃取
分液
重结晶
过滤
小结与提升
液液相溶,沸点不同
溶解性不同
液液不溶,密度不同
固固溶解同,而随温度变化不同
固固溶解异,固液分离用过滤
[练习1]下列每组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒精和水,植物油和水
B 四氯化碳和水,溴苯和水,硝基苯和水
C 甘油和水,乙酸和水,乙酸和乙醇
D 汽油和水,苯和水,己烷和水
[练习2]可以用分液漏斗分离的一组液体混和物是 A 溴和四氯化碳 B 苯和溴苯
C 汽油和苯 D 硝基苯和水
学以致用
练习:
欲用96%的工业酒精制取无水乙醇时,可选用的方法是
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出来
科学视野:
层析法也称色谱法,是1906年俄国植物学家Michael Tswett发现并命名的。他将植物叶子的色素通过装填有吸附剂的柱子,各种色素以不同的速率流动后形成不同的色带而被分开,由此得名为“色谱法”(Chromatography) 。
后来无色物质也可利用吸附柱层析分离。
1944年出现纸层析。
以后层析法不断发展,相继出现气相层析、高压液相层析、薄层层析、亲和层析、凝胶层析等。
层析法分离原理是:
使混合物中各组分在两相间进行分配,其中一相是不动的,称为固定相。另一相是携带混合物流过此固定相的流体,称为流动相。当流动相中所含混合物经过固定相时,就会与固定相发生作用。由于各组分在性质和结构上的差异,与固定相发生作用的大小、强弱也有差异,因此在同一推动力作用下,不同组分在固定相中的滞留时间有长有短,从而按先后不同的次序从固定相中流出。
柱色谱:
柱色谱常用的有吸附色谱和分配色谱两类。前者常用氧化铝或硅胶等为吸附剂。后者以硅胶、硅藻土和纤维素为支持剂,以吸收较大量的液体作为固定相。下面以吸附色谱说明。
[练习3]某工厂废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。根据各物质的性质(如下表),确定通过下列步骤回收乙醇和乙酸。
物质丙酮、乙酸乙酯、乙醇、乙酸的沸点(℃)分别是:56.2、77.06、78、117.9
①向废液中加入烧碱溶液,调整溶液的pH=10
②将混和液放入蒸馏器中缓缓加热
③收集温度在70~85℃时的馏出物
④排出蒸馏器中的残液。冷却后向其中加浓硫酸(过量),然后再放入耐酸蒸馏器进行蒸馏,回收馏出物
请回答下列问题:
(1)加入烧使溶液的pH=10的目的是 ;
(2)在70~85℃时的馏出物的主要成份是 ;
(3)在步骤④中,加入过量浓硫酸的目的是(用化学方程式表示)______________________________________
(4)当最后蒸馏的温度控制在85~125℃一段时间后,残留液中溶质的主要成份是 。
使乙酸转变成钠盐,使乙酸乙酯在加热时水解成乙酸钠和乙醇
乙醇
2CH3COONa+H2SO4→2CH3COOH+Na2SO4
Na2SO4 H2SO4
分离和提纯的方法 分离的原理 应注意的事项 所需的主要仪器 应用举例
过滤 不溶性固体与水的混合物 一贴、二低、三靠 铁架台,滤纸,烧杯,玻璃棒等 泥沙与水,粗盐的提纯
蒸发 可溶性固体与水的混合物 加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 三脚架,酒精灯,石棉网,烧杯,玻璃棒等 食盐的水溶液中分离NaCl
结晶,重结晶 两种可溶性固体,若它们的溶解度随温度变化明显不同 加热把两种物质配成浓溶液,冷却有晶体析出,再过滤 酒精灯,烧杯,玻璃棒,铁架台,滤纸等 分离KCl和KNO3
萃取 溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 选择的萃取剂应符合下列要求:①和原溶液中的溶剂互不相溶;②和原溶液中的物质互不反应③对溶质的溶解度要远大于原溶剂 试管等 用四氯化碳萃取溴水里的溴,把溴单质与水分离
分液 两种互不相溶的分层液体混合物 打开上端活塞,使下层液体慢慢从下口流出,及时关闭活塞,上层液体由上端倒出 铁架台,分液漏斗,烧杯等 把溴的四氯化碳层与水层分离
蒸馏 两种互相溶解但沸点不同的液体混合物 ①加入沸石或碎瓷片,防止液体暴沸,②湿度计水银球的位置:在烧瓶的支管口附近③冷凝管中水的流向:下口进,上口出,与气体流向相反 铁架台,温度计,烧瓶,酒精灯,冷凝管,弯管,锥形瓶等 石油的蒸馏,自来水中提纯蒸馏水
层析法 若混合物中各成分被某种固体吸附的难易不同 加入合适的溶剂 铁架台,烧杯等 墨水中的染料
