2020-2021学年江苏省泰州市高三(上)期中化学试卷( 含解析)
文档属性
| 名称 | 2020-2021学年江苏省泰州市高三(上)期中化学试卷( 含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 269.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-09 17:07:28 | ||
图片预览



文档简介
2020-2021学年江苏省泰州市高三(上)期中化学试卷
一、选择题(共8小题,每小题2分,满分12分)
1.化学在切断传播途径,防控新冠肺炎疫情的过程中发挥了重要作用。下列说法正确的是( )
A.新冠病毒的外壳蛋白质是小分子
B.医用酒精通过氧化灭活病毒
C.医用口罩可以水洗重复使用
D.抗病毒疫苗冷藏存放避免蛋白质受热变性
2.黑火药爆炸的主要反应为S+2KNO3+3C═K2S+3CO2↑+N2↑。下列表示相关微粒的化学用语正确的是( )
A.S2﹣的结构示意图:
B.中子数为10的氧原子O
C.N2分子的结构式:N﹣N
D.基态C原子2p能级电子轨道表示式:
3.下列有关物质的性质与用途具有对应关系的是( )
A.钠钾合金的密度小,可用作快中子反应堆的热交换剂
B.Al2O3的熔点很高,可用作耐火材料
C.Na2SiO3溶液呈碱性,可用作木材的防火剂
D.FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
4.室温下,下列各组微粒在指定溶液中能大量共存的是( )
A.0.1mol?L﹣1KMnO4溶液:Na+、H+、SO42﹣、Fe2+
B.0.1mol?L﹣1盐酸溶液:Na+、K+、HCO3﹣、SO42﹣
C.0.1mol?L﹣1Na2CO3溶液:Na+、NO2﹣、K+、SO42﹣
D.28%的浓氨水:Cu(OH)2、K+、Cl﹣、NO2﹣
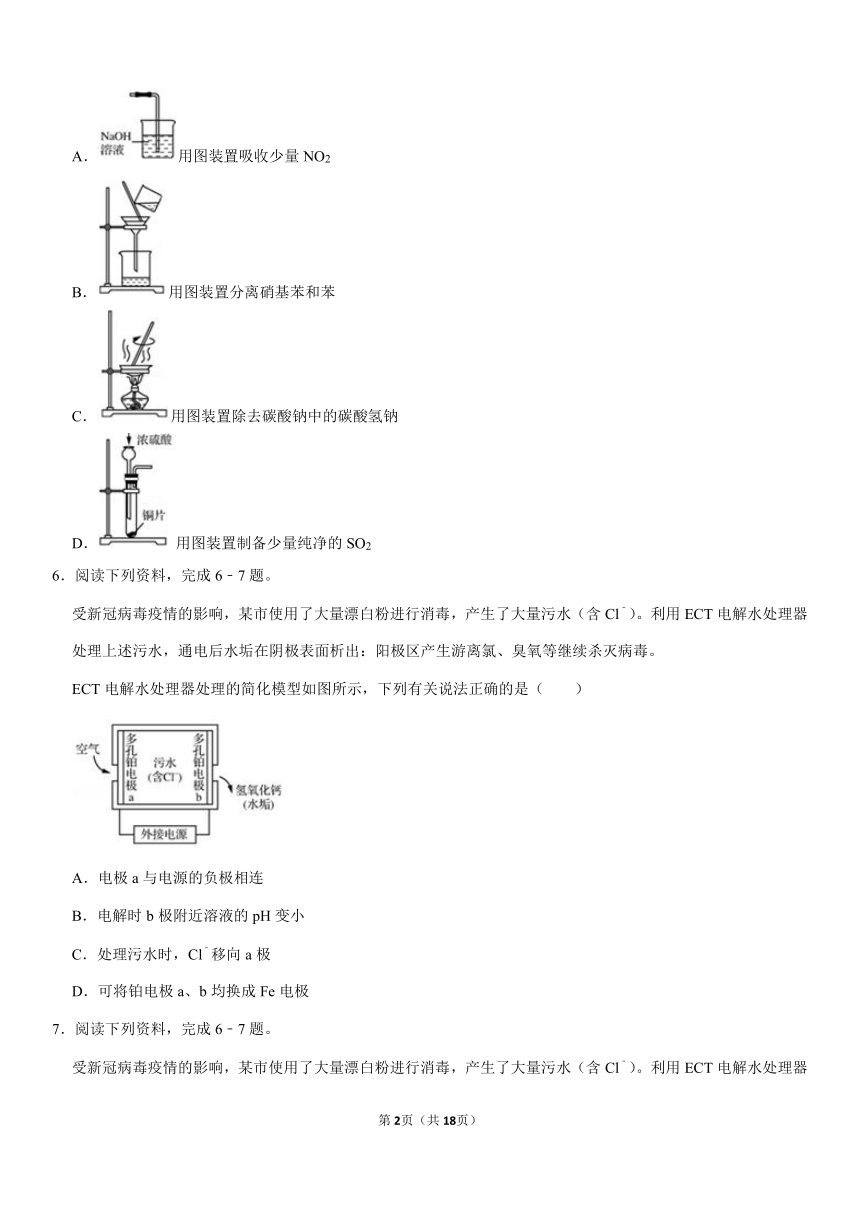
5.下列装置进行相应的实验,能达到实验目的的是( )
A.用图装置吸收少量NO2
B.用图装置分离硝基苯和苯
C.用图装置除去碳酸钠中的碳酸氢钠
D.用图装置制备少量纯净的SO2
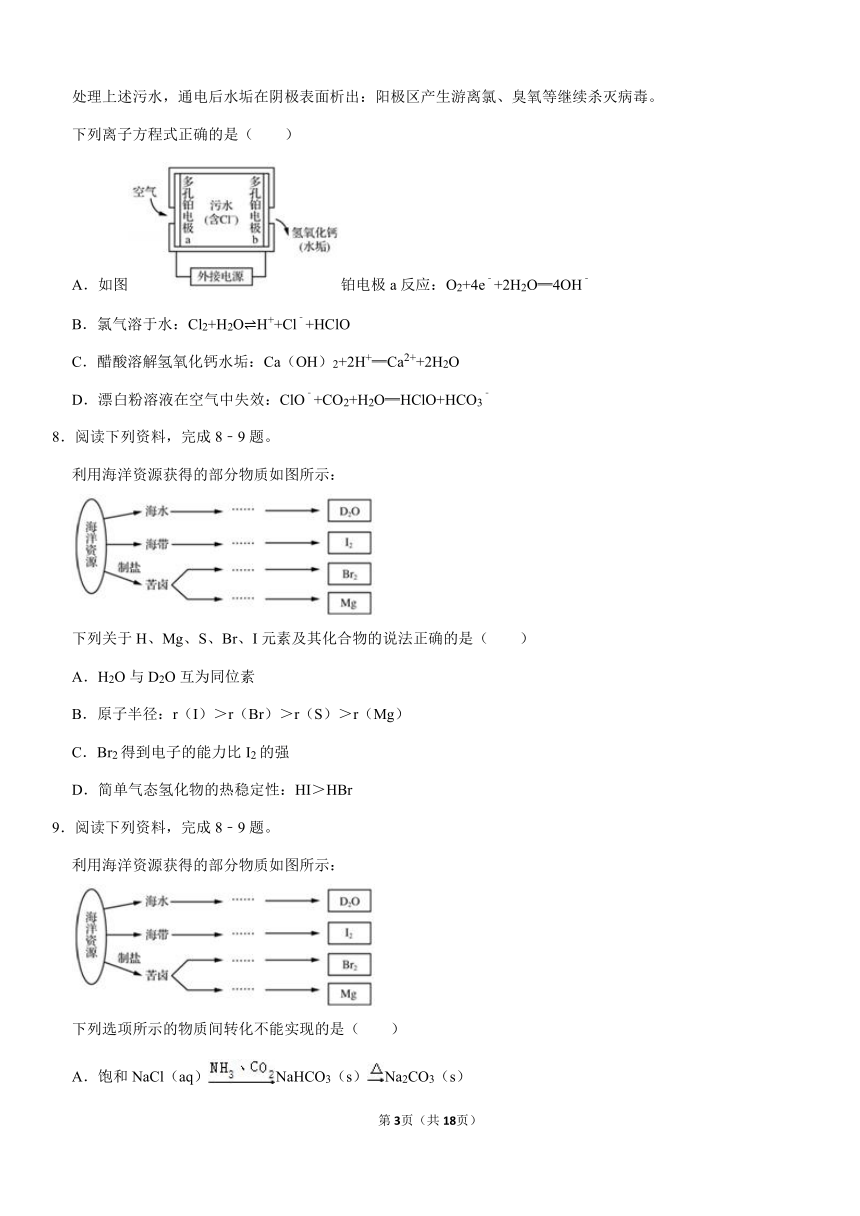
6.阅读下列资料,完成6﹣7题。
受新冠病毒疫情的影响,某市使用了大量漂白粉进行消毒,产生了大量污水(含Cl﹣)。利用ECT电解水处理器处理上述污水,通电后水垢在阴极表面析出:阳极区产生游离氯、臭氧等继续杀灭病毒。
ECT电解水处理器处理的简化模型如图所示,下列有关说法正确的是( )
A.电极a与电源的负极相连
B.电解时b极附近溶液的pH变小
C.处理污水时,Cl﹣移向a极
D.可将铂电极a、b均换成Fe电极
7.阅读下列资料,完成6﹣7题。
受新冠病毒疫情的影响,某市使用了大量漂白粉进行消毒,产生了大量污水(含Cl﹣)。利用ECT电解水处理器处理上述污水,通电后水垢在阴极表面析出:阳极区产生游离氯、臭氧等继续杀灭病毒。
下列离子方程式正确的是( )
A.如图铂电极a反应:O2+4e﹣+2H2O═4OH﹣
B.氯气溶于水:Cl2+H2O?H++Cl﹣+HClO
C.醋酸溶解氢氧化钙水垢:Ca(OH)2+2H+═Ca2++2H2O
D.漂白粉溶液在空气中失效:ClO﹣+CO2+H2O═HClO+HCO3﹣
8.阅读下列资料,完成8﹣9题。
利用海洋资源获得的部分物质如图所示:
下列关于H、Mg、S、Br、I元素及其化合物的说法正确的是( )
A.H2O与D2O互为同位素
B.原子半径:r(I)>r(Br)>r(S)>r(Mg)
C.Br2得到电子的能力比I2的强
D.简单气态氢化物的热稳定性:HI>HBr
9.阅读下列资料,完成8﹣9题。
利用海洋资源获得的部分物质如图所示:
下列选项所示的物质间转化不能实现的是( )
A.饱和NaCl(aq)NaHCO3(s)Na2CO3(s)
B.NaBr(aq)Br2(aq)HBr(aq)
C.MgCl2(aq)Mg(OH)2(s)MgO(s)
D.KI(aq)I2(aq)FeI3(aq)
10.实验发现,向H2O2溶液中加入I﹣可以加快其分解速率。有人提出反应机理可能有2步,第1步反应为H2O2+I﹣═H2O+IO﹣(慢),第2步反应为H2O2+IO﹣═H2O+O2↑+I﹣(快)。下列说法正确的是( )
A.H2O2、O2均为非极性分子
B.IO﹣为反应的中间产物
C.总反应速率由第2步反应决定
D.若生成0.1mol
O2,第2步反应中转移0.4mol电子
不定项选择题:本题包括4小题,每小题4分,共计16分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.下列说法正确的是( )
A.图可表示恒温恒容下,反应I2(g)+H2(g)?2HI(g)达到平衡后,加入HI(g)后反应速率随时间变化的曲线
B.反应CO2(g)+H2(g)?CO(g)+H2O(g)中各物质的相对能量如图乙所示,该反应高温下能自发进行的原因是△S>0
C.图可表示反应N2(g)+3H2(g)?2NH3(g)平衡时NH3体积分数随起始变化的曲线,且H2的平衡转化率:αA(H2)=αB(H2)
D.图可表示室温下0.1mol?L﹣1盐酸滴加到40mL0.1mol?L﹣1NaOH溶液的滴定曲线
12.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
取室温下少量0.5mol?L﹣1CH3COONa溶液,加热至60℃,并测定溶液的pH,pH减小
CH3COONa的水解是放热反应
B
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红
Fe(NO3)2样品溶于酸前已氧化变质
C
室温下,用pH试纸测得:NaF溶液的pH约为8,NaNO2溶液的pH约为9
结合H+的能力比F﹣的强
D
将0.1mol?L﹣1MgSO4溶液滴入0.1mol?L﹣1NaOH溶液至不再有沉淀产生,再滴加0.1mol?L﹣1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀
KspCu(OH)2<KspMg(OH)2
A.A
B.B
C.C
D.D
13.室温下,向20mL0.10mol?L﹣1的CH3COOH溶液中逐滴加入0.10mol?L﹣1的NaOH溶液,溶液中由水电离出H+浓度的负对数﹣lgc水(H+)与所加NaOH溶液体积关系如图所示。若溶液混合引起的体积变化可忽略,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.b点溶液中:c(CH3COO﹣)+c(OH﹣)>c(CH3COOH)+c(H+)
B.c、e两点溶液中:c(Na+)=c(CH3COO﹣)>c(H+)=c(OH﹣)
C.d点溶液中:c(Na+)+c(CH3COO﹣)+c(CH3COOH)=0.10mol?L﹣1
D.f点溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
14.在催化剂存在下,CO2和H2能同时发生两个平行反应,反应的热化学方程式如下:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=﹣53.7kJ/mol
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ/mol
在恒压、反应物起始物质的量比n(CO2):n(H2)=1:2.2条件下,相同反应时间测得的实验数据如下表,下列有关说法正确的是( )
实验编号
T(K)
催化剂
CO2转化率(%)
甲醇产率(%)
1
543
催化剂a
12.3
5.2
2
543
催化剂b
10.9
7.9
3
553
催化剂a
15.3
6.0
4
553
催化剂b
12.0
8.6
A.其他条件不变,升高温度反应①中CO2转化为CH3OH平衡转化率增大
B.相同温度下,选择催化剂b有利于CO2转化为CH3OH
C.反应①正反应的活化能:无催化剂>有催化剂b>有催化剂a
D.其他条件不变,当T=620K时,测得不同压强下CO2的平衡转化率几乎相等,说明620K时以反应②为主
二、解答题(共5小题,满分64分)
15.以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和硫酸盐)为原料,制备聚合硫酸铁铝AlFe(OH)的部分工艺流程如图。
(1)赤泥液中显碱性的主要物质为Na2CO3,用离子方程式表示显碱性的原因
。赤泥液的pH与吸收后尾气中SO2含量的关系如图所示,每隔
分钟需要更换赤泥液。
(2)“聚合”步骤的离子方程式为
,若增加NaHCO3用量,会使聚合硫酸铁铝化学式中n
(填“变大”、“变小”或“不变”)。
(3)若在铝土矿中添加CaCO3脱硫,焙烧后矿粉中含硫量下降不明显,原因是
。
(4)请补充完整测定产品中SO42﹣含量的实验方案:准确称取ag样品,
,将沉淀置于坩埚中,灼烧至恒重,记录数据。(实验中必须使用的试剂:1mol?L﹣1盐酸、AgNO3溶液、BaCl2溶液)
16.氮、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物在生活和生产中有许多重要用途。
(1)有机铁肥中Fe的化合价为+3,Fe3+基态核外电子排布式为
。
(2)(CH3)3N极易溶于H2O,除因为它们都是极性分子外,还因为
。
(3)图1所示的盐可用于处理黑磷纳米材料,从而保护和控制其性质。
①该盐中碳原子的轨道杂化类型为
。
②1mol该盐的阳离子含有σ键的数目为
。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。磷化硼晶体晶胞的示意图见图2,图3是晶胞沿着体对角线方向的投影图。
①图2中,原子1的分数坐标是(,,0),则原子2的分数坐标为
。
②图3中“N”球表示
原子。(填元素符号)
17.(1)MnSO4有多种制备方法。
①方法1:将锌精矿(主要成分为ZnS)和软锰矿(主要成分为MnO2)混合后用硫酸溶液浸出,反应的离子方程式为ZnS+MnO2+4H+═Zn2++Mn2++S+2H2O。溶液中加入Fe3+可以促进反应的发生,反应原理如图所示,其中
(填“A”或“B”)表示Fe3+。
②方法2:在硫酸溶液中用铁屑还原MnO2,铁屑被氧化为Fe3+,该反应的离子方程式为
。为除去MnSO4溶液中的Cd2+,向溶液中通入H2S气体至饱和(H2S饱和溶液的浓度为0.1mol?L﹣1,H2S的电离常数K=1.5×10﹣7、K=6×10﹣15),c(H+)=0.3mol?L﹣1时,溶液中c(Cd2+)=
mol?L﹣1。Ksp(CdS)=8×10﹣27
(2)MnSO4和(NH4)2SO4可制取硫酸铵锰晶体[(NH4)aMnb(SO4)c?xH2O],为测定该晶体的组成,进行如下实验:
①称取一定质量的硫酸铵锰晶体,在空气中加热至脱去全部结晶水,质量减少30.8%;
②将残留固体配成250mL溶液A,取出25.00mL,加入足量NaOH溶液充分加热,生成22.40mL(标准状况)NH3;
③另取25.00mL溶液A,加入足量的BaCl2溶液得到0.233g
BaSO4。通过计算确定该晶体的化学式
。(写出计算过程)
18.合理利用或转化NO2、NO、CO等污染性气体是人们共同关注的课题。
(1)实验证明汽车尾气中的NO与CO反应生成无污染气体而除去。
已知:ⅰ.N2(g)和O2(g)生成NO(g)过程中的能量变化如图。
ⅱ.NO2(g)+CO(g)?CO2(g)+NO(g)△H=﹣234kJ?mol﹣1
ⅲ.1mol
NO(g)被O2(g)氧化时放出的热量为56.15kJ
①反应2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=
kJ?mol﹣1。
②工业上常用醋酸亚铜氨溶液来吸收CO,反应的化学方程式如下:CH3COOCu(NH3)2(aq)+CO(g)?CH3COOCu(NH3)2?CO(aq)△H<0吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有
(选填序号)。
a.适当升高温度
b.适当降低温度
c.适当增大压强
d.适当减小压强
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,一般采用NH3或尿素[CO(NH2)2]作还原剂,基本流程如图1所示。
①SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0,1mol
O2能氧化NH3的物质的量是
。若用CO(NH2)2作还原剂,还原NO2的化学方程式为
。
②其他条件不变,在相同时间内,NO转化为N2的转化率随温度的变化如图2所示。反应温度在50℃150℃范围内,NO转化为N2的转化率迅速上升,原因有
。
(3)用P﹣g﹣C3N4光催化氧化法脱除NO的过程如图3所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似,此时g﹣C3N4端的反应为
。
19.资料显示:IO2﹣在酸性溶液中能氧化I﹣,反应为IO2﹣+5I﹣+6H+═3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
,SO42﹣的还原性
I﹣。(填“>”、“=”或“<”)
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
①甲同学在b电极附近的溶液中检测出了SO42﹣。
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。IO2﹣在a极放电的产物是
。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
。
④下列说法正确的是
。
a.a电极附近蓝色不再褪去时,SO32尚未完全氧化
b.a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被SO32﹣还原
c.电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
2020-2021学年江苏省泰州市高三(上)期中化学试卷
试题解析
一、选择题(共8小题,每小题2分,满分12分)
1.解:A.蛋白质是高分子化合物,所以新冠病毒的外壳蛋白质是高分子,故A错误;
B.酒精没有强氧化性,不能氧化灭活病毒,医用酒精的杀菌原理为使蛋白质变性失活,故B错误;
C.医用口罩均为一次性口罩,水洗会大大降低过滤效果,不能重复使用,故C错误;
D.抗病毒疫苗是蛋白质,蛋白质受热会变性失活,因此应冷藏存放,故D正确;
故选:D。
2.解:A.硫离子的核电荷数为16,最外层达到8电子稳定结构,硫离子的离子结构示意图为:,故A正确;
B.质子数为8,中子数为10的氧原子的质量数为8+10=18,核素符号为:,故B错误;
C.N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出,N2的结构式为N≡N,故C错误;
D.碳核外有2个电子层,最外层电子数为4,位于p区,基态碳原子核外有6个电子,其中价电子为4,分布在2s、sp轨道上,价电子轨道表示式为
,2p能级电子轨道表示式:,故D错误;
故选:A。
3.解:A.钠钾合金具有良好的导热性,可用作快中子反应堆的热交换剂,故A错误;
B.Al2O3的熔点很高,可用作耐火材料,故B正确;
C.Na2SiO3溶液耐高温,不易燃烧,可用作木材的防火剂,故C错误;
D.氯化铁具有氧化性,能够氧化铜,可用作铜制线路板的蚀刻剂,故D错误。
故选:B。
4.解:A.KMnO4、H+、Fe2+之间发生氧化还原反应,不能大量共存,故A错误;
B.H+、HCO3﹣之间发生反应,不能大量共存,故B错误;
C.Na+、NO2﹣、K+、SO42﹣之间不反应,都不与Na+、CO32﹣反应,能够大量共存,故C正确;
D.Cu(OH)2溶于浓氨水,不能大量共存,故D错误;
故选:C。
5.解:A.二氧化氮可与氢氧化钠溶液反应,反应生成硝酸钠、亚硝酸钠,则可用氢氧化钠溶液吸收,故A正确;
B.二者混溶,不能用过滤的方法分离,可用蒸馏的方法分离,故B错误;
C.蒸发皿用于加热液体,蒸发固体,应在坩埚中进行,故C错误;
D.二氧化硫从长颈漏斗逸出,应用分液漏斗,故D错误。
故选:A。
6.解:A.处理污水时,产生的OH﹣与Ca2+形成氢氧化钙(水垢)析出,说明b极电极反应式是:2H2O+2e﹣=H2↑+2OH﹣,为阴极,与电源的负极相连,故A错误;
B.b极电极反应式是:2H2O+2e﹣=H2↑+2OH﹣,所以b极附近溶液的pH增大,故B错误;
C.b极为阴极,电极a为阳极,Cl﹣移向阳极a极,故C正确;
D.若Fe电极做阳极,会参与电极反应而被氧化,故D错误;
故选:C。
7.解:A.铂电极a为阳极,阳极上氯气放电,正确的电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,故A错误;
B.氯气溶于水的离子方程式为:Cl2+H2O?H++Cl﹣+HClO,故B正确;
C.醋酸与氢氧化钙水垢反应的离子方程式为:Ca(OH)2+2CH3COOH=Ca2++H2O+2CH3COO﹣,故C错误;
D.漂白粉失效的化学方程式为:Ca(ClO)2+H2O+CO2=CaCO3+2HClO,其离子方程式为:Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO,故D错误;
故选:B。
8.解:A.同位素是同种元素的不同原子,而H2O与D2O属于化合物,二者不互为同位素,是同一物质,故A错误;
B.同主族自上而下原子半径增大,故原子半径:r(S)<r(Mg),故B错误;
C.非金属性越强,单质的氧化能力越强,非金属性Br>I,故Br2得到电子的能力比I2的强,故C正确;
D.非金属性越强,氢化物越稳定,非金属性Br>I,故氢化物的热稳定性HI<HBr,故D错误。
故选:C。
9.解:A.饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,溶液中碳酸氢根离子浓度增大,由于碳酸氢钠的溶解度相对较小,析出碳酸氢钠,碳酸氢钠加热分解生成碳酸钠,所以饱和NaCl(aq)
NH3、CO2
NaHCO3(s)
△
Na2CO3(s)可以实现,故A正确;
B.氯气氧化性强于溴,故氯气能和NaBr溶液反应生成溴单质,故NaBr(aq)
Cl2(g)
Br2(aq)可以发生,而溴能被二氧化硫还原为溴离子,即转化Br2(aq)
SO2(g)
HBr(aq)可以发生,故B正确;
C.氯化镁与氢氧化钙反应生成氢氧化镁沉淀,氢氧化镁是弱碱,不稳定,受热分解生成MgO,物质间转化均能实现,故C正确;
D.氯气的氧化性强于碘,故转化KI(aq)
Cl2(g)
I2(aq)可以发生,但由于I2的氧化性较弱,只能将铁单质氧化为+2价,故转化I2(aq)
Fe(s)
△
FeI3(aq)不能发生,故D错误。
故选:D。
10.解:A.正负电荷中心重合的分子为非极性分子,双氧水分子为书页形结构,正负电荷中心不重合,为极性分子,故A错误;
B.第一步反应中有IO﹣生成、第二步反应中有IO﹣参加,所以该离子为反应的中间产物,故B正确;
C.总反应速率由慢反应速率决定,则总反应速率由第一步决定,故C错误;
D.总反应方程式为2H2O22H2O+O2↑,生成1mol氧气转移电子物质的量=1mol×2×[0﹣(﹣1)]=2mol,则生成0.1mol氧气,转移0.2mol电子,故D错误;
故选:B。
不定项选择题:本题包括4小题,每小题4分,共计16分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.解:A.反应I2(g)+H2(g)?2HI(g)达到平衡后,加入HI(g),反应物浓度不变,则正反应速率不可能减小,故A错误;
B.反应CO2(g)+H2(g)?CO(g)+H2O(g)的△H=(﹣110﹣242)kJ/mol﹣(﹣393)kJ/mol=+51kJ/mol,如能自发进行,应满足△H﹣T?△S<0,则△S>0,故B正确;
C.氮气的物质的量越多,氢气的转化率越大,则H2的平衡转化率:αA(H2)<αB(H2),故C错误;
D.室温下,0.1mol?L﹣1NaOH溶液的pH=13,应大于12,图象错误,故D错误。
故选:B。
12.解:A.醋酸钠水解为吸热反应,加热促进醋酸钠的水解,溶液pH增大,故A错误;
B.酸性条件下,硝酸根离子可氧化亚铁离子,不能确定是否变质,故B错误;
C.两种溶液的浓度大小未知,不能由pH大小确定酸性强弱,故C错误;
D.白色沉淀逐渐变为蓝色沉淀,说明生成氢氧化铜,存在沉淀的转化,可说明KspCu(OH)2<KspMg(OH)2,故D正确;
故选:D。
13.解:A.b点加入10mLNaOH,溶液为CH3COOH、CH3COONa,二者物质的量相等,醋酸进一步电离,则c(Na+)>c(CH3COOH),溶液中存在c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+),则c(CH3COO﹣)+c(OH﹣)>c(CH3COOH)+c(H+),故A正确;
B.c点存在CH3COONa和CH3COOH,e点存在CH3COONa和NaOH,可知e点c(OH﹣)>c(H+),故B错误;
C.d点恰好完全中和,n(CH3COOH)=n(NaOH)=0.10mol/L×0.02L=0.002mol,溶液体积为0.04L,则c(Na+)=c(CH3COO﹣)+c(CH3COOH)==0.05mol?L﹣1,则c(Na+)+c(CH3COO﹣)+c(CH3COOH)=0.10mol?L﹣1,故C正确;
D.f点加入NaOH
40mL,反应产生等量的NaOH和CH3COONa,溶液中c(OH﹣)>c(CH3COO﹣),则应为c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+),故D错误。
故选:AC。
14.解:A.反应①为放热反应,升高温度,平衡逆向移动。则CH3OH平衡转化率减小,故A错误;
B.相同温度下,选择催化剂b,甲醇的产率较大,则选择催化剂b有利于CO2转化为CH3OH,故B正确;
C.相同时间内,加入催化剂b,甲醇产率较大,说明反应①反应速率较大,则活化能较低,可知无催化剂>有催化剂a>有催化剂b,故C错误;
D.其他条件不变,当T=620K时,测得不同压强下CO2的平衡转化率几乎相等,说明增大压强,平衡基本不移动,则说明620K时以反应②为主,故D正确。
故选:BD。
二、解答题(共5小题,满分64分)
15.解:(1)Na2CO3溶液显碱性是因为CO32﹣水解,即CO32﹣+H2O?HCO3﹣+OH﹣;根据图2pH<5
时,尾气中SO2明显增多,说明此时赤泥液吸收效率严重下降,需要更换,通过图1可判断pH=5时对应时间为18min,故每隔18min需要更换赤泥液,
故答案为:CO+H2O?HCO+OH﹣;18;
(2)聚合时,参与反应的离子有Al3+、Fe3+、HCO3﹣、SO42﹣,即Al3++Fe3++SO42﹣+HCO3﹣→AlFe(OH)6﹣2n(SO4)n,此时利用了Al3+、Fe3+与HCO3﹣彻底双水解性质,推测还有CO2生成,再结合元素守恒和电荷守恒配平即可,最终离子方程式为:Al3++Fe3++nSO42﹣+(6﹣2n)HCO=AlFe(OH)6﹣2n(SO4)n↓+(6﹣2n)CO2↑;
若增加NaHCO3用量,则会导致Al3+、Fe3+与之发生彻底双水解更多的转化为Al(OH)3和Fe(OH)3沉淀,与AlFe(OH)6﹣2n(SO4)n相比,OH﹣相对量增多,即6﹣2n值增大,故n值变小,
故答案为:Al3++Fe3++nSO42﹣+(6﹣2n)HCO3﹣=AlFe(OH)6﹣2n(SO4)n↓+(6﹣2n)CO2↑;变小;
(3)CaCO3脱硫主要发生反应:2CaCO3+2SO2+O22CaSO4+2CO2,生成CaSO4留在了矿粉中,故含硫量下降不明显,
故答案为:焙烧生成的硫氧化物被CaCO3吸收生成CaSO4留在了矿粉中或2CaCO3+2SO2+O22CaSO4+2CO2;
(4)测定样品中SO42﹣含量,可将其转化为BaSO4沉淀,通过SO42﹣进行计算,具体操作如下:加入足量1mol?L﹣1HCl溶液(注意此时不能用硫酸溶解)并充分搅拌,滴加BaCl2溶液至不再产生沉淀,过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加AgNO3溶液,不出现白色沉淀(目的:检验洗涤是否充分),
故答案为:加入足量1mol?L﹣1HCl溶液并充分搅拌,滴加BaCl2溶液至不再产生沉淀,过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加AgNO3溶液,不出现白色沉淀。
16.解:(1)Fe是26号元素,原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+基态核外电子排布式为1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5;
(2)(CH3)3N极易溶于H2O,除因为它们都是极性分子外,还因为(CH3)3N能与水形成分子间氢键,
故答案为:(CH3)3N能与水形成分子间氢键;
(3)①甲基中碳原子形成4个σ键,苯环上碳原子形成3个σ键,杂化轨道数目分别为3、2,分别采取sp3、sp2杂化,
故答案为:sp3、sp2;
②各原子之间形成1个σ键,阳离子含有17个σ键,1mol该盐的阳离子含有σ键的数目为
17×6.02×1023
,
故答案为:17×6.02×1023
;
(4)①原子1的分数坐标是(,,0),原子2处于晶胞左侧面面心,则原子2坐标参数x=z=,y=0,则原子2的分数坐标为(,0,),
故答案为:(,0,);
②正六边形顶点M是晶胞中体对角线顶点以外的6个顶点原子投影形成的,则M代表P原子,N代表B原子,
故答案为:B。
17.解:(1)①从图示可知,MnO2和A反应生成Mn2+和B,锰元素的化合价从+4价→+2价,化合价降低,A元素的化合价升高,所以A为Fe2+,B为Fe3+,
故答案为:B;
②在硫酸溶液中用铁屑还原MnO2,铁屑被氧化为Fe3+,MnO2被还原为Mn2+.该反应的离子方程式为:2Fe+3MnO2+12H+═3Mn2++2Fe3++6H2O,H2S饱和溶液的浓度为0.1mol?L﹣1,H2S的电离常数K=1.5×10﹣7、K=6×10﹣15),氢硫酸是二元弱酸分步电离,其电离方程式为H2S?H++HS﹣,HS﹣?H++S2﹣,c2(H+)×c(S2﹣)=Ka1×Ka2×c(H2S),H2S饱和溶液的浓度为0.1mol?L﹣1,H2S的电离常数K=1.5×10﹣7、K=6×10﹣15),c(H+)=0.3mol?L﹣1时,c(S2﹣)=1×10﹣21mol?L﹣1,Ksp(CdS)=8×10﹣27,溶液中c(Cd2+)==8×10﹣6,
故答案为:2Fe+3MnO2+12H+═3Mn2++2Fe3++6H2O;8×10﹣6;
(2)25.00mL溶液中:(若按照250.00mL溶液中计算亦同)
n(NH4+)=n(NH3)==1.0×10﹣3mol,
n(SO42﹣)=n(BaSO4)==1.0×10﹣3mol,
根据电荷守恒可得:
n(NH4+)+2n(Mn2+)=2n(SO42﹣)
n(Mn2+)=5.00×10﹣4mol
假设化学式为:(NH4)2Mn(SO4)2?xH2O
=30.8%或=
x=7
硫酸铵锰晶体化学式为:(NH4)2Mn(SO4)2?7H2O,
故答案为:(NH4)2Mn(SO4)2?7H2O。
18.解:(1)①过程i对应热化学方程式:①N2(g)+O2(g)=2NO(g)△H=946kJ/mol+498
kJ/mol﹣2×632
kJ/mol=+180
kJ/mol;过程iii对应热化学方程式:③2NO(g)+O2(g)=2NO2(g)△H=﹣56.15×2
kJ/mol=﹣112.3
kJ/mol;设过程ii的热化学方程式为②,根据②﹣①+③×2可得目标方程式,由此计算出△H=﹣760.3kJ/mol,
故答案为:﹣760.3;
②适当升温或减小压强都能促进平衡逆向移动,从而使CH3COOCu(NH3)2再生,
故答案为:ad;
(2)①根据电子守恒计算1mol
O2能氧化NH3的物质的量;用尿素[CO(NH2)2]作还原剂还原NO2的反应生成二氧化碳、氮气和水;
②由于是反应相同时间,故未达平衡前反应速率越快,相同时间内NO转化率越高,故50~150℃NO转化率迅速上升原因可能是温度升高导致反应速率加快,另外此反应用到了催化剂,所以还可能是因为温度升高催化剂活性增强导致反应速率加快,
故答案为:温度升高反应速率增大,温度升高催化剂的活性增强;
(3)根据图示g﹣C3N4端转为为O2得电子生成H2O2,即O2+2e﹣→H2O2,酸性溶液添加H+配平电荷守恒,故最终方程式为:O2+2H++2e﹣=H2O2,
故答案为:O2+2H++2e﹣=H2O2。
19.解:(1)I2具有氧化性,能氧化Na2SO3,反应生成Na2SO4和NaI,酸性条件下发生的反应的离子方程式为:I2+SO32﹣+H2O═SO42﹣+2H++2I﹣;氧化还原反应中还原剂的还原性大于还原产物的还原性,则还原性:SO42﹣<I﹣,
故答案为:I2+SO32﹣+H2O═SO42﹣+2H++2I﹣;<;
(2)甲同学向反应后的蓝色溶液中加入少量Na2SO3,蓝色迅速消失,说明Na2SO3与I2反应,证明甲同学的猜想正确,
故答案为:Na2SO3溶液;
(3)②刚开始放电时,a电极附近溶液未变蓝,说明没有碘单质生成;取出a电极附近溶液于试管中,溶液变蓝,生成的I﹣与IO3﹣生成了碘单质,所以IO3﹣
在a极放电的产物是I﹣,生成的I﹣与IO3﹣生成了碘单质,
故答案为:I﹣;
③放电一段时间后,指针指针回到“0”处说明无电流生成,原因是:a极区发生反应IO3﹣+5I﹣+6H+=3I2+3H2O,IO3﹣
不再与SO32﹣发生反应,外电路无电流通过,
故答案为:a极区发生反应IO3﹣+5I﹣+6H+=3I2+3H2O,IO3﹣不再与SO32﹣发生反应,外电路无电流通过;
④a.过量的KIO3酸性溶液与Na2SO3溶液反应,Na2SO3反应完全,得到I﹣,I﹣与多余的KIO3反应得到碘单质,溶液变蓝,所以a电极附近蓝色不再褪去时,SO32已经完全被氧化,故a错误;
b.a电极附近短暂出现蓝色,生成的I﹣与IO3﹣生成了碘单质,溶液显蓝色,当I2被SO32﹣还原时,溶液又褪色,故b正确;
c.向b电极附近加入过量Na2SO3溶液,与a电极附近的I2发生原电池反应,构成原电池,所以重新产生电流,a电极附近I2被消耗,则溶液蓝色褪去,故c正确,
故答案为:bc。
第1页(共1页)
一、选择题(共8小题,每小题2分,满分12分)
1.化学在切断传播途径,防控新冠肺炎疫情的过程中发挥了重要作用。下列说法正确的是( )
A.新冠病毒的外壳蛋白质是小分子
B.医用酒精通过氧化灭活病毒
C.医用口罩可以水洗重复使用
D.抗病毒疫苗冷藏存放避免蛋白质受热变性
2.黑火药爆炸的主要反应为S+2KNO3+3C═K2S+3CO2↑+N2↑。下列表示相关微粒的化学用语正确的是( )
A.S2﹣的结构示意图:
B.中子数为10的氧原子O
C.N2分子的结构式:N﹣N
D.基态C原子2p能级电子轨道表示式:
3.下列有关物质的性质与用途具有对应关系的是( )
A.钠钾合金的密度小,可用作快中子反应堆的热交换剂
B.Al2O3的熔点很高,可用作耐火材料
C.Na2SiO3溶液呈碱性,可用作木材的防火剂
D.FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
4.室温下,下列各组微粒在指定溶液中能大量共存的是( )
A.0.1mol?L﹣1KMnO4溶液:Na+、H+、SO42﹣、Fe2+
B.0.1mol?L﹣1盐酸溶液:Na+、K+、HCO3﹣、SO42﹣
C.0.1mol?L﹣1Na2CO3溶液:Na+、NO2﹣、K+、SO42﹣
D.28%的浓氨水:Cu(OH)2、K+、Cl﹣、NO2﹣
5.下列装置进行相应的实验,能达到实验目的的是( )
A.用图装置吸收少量NO2
B.用图装置分离硝基苯和苯
C.用图装置除去碳酸钠中的碳酸氢钠
D.用图装置制备少量纯净的SO2
6.阅读下列资料,完成6﹣7题。
受新冠病毒疫情的影响,某市使用了大量漂白粉进行消毒,产生了大量污水(含Cl﹣)。利用ECT电解水处理器处理上述污水,通电后水垢在阴极表面析出:阳极区产生游离氯、臭氧等继续杀灭病毒。
ECT电解水处理器处理的简化模型如图所示,下列有关说法正确的是( )
A.电极a与电源的负极相连
B.电解时b极附近溶液的pH变小
C.处理污水时,Cl﹣移向a极
D.可将铂电极a、b均换成Fe电极
7.阅读下列资料,完成6﹣7题。
受新冠病毒疫情的影响,某市使用了大量漂白粉进行消毒,产生了大量污水(含Cl﹣)。利用ECT电解水处理器处理上述污水,通电后水垢在阴极表面析出:阳极区产生游离氯、臭氧等继续杀灭病毒。
下列离子方程式正确的是( )
A.如图铂电极a反应:O2+4e﹣+2H2O═4OH﹣
B.氯气溶于水:Cl2+H2O?H++Cl﹣+HClO
C.醋酸溶解氢氧化钙水垢:Ca(OH)2+2H+═Ca2++2H2O
D.漂白粉溶液在空气中失效:ClO﹣+CO2+H2O═HClO+HCO3﹣
8.阅读下列资料,完成8﹣9题。
利用海洋资源获得的部分物质如图所示:
下列关于H、Mg、S、Br、I元素及其化合物的说法正确的是( )
A.H2O与D2O互为同位素
B.原子半径:r(I)>r(Br)>r(S)>r(Mg)
C.Br2得到电子的能力比I2的强
D.简单气态氢化物的热稳定性:HI>HBr
9.阅读下列资料,完成8﹣9题。
利用海洋资源获得的部分物质如图所示:
下列选项所示的物质间转化不能实现的是( )
A.饱和NaCl(aq)NaHCO3(s)Na2CO3(s)
B.NaBr(aq)Br2(aq)HBr(aq)
C.MgCl2(aq)Mg(OH)2(s)MgO(s)
D.KI(aq)I2(aq)FeI3(aq)
10.实验发现,向H2O2溶液中加入I﹣可以加快其分解速率。有人提出反应机理可能有2步,第1步反应为H2O2+I﹣═H2O+IO﹣(慢),第2步反应为H2O2+IO﹣═H2O+O2↑+I﹣(快)。下列说法正确的是( )
A.H2O2、O2均为非极性分子
B.IO﹣为反应的中间产物
C.总反应速率由第2步反应决定
D.若生成0.1mol
O2,第2步反应中转移0.4mol电子
不定项选择题:本题包括4小题,每小题4分,共计16分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.下列说法正确的是( )
A.图可表示恒温恒容下,反应I2(g)+H2(g)?2HI(g)达到平衡后,加入HI(g)后反应速率随时间变化的曲线
B.反应CO2(g)+H2(g)?CO(g)+H2O(g)中各物质的相对能量如图乙所示,该反应高温下能自发进行的原因是△S>0
C.图可表示反应N2(g)+3H2(g)?2NH3(g)平衡时NH3体积分数随起始变化的曲线,且H2的平衡转化率:αA(H2)=αB(H2)
D.图可表示室温下0.1mol?L﹣1盐酸滴加到40mL0.1mol?L﹣1NaOH溶液的滴定曲线
12.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
取室温下少量0.5mol?L﹣1CH3COONa溶液,加热至60℃,并测定溶液的pH,pH减小
CH3COONa的水解是放热反应
B
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红
Fe(NO3)2样品溶于酸前已氧化变质
C
室温下,用pH试纸测得:NaF溶液的pH约为8,NaNO2溶液的pH约为9
结合H+的能力比F﹣的强
D
将0.1mol?L﹣1MgSO4溶液滴入0.1mol?L﹣1NaOH溶液至不再有沉淀产生,再滴加0.1mol?L﹣1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀
KspCu(OH)2<KspMg(OH)2
A.A
B.B
C.C
D.D
13.室温下,向20mL0.10mol?L﹣1的CH3COOH溶液中逐滴加入0.10mol?L﹣1的NaOH溶液,溶液中由水电离出H+浓度的负对数﹣lgc水(H+)与所加NaOH溶液体积关系如图所示。若溶液混合引起的体积变化可忽略,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.b点溶液中:c(CH3COO﹣)+c(OH﹣)>c(CH3COOH)+c(H+)
B.c、e两点溶液中:c(Na+)=c(CH3COO﹣)>c(H+)=c(OH﹣)
C.d点溶液中:c(Na+)+c(CH3COO﹣)+c(CH3COOH)=0.10mol?L﹣1
D.f点溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
14.在催化剂存在下,CO2和H2能同时发生两个平行反应,反应的热化学方程式如下:
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=﹣53.7kJ/mol
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ/mol
在恒压、反应物起始物质的量比n(CO2):n(H2)=1:2.2条件下,相同反应时间测得的实验数据如下表,下列有关说法正确的是( )
实验编号
T(K)
催化剂
CO2转化率(%)
甲醇产率(%)
1
543
催化剂a
12.3
5.2
2
543
催化剂b
10.9
7.9
3
553
催化剂a
15.3
6.0
4
553
催化剂b
12.0
8.6
A.其他条件不变,升高温度反应①中CO2转化为CH3OH平衡转化率增大
B.相同温度下,选择催化剂b有利于CO2转化为CH3OH
C.反应①正反应的活化能:无催化剂>有催化剂b>有催化剂a
D.其他条件不变,当T=620K时,测得不同压强下CO2的平衡转化率几乎相等,说明620K时以反应②为主
二、解答题(共5小题,满分64分)
15.以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和硫酸盐)为原料,制备聚合硫酸铁铝AlFe(OH)的部分工艺流程如图。
(1)赤泥液中显碱性的主要物质为Na2CO3,用离子方程式表示显碱性的原因
。赤泥液的pH与吸收后尾气中SO2含量的关系如图所示,每隔
分钟需要更换赤泥液。
(2)“聚合”步骤的离子方程式为
,若增加NaHCO3用量,会使聚合硫酸铁铝化学式中n
(填“变大”、“变小”或“不变”)。
(3)若在铝土矿中添加CaCO3脱硫,焙烧后矿粉中含硫量下降不明显,原因是
。
(4)请补充完整测定产品中SO42﹣含量的实验方案:准确称取ag样品,
,将沉淀置于坩埚中,灼烧至恒重,记录数据。(实验中必须使用的试剂:1mol?L﹣1盐酸、AgNO3溶液、BaCl2溶液)
16.氮、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物在生活和生产中有许多重要用途。
(1)有机铁肥中Fe的化合价为+3,Fe3+基态核外电子排布式为
。
(2)(CH3)3N极易溶于H2O,除因为它们都是极性分子外,还因为
。
(3)图1所示的盐可用于处理黑磷纳米材料,从而保护和控制其性质。
①该盐中碳原子的轨道杂化类型为
。
②1mol该盐的阳离子含有σ键的数目为
。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。磷化硼晶体晶胞的示意图见图2,图3是晶胞沿着体对角线方向的投影图。
①图2中,原子1的分数坐标是(,,0),则原子2的分数坐标为
。
②图3中“N”球表示
原子。(填元素符号)
17.(1)MnSO4有多种制备方法。
①方法1:将锌精矿(主要成分为ZnS)和软锰矿(主要成分为MnO2)混合后用硫酸溶液浸出,反应的离子方程式为ZnS+MnO2+4H+═Zn2++Mn2++S+2H2O。溶液中加入Fe3+可以促进反应的发生,反应原理如图所示,其中
(填“A”或“B”)表示Fe3+。
②方法2:在硫酸溶液中用铁屑还原MnO2,铁屑被氧化为Fe3+,该反应的离子方程式为
。为除去MnSO4溶液中的Cd2+,向溶液中通入H2S气体至饱和(H2S饱和溶液的浓度为0.1mol?L﹣1,H2S的电离常数K=1.5×10﹣7、K=6×10﹣15),c(H+)=0.3mol?L﹣1时,溶液中c(Cd2+)=
mol?L﹣1。Ksp(CdS)=8×10﹣27
(2)MnSO4和(NH4)2SO4可制取硫酸铵锰晶体[(NH4)aMnb(SO4)c?xH2O],为测定该晶体的组成,进行如下实验:
①称取一定质量的硫酸铵锰晶体,在空气中加热至脱去全部结晶水,质量减少30.8%;
②将残留固体配成250mL溶液A,取出25.00mL,加入足量NaOH溶液充分加热,生成22.40mL(标准状况)NH3;
③另取25.00mL溶液A,加入足量的BaCl2溶液得到0.233g
BaSO4。通过计算确定该晶体的化学式
。(写出计算过程)
18.合理利用或转化NO2、NO、CO等污染性气体是人们共同关注的课题。
(1)实验证明汽车尾气中的NO与CO反应生成无污染气体而除去。
已知:ⅰ.N2(g)和O2(g)生成NO(g)过程中的能量变化如图。
ⅱ.NO2(g)+CO(g)?CO2(g)+NO(g)△H=﹣234kJ?mol﹣1
ⅲ.1mol
NO(g)被O2(g)氧化时放出的热量为56.15kJ
①反应2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=
kJ?mol﹣1。
②工业上常用醋酸亚铜氨溶液来吸收CO,反应的化学方程式如下:CH3COOCu(NH3)2(aq)+CO(g)?CH3COOCu(NH3)2?CO(aq)△H<0吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有
(选填序号)。
a.适当升高温度
b.适当降低温度
c.适当增大压强
d.适当减小压强
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,一般采用NH3或尿素[CO(NH2)2]作还原剂,基本流程如图1所示。
①SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0,1mol
O2能氧化NH3的物质的量是
。若用CO(NH2)2作还原剂,还原NO2的化学方程式为
。
②其他条件不变,在相同时间内,NO转化为N2的转化率随温度的变化如图2所示。反应温度在50℃150℃范围内,NO转化为N2的转化率迅速上升,原因有
。
(3)用P﹣g﹣C3N4光催化氧化法脱除NO的过程如图3所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似,此时g﹣C3N4端的反应为
。
19.资料显示:IO2﹣在酸性溶液中能氧化I﹣,反应为IO2﹣+5I﹣+6H+═3I2+3H2O。为探究Na2SO3溶液和KIO3溶液的反应,甲同学向过量的KIO3酸性溶液中加入Na2SO3溶液,并加入两滴淀粉溶液:开始时无明显现象,t秒后溶液突然变为蓝色。
(1)甲同学对这一现象做出如下假设:t秒前生成了I2,但由于存在Na2SO3,I2被消耗,该反应的离子方程式为
,SO42﹣的还原性
I﹣。(填“>”、“=”或“<”)
(2)为验证他的猜想,甲同学向反应后的蓝色溶液中加入
,蓝色迅速消失,随后再次变蓝。
(3)甲同学设计了如下实验,进一步研究Na2SO3溶液和KIO3溶液反应的过程。
①甲同学在b电极附近的溶液中检测出了SO42﹣。
②刚开始放电时,a电极附近溶液未变蓝;取出a电极附近溶液于试管中,溶液变蓝。IO2﹣在a极放电的产物是
。
③放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失,重复多次后,蓝色不再褪去。电流表显示电路中时而出现电流,时而归零,最终电流消失。电流表短暂归零的原因是
。
④下列说法正确的是
。
a.a电极附近蓝色不再褪去时,SO32尚未完全氧化
b.a电极附近短暂出现蓝色,随即消失的原因可能是因为I2被SO32﹣还原
c.电流消失后,向b电极附近加入过量Na2SO3溶液,重新产生电流,a电极附近蓝色褪去
2020-2021学年江苏省泰州市高三(上)期中化学试卷
试题解析
一、选择题(共8小题,每小题2分,满分12分)
1.解:A.蛋白质是高分子化合物,所以新冠病毒的外壳蛋白质是高分子,故A错误;
B.酒精没有强氧化性,不能氧化灭活病毒,医用酒精的杀菌原理为使蛋白质变性失活,故B错误;
C.医用口罩均为一次性口罩,水洗会大大降低过滤效果,不能重复使用,故C错误;
D.抗病毒疫苗是蛋白质,蛋白质受热会变性失活,因此应冷藏存放,故D正确;
故选:D。
2.解:A.硫离子的核电荷数为16,最外层达到8电子稳定结构,硫离子的离子结构示意图为:,故A正确;
B.质子数为8,中子数为10的氧原子的质量数为8+10=18,核素符号为:,故B错误;
C.N原子之间形成三对共用电子对,结构式只把共用电子对用短线表示,未成键的电子不画出,N2的结构式为N≡N,故C错误;
D.碳核外有2个电子层,最外层电子数为4,位于p区,基态碳原子核外有6个电子,其中价电子为4,分布在2s、sp轨道上,价电子轨道表示式为
,2p能级电子轨道表示式:,故D错误;
故选:A。
3.解:A.钠钾合金具有良好的导热性,可用作快中子反应堆的热交换剂,故A错误;
B.Al2O3的熔点很高,可用作耐火材料,故B正确;
C.Na2SiO3溶液耐高温,不易燃烧,可用作木材的防火剂,故C错误;
D.氯化铁具有氧化性,能够氧化铜,可用作铜制线路板的蚀刻剂,故D错误。
故选:B。
4.解:A.KMnO4、H+、Fe2+之间发生氧化还原反应,不能大量共存,故A错误;
B.H+、HCO3﹣之间发生反应,不能大量共存,故B错误;
C.Na+、NO2﹣、K+、SO42﹣之间不反应,都不与Na+、CO32﹣反应,能够大量共存,故C正确;
D.Cu(OH)2溶于浓氨水,不能大量共存,故D错误;
故选:C。
5.解:A.二氧化氮可与氢氧化钠溶液反应,反应生成硝酸钠、亚硝酸钠,则可用氢氧化钠溶液吸收,故A正确;
B.二者混溶,不能用过滤的方法分离,可用蒸馏的方法分离,故B错误;
C.蒸发皿用于加热液体,蒸发固体,应在坩埚中进行,故C错误;
D.二氧化硫从长颈漏斗逸出,应用分液漏斗,故D错误。
故选:A。
6.解:A.处理污水时,产生的OH﹣与Ca2+形成氢氧化钙(水垢)析出,说明b极电极反应式是:2H2O+2e﹣=H2↑+2OH﹣,为阴极,与电源的负极相连,故A错误;
B.b极电极反应式是:2H2O+2e﹣=H2↑+2OH﹣,所以b极附近溶液的pH增大,故B错误;
C.b极为阴极,电极a为阳极,Cl﹣移向阳极a极,故C正确;
D.若Fe电极做阳极,会参与电极反应而被氧化,故D错误;
故选:C。
7.解:A.铂电极a为阳极,阳极上氯气放电,正确的电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,故A错误;
B.氯气溶于水的离子方程式为:Cl2+H2O?H++Cl﹣+HClO,故B正确;
C.醋酸与氢氧化钙水垢反应的离子方程式为:Ca(OH)2+2CH3COOH=Ca2++H2O+2CH3COO﹣,故C错误;
D.漂白粉失效的化学方程式为:Ca(ClO)2+H2O+CO2=CaCO3+2HClO,其离子方程式为:Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO,故D错误;
故选:B。
8.解:A.同位素是同种元素的不同原子,而H2O与D2O属于化合物,二者不互为同位素,是同一物质,故A错误;
B.同主族自上而下原子半径增大,故原子半径:r(S)<r(Mg),故B错误;
C.非金属性越强,单质的氧化能力越强,非金属性Br>I,故Br2得到电子的能力比I2的强,故C正确;
D.非金属性越强,氢化物越稳定,非金属性Br>I,故氢化物的热稳定性HI<HBr,故D错误。
故选:C。
9.解:A.饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,溶液中碳酸氢根离子浓度增大,由于碳酸氢钠的溶解度相对较小,析出碳酸氢钠,碳酸氢钠加热分解生成碳酸钠,所以饱和NaCl(aq)
NH3、CO2
NaHCO3(s)
△
Na2CO3(s)可以实现,故A正确;
B.氯气氧化性强于溴,故氯气能和NaBr溶液反应生成溴单质,故NaBr(aq)
Cl2(g)
Br2(aq)可以发生,而溴能被二氧化硫还原为溴离子,即转化Br2(aq)
SO2(g)
HBr(aq)可以发生,故B正确;
C.氯化镁与氢氧化钙反应生成氢氧化镁沉淀,氢氧化镁是弱碱,不稳定,受热分解生成MgO,物质间转化均能实现,故C正确;
D.氯气的氧化性强于碘,故转化KI(aq)
Cl2(g)
I2(aq)可以发生,但由于I2的氧化性较弱,只能将铁单质氧化为+2价,故转化I2(aq)
Fe(s)
△
FeI3(aq)不能发生,故D错误。
故选:D。
10.解:A.正负电荷中心重合的分子为非极性分子,双氧水分子为书页形结构,正负电荷中心不重合,为极性分子,故A错误;
B.第一步反应中有IO﹣生成、第二步反应中有IO﹣参加,所以该离子为反应的中间产物,故B正确;
C.总反应速率由慢反应速率决定,则总反应速率由第一步决定,故C错误;
D.总反应方程式为2H2O22H2O+O2↑,生成1mol氧气转移电子物质的量=1mol×2×[0﹣(﹣1)]=2mol,则生成0.1mol氧气,转移0.2mol电子,故D错误;
故选:B。
不定项选择题:本题包括4小题,每小题4分,共计16分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.解:A.反应I2(g)+H2(g)?2HI(g)达到平衡后,加入HI(g),反应物浓度不变,则正反应速率不可能减小,故A错误;
B.反应CO2(g)+H2(g)?CO(g)+H2O(g)的△H=(﹣110﹣242)kJ/mol﹣(﹣393)kJ/mol=+51kJ/mol,如能自发进行,应满足△H﹣T?△S<0,则△S>0,故B正确;
C.氮气的物质的量越多,氢气的转化率越大,则H2的平衡转化率:αA(H2)<αB(H2),故C错误;
D.室温下,0.1mol?L﹣1NaOH溶液的pH=13,应大于12,图象错误,故D错误。
故选:B。
12.解:A.醋酸钠水解为吸热反应,加热促进醋酸钠的水解,溶液pH增大,故A错误;
B.酸性条件下,硝酸根离子可氧化亚铁离子,不能确定是否变质,故B错误;
C.两种溶液的浓度大小未知,不能由pH大小确定酸性强弱,故C错误;
D.白色沉淀逐渐变为蓝色沉淀,说明生成氢氧化铜,存在沉淀的转化,可说明KspCu(OH)2<KspMg(OH)2,故D正确;
故选:D。
13.解:A.b点加入10mLNaOH,溶液为CH3COOH、CH3COONa,二者物质的量相等,醋酸进一步电离,则c(Na+)>c(CH3COOH),溶液中存在c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+),则c(CH3COO﹣)+c(OH﹣)>c(CH3COOH)+c(H+),故A正确;
B.c点存在CH3COONa和CH3COOH,e点存在CH3COONa和NaOH,可知e点c(OH﹣)>c(H+),故B错误;
C.d点恰好完全中和,n(CH3COOH)=n(NaOH)=0.10mol/L×0.02L=0.002mol,溶液体积为0.04L,则c(Na+)=c(CH3COO﹣)+c(CH3COOH)==0.05mol?L﹣1,则c(Na+)+c(CH3COO﹣)+c(CH3COOH)=0.10mol?L﹣1,故C正确;
D.f点加入NaOH
40mL,反应产生等量的NaOH和CH3COONa,溶液中c(OH﹣)>c(CH3COO﹣),则应为c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H+),故D错误。
故选:AC。
14.解:A.反应①为放热反应,升高温度,平衡逆向移动。则CH3OH平衡转化率减小,故A错误;
B.相同温度下,选择催化剂b,甲醇的产率较大,则选择催化剂b有利于CO2转化为CH3OH,故B正确;
C.相同时间内,加入催化剂b,甲醇产率较大,说明反应①反应速率较大,则活化能较低,可知无催化剂>有催化剂a>有催化剂b,故C错误;
D.其他条件不变,当T=620K时,测得不同压强下CO2的平衡转化率几乎相等,说明增大压强,平衡基本不移动,则说明620K时以反应②为主,故D正确。
故选:BD。
二、解答题(共5小题,满分64分)
15.解:(1)Na2CO3溶液显碱性是因为CO32﹣水解,即CO32﹣+H2O?HCO3﹣+OH﹣;根据图2pH<5
时,尾气中SO2明显增多,说明此时赤泥液吸收效率严重下降,需要更换,通过图1可判断pH=5时对应时间为18min,故每隔18min需要更换赤泥液,
故答案为:CO+H2O?HCO+OH﹣;18;
(2)聚合时,参与反应的离子有Al3+、Fe3+、HCO3﹣、SO42﹣,即Al3++Fe3++SO42﹣+HCO3﹣→AlFe(OH)6﹣2n(SO4)n,此时利用了Al3+、Fe3+与HCO3﹣彻底双水解性质,推测还有CO2生成,再结合元素守恒和电荷守恒配平即可,最终离子方程式为:Al3++Fe3++nSO42﹣+(6﹣2n)HCO=AlFe(OH)6﹣2n(SO4)n↓+(6﹣2n)CO2↑;
若增加NaHCO3用量,则会导致Al3+、Fe3+与之发生彻底双水解更多的转化为Al(OH)3和Fe(OH)3沉淀,与AlFe(OH)6﹣2n(SO4)n相比,OH﹣相对量增多,即6﹣2n值增大,故n值变小,
故答案为:Al3++Fe3++nSO42﹣+(6﹣2n)HCO3﹣=AlFe(OH)6﹣2n(SO4)n↓+(6﹣2n)CO2↑;变小;
(3)CaCO3脱硫主要发生反应:2CaCO3+2SO2+O22CaSO4+2CO2,生成CaSO4留在了矿粉中,故含硫量下降不明显,
故答案为:焙烧生成的硫氧化物被CaCO3吸收生成CaSO4留在了矿粉中或2CaCO3+2SO2+O22CaSO4+2CO2;
(4)测定样品中SO42﹣含量,可将其转化为BaSO4沉淀,通过SO42﹣进行计算,具体操作如下:加入足量1mol?L﹣1HCl溶液(注意此时不能用硫酸溶解)并充分搅拌,滴加BaCl2溶液至不再产生沉淀,过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加AgNO3溶液,不出现白色沉淀(目的:检验洗涤是否充分),
故答案为:加入足量1mol?L﹣1HCl溶液并充分搅拌,滴加BaCl2溶液至不再产生沉淀,过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加AgNO3溶液,不出现白色沉淀。
16.解:(1)Fe是26号元素,原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+基态核外电子排布式为1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5;
(2)(CH3)3N极易溶于H2O,除因为它们都是极性分子外,还因为(CH3)3N能与水形成分子间氢键,
故答案为:(CH3)3N能与水形成分子间氢键;
(3)①甲基中碳原子形成4个σ键,苯环上碳原子形成3个σ键,杂化轨道数目分别为3、2,分别采取sp3、sp2杂化,
故答案为:sp3、sp2;
②各原子之间形成1个σ键,阳离子含有17个σ键,1mol该盐的阳离子含有σ键的数目为
17×6.02×1023
,
故答案为:17×6.02×1023
;
(4)①原子1的分数坐标是(,,0),原子2处于晶胞左侧面面心,则原子2坐标参数x=z=,y=0,则原子2的分数坐标为(,0,),
故答案为:(,0,);
②正六边形顶点M是晶胞中体对角线顶点以外的6个顶点原子投影形成的,则M代表P原子,N代表B原子,
故答案为:B。
17.解:(1)①从图示可知,MnO2和A反应生成Mn2+和B,锰元素的化合价从+4价→+2价,化合价降低,A元素的化合价升高,所以A为Fe2+,B为Fe3+,
故答案为:B;
②在硫酸溶液中用铁屑还原MnO2,铁屑被氧化为Fe3+,MnO2被还原为Mn2+.该反应的离子方程式为:2Fe+3MnO2+12H+═3Mn2++2Fe3++6H2O,H2S饱和溶液的浓度为0.1mol?L﹣1,H2S的电离常数K=1.5×10﹣7、K=6×10﹣15),氢硫酸是二元弱酸分步电离,其电离方程式为H2S?H++HS﹣,HS﹣?H++S2﹣,c2(H+)×c(S2﹣)=Ka1×Ka2×c(H2S),H2S饱和溶液的浓度为0.1mol?L﹣1,H2S的电离常数K=1.5×10﹣7、K=6×10﹣15),c(H+)=0.3mol?L﹣1时,c(S2﹣)=1×10﹣21mol?L﹣1,Ksp(CdS)=8×10﹣27,溶液中c(Cd2+)==8×10﹣6,
故答案为:2Fe+3MnO2+12H+═3Mn2++2Fe3++6H2O;8×10﹣6;
(2)25.00mL溶液中:(若按照250.00mL溶液中计算亦同)
n(NH4+)=n(NH3)==1.0×10﹣3mol,
n(SO42﹣)=n(BaSO4)==1.0×10﹣3mol,
根据电荷守恒可得:
n(NH4+)+2n(Mn2+)=2n(SO42﹣)
n(Mn2+)=5.00×10﹣4mol
假设化学式为:(NH4)2Mn(SO4)2?xH2O
=30.8%或=
x=7
硫酸铵锰晶体化学式为:(NH4)2Mn(SO4)2?7H2O,
故答案为:(NH4)2Mn(SO4)2?7H2O。
18.解:(1)①过程i对应热化学方程式:①N2(g)+O2(g)=2NO(g)△H=946kJ/mol+498
kJ/mol﹣2×632
kJ/mol=+180
kJ/mol;过程iii对应热化学方程式:③2NO(g)+O2(g)=2NO2(g)△H=﹣56.15×2
kJ/mol=﹣112.3
kJ/mol;设过程ii的热化学方程式为②,根据②﹣①+③×2可得目标方程式,由此计算出△H=﹣760.3kJ/mol,
故答案为:﹣760.3;
②适当升温或减小压强都能促进平衡逆向移动,从而使CH3COOCu(NH3)2再生,
故答案为:ad;
(2)①根据电子守恒计算1mol
O2能氧化NH3的物质的量;用尿素[CO(NH2)2]作还原剂还原NO2的反应生成二氧化碳、氮气和水;
②由于是反应相同时间,故未达平衡前反应速率越快,相同时间内NO转化率越高,故50~150℃NO转化率迅速上升原因可能是温度升高导致反应速率加快,另外此反应用到了催化剂,所以还可能是因为温度升高催化剂活性增强导致反应速率加快,
故答案为:温度升高反应速率增大,温度升高催化剂的活性增强;
(3)根据图示g﹣C3N4端转为为O2得电子生成H2O2,即O2+2e﹣→H2O2,酸性溶液添加H+配平电荷守恒,故最终方程式为:O2+2H++2e﹣=H2O2,
故答案为:O2+2H++2e﹣=H2O2。
19.解:(1)I2具有氧化性,能氧化Na2SO3,反应生成Na2SO4和NaI,酸性条件下发生的反应的离子方程式为:I2+SO32﹣+H2O═SO42﹣+2H++2I﹣;氧化还原反应中还原剂的还原性大于还原产物的还原性,则还原性:SO42﹣<I﹣,
故答案为:I2+SO32﹣+H2O═SO42﹣+2H++2I﹣;<;
(2)甲同学向反应后的蓝色溶液中加入少量Na2SO3,蓝色迅速消失,说明Na2SO3与I2反应,证明甲同学的猜想正确,
故答案为:Na2SO3溶液;
(3)②刚开始放电时,a电极附近溶液未变蓝,说明没有碘单质生成;取出a电极附近溶液于试管中,溶液变蓝,生成的I﹣与IO3﹣生成了碘单质,所以IO3﹣
在a极放电的产物是I﹣,生成的I﹣与IO3﹣生成了碘单质,
故答案为:I﹣;
③放电一段时间后,指针指针回到“0”处说明无电流生成,原因是:a极区发生反应IO3﹣+5I﹣+6H+=3I2+3H2O,IO3﹣
不再与SO32﹣发生反应,外电路无电流通过,
故答案为:a极区发生反应IO3﹣+5I﹣+6H+=3I2+3H2O,IO3﹣不再与SO32﹣发生反应,外电路无电流通过;
④a.过量的KIO3酸性溶液与Na2SO3溶液反应,Na2SO3反应完全,得到I﹣,I﹣与多余的KIO3反应得到碘单质,溶液变蓝,所以a电极附近蓝色不再褪去时,SO32已经完全被氧化,故a错误;
b.a电极附近短暂出现蓝色,生成的I﹣与IO3﹣生成了碘单质,溶液显蓝色,当I2被SO32﹣还原时,溶液又褪色,故b正确;
c.向b电极附近加入过量Na2SO3溶液,与a电极附近的I2发生原电池反应,构成原电池,所以重新产生电流,a电极附近I2被消耗,则溶液蓝色褪去,故c正确,
故答案为:bc。
第1页(共1页)
同课章节目录
