人教版选修5高中化学第3节 卤代烃(29张PPT)
文档属性
| 名称 | 人教版选修5高中化学第3节 卤代烃(29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 828.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-09 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
2.3卤代烃
第一课时
溴乙烷
1.溴乙烷的组成与结构
1.结构简式
2.结构式
3.电子式
4.官能团
CH3CH2Br
C2H5Br
或
H-C-C-Br
H
H
H
H
Br原子
球棍模型
在核磁共振氢谱中怎样表现
溴乙烷的结构特点
溴原子吸引电子的能力较强,使共用电子对偏移,C-Br键具有较强的极性,因此
C-Br键易断断。使溴原子易被取代。由于官能团(-Br)的作用,溴乙烷的化学性质比乙烷活泼,能发生许多化学反应。
2.溴乙烷的物理性质
1.颜色:
2.状态:
3.沸点:
4.密度:
5.溶解性:
无色
液体
38.4℃
比水大
难溶于水,易溶于有机溶剂
3、溴乙烷化学性质
⑴与氢氧化钠溶液共热:
溴乙烷中不存在溴离子,溴乙烷是非电解质,不能电离。
实验1.取溴乙烷加入用硝酸酸化的硝酸银溶液,观察有无浅黄色沉淀析出。
实验2.取溴乙烷加入氢氧化钠溶液,共热;加热完毕,取上层清液,加入硝酸酸化的硝酸银溶液,观察有无浅黄色沉淀析出。
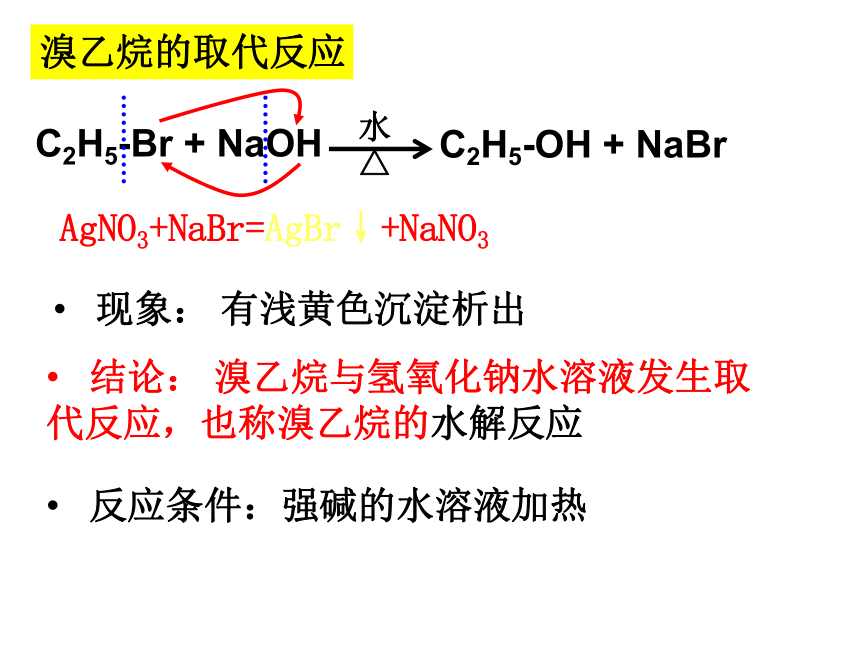
溴乙烷的取代反应
C2H5-Br
+
NaOH
水
△
C2H5-OH
+
NaBr
现象:
有浅黄色沉淀析出
AgNO3+NaBr=AgBr↓+NaNO3
结论:
溴乙烷与氢氧化钠水溶液发生取代反应,也称溴乙烷的水解反应
反应条件:强碱的水溶液加热
①取水解后上层清液少许加入稀硝酸至酸性
②再加入硝酸银溶液
因为Ag++OH-=AgOH(白色)↓
2AgOH=Ag2O(褐色)+H2O;
褐色掩蔽AgBr的浅黄色,使产物检验实验失败。所以必须用硝酸酸化!
产物检验步骤
思考
1.如何证明溴乙烷与NaOH溶液的反应中,溴乙烷中的Br原子变成了Br-?
2.用何种波普的方法可以方便检验出溴乙烷的取代反应的生成物中有乙醇生成?
从水中取出大试管,冷却后用滴管吸取上层清液放入另一试管中,向试管中加入稀硝酸,并用石蕊试液检验溶液显酸性,然后再向溶液中滴加几滴AgNO3溶液,观察到有淡黄色沉淀生成说明Br原子变成了Br-。
核磁共振氢谱
例:在实验室里用氯乙烷与氢氧化钠共热后,检验氯元素的操作程序:
A.滴加AgNO3溶液;
B.加热;
C.将氢氧化钠溶液与氯乙烷混合;D.用HNO3酸化
(2)鉴定氯氯元素的操作步聚是?
CBDA
(1)此过程涉及到哪些反应?
(3)在核磁共振氢谱中有机产物有几种类型的氢?
3种
3个
⑵与氢氧化钠的醇溶液共热:
实验3.取溴乙烷加入氢氧化钠的醇溶液,共热;将产生的气体通入溴水中,观察溶液是否褪色。
现象:溴水褪色
结论:有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等),而形成不饱和(含双键或三键)化合物的反应,叫做消去反应。
溴乙烷的消去反应
小分子
不饱和
CH2-CH2
H
Br
+
NaOH
醇
△
CH2=CH2↑+NaBr+H2O
卤代烃发生消去反应的条件是什么?
卤代烃发生消去反应的条件:
①卤素原子相连碳有邻碳
②邻碳有氢
③强碱的乙醇溶液加热
卤苯不能发生消去反应
思考
1.实验中可以用如图装置,通过观察酸性高锰酸钾溶液是否褪色来检验溴乙烷消去反应中生成的气体是否为乙烯。为什么要在气体通入酸性KMnO4溶液前加一个盛有水的试管?起什么作用?
2.还可以用什么方法检验乙烯?此时还有必要将气体先通入水中吗?
先用水吸收挥发出来的乙醇和HBr气体,因为乙醇和HBr气体也能使酸性KMnO4溶液褪色。
还可以用溴水检验。此时没必要将气体先通入水中。
取代反应
消去反应
反应物
反应条件
断裂化学键
生成物
结论
NaOH和CH3CH2Br
NaOH和CH3CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
C-Br
C-Br C-H
乙醇
乙烯
有机反应中,反应条件不同,发生反应的反应类型和反应产物不同。
“无醇生成醇,有醇不生成醇”。
取代、消去反应小结
练习
1、下列物质与NaOH醇溶液共热可制得烯烃的是:
C6H5CH2Cl
B.
(CH3)
3CBr
C.
CH3CHBrCH3
D.
CH3Cl
2、写出由CH2BrCH2Br与NaOH醇溶液共热的反应方程式
√
√
CH2BrCH2Br
CH≡CH+2HBr
NaOH、△
CH3CH2OH
课堂练习
3.下列化合物在一定条件下,既能发生消去反应,又能发生水解反应的是(
)
A.
B.
C.
D.
B
4.写出下列反应的化学方程式
①由碘乙烷转化为乙醇
②由2-溴丙烷转化为丙烯
CH3
③以
CH3-CH-CH2
OH
CH3-C-CH2
OH
H3C
为原料制取
Br
2.3卤代烃
第二课时
卤代烃
卤代烃的概念、分类
1.概念:
烃分子中的氢原子被卤素原子取代后生成的化合物叫做卤代烃。
按卤素原子种类
按卤素原子个数
按烃基种类
氟代烃、氯代烃、溴代烃、碘代烃
一卤代烃、二卤代烃、多卤代烃
饱和卤代烃、不饱和卤代烃、芳香卤代烃
2.分类
卤代烃不是烃
卤代烃的物理性质——沸点变化规律
①常温下,卤代烃中除少数为气体外,大多为液体或固体
②一卤代烷的沸点随碳原子数的增加而升高,且较相应烷烃的高
③同一卤代烃的同分异构体中支链越多,沸点越低
卤代烃的密度变化规律
①一卤代烷的密度较相应的烷烃大
②卤代烃的同系物中,密度随碳原子数的增加而减小
③烃基相同,卤素原子不同的卤代烃中,密度和沸点最低的是氟代物,最高的是碘代物
(与溴乙烷相似)
◆活泼性:
卤代烃强于烃
原因:卤素原子的引入。
1)取代反应(水解):
卤代烷烃水解成醇
R-X
+
NaOH
R-OH
+
NaX
H2O
△
4、卤代烃化学的性质
说明:同一碳原子上的多卤代烃水解得到的产物一般不是醇。
反应条件:强碱的水溶液加热
卤代烃中卤素原子的检验:
NaOH水溶液
△
过量HNO3
AgNO3溶液
有沉淀产生
说明有卤素原子
白色
淡黄色
黄色
卤代烃
AgF溶于水。
4、卤代烃化学的性质
2)消去反应
NaOH醇溶液
△
C
C
+
HX
C
C
X
H
说明:苯环上的卤素原子不能发生消去反应。
NaOH醇溶液
△
C
C
+
2HX
C
C
X
X
反应条件:强碱的醇溶液,加热或锌,加热
①烃中碳原子数≥2
②邻碳有氢才消去
说明:同一碳原子上的多卤代烃水解得到的产物一般不是醇。
CH3CH2CH2Cl+H2O
CH3CH2CH2OH+HCl
NaOH
△
CH3CHClCH3+NaOH
CH3CHCH3+
NaCl
△
H2O
OH
CH2CH2CH2+2H2O
Br
Br
CH2CH2CH2+2HBr
OH
OH
NaOH
△
练习:写出CH3CH2CH2Cl和CH3CHClCH3分别与NaOH的水溶液发生反应的化学方程式。
练习:
1、写出2-氯丙烷与氢氧化钠醇溶液反应的化学方程式
2、写出2-氯丁烷与氢氧化钠醇溶液反应的化学方程式
说明:饱和卤代烃和芳香卤代烃不被酸性高锰酸钾溶液氧化!!!!
3.以CH3CH2Br
为主要原料制备CH2BrCH2Br
4.怎样由乙烯为主要原料来制CH2OHCH2OH(乙二醇)?
CH3CH2Br
CH2=CH2↑+HBr
NaOH、△
CH3CH2OH
CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2+Br2→CH2BrCH2Br
CH2BrCH2Br
CH2OHCH2OH
NaOH
H2O
△
5、下列物质中不能发生消去反应的是(
)
②
③
④
⑥
A、①②③⑤
B、
②④
C、②④⑤
D、①⑤⑥
B
6、下列叙述中,正确的是(
)
A、含有卤素原子的有机物称为卤代烃
B、卤代烃能发生消去反应,但不能发生取代反应
C、卤代烃包括卤代烷烃、卤代烯烃、卤代炔烃和卤代芳香烃
D、乙醇分子内脱水不属于消去反应
(
)
C
有机物间转化关系图
H2/催化剂
△
H2/催化剂
△
Cl2/
光照
HCl/催化剂
△
H2O/催化剂
△
O2/Cu
△
O2/催化剂
△
银氨溶液/
△
新制氢氧化铜/
△
HCl
H2O/催化剂
△
加压
CH2XCH2X
溴水或溴的CCl4溶液
NaOH醇溶液/△
NaOH
水溶液/△
2.3卤代烃
第一课时
溴乙烷
1.溴乙烷的组成与结构
1.结构简式
2.结构式
3.电子式
4.官能团
CH3CH2Br
C2H5Br
或
H-C-C-Br
H
H
H
H
Br原子
球棍模型
在核磁共振氢谱中怎样表现
溴乙烷的结构特点
溴原子吸引电子的能力较强,使共用电子对偏移,C-Br键具有较强的极性,因此
C-Br键易断断。使溴原子易被取代。由于官能团(-Br)的作用,溴乙烷的化学性质比乙烷活泼,能发生许多化学反应。
2.溴乙烷的物理性质
1.颜色:
2.状态:
3.沸点:
4.密度:
5.溶解性:
无色
液体
38.4℃
比水大
难溶于水,易溶于有机溶剂
3、溴乙烷化学性质
⑴与氢氧化钠溶液共热:
溴乙烷中不存在溴离子,溴乙烷是非电解质,不能电离。
实验1.取溴乙烷加入用硝酸酸化的硝酸银溶液,观察有无浅黄色沉淀析出。
实验2.取溴乙烷加入氢氧化钠溶液,共热;加热完毕,取上层清液,加入硝酸酸化的硝酸银溶液,观察有无浅黄色沉淀析出。
溴乙烷的取代反应
C2H5-Br
+
NaOH
水
△
C2H5-OH
+
NaBr
现象:
有浅黄色沉淀析出
AgNO3+NaBr=AgBr↓+NaNO3
结论:
溴乙烷与氢氧化钠水溶液发生取代反应,也称溴乙烷的水解反应
反应条件:强碱的水溶液加热
①取水解后上层清液少许加入稀硝酸至酸性
②再加入硝酸银溶液
因为Ag++OH-=AgOH(白色)↓
2AgOH=Ag2O(褐色)+H2O;
褐色掩蔽AgBr的浅黄色,使产物检验实验失败。所以必须用硝酸酸化!
产物检验步骤
思考
1.如何证明溴乙烷与NaOH溶液的反应中,溴乙烷中的Br原子变成了Br-?
2.用何种波普的方法可以方便检验出溴乙烷的取代反应的生成物中有乙醇生成?
从水中取出大试管,冷却后用滴管吸取上层清液放入另一试管中,向试管中加入稀硝酸,并用石蕊试液检验溶液显酸性,然后再向溶液中滴加几滴AgNO3溶液,观察到有淡黄色沉淀生成说明Br原子变成了Br-。
核磁共振氢谱
例:在实验室里用氯乙烷与氢氧化钠共热后,检验氯元素的操作程序:
A.滴加AgNO3溶液;
B.加热;
C.将氢氧化钠溶液与氯乙烷混合;D.用HNO3酸化
(2)鉴定氯氯元素的操作步聚是?
CBDA
(1)此过程涉及到哪些反应?
(3)在核磁共振氢谱中有机产物有几种类型的氢?
3种
3个
⑵与氢氧化钠的醇溶液共热:
实验3.取溴乙烷加入氢氧化钠的醇溶液,共热;将产生的气体通入溴水中,观察溶液是否褪色。
现象:溴水褪色
结论:有机化合物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等),而形成不饱和(含双键或三键)化合物的反应,叫做消去反应。
溴乙烷的消去反应
小分子
不饱和
CH2-CH2
H
Br
+
NaOH
醇
△
CH2=CH2↑+NaBr+H2O
卤代烃发生消去反应的条件是什么?
卤代烃发生消去反应的条件:
①卤素原子相连碳有邻碳
②邻碳有氢
③强碱的乙醇溶液加热
卤苯不能发生消去反应
思考
1.实验中可以用如图装置,通过观察酸性高锰酸钾溶液是否褪色来检验溴乙烷消去反应中生成的气体是否为乙烯。为什么要在气体通入酸性KMnO4溶液前加一个盛有水的试管?起什么作用?
2.还可以用什么方法检验乙烯?此时还有必要将气体先通入水中吗?
先用水吸收挥发出来的乙醇和HBr气体,因为乙醇和HBr气体也能使酸性KMnO4溶液褪色。
还可以用溴水检验。此时没必要将气体先通入水中。
取代反应
消去反应
反应物
反应条件
断裂化学键
生成物
结论
NaOH和CH3CH2Br
NaOH和CH3CH2Br
NaOH水溶液,加热
NaOH醇溶液,加热
C-Br
C-Br C-H
乙醇
乙烯
有机反应中,反应条件不同,发生反应的反应类型和反应产物不同。
“无醇生成醇,有醇不生成醇”。
取代、消去反应小结
练习
1、下列物质与NaOH醇溶液共热可制得烯烃的是:
C6H5CH2Cl
B.
(CH3)
3CBr
C.
CH3CHBrCH3
D.
CH3Cl
2、写出由CH2BrCH2Br与NaOH醇溶液共热的反应方程式
√
√
CH2BrCH2Br
CH≡CH+2HBr
NaOH、△
CH3CH2OH
课堂练习
3.下列化合物在一定条件下,既能发生消去反应,又能发生水解反应的是(
)
A.
B.
C.
D.
B
4.写出下列反应的化学方程式
①由碘乙烷转化为乙醇
②由2-溴丙烷转化为丙烯
CH3
③以
CH3-CH-CH2
OH
CH3-C-CH2
OH
H3C
为原料制取
Br
2.3卤代烃
第二课时
卤代烃
卤代烃的概念、分类
1.概念:
烃分子中的氢原子被卤素原子取代后生成的化合物叫做卤代烃。
按卤素原子种类
按卤素原子个数
按烃基种类
氟代烃、氯代烃、溴代烃、碘代烃
一卤代烃、二卤代烃、多卤代烃
饱和卤代烃、不饱和卤代烃、芳香卤代烃
2.分类
卤代烃不是烃
卤代烃的物理性质——沸点变化规律
①常温下,卤代烃中除少数为气体外,大多为液体或固体
②一卤代烷的沸点随碳原子数的增加而升高,且较相应烷烃的高
③同一卤代烃的同分异构体中支链越多,沸点越低
卤代烃的密度变化规律
①一卤代烷的密度较相应的烷烃大
②卤代烃的同系物中,密度随碳原子数的增加而减小
③烃基相同,卤素原子不同的卤代烃中,密度和沸点最低的是氟代物,最高的是碘代物
(与溴乙烷相似)
◆活泼性:
卤代烃强于烃
原因:卤素原子的引入。
1)取代反应(水解):
卤代烷烃水解成醇
R-X
+
NaOH
R-OH
+
NaX
H2O
△
4、卤代烃化学的性质
说明:同一碳原子上的多卤代烃水解得到的产物一般不是醇。
反应条件:强碱的水溶液加热
卤代烃中卤素原子的检验:
NaOH水溶液
△
过量HNO3
AgNO3溶液
有沉淀产生
说明有卤素原子
白色
淡黄色
黄色
卤代烃
AgF溶于水。
4、卤代烃化学的性质
2)消去反应
NaOH醇溶液
△
C
C
+
HX
C
C
X
H
说明:苯环上的卤素原子不能发生消去反应。
NaOH醇溶液
△
C
C
+
2HX
C
C
X
X
反应条件:强碱的醇溶液,加热或锌,加热
①烃中碳原子数≥2
②邻碳有氢才消去
说明:同一碳原子上的多卤代烃水解得到的产物一般不是醇。
CH3CH2CH2Cl+H2O
CH3CH2CH2OH+HCl
NaOH
△
CH3CHClCH3+NaOH
CH3CHCH3+
NaCl
△
H2O
OH
CH2CH2CH2+2H2O
Br
Br
CH2CH2CH2+2HBr
OH
OH
NaOH
△
练习:写出CH3CH2CH2Cl和CH3CHClCH3分别与NaOH的水溶液发生反应的化学方程式。
练习:
1、写出2-氯丙烷与氢氧化钠醇溶液反应的化学方程式
2、写出2-氯丁烷与氢氧化钠醇溶液反应的化学方程式
说明:饱和卤代烃和芳香卤代烃不被酸性高锰酸钾溶液氧化!!!!
3.以CH3CH2Br
为主要原料制备CH2BrCH2Br
4.怎样由乙烯为主要原料来制CH2OHCH2OH(乙二醇)?
CH3CH2Br
CH2=CH2↑+HBr
NaOH、△
CH3CH2OH
CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2+Br2→CH2BrCH2Br
CH2BrCH2Br
CH2OHCH2OH
NaOH
H2O
△
5、下列物质中不能发生消去反应的是(
)
②
③
④
⑥
A、①②③⑤
B、
②④
C、②④⑤
D、①⑤⑥
B
6、下列叙述中,正确的是(
)
A、含有卤素原子的有机物称为卤代烃
B、卤代烃能发生消去反应,但不能发生取代反应
C、卤代烃包括卤代烷烃、卤代烯烃、卤代炔烃和卤代芳香烃
D、乙醇分子内脱水不属于消去反应
(
)
C
有机物间转化关系图
H2/催化剂
△
H2/催化剂
△
Cl2/
光照
HCl/催化剂
△
H2O/催化剂
△
O2/Cu
△
O2/催化剂
△
银氨溶液/
△
新制氢氧化铜/
△
HCl
H2O/催化剂
△
加压
CH2XCH2X
溴水或溴的CCl4溶液
NaOH醇溶液/△
NaOH
水溶液/△
