人教版选修4高中化学第二章第一节 化学反应速率(29张PPT)
文档属性
| 名称 | 人教版选修4高中化学第二章第一节 化学反应速率(29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 774.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-09 18:17:52 | ||
图片预览








文档简介
(共29张PPT)
第二章
化学反应速率和化学平衡
第一节
化学反应速率
回忆钠和钾分别与水反应的现象。
比较等物质的量浓度的盐酸和醋酸与大理石反应的快慢。
不同的化学反应快慢是不一样的。怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
浓度常用单位:mol/L
时间常用单位:s
、
min、h
化学反应速率常用单位:mol/(L·s)
或
mol/(L·min)
表达式:v
=
△c/△t
一、化学反应速率的表示
v
=
△n/(V·△t)
PS:
1、通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,所以反应速率是正值。
2、中学阶段的化学反应速率是平均速率。
3、仅应用于溶液或气体的体系,固体、纯液体无浓度变化。
【例题】在2L的密闭容器中,加入1molN2和3molH2,发生
N2+3H2
=?2NH3
,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。
起始浓度(mol/L)
2s末浓度(mol/L)
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
问题1
变化浓度(mol/L)
三步法
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。
同一反应中,各物质的速率之比等于它们在化学方程式中的化学计量数之比。
如在N2
+
3H2
=?2NH3
中,
v(N2):v(H2):v(NH3)=1:3:2
结论1
常见题型例举
1、用不同的物质来表示反应速率。
例1、反应4NH3
+
5O2
===
4NO
+
6H2O
在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A、v
(O2)=0.01
mol/(L·s)
B、
v
(NO)=0.008
mol/(L·s)
C、v
(H2O)=0.003
mol/(L·s)
D、
v
(NH3)=0.002
(mol/L·s
)
v
(NO)=0.3/(5×30)
=0.002
mol/(L·s)
2、比较反应速率的大小
例2、反应A
+
3B
==
2C
+
2D在四种不同情况下的反应速率分别为①VA
=
0.15mol·L-1·s-1
②VB
=
0.6mol·L-1·s-1
③Vc
=
0.4mol·L-1·s-1
④VD
=
0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是
④﹥
②=
③﹥
①
结论2:在同一反应中,反应速率的大小不能单纯地看数值大小。应转化为同一种物质的反应速率再进行比较。
3、根据各物质的反应速率之比写出化学方程式。
例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t
min后,测得物质的量浓度分别为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L
,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:
3X2
+
Y2
===
2Z
3X2
+
Y2
===
2X3Y
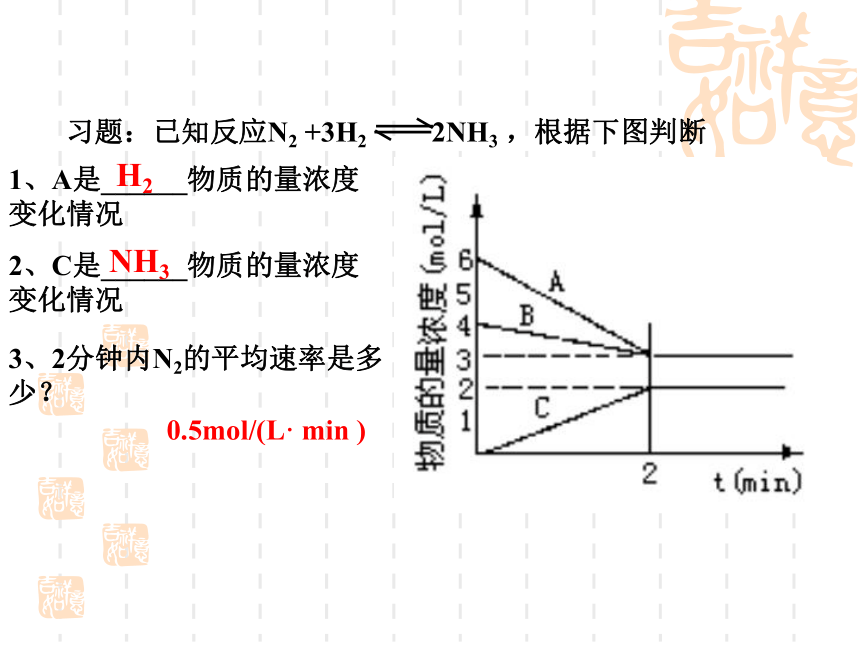
习题:已知反应N2
+3H2
2NH3
,根据下图判断
1、A是______物质的量浓度变化情况
2、C是______物质的量浓度变化情况
3、2分钟内N2的平均速率是多少?
H2
NH3
0.5mol/(L·
min
)
化学反应速率的测量
2、化学反应进行的时候,反应物和生成物的浓度都在不断地变化,由于反应体系中一种反应物浓度的变化,必然引起其他物质浓度发生相应的变化。因此,化学反应速率可以用反应体系中任何一种物质(反应物或生成物)的浓度变化来表示,一般以最容易测定的物质表示。
3、在物质的诸多性质中,特别是在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
1、化学反应速率是通过实验测定的。
化学反应速率测定的基本思路:
可用于化学反应速率测定的基本性质
①可直接观察的性质,如释放出的气体的体积和体系的压强
②依靠科学仪器才能测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力
③在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
1、
下列反应中
2
SO2
+
O2
2
SO3
起始浓度(mol/L)
0.4
0.2
0
2
s后浓度(mol/L)
0.2
求:V(SO2)、V(O2)、V(SO3)
2、在500
mL的密闭容器中装入1.5
mol
H2,0.5
mol
N2和0.05
mol
NH3。若该反应的反应速率
V(H2)=
0.3
mol/(L·min)时,求3分钟末时NH3的浓度?
3、把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X+Y=
nZ+2W。2min末已生成0.2molW,若测知V(z)=0.1mol/(L·min),则⑴上述反应中Z气体的计量数n的值是(
)
A.1
B.2
C.3
D.4
⑵上述反应在2min末时,已消耗的Y占原来的百分比是(
)
A.20%
B.25%
C.33%
D.50%
D
B
反应物的消耗量
转化率=
反应物的起始量
×100%
4、在4个不同的容器中,在不同的条件下进行合成氨反应,根据在相同时间内测定的结果判断,生成氨的速率最快的是(
)
A.V(H2)=
0.1
mol/(L·min)
B.V(N2)=
0.2
mol/(L·min)
C.V(NH3)=
0.15
mol/(L·min)
D.V(H2)=
0.3
mol/(L·min)
注:此类题均换算为同一物质的速率为标准比较
B
5、一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1molN2和3mol
H2,3min末测此容器内压强是起始时压强的0.9倍。在此时间内用
H2的量的变化来表示该反应的平均反应速率
是(??
)
A、0.2
mol/(L·min)
?
B、0.6
mol/(L·min)
C
、0.1
mol/(L·min)
???
D、0.1
mol/(L·min)
C
6、将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:
NH4Br(s)
NH3(g)+HBr(g),
2HBr(g)
Br2(g)+H2(g)
2min后,测知H2的浓度为0.5mol/L,HBr的浓度为4mol/L,若上述反应速率用V(NH3)表示,求V(NH3)
7、某温度时,在2
L容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线图,由图中数据分析,该反应的化学方程式为?反应开始至2
min,Z的平均反应速率?
V(Z)=
=
0.05
mol/(L?min)
由图知,2
min内X、Y、Z物质的量的变化为0.3
mol、0.1
mol、0.2
mol比值为3∶1∶2,可知
3
X
+
Y
2Z,
化学反应速率的微观原理
如何来研究一个反应,研究化学反应原理的
基本方法和思路是怎样?
即:我们从哪些方面来认识一个反应!
先认识几个概念:
1、有效碰撞
2、活化分子
3、活化能
4、催化剂
——概念模型法
有
效
碰
撞
1、什么是有效碰撞?
引起分子间的化学反应的碰撞
结论:
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充分条件
推论:
某一化学反应的速率大小与
单位时间内有效碰撞的次数有关
为什么有的碰撞可以发生反应,
而有的不能发生反应?与哪些因
素有关系?
问题:
活
化
分
子
2、什么是活化分子?
具有较高能量,能够发生有效碰撞的分子
结论:
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
推论:
有效碰撞次数的多少与
单位体积内反应物中活化分子
的多少有关。
活化分子的多少又与什么有关?
问题:
活
化
能
3、什么是活化能?
活化分子高出反应物分子平均能量的部分
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应?
活化能与反应热有关吗?
反应热
结论:
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定,
内因
推论:
活化能越小则一般分子成为活化分子越容易,
则活化分子越多,
则单位时间内有效碰撞越多,
则反应速率越快。
对于“活化能的大小虽然意味着一般
分子成为活化分子的难易,但是却
对这个化学反应前后的能量变化并
不产生任何影响”这一句话如何理解?
问题1:
活化能为“0”的例子是怎么回事?
问题2、
归
纳
总
结
一个反应要发生一般要经历哪些过程?
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
解
释
问
题
1、为什么可燃物有氧气参与,还必
须达到着火点才能燃烧?
2、催化剂在我们技术改造和生产中
起关键作用,它主要作用是提高
化学反应速率,试想一下为什么
催化剂能提高反应速率?
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
第二章
化学反应速率和化学平衡
第一节
化学反应速率
回忆钠和钾分别与水反应的现象。
比较等物质的量浓度的盐酸和醋酸与大理石反应的快慢。
不同的化学反应快慢是不一样的。怎么样来比较和描述不同反应的快慢呢?
化学反应速率是用来衡量化学反应进行快慢程度的一个物理量。
化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
浓度常用单位:mol/L
时间常用单位:s
、
min、h
化学反应速率常用单位:mol/(L·s)
或
mol/(L·min)
表达式:v
=
△c/△t
一、化学反应速率的表示
v
=
△n/(V·△t)
PS:
1、通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示,所以反应速率是正值。
2、中学阶段的化学反应速率是平均速率。
3、仅应用于溶液或气体的体系,固体、纯液体无浓度变化。
【例题】在2L的密闭容器中,加入1molN2和3molH2,发生
N2+3H2
=?2NH3
,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。
起始浓度(mol/L)
2s末浓度(mol/L)
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
问题1
变化浓度(mol/L)
三步法
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
同一个反应,用不同的物质来表示反应速率,数值是不一样的,所以应注明是由哪种物质表示的。
同一反应中,各物质的速率之比等于它们在化学方程式中的化学计量数之比。
如在N2
+
3H2
=?2NH3
中,
v(N2):v(H2):v(NH3)=1:3:2
结论1
常见题型例举
1、用不同的物质来表示反应速率。
例1、反应4NH3
+
5O2
===
4NO
+
6H2O
在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A、v
(O2)=0.01
mol/(L·s)
B、
v
(NO)=0.008
mol/(L·s)
C、v
(H2O)=0.003
mol/(L·s)
D、
v
(NH3)=0.002
(mol/L·s
)
v
(NO)=0.3/(5×30)
=0.002
mol/(L·s)
2、比较反应速率的大小
例2、反应A
+
3B
==
2C
+
2D在四种不同情况下的反应速率分别为①VA
=
0.15mol·L-1·s-1
②VB
=
0.6mol·L-1·s-1
③Vc
=
0.4mol·L-1·s-1
④VD
=
0.45mol·L-1·s-1
则该反应在不同条件下速率快慢顺序是
④﹥
②=
③﹥
①
结论2:在同一反应中,反应速率的大小不能单纯地看数值大小。应转化为同一种物质的反应速率再进行比较。
3、根据各物质的反应速率之比写出化学方程式。
例3、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t
min后,测得物质的量浓度分别为:c(X2)=0.4mol/L,c(Y2)=0.8mol/L
,c(Z)=0.4mol/L,则该反应的反应方程式可表示为:
3X2
+
Y2
===
2Z
3X2
+
Y2
===
2X3Y
习题:已知反应N2
+3H2
2NH3
,根据下图判断
1、A是______物质的量浓度变化情况
2、C是______物质的量浓度变化情况
3、2分钟内N2的平均速率是多少?
H2
NH3
0.5mol/(L·
min
)
化学反应速率的测量
2、化学反应进行的时候,反应物和生成物的浓度都在不断地变化,由于反应体系中一种反应物浓度的变化,必然引起其他物质浓度发生相应的变化。因此,化学反应速率可以用反应体系中任何一种物质(反应物或生成物)的浓度变化来表示,一般以最容易测定的物质表示。
3、在物质的诸多性质中,特别是在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
1、化学反应速率是通过实验测定的。
化学反应速率测定的基本思路:
可用于化学反应速率测定的基本性质
①可直接观察的性质,如释放出的气体的体积和体系的压强
②依靠科学仪器才能测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力
③在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
1、
下列反应中
2
SO2
+
O2
2
SO3
起始浓度(mol/L)
0.4
0.2
0
2
s后浓度(mol/L)
0.2
求:V(SO2)、V(O2)、V(SO3)
2、在500
mL的密闭容器中装入1.5
mol
H2,0.5
mol
N2和0.05
mol
NH3。若该反应的反应速率
V(H2)=
0.3
mol/(L·min)时,求3分钟末时NH3的浓度?
3、把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X+Y=
nZ+2W。2min末已生成0.2molW,若测知V(z)=0.1mol/(L·min),则⑴上述反应中Z气体的计量数n的值是(
)
A.1
B.2
C.3
D.4
⑵上述反应在2min末时,已消耗的Y占原来的百分比是(
)
A.20%
B.25%
C.33%
D.50%
D
B
反应物的消耗量
转化率=
反应物的起始量
×100%
4、在4个不同的容器中,在不同的条件下进行合成氨反应,根据在相同时间内测定的结果判断,生成氨的速率最快的是(
)
A.V(H2)=
0.1
mol/(L·min)
B.V(N2)=
0.2
mol/(L·min)
C.V(NH3)=
0.15
mol/(L·min)
D.V(H2)=
0.3
mol/(L·min)
注:此类题均换算为同一物质的速率为标准比较
B
5、一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1molN2和3mol
H2,3min末测此容器内压强是起始时压强的0.9倍。在此时间内用
H2的量的变化来表示该反应的平均反应速率
是(??
)
A、0.2
mol/(L·min)
?
B、0.6
mol/(L·min)
C
、0.1
mol/(L·min)
???
D、0.1
mol/(L·min)
C
6、将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:
NH4Br(s)
NH3(g)+HBr(g),
2HBr(g)
Br2(g)+H2(g)
2min后,测知H2的浓度为0.5mol/L,HBr的浓度为4mol/L,若上述反应速率用V(NH3)表示,求V(NH3)
7、某温度时,在2
L容器中,X、Y、Z三种气体物质的物质的量随时间变化的曲线图,由图中数据分析,该反应的化学方程式为?反应开始至2
min,Z的平均反应速率?
V(Z)=
=
0.05
mol/(L?min)
由图知,2
min内X、Y、Z物质的量的变化为0.3
mol、0.1
mol、0.2
mol比值为3∶1∶2,可知
3
X
+
Y
2Z,
化学反应速率的微观原理
如何来研究一个反应,研究化学反应原理的
基本方法和思路是怎样?
即:我们从哪些方面来认识一个反应!
先认识几个概念:
1、有效碰撞
2、活化分子
3、活化能
4、催化剂
——概念模型法
有
效
碰
撞
1、什么是有效碰撞?
引起分子间的化学反应的碰撞
结论:
分子间的碰撞是发生化学反应的必要条件
而有效碰撞是发生化学反应的充分条件
推论:
某一化学反应的速率大小与
单位时间内有效碰撞的次数有关
为什么有的碰撞可以发生反应,
而有的不能发生反应?与哪些因
素有关系?
问题:
活
化
分
子
2、什么是活化分子?
具有较高能量,能够发生有效碰撞的分子
结论:
发生有效碰撞的分子一定是活化分子,
但活化分子的碰撞不一定是有效碰撞。
推论:
有效碰撞次数的多少与
单位体积内反应物中活化分子
的多少有关。
活化分子的多少又与什么有关?
问题:
活
化
能
3、什么是活化能?
活化分子高出反应物分子平均能量的部分
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应?
活化能与反应热有关吗?
反应热
结论:
活化分子的多少与该反应的活化能的大小有关,
活化能的大小是由反应物分子的性质决定,
内因
推论:
活化能越小则一般分子成为活化分子越容易,
则活化分子越多,
则单位时间内有效碰撞越多,
则反应速率越快。
对于“活化能的大小虽然意味着一般
分子成为活化分子的难易,但是却
对这个化学反应前后的能量变化并
不产生任何影响”这一句话如何理解?
问题1:
活化能为“0”的例子是怎么回事?
问题2、
归
纳
总
结
一个反应要发生一般要经历哪些过程?
普通
分子
活化
能
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
能量
解
释
问
题
1、为什么可燃物有氧气参与,还必
须达到着火点才能燃烧?
2、催化剂在我们技术改造和生产中
起关键作用,它主要作用是提高
化学反应速率,试想一下为什么
催化剂能提高反应速率?
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
没加催化剂
加了催化剂
