人教版九年级化学下册第八单元课题 2 金属的化学性质-流程推断题专练
文档属性
| 名称 | 人教版九年级化学下册第八单元课题 2 金属的化学性质-流程推断题专练 |
|
|
| 格式 | docx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-10 00:00:00 | ||
图片预览

文档简介
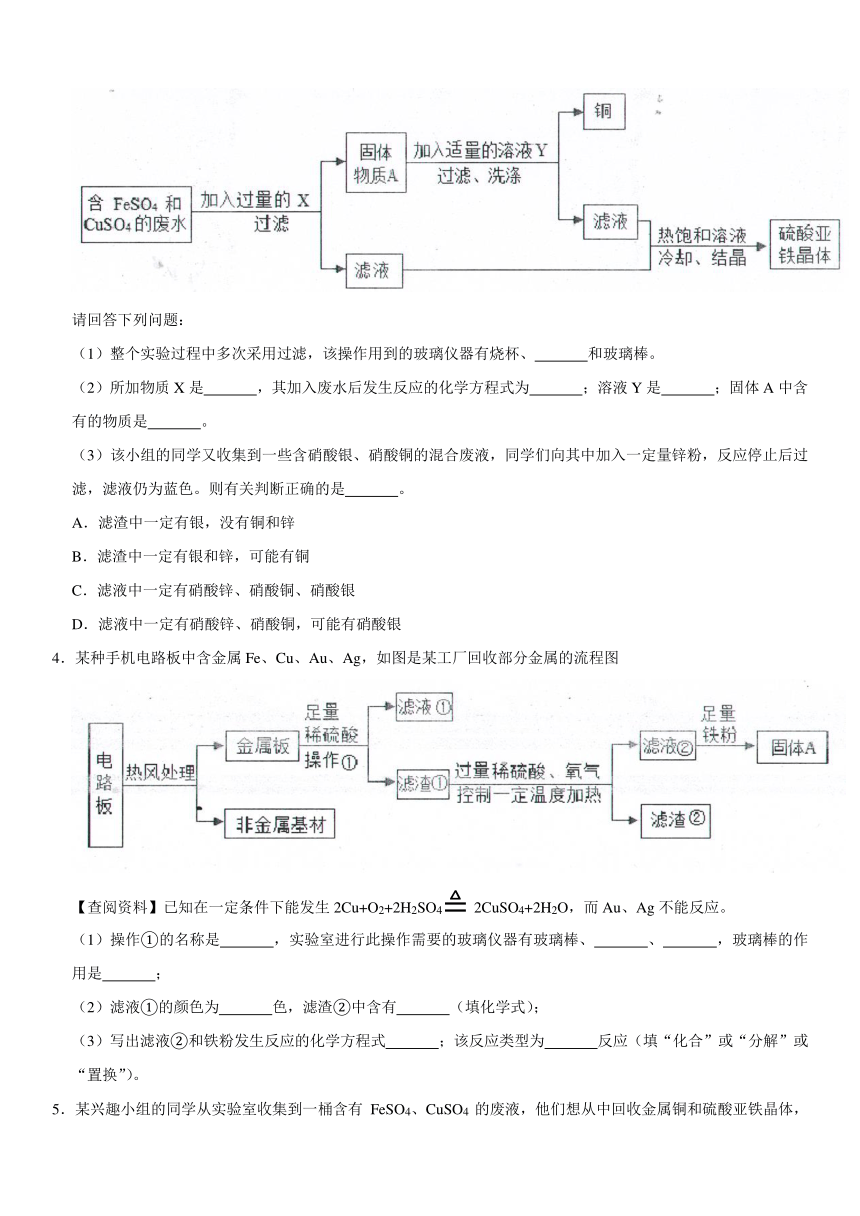
11645900107823001.实验室有100g废液,其中含有硫酸铜、硫酸亚铁、硫酸锌。现对废被进行处理得到铜和硫酸锌溶液,实验流程如图所示。
(1)步骤I、Ⅱ、Ⅲ中均包含的操作名称是 。
(2)步骤I反应的化学方程式 。
(3)当观察到 时,说明滤渣A中铁已经完全反应。
(4)步骤Ⅲ中加入的X是 。(填化学式)
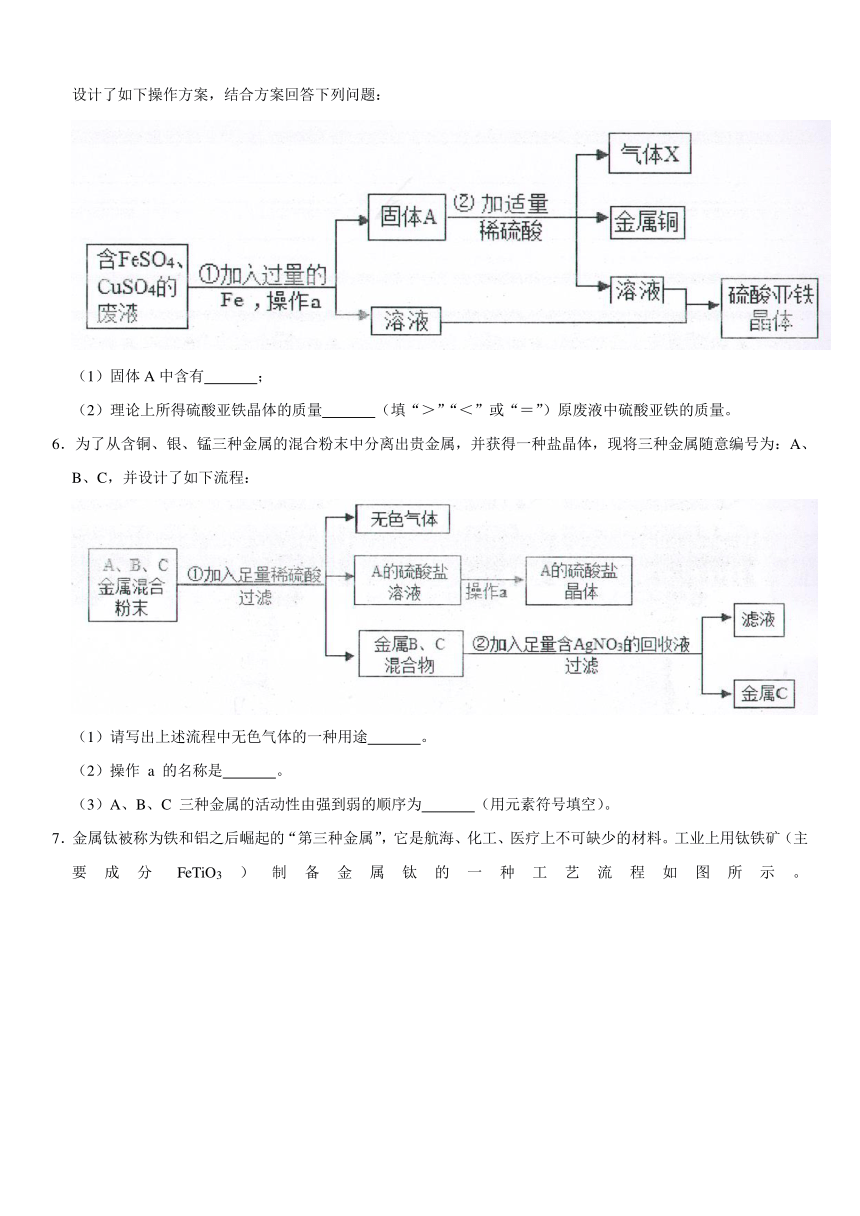
2.白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。已知溶液B中含有一种二价金属化合物,溶液D中也含有一种二价金属化合物。分析该流程,回答下列问题:
(1)过程Ⅰ、Ⅱ中的实验操作名称是 。
(2)固体C的化学式为 。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是 。
3.我区某校化学社团﹣“拉瓦锡实验室”的活动丰富多彩。他们以“绿色化学”为主题进行了如下活动。他们在实验室废液桶中收集了含有大量FeSO4、CuSO4的废水,为防止废水直接排放到下水道造成重金属污染和浪费。设计了如下回收硫酸亚铁晶体和铜的实验方案:
请回答下列问题:
(1)整个实验过程中多次采用过滤,该操作用到的玻璃仪器有烧杯、 和玻璃棒。
(2)所加物质X是 ,其加入废水后发生反应的化学方程式为 ;溶液Y是 ;固体A中含有的物质是 。
(3)该小组的同学又收集到一些含硝酸银、硝酸铜的混合废液,同学们向其中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色。则有关判断正确的是 。
A.滤渣中一定有银,没有铜和锌
B.滤渣中一定有银和锌,可能有铜
C.滤液中一定有硝酸锌、硝酸铜、硝酸银
D.滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
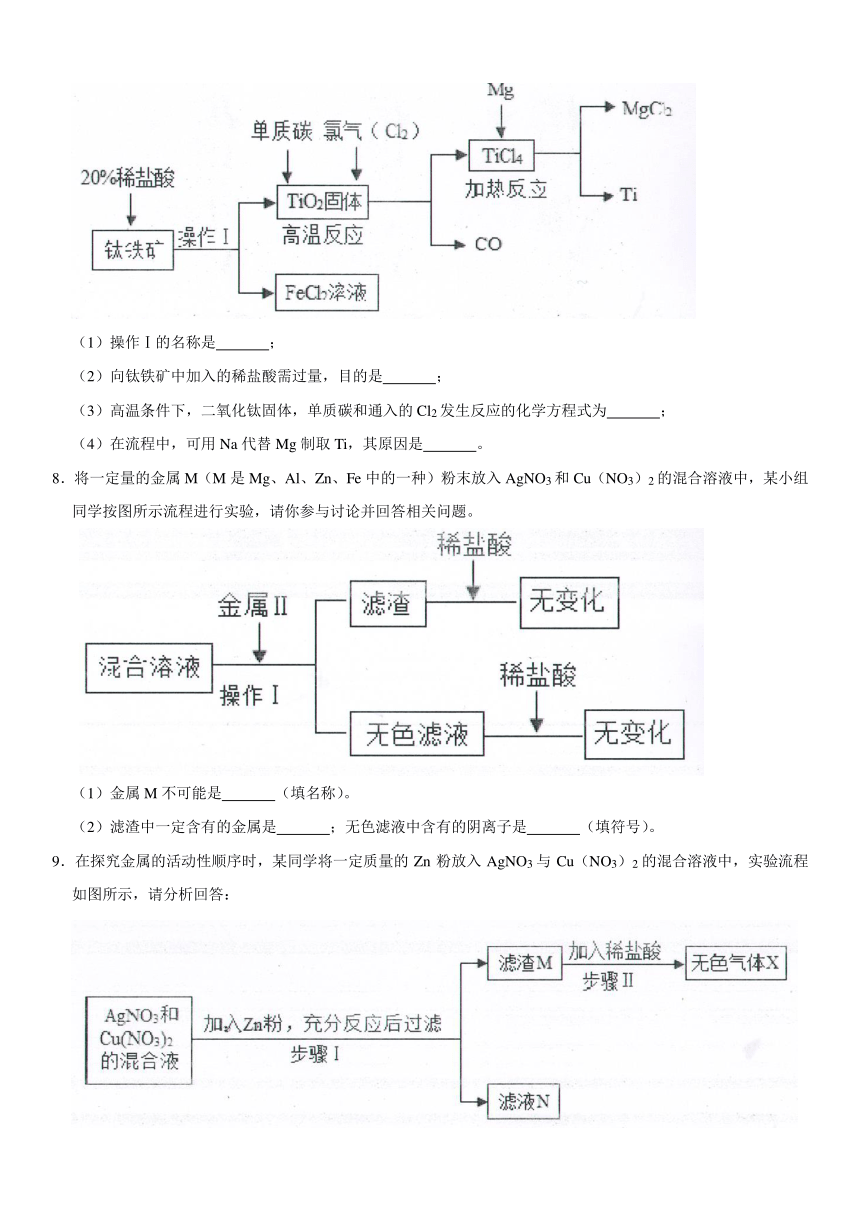
4.某种手机电路板中含金属Fe、Cu、Au、Ag,如图是某工厂回收部分金属的流程图
【查阅资料】已知在一定条件下能发生2Cu+O2+2H2SO4? 2CuSO4+2H2O,而Au、Ag不能反应。
(1)操作①的名称是 ,实验室进行此操作需要的玻璃仪器有玻璃棒、 、 ,玻璃棒的作用是 ;
(2)滤液①的颜色为 色,滤渣②中含有 (填化学式);
(3)写出滤液②和铁粉发生反应的化学方程式 ;该反应类型为 反应(填“化合”或“分解”或“置换”)。
5.某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:
(1)固体A中含有 ;
(2)理论上所得硫酸亚铁晶体的质量 (填“>”“<”或“=”)原废液中硫酸亚铁的质量。
6.为了从含铜、银、锰三种金属的混合粉末中分离出贵金属,并获得一种盐晶体,现将三种金属随意编号为:A、B、C,并设计了如下流程:
(1)请写出上述流程中无色气体的一种用途 。
(2)操作 a 的名称是 。
(3)A、B、C 三种金属的活动性由强到弱的顺序为 (用元素符号填空)。
7.金属钛被称为铁和铝之后崛起的“第三种金属”,它是航海、化工、医疗上不可缺少的材料。工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如图所示。
(1)操作Ⅰ的名称是 ;
(2)向钛铁矿中加入的稀盐酸需过量,目的是 ;
(3)高温条件下,二氧化钛固体,单质碳和通入的Cl2发生反应的化学方程式为 ;
(4)在流程中,可用Na代替Mg制取Ti,其原因是 。
8.将一定量的金属M(M是Mg、Al、Zn、Fe中的一种)粉末放入AgNO3和Cu(NO3)2的混合溶液中,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题。
(1)金属M不可能是 (填名称)。
(2)滤渣中一定含有的金属是 ;无色滤液中含有的阴离子是 (填符号)。
9.在探究金属的活动性顺序时,某同学将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,实验流程如图所示,请分析回答:
(1)步骤Ⅱ中生成的无色气体X是 ,该反应的基本反应类型是 。
(2)滤液N中的溶质是 ;生成该溶质的化学方程式 。
10.某工厂排出的废水中含有硝酸银,为了回收废水中的贵金属银,工厂进行了如下的操作。
(1)锌的金属活动性比银的金属活动性 (选填“强”或者“弱”),固体A的成分有 ,气体C的化学式是 。
(2)操作I、Ⅱ的名称是 ,该操作中需要用到的玻璃仪器有烧杯、漏斗和 。
(3)若往溶液D中加入适量的氧化锌,可得到只含有一种溶质的溶液,则发生反应的化学方程式为 。
11.用废弃的金属镁、铁、铜制取重要化工原料MgSO4的实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 ;在操作a中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式: 。
(4)实验步骤②中除选用稀硫酸外,还可选用下列试剂 (填序号)。
A.硫酸铜溶液 B.氯化钠溶液 C.硝酸银溶液
(5)小红要探究镁和铁与稀硫酸反应的快慢,不需要控制的量是 (填序号)。
A.两种金属的形状 B.硫酸的质量分数 C.反应容器的大小 D.反应的初始温度
12.某课外小组用废弃白铜(Cu、Ni)粉末分离得到Cu、Ni两种金属,其主要流程如下(部分反应产物在图中已略去):
已知:Ni与Fe化学性质相似,常见化合价为+2价。
(1)固体A的化学式是 ;
(2)Ⅱ中反应的化学方程式有: 、 ;
(3)Ⅱ中分离出固体C的操作名称是 ;
(4)由上述流程得出Cu、Ni、Zn的金属活动性由强到弱的顺序是 。
13.某种手机电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4?2CuSO4+2H2O
(1)操作①的名称是 。
(2)写出滤液②中金属阳离子符号 。
(3)滤渣①中含有的金属 。
(4)写出滤液①和铁粉发生反应的一个化学方程式 。
(5)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是 。
14.化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属.流程如下:
请回答:
(1)气体Q的化学式为: ;
(2)四种金属的活动性顺序由强到弱的是 ;
(3)固体丙中一定含有的金属是 ;
(4)写出③中反应的化学方程式 .
15.某工厂排放的废液中含有Zn(NO3)2和AgNO3,为回收金属Ag,设计了如图所示方案:
A是 ,B中含有 ,C是 。操作2是 。
16.某金属冶炼厂的管道烟泥中含有炭黑及少量金属铜和锌.某实验小组的同学设计了从管道烟泥中回收铜的实验方案,实验过程如图所示:
请回答:
(1)滤液B中的溶质是 ,无色气体C是 .
(2)制作过滤器时,滤纸润湿后应紧贴在漏斗内壁上,不留气泡,若有气泡,则导致的后果是 .
(3)写出步骤③的化学方程式 .
(4)步骤④中所加入的金属X和Zn的活动性顺序是Zn>X,则X可选 ;欲除去得到的不纯的铜中的杂质,可选用的试剂有 (填一种).
参考答案
过滤;Fe+CuSO4═FeSO4+Cu;气泡不再产生;Zn;
2.过滤;Ni;Zn>Ni>Cu;
3.漏斗;Fe;Fe+CuSO4=FeSO4+Cu;稀硫酸;Cu、Fe;D;
4.过滤;烧杯;漏斗;引流;浅绿;Ag、Au;Fe+CuSO4=Cu+FeSO4;置换;
5.铁、铜;>;
6.填充探空气球;蒸发结晶;Mn、Cu、Ag;
高温
7.过滤;使钛铁矿完全反应;TiO2+2C+2Cl2==TiCl4+2CO;钠比镁活泼;
8.铁;银、铜;NO3﹣;
9.氢气;置换反应;硝酸锌;Zn+2AgNO3═Zn(NO3)2+2Ag、Zn+Cu(NO3)2=Zn(NO3)2+Cu;
10.强;银、锌;H2;过滤;玻璃棒;ZnO+H2SO4═ZnSO4+H2O;
11.铁;铜;过滤;引流;Mg+H2SO4═MgSO4+H2↑;A;C;
12.Cu;Zn+H2SO4═ZnSO4+H2↑;Zn+NiSO4═ZnSO4+Ni;过滤;Zn、Ni、Cu;
13.过滤;Fe2+;Cu、Ag;Fe+NiSO4═FeSO4+Ni或Fe+H2SO4═FeSO4+H2↑;Ni、Cu、Ag;
14.H2;Zn、X、Cu、Ag;Ag;Cu+2AgNO3=Cu(NO3)2+2Ag;
15.Zn;Zn(NO3)2;H2SO4;过滤;
16.硫酸锌、硫酸;二氧化碳;过滤的速率慢;CuO+H2SO4═CuSO4+H2O;铁;磁铁;
(1)步骤I、Ⅱ、Ⅲ中均包含的操作名称是 。
(2)步骤I反应的化学方程式 。
(3)当观察到 时,说明滤渣A中铁已经完全反应。
(4)步骤Ⅲ中加入的X是 。(填化学式)
2.白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。已知溶液B中含有一种二价金属化合物,溶液D中也含有一种二价金属化合物。分析该流程,回答下列问题:
(1)过程Ⅰ、Ⅱ中的实验操作名称是 。
(2)固体C的化学式为 。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是 。
3.我区某校化学社团﹣“拉瓦锡实验室”的活动丰富多彩。他们以“绿色化学”为主题进行了如下活动。他们在实验室废液桶中收集了含有大量FeSO4、CuSO4的废水,为防止废水直接排放到下水道造成重金属污染和浪费。设计了如下回收硫酸亚铁晶体和铜的实验方案:
请回答下列问题:
(1)整个实验过程中多次采用过滤,该操作用到的玻璃仪器有烧杯、 和玻璃棒。
(2)所加物质X是 ,其加入废水后发生反应的化学方程式为 ;溶液Y是 ;固体A中含有的物质是 。
(3)该小组的同学又收集到一些含硝酸银、硝酸铜的混合废液,同学们向其中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色。则有关判断正确的是 。
A.滤渣中一定有银,没有铜和锌
B.滤渣中一定有银和锌,可能有铜
C.滤液中一定有硝酸锌、硝酸铜、硝酸银
D.滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
4.某种手机电路板中含金属Fe、Cu、Au、Ag,如图是某工厂回收部分金属的流程图
【查阅资料】已知在一定条件下能发生2Cu+O2+2H2SO4? 2CuSO4+2H2O,而Au、Ag不能反应。
(1)操作①的名称是 ,实验室进行此操作需要的玻璃仪器有玻璃棒、 、 ,玻璃棒的作用是 ;
(2)滤液①的颜色为 色,滤渣②中含有 (填化学式);
(3)写出滤液②和铁粉发生反应的化学方程式 ;该反应类型为 反应(填“化合”或“分解”或“置换”)。
5.某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案,结合方案回答下列问题:
(1)固体A中含有 ;
(2)理论上所得硫酸亚铁晶体的质量 (填“>”“<”或“=”)原废液中硫酸亚铁的质量。
6.为了从含铜、银、锰三种金属的混合粉末中分离出贵金属,并获得一种盐晶体,现将三种金属随意编号为:A、B、C,并设计了如下流程:
(1)请写出上述流程中无色气体的一种用途 。
(2)操作 a 的名称是 。
(3)A、B、C 三种金属的活动性由强到弱的顺序为 (用元素符号填空)。
7.金属钛被称为铁和铝之后崛起的“第三种金属”,它是航海、化工、医疗上不可缺少的材料。工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如图所示。
(1)操作Ⅰ的名称是 ;
(2)向钛铁矿中加入的稀盐酸需过量,目的是 ;
(3)高温条件下,二氧化钛固体,单质碳和通入的Cl2发生反应的化学方程式为 ;
(4)在流程中,可用Na代替Mg制取Ti,其原因是 。
8.将一定量的金属M(M是Mg、Al、Zn、Fe中的一种)粉末放入AgNO3和Cu(NO3)2的混合溶液中,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题。
(1)金属M不可能是 (填名称)。
(2)滤渣中一定含有的金属是 ;无色滤液中含有的阴离子是 (填符号)。
9.在探究金属的活动性顺序时,某同学将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,实验流程如图所示,请分析回答:
(1)步骤Ⅱ中生成的无色气体X是 ,该反应的基本反应类型是 。
(2)滤液N中的溶质是 ;生成该溶质的化学方程式 。
10.某工厂排出的废水中含有硝酸银,为了回收废水中的贵金属银,工厂进行了如下的操作。
(1)锌的金属活动性比银的金属活动性 (选填“强”或者“弱”),固体A的成分有 ,气体C的化学式是 。
(2)操作I、Ⅱ的名称是 ,该操作中需要用到的玻璃仪器有烧杯、漏斗和 。
(3)若往溶液D中加入适量的氧化锌,可得到只含有一种溶质的溶液,则发生反应的化学方程式为 。
11.用废弃的金属镁、铁、铜制取重要化工原料MgSO4的实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 ;在操作a中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式: 。
(4)实验步骤②中除选用稀硫酸外,还可选用下列试剂 (填序号)。
A.硫酸铜溶液 B.氯化钠溶液 C.硝酸银溶液
(5)小红要探究镁和铁与稀硫酸反应的快慢,不需要控制的量是 (填序号)。
A.两种金属的形状 B.硫酸的质量分数 C.反应容器的大小 D.反应的初始温度
12.某课外小组用废弃白铜(Cu、Ni)粉末分离得到Cu、Ni两种金属,其主要流程如下(部分反应产物在图中已略去):
已知:Ni与Fe化学性质相似,常见化合价为+2价。
(1)固体A的化学式是 ;
(2)Ⅱ中反应的化学方程式有: 、 ;
(3)Ⅱ中分离出固体C的操作名称是 ;
(4)由上述流程得出Cu、Ni、Zn的金属活动性由强到弱的顺序是 。
13.某种手机电路板中含有Fe、Cu、Ag、Ni(镍,银白色金属)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4?2CuSO4+2H2O
(1)操作①的名称是 。
(2)写出滤液②中金属阳离子符号 。
(3)滤渣①中含有的金属 。
(4)写出滤液①和铁粉发生反应的一个化学方程式 。
(5)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是 。
14.化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属.流程如下:
请回答:
(1)气体Q的化学式为: ;
(2)四种金属的活动性顺序由强到弱的是 ;
(3)固体丙中一定含有的金属是 ;
(4)写出③中反应的化学方程式 .
15.某工厂排放的废液中含有Zn(NO3)2和AgNO3,为回收金属Ag,设计了如图所示方案:
A是 ,B中含有 ,C是 。操作2是 。
16.某金属冶炼厂的管道烟泥中含有炭黑及少量金属铜和锌.某实验小组的同学设计了从管道烟泥中回收铜的实验方案,实验过程如图所示:
请回答:
(1)滤液B中的溶质是 ,无色气体C是 .
(2)制作过滤器时,滤纸润湿后应紧贴在漏斗内壁上,不留气泡,若有气泡,则导致的后果是 .
(3)写出步骤③的化学方程式 .
(4)步骤④中所加入的金属X和Zn的活动性顺序是Zn>X,则X可选 ;欲除去得到的不纯的铜中的杂质,可选用的试剂有 (填一种).
参考答案
过滤;Fe+CuSO4═FeSO4+Cu;气泡不再产生;Zn;
2.过滤;Ni;Zn>Ni>Cu;
3.漏斗;Fe;Fe+CuSO4=FeSO4+Cu;稀硫酸;Cu、Fe;D;
4.过滤;烧杯;漏斗;引流;浅绿;Ag、Au;Fe+CuSO4=Cu+FeSO4;置换;
5.铁、铜;>;
6.填充探空气球;蒸发结晶;Mn、Cu、Ag;
高温
7.过滤;使钛铁矿完全反应;TiO2+2C+2Cl2==TiCl4+2CO;钠比镁活泼;
8.铁;银、铜;NO3﹣;
9.氢气;置换反应;硝酸锌;Zn+2AgNO3═Zn(NO3)2+2Ag、Zn+Cu(NO3)2=Zn(NO3)2+Cu;
10.强;银、锌;H2;过滤;玻璃棒;ZnO+H2SO4═ZnSO4+H2O;
11.铁;铜;过滤;引流;Mg+H2SO4═MgSO4+H2↑;A;C;
12.Cu;Zn+H2SO4═ZnSO4+H2↑;Zn+NiSO4═ZnSO4+Ni;过滤;Zn、Ni、Cu;
13.过滤;Fe2+;Cu、Ag;Fe+NiSO4═FeSO4+Ni或Fe+H2SO4═FeSO4+H2↑;Ni、Cu、Ag;
14.H2;Zn、X、Cu、Ag;Ag;Cu+2AgNO3=Cu(NO3)2+2Ag;
15.Zn;Zn(NO3)2;H2SO4;过滤;
16.硫酸锌、硫酸;二氧化碳;过滤的速率慢;CuO+H2SO4═CuSO4+H2O;铁;磁铁;
同课章节目录
