高中化学鲁教版必修2第二章第一节化学键与物质构成练习题
文档属性
| 名称 | 高中化学鲁教版必修2第二章第一节化学键与物质构成练习题 |

|
|
| 格式 | zip | ||
| 文件大小 | 87.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-10 00:00:00 | ||
图片预览




文档简介
高中化学鲁教版必修2第二章第一节化学键与物质构成练习题
一、单选题
表中物质与其所含化学键类型、所属化合物类型完全对应的一组是
选项
A
B
C
D
物质
HCl
NaOH
化学键类型
共价键
离子键、共价键
离子键
离子键、共价键
化合物类型
共价化合物
离子化合物
离子化合物
共价化合物
A.
A
B.
B
C.
C
D.
D
下列有关化学键的说法中正确的是?
?
?
?
A.
碘晶体升华和冰熔化时都涉及化学键的变化
B.
氯化钠熔化或氯化氢溶于水时都要破坏化学键
C.
离子化合物中可能含有共价键,共价化合物中可能含有离子键
D.
氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
下列关于化学键的叙述中,正确的是
A.
氢键是一种特殊的共价键
B.
离子化合物中可能含有共价键
C.
的挥发破坏了共价键
D.
非极性键只能存在双原子单质中
下列说法中正确的是
离子化合物中一定有离子键,一定没有共价键
固体中阳离子和阴离子的个数比是
共价化合物中不含离子键,一定只含共价键
稳定性:,沸点:
和HCl溶于水破坏相同的作用力
非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.
B.
C.
D.
有共价键的离子化合物是
A.
B.
NaOH
C.
D.
下列物质中,属于共价化合物的是
A.
B.
C.
D.
下列各组物质中化学键的类型完全相同的是
A.
HCl和
B.
?和
C.
和NaOH
D.
和
下列物质中既含有离子键又含有共价键的是?
A.
KOH
B.
C.
CaO
D.
下列说法不正确的是
A.
离子化合物不可能含共价键
B.
是共价化合物
C.
只由非金属元素形成的化合物也可能是离子化合物
D.
稀有气体分子中不存在化学键
实验室利用固体和固体反应制氨气,反应方程式为:,下列关于该反应的说法错误的是?
?
A.
中存在离子键和极性键
B.
此反应过程中既有离子键、极性键断裂,也有离子键和极性键形成
C.
含“”键,含“”键
D.
像、这样含金属元素的化合物一定属于离子化合物
下列关于化学键的叙述中正确的是
A.
离子化合物可能含有共价键,共价化合物不可能含有离子键
B.
单质分子中均含共价键
C.
仅由非金属元素形成的化合物中不可能有离子键
D.
由不同元素形成的多原子分子中,一定只存在极性键
下列含有非极性键的共价化合物是
A.
B.
C.
D.
二、多选题
a为乙二胺四乙酸,易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.
a和b中的N原子均为杂化
B.
b中的配位数为6
C.
a属于高分子化合物
D.
b含有共价键、离子键和配位键
偏二甲肼为价与是常用的火箭推进剂,发生的化学反应如下:
?
,下列说法不正确的是???
A.
该反应在任何情况下都不能自发进行
B.
含有共价键
C.
该反应的氧化产物为,还原产物为
D.
反应中生成时,转移
下列说法正确的是
A.
每一个化学反应都会伴随着能量变化
B.
氯化氢溶于水氢氯共价键被破坏
C.
化学键的断裂和形成是化学反应能量变化的主要原因
D.
离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物
下列物质中,既有离子键又有共价键的是
A.
B.
KOH
C.
D.
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.
NaCl?和HCl
B.
?和
C.
和
D.
NaOH?和
三、填空题
按照要求用序号回答下列问题:
下列各种物质:?
?
?
?
?
,不存在化学键的是________;只存在离子键的是________;属于共价化合物的是________;含非极性键的离子化合物是________。
下列变化过程:碘的升华?
固体溶于水?
溶于水?
气体溶于水?
烧碱熔化?
氯化铵受热分解,化学键没有被破坏的是________;仅破坏离子键的是________;仅破坏共价键的是________。
下面是我们熟悉的物质:??金刚石???????????
这些物质中,只含共价键的是______;只含离子键的是______;既含共价键又含离子键的是______;不存在化学键的是______填序号
属于共价化合物的是______;属于离子化合物的是______填序号
将溶于水,破坏中的______键,写出其电离方程式______;熔融状态下电离,破坏了______键,写出电离方程式______.
对于HCl、、NaOH、NaCl、、Ne、、金刚石,回答下列问题:
不存在化学键的是______.
属于共价化合物的是______、______.
属于离子化合物的是______、______、______.
既含离子键,又含共价键的是______.
四、流程题
由钛精矿主要成分为制备钛的工艺流程示意图如下:
回答下列问题:
元素在周期表中的位置是______________。
钛精矿、焦炭和氯气高温反应制取粗过程中产生CO和,若产生CO和
物质的量之比为,则该步反应的化学方程式为_________________________。
实验室进行蒸馏提纯时所用的玻璃仪器有蒸馏烧瓶、酒精灯、牛角管、锥形瓶、_________、_________。______
用金属镁还原过程中需要保护气,下列气体可作为保护气的是___________。
??????????
????????
有同学认为用金属镁制取钛生产成本较高,若采用电解的方法制取金属钛可降低生产成本。你是否认同该同学的设想?___填“是”或“否”。你的理由是________。
五、实验题
某兴趣小组拟制备氯气及验证其性质并比较氯、溴、碘的非金属性强弱。
Ⅰ查阅资料当溴水浓度较小时,溶液颜色与氯水相似,也呈黄色。
硫代硫酸钠溶液在工业上可作脱氯剂。
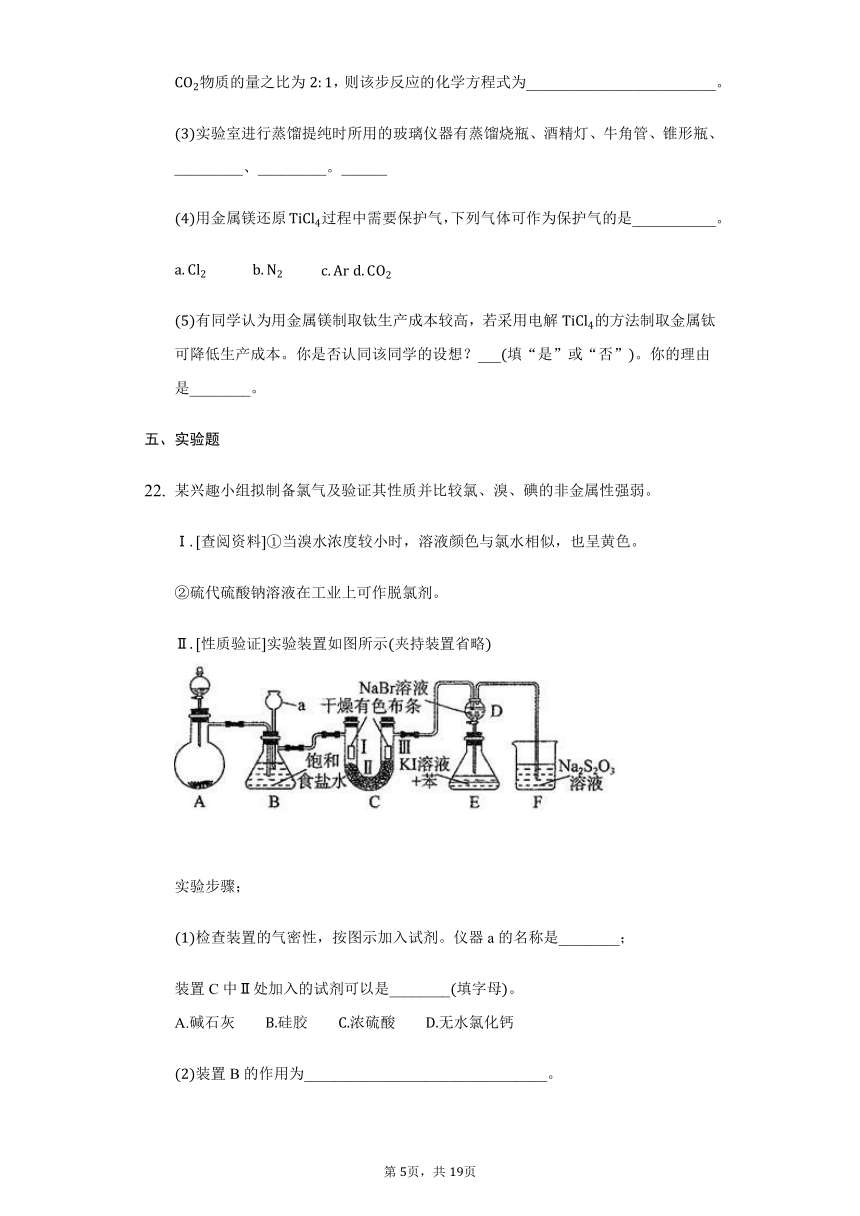
Ⅱ性质验证实验装置如图所示夹持装置省略
实验步骤;
检查装置的气密性,按图示加入试剂。仪器a的名称是________;
装置C中Ⅱ处加入的试剂可以是________填字母。
A.碱石灰???
???硅胶?????
?浓硫酸?????
?无水氯化钙
装置B的作用为________________________________。
的电子式为________;硫代硫酸钠中所含的化学键类型为________________;写出装置F中反应的离子方程式____________________________中的S元素被氧化成最高价。
Ⅲ探究与反思
图中设计装置D、E的目的是比较氯、溴、碘的非金属性强弱,有同学认为该设计不能达到实验目的,其理由是___________________________________。该组同学思考后将上述D、E、F装置改为下图装置,实验操作步骤如下:
打开弹簧夹,缓缓通入氯气。
当a和b中的溶液都变为黄色时,夹紧弹簧夹。
当a中溶液由黄色变为棕色时,停止通氯气。
步骤的操作是________________________________________________。
六、计算题
我国已经成功研制出了碱金属的球碳盐实验测知该物质在熔融状态下可以导电,而且在超临界温度18K时具有超导性.
你猜测一下中含有什么样的化学键?
含有的离子数目为多少?
中的俗称足球烯,分子结构酷似足球,由12个正五边形与20个正六边形构成,碳碳键长介于碳碳单键与双键之间,你能推测一下其中碳的杂化方式吗?
答案和解析
1.【答案】A
【解析】
【分析】
本题考查化学键、化合物的类型,明确元素之间的成键原因、化学键与化合物的关系是解答本题的关键,难度不大。
【解答】
A.中只含共价键,碳原子和氧原子之间存在共价键,属于共价化合物,故A正确;
B.中只含离子键,镁离子与氯离子中存在离子键,属于离子化合物,故B错误;
C.HCl中只含共价键,氢原子和氯原子之间存在共价键,属于共价化合物,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,属于离子化合物,故D错误;
故选:A。
2.【答案】B
【解析】
【分析】
本题考查化学键,为高频考点,把握化学变化及电离过程中化学键变化、物质的三态变化为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大。
【解答】
A.碘晶体升华和冰熔化均为物理变化,化学键不变,只破坏分子间作用力,故A错误;
B.氯化钠熔化或氯化氢溶于水,均发生电离,前者破坏离子键,后者破坏共价键,故B正确;
C.含离子键的一定为离子化合物,则共价化合物中一定不含离子键,故C错误;
D.氯化铵受热变成气体,发生化学变化生成氨气、HCl,后氨气与HCl发生化合反应生成氯化铵,发生化学键的断裂和生成,故D错误;
故选B。
3.【答案】B
【解析】
【分析】本题考查了化学键的判断、化合物类型的判断、氢键,根据离子键、共价键和离子化合物的概念来分析解答即可,题目难度不大。
【解答】氢键属于分子间作用力,不是共价键,故A错误;
B.离子化合物一定含有离子键,可能含有共价键,如过氧化钠中既含离子键又含共价键,故B正确;
C.的挥发破坏了分子间作用力,共价键没有被破坏,故C错误;
D.同种非金属原子间形成非极性键,化合物中也可能含有非极性键,如过氧化氢中含有非极性键,故D错误;
故选:B。
4.【答案】C
【解析】
【分析】
本题考查了物质与化学键的关系,难度不大,注意:不是所有物质都含化学键,如稀有气体中不存在化学键,只存在分子间作用力。
【解答】
离子化合物中一定有离子键,可能有共价键,如NaOH含离子键及共价键,故错误;
固体中阳离子是钠离子和阴离子是硫酸氢根离子,阳离子和阴离子的个数比是1:1,故正确;
共价化合物只含共价键,不含有离子键,故正确;
非金属性越强,稳定性越强,氧的非金属性强于硫,所以稳定性;水分子间含氢键,所以沸点,故错误;
溶于水破坏离子键,HCl溶于水破坏共价键,所以破坏不同的作用力,故错误;
离子化合物中可能含有非极性键,如中含有非极性键,共价化合物过氧化氢中含有非极性键,故正确;
故选C。
5.【答案】B
【解析】
【分析】
本题旨在考查学生对离子化合物、共价键等应用。侧重学生对概念的理解,难度不大。
【解答】
A.是单质不是化合物,故A错误;
B.NaOH是离子化合物,氧和氢之间形成的是共价键,故B正确;
C.二氧化硅只存在硅氧极性键,不存在离子键,故C错误;
D.是共价化合物,不是离子化合物,故D错误。
故选B。
6.【答案】C
【解析】【解析】
本题考查了化学键和化合物的关系,明确离子化合物和共价键化合物的概念是解本题关键,一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物,注意:并不是所有的物质中都含有化学键,稀有气体中不含化学键,为易错点。
【解答】
A.中只含离子键,为离子化合物,故A错误;
B.含有离子键和共价键,属于离子化合物,故B错误;
C.硫酸分子中只含共价键,是共价化合物,故C正确;
D.中既含离子键又含共价键,为离子化合物,故D错误。
故选C。
7.【答案】D
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大。
【解答】
一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答。
A.HCl只含极性键,只含离子键,故A不选;
B.只含离子键,只含极性键,故B不选;
C.只含离子键,NaOH含离子键、极性键,故C不选;
D.和均含极性键,故D选;
故选:D。
8.【答案】A
【解析】
【分析】
本题考查区分离子化合物和共价化合物的方法,以及判断离子键和共价键的方法,比较基础,要求对基本概念和基本理论有清晰的理解。
【解答】
A.KOH是离子化合物,其中含有离子键,氢氧之间形成共价键,即氢氧化钾中含有离子键和共价键,故A正确;
B.中含碳氧两种元素,属于共价化合物,只含共价键,故B错误;
C.CaO由活泼金属Ca元素和活泼非金属O元素组成,形成的是离子化合物,只含离子键,故C错误;
D.为双原子分子,只含共价键,故D错误。
故选A。
9.【答案】A
【解析】
【分析】
本题考查了化合物和化学键的关系,根据物质中存在的化学键确定化合物类型,注意离子化合物和共价化合物概念的区别,题目难度不大。
【解答】
A.离子化合物中可能含有共价键,如KOH,故A错误;
B.是共价化合物,故B正确;
C.只由非金属元素形成的化合物也可能是离子化合物,如,故B正确;??
D.稀有气体是单原子分子,则分子中不存在化学键,故D正确;
故选A。
10.【答案】D
【解析】
【分析】
本题考查化学键相关知识点,需能正确判断化学键的类型、掌握离子化合物的定义,题目难度不大。
【解答】
A.铵根离子和氯离子之间存在离子键、原子之间存在极性键,故A正确;
B.此反应过程中既有铵根离子和氯离子之间的离子键、原子之间的极性键断裂,也有钙离子和氯离子之间的离子键和原子之间极性键形成,故B正确;
C.氢氧化钙中氧原子与氢原子之间形成共价键,则含2mol“”极性键;氨气分子中氮原子与氢原子形成共价键,含3mol“”极性键,故C正确;
D.含金属元素的化合物不一定属于离子化合物,如属于共价化合物,故D错误;
故选D。
11.【答案】A
【解析】
【分析】
本题主要考查的是共价键和离子键形成和判断,题目难度不大,掌握构成离子键、共价键的元素的特点和理解离子化合物、共价化合物的概念是解题的关键。
【解答】
A.离子化合物可能含有共价键,如、等,共价化合物只含共价键,不可能含有离子键,A正确;
B.稀有气体单质分子中不含任何化学键,B错误;
C.常见的铵盐都是仅由非金属元素形成的化合物,含有离子键,C错误;
D.是由不同元素形成的多原子分子,其中含有非极性键,D错误。
故选A。
12.【答案】C
【解析】
【分析】
本题考查了化学键和化合物的关系,难度不大,注意:离子化合物中可能含有共价键,但共价化合物中一定不含离子键。
【解答】
A、中只含极性共价键,故A错误;
B、氯气是单质,故B错误;
C、中含有极性键和非极性键,属于含有非极性键的共价化合物,故C正确;
D、中含有离子键和非极性键,属于含有非极性键的离子化合物,故D错误;
故选:C。
13.【答案】AB
【解析】
【分析】
本题考查配合物成键情况与杂化方式判断,注意b为配离子,内界没有离子键,难度不大。
【解答】
A.a中N原子形成3个键、含有1对孤对电子,而b中N原子形成4个键、没有孤对电子,N原子杂化轨道数目均为4,N原子均采取杂化,故A正确;
B.b为配离子,钙离子与N、O原子之间形成配位键,b中的配位数为6,故B正确;
C.虽然乙二胺四乙酸的分子比较大,但仍未进入高分子的相对分子质量的范围,所以叶绿素乙二胺四乙酸不属于高分子化合物,故C错误;
D.b为配离子,钙离子与N、O原子之间形成配位键,其它原子之间形成共价键,不含离子键,故D错误。
14.【答案】AC
【解析】
【分析】
本题考查氧化还原反应、共价键及其反应自发判断等,侧重于学生的分析能力的考查,注意把握氧化还原反应中元素化合价的变化,难度不大。
【解答】
A.反应中,,,所以在任何情况下,都能自发进行,故A错误;
B.根据的结构式,含有11mol共价键,故B正确;
C.反应中中N元素的化合价由价降低为0价,偏二甲肼中N元素的化合价由价升高为0价,中C元素的化合价有价升高为价,所以氧化产物为和,还原产物为,故C错误;
D.反应中中N元素的化合价由价降低0价,所以反应共转移,生成,则生成1mol?时,转移8?mol?,故D正确。
15.【答案】ABC
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断是为解答的关键,并注意利用实例来分析解答,侧重分析与应用能力的考查,题目难度不大。
【解答】
A.因为化学反应的本质为旧键的断裂和新键的形成,化学键断裂吸收能量,生成化学键释放能量,所以化学反应都会伴随着能量变化,故A正确;
B.氯化氢溶于水,发生电离,共价键破坏,故B正确;
C.化学键断裂吸收能量,生成化学键释放能量,化学反应的实质为化学键的断裂和形成,则化学键的断裂和形成是化学反应能量变化的主要原因,故C正确;
D.铵盐为离子化合物,但不含金属元素,氯化铝含金属元素为共价化合物,故D错误;
故选:ABC。
16.【答案】BD
【解析】
【分析】
本题考查了离子键和共价键的判断,根据物质的构成微粒及微粒间作用力分析解答,注意二者区别,铵盐中存在离子键,且铵根离子中存在配位键,配位键属于共价键。
【解答】
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐和金属氧化物中含有离子键,多原子非金属单质、酸、部分非金属氧化物、部分碱、部分盐中含有共价键。
A.氯化钙中钙离子和氯离子之间存在离子键,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键,O原子和H原子之间存在共价键,故B正确;
C.水分子中H原子和O原子之间只存在共价键,故C错误;
D.氟化铵中铵根离子和氟离子之间存在离子键、N原子和H原子之间存在共价键,故D正确。
故选BD。
17.【答案】CD
【解析】
【分析】
本题考查物质结构知识,较为基础。侧重考查物质中所含化学键类型以及晶体类型相关知识,掌握成键类型是解答关键。
【解答】
A.NaCl含离子键,为离子晶体;HCl含共价键,为分子晶体,故A错误;
B.含共价键,为分子晶体;含共价键,为原子晶体,故B错误;
C.和都含共价键,都为分子晶体,故C正确;
D.NaOH和都含共价键,离子键,都为离子晶体,故D正确。
故选CD。
18.【答案】;;;?
;;
【解析】
【分析】本题考查了化学键的相关知识,试题难度较易。
【解答】
水分子中含有极性共价键,
氨气分子中含有极性共价键,
中含有离子键和极性共价键,
过氧化钠中含有离子键和非极性共价键,
氯化镁中含有离子键,
稀有气体单质为单原子分子,不存在化学键。
所以不存在化学键的是Ne;只存在离子键的是氯化镁;全部由共价键形成的化合物是共价化合物,则属于共价化合物的是水和氨气;含非极性键的离子化合物是过氧化钠。
碘的升华是物理变化,化学键没有被破坏;
固体溶于水电离出阴离子和阳离子,离子键被破坏;
溶于水是物理变化,化学键没有被破坏;
气体溶于水电离出阴离子和阳离子,共价键被破坏;
烧碱熔化电离出阴离子和阳离子,离子键被破坏;
氯化铵受热分解发生化学变化,生成氨气和氯化氢,离子键和共价键均被破坏,
则化学键没有被破坏的是和;仅破坏离子键的是和;仅破坏共价键的是。
19.【答案】;;
;;?
?
;;?
?
离子键和共价;
;
?
离子;?
?
【解析】
【分析】
本题考查了物质和化学键的关系,为高频考点,根据物质的构成微粒确定化学键,知道离子键和共价键的区别,注意稀有气体中不存在化学键为易错点,题目难度不大.
【解答】
中O原子之间只存在非极性共价键,为单质;
金刚石中碳原子之间只存在非极性共价键;
中钠离子和溴离子之间只存在离子键,为离子化合物;
中S原子和O原子、O原子和H原子之间存在极性共价键,为共价化合物;
中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,为离子化合物;
中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
中钠离子和硫酸氢根离子之间存在离子键、S原子和O原子之间存在共价键,为离子化合物;
中不存在化学键;
中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,为离子化合物;
中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
只含有共价键的是;只含有离子键的是;既含共价键又含离子键的是,不存在化学键的是;
故答案为:;;;;
只含共价键的化合物是共价化合物,属于共价化合物的是,含有离子键的化合物是离子化合物,为,
故答案为:;;
是强酸强碱酸式盐,属强电解质,完全电离,电离出钠离子、氢离子和硫酸根离子,离子方程式为,所以破坏了中的离子键和共价键,在熔融状态下电离,破坏了离子键,电离方程式为,
故答案为:离子键和共价;;离子;.
20.【答案】
;
;NaCl;
、NaOH。
【解析】
【分析】
本题考查了化学键和化合物的判断,根据物质的构成微粒及微粒间的作用力来分析解答,题目难度不大。
【解答】
一般活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;稀有气体为单原子分子,不存在化学键。
稀有气体为单原子分子,不存在化学键,则不存在化学键的是Ne;
故答案为:Ne;
非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,则属于共价化合物的是HCl、;
故答案为:HCl、;
一般活泼金属和活泼非金属元素之间易形成离子键,铵盐中存在离子键,则属于离子化合物的是NaOH、NaCl、;
故答案为:NaOH、NaCl、;
氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,N元素与H元素之间存在共价键,则氢氧化钠与既含离子键又含共价键。
故答案为:、NaOH。
21.【答案】第四周期ⅣB族;
;
温度计、冷凝管;
;
否;是共价化合物,熔融态不导电。
【解析】
【分析】
本题主要考查的是制备钛的工艺流程,意在考查学生的分析能力和知识应用能力,解题时根据原料的成分和所加试剂、操作方法判断各步骤操作的作用和涉及的反应。
【解答】
元素在周期表中的位置是第四周期ⅣB族;
故答案为:第四周期ⅣB族;
由题干信息可知,该步反应的反应物是、焦炭和氯气,生成物是、CO、,其中CO和在方程式中的计量系数之比为,则该步反应的化学方程式为;
故答案为:;
实验室进行蒸馏提纯时所用的玻璃仪器有蒸馏烧瓶、酒精灯、牛角管、锥形瓶、温度计、冷凝管;
故答案为:温度计、冷凝管;
镁是活泼金属,高温条件下能与、、反应,则用金属镁还原过程中需要用惰性气体作保护气,故c正确,
故答案为:c;
该同学提出的设想不能实现,因为是共价化合物,熔融态不导电。
故答案为:否;是共价化合物,熔融态不导电。
22.【答案】长颈漏斗;BD;
除去氯气中的氯化氢并作安全瓶;
??
;共价键、离子键;?;
未排除对溴、碘的非金属性的强弱实验的干扰?;
打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c振荡?。
【解析】
【分析】
本题考查氯气的制备实验及性质实验,为高频考点,把握实验装置的作用、物质的性质及非金属性比较的方法为解答的关键,侧重分析与实验能力的考查,注意实验中对比方法及干扰因素的分析,题目难度中等。
【解答】
Ⅱ仪器a的名称是长颈漏斗;装置CⅡ处加的试剂干燥氯气,且为固体,A可以吸收氯气无法进行实验,只有BD符合,故答案为:长颈漏斗;BD;
生成的氯气中混有HCl,则装置B的作用是除去氯气中的氯化氢并作安全瓶,
故答案为:除去氯气中的氯化氢并作安全瓶;
为离子化合物,电子式为;中S与O之间存在共价键,钠离子与硫代硫酸根离子之间存在离子键,所以硫代硫酸钠中所含的化学键类型为共价键、离子键;中硫显价,被氯气氧化为,则装置F中相应的离子反应方程式为,
故答案为:??
;共价键、离子键;;
Ⅲ由于在D中生成了,也可能有过量的,当滴入KI溶液中时,也可能是氧化生成的,干扰溴、碘非金属性强弱的判断,
故答案为:未排除对溴、碘的非金属性的强弱实验的干扰?;
改进的实验步骤为打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c振荡,发生溴与KI的反应,
故答案为:打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c振荡。
23.【答案】解:为离子化合物,含有离子键,且分子中存在、键,为非极性键,
答:中含有非极性键、离子键;
由、构成,则含有的离子数目为,
答:含有的离子数目为;
中每个C与其它3个C成键,形成3个键,为杂化,
答:碳的杂化方式为杂化.
【解析】为离子化合物,含有离子键,且分子中存在、键;
由、构成;
中每个C与其它3个C成键,形成3个键.
本题以信息考查化学键,为高频考点,明确盐的组成、化学键的形成是解答本题的关键,注意阴离子为形成的阴离子,为学生解答中的难点和易错点,题目难度不大.
第2页,共19页
第1页,共19页
一、单选题
表中物质与其所含化学键类型、所属化合物类型完全对应的一组是
选项
A
B
C
D
物质
HCl
NaOH
化学键类型
共价键
离子键、共价键
离子键
离子键、共价键
化合物类型
共价化合物
离子化合物
离子化合物
共价化合物
A.
A
B.
B
C.
C
D.
D
下列有关化学键的说法中正确的是?
?
?
?
A.
碘晶体升华和冰熔化时都涉及化学键的变化
B.
氯化钠熔化或氯化氢溶于水时都要破坏化学键
C.
离子化合物中可能含有共价键,共价化合物中可能含有离子键
D.
氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
下列关于化学键的叙述中,正确的是
A.
氢键是一种特殊的共价键
B.
离子化合物中可能含有共价键
C.
的挥发破坏了共价键
D.
非极性键只能存在双原子单质中
下列说法中正确的是
离子化合物中一定有离子键,一定没有共价键
固体中阳离子和阴离子的个数比是
共价化合物中不含离子键,一定只含共价键
稳定性:,沸点:
和HCl溶于水破坏相同的作用力
非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.
B.
C.
D.
有共价键的离子化合物是
A.
B.
NaOH
C.
D.
下列物质中,属于共价化合物的是
A.
B.
C.
D.
下列各组物质中化学键的类型完全相同的是
A.
HCl和
B.
?和
C.
和NaOH
D.
和
下列物质中既含有离子键又含有共价键的是?
A.
KOH
B.
C.
CaO
D.
下列说法不正确的是
A.
离子化合物不可能含共价键
B.
是共价化合物
C.
只由非金属元素形成的化合物也可能是离子化合物
D.
稀有气体分子中不存在化学键
实验室利用固体和固体反应制氨气,反应方程式为:,下列关于该反应的说法错误的是?
?
A.
中存在离子键和极性键
B.
此反应过程中既有离子键、极性键断裂,也有离子键和极性键形成
C.
含“”键,含“”键
D.
像、这样含金属元素的化合物一定属于离子化合物
下列关于化学键的叙述中正确的是
A.
离子化合物可能含有共价键,共价化合物不可能含有离子键
B.
单质分子中均含共价键
C.
仅由非金属元素形成的化合物中不可能有离子键
D.
由不同元素形成的多原子分子中,一定只存在极性键
下列含有非极性键的共价化合物是
A.
B.
C.
D.
二、多选题
a为乙二胺四乙酸,易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.
a和b中的N原子均为杂化
B.
b中的配位数为6
C.
a属于高分子化合物
D.
b含有共价键、离子键和配位键
偏二甲肼为价与是常用的火箭推进剂,发生的化学反应如下:
?
,下列说法不正确的是???
A.
该反应在任何情况下都不能自发进行
B.
含有共价键
C.
该反应的氧化产物为,还原产物为
D.
反应中生成时,转移
下列说法正确的是
A.
每一个化学反应都会伴随着能量变化
B.
氯化氢溶于水氢氯共价键被破坏
C.
化学键的断裂和形成是化学反应能量变化的主要原因
D.
离子化合物一定由金属元素和非金属元素组成,非金属元素之间不能形成离子化合物
下列物质中,既有离子键又有共价键的是
A.
B.
KOH
C.
D.
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.
NaCl?和HCl
B.
?和
C.
和
D.
NaOH?和
三、填空题
按照要求用序号回答下列问题:
下列各种物质:?
?
?
?
?
,不存在化学键的是________;只存在离子键的是________;属于共价化合物的是________;含非极性键的离子化合物是________。
下列变化过程:碘的升华?
固体溶于水?
溶于水?
气体溶于水?
烧碱熔化?
氯化铵受热分解,化学键没有被破坏的是________;仅破坏离子键的是________;仅破坏共价键的是________。
下面是我们熟悉的物质:??金刚石???????????
这些物质中,只含共价键的是______;只含离子键的是______;既含共价键又含离子键的是______;不存在化学键的是______填序号
属于共价化合物的是______;属于离子化合物的是______填序号
将溶于水,破坏中的______键,写出其电离方程式______;熔融状态下电离,破坏了______键,写出电离方程式______.
对于HCl、、NaOH、NaCl、、Ne、、金刚石,回答下列问题:
不存在化学键的是______.
属于共价化合物的是______、______.
属于离子化合物的是______、______、______.
既含离子键,又含共价键的是______.
四、流程题
由钛精矿主要成分为制备钛的工艺流程示意图如下:
回答下列问题:
元素在周期表中的位置是______________。
钛精矿、焦炭和氯气高温反应制取粗过程中产生CO和,若产生CO和
物质的量之比为,则该步反应的化学方程式为_________________________。
实验室进行蒸馏提纯时所用的玻璃仪器有蒸馏烧瓶、酒精灯、牛角管、锥形瓶、_________、_________。______
用金属镁还原过程中需要保护气,下列气体可作为保护气的是___________。
??????????
????????
有同学认为用金属镁制取钛生产成本较高,若采用电解的方法制取金属钛可降低生产成本。你是否认同该同学的设想?___填“是”或“否”。你的理由是________。
五、实验题
某兴趣小组拟制备氯气及验证其性质并比较氯、溴、碘的非金属性强弱。
Ⅰ查阅资料当溴水浓度较小时,溶液颜色与氯水相似,也呈黄色。
硫代硫酸钠溶液在工业上可作脱氯剂。
Ⅱ性质验证实验装置如图所示夹持装置省略
实验步骤;
检查装置的气密性,按图示加入试剂。仪器a的名称是________;
装置C中Ⅱ处加入的试剂可以是________填字母。
A.碱石灰???
???硅胶?????
?浓硫酸?????
?无水氯化钙
装置B的作用为________________________________。
的电子式为________;硫代硫酸钠中所含的化学键类型为________________;写出装置F中反应的离子方程式____________________________中的S元素被氧化成最高价。
Ⅲ探究与反思
图中设计装置D、E的目的是比较氯、溴、碘的非金属性强弱,有同学认为该设计不能达到实验目的,其理由是___________________________________。该组同学思考后将上述D、E、F装置改为下图装置,实验操作步骤如下:
打开弹簧夹,缓缓通入氯气。
当a和b中的溶液都变为黄色时,夹紧弹簧夹。
当a中溶液由黄色变为棕色时,停止通氯气。
步骤的操作是________________________________________________。
六、计算题
我国已经成功研制出了碱金属的球碳盐实验测知该物质在熔融状态下可以导电,而且在超临界温度18K时具有超导性.
你猜测一下中含有什么样的化学键?
含有的离子数目为多少?
中的俗称足球烯,分子结构酷似足球,由12个正五边形与20个正六边形构成,碳碳键长介于碳碳单键与双键之间,你能推测一下其中碳的杂化方式吗?
答案和解析
1.【答案】A
【解析】
【分析】
本题考查化学键、化合物的类型,明确元素之间的成键原因、化学键与化合物的关系是解答本题的关键,难度不大。
【解答】
A.中只含共价键,碳原子和氧原子之间存在共价键,属于共价化合物,故A正确;
B.中只含离子键,镁离子与氯离子中存在离子键,属于离子化合物,故B错误;
C.HCl中只含共价键,氢原子和氯原子之间存在共价键,属于共价化合物,故C错误;
D.NaOH中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,属于离子化合物,故D错误;
故选:A。
2.【答案】B
【解析】
【分析】
本题考查化学键,为高频考点,把握化学变化及电离过程中化学键变化、物质的三态变化为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大。
【解答】
A.碘晶体升华和冰熔化均为物理变化,化学键不变,只破坏分子间作用力,故A错误;
B.氯化钠熔化或氯化氢溶于水,均发生电离,前者破坏离子键,后者破坏共价键,故B正确;
C.含离子键的一定为离子化合物,则共价化合物中一定不含离子键,故C错误;
D.氯化铵受热变成气体,发生化学变化生成氨气、HCl,后氨气与HCl发生化合反应生成氯化铵,发生化学键的断裂和生成,故D错误;
故选B。
3.【答案】B
【解析】
【分析】本题考查了化学键的判断、化合物类型的判断、氢键,根据离子键、共价键和离子化合物的概念来分析解答即可,题目难度不大。
【解答】氢键属于分子间作用力,不是共价键,故A错误;
B.离子化合物一定含有离子键,可能含有共价键,如过氧化钠中既含离子键又含共价键,故B正确;
C.的挥发破坏了分子间作用力,共价键没有被破坏,故C错误;
D.同种非金属原子间形成非极性键,化合物中也可能含有非极性键,如过氧化氢中含有非极性键,故D错误;
故选:B。
4.【答案】C
【解析】
【分析】
本题考查了物质与化学键的关系,难度不大,注意:不是所有物质都含化学键,如稀有气体中不存在化学键,只存在分子间作用力。
【解答】
离子化合物中一定有离子键,可能有共价键,如NaOH含离子键及共价键,故错误;
固体中阳离子是钠离子和阴离子是硫酸氢根离子,阳离子和阴离子的个数比是1:1,故正确;
共价化合物只含共价键,不含有离子键,故正确;
非金属性越强,稳定性越强,氧的非金属性强于硫,所以稳定性;水分子间含氢键,所以沸点,故错误;
溶于水破坏离子键,HCl溶于水破坏共价键,所以破坏不同的作用力,故错误;
离子化合物中可能含有非极性键,如中含有非极性键,共价化合物过氧化氢中含有非极性键,故正确;
故选C。
5.【答案】B
【解析】
【分析】
本题旨在考查学生对离子化合物、共价键等应用。侧重学生对概念的理解,难度不大。
【解答】
A.是单质不是化合物,故A错误;
B.NaOH是离子化合物,氧和氢之间形成的是共价键,故B正确;
C.二氧化硅只存在硅氧极性键,不存在离子键,故C错误;
D.是共价化合物,不是离子化合物,故D错误。
故选B。
6.【答案】C
【解析】【解析】
本题考查了化学键和化合物的关系,明确离子化合物和共价键化合物的概念是解本题关键,一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物为共价化合物,注意:并不是所有的物质中都含有化学键,稀有气体中不含化学键,为易错点。
【解答】
A.中只含离子键,为离子化合物,故A错误;
B.含有离子键和共价键,属于离子化合物,故B错误;
C.硫酸分子中只含共价键,是共价化合物,故C正确;
D.中既含离子键又含共价键,为离子化合物,故D错误。
故选C。
7.【答案】D
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大。
【解答】
一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答。
A.HCl只含极性键,只含离子键,故A不选;
B.只含离子键,只含极性键,故B不选;
C.只含离子键,NaOH含离子键、极性键,故C不选;
D.和均含极性键,故D选;
故选:D。
8.【答案】A
【解析】
【分析】
本题考查区分离子化合物和共价化合物的方法,以及判断离子键和共价键的方法,比较基础,要求对基本概念和基本理论有清晰的理解。
【解答】
A.KOH是离子化合物,其中含有离子键,氢氧之间形成共价键,即氢氧化钾中含有离子键和共价键,故A正确;
B.中含碳氧两种元素,属于共价化合物,只含共价键,故B错误;
C.CaO由活泼金属Ca元素和活泼非金属O元素组成,形成的是离子化合物,只含离子键,故C错误;
D.为双原子分子,只含共价键,故D错误。
故选A。
9.【答案】A
【解析】
【分析】
本题考查了化合物和化学键的关系,根据物质中存在的化学键确定化合物类型,注意离子化合物和共价化合物概念的区别,题目难度不大。
【解答】
A.离子化合物中可能含有共价键,如KOH,故A错误;
B.是共价化合物,故B正确;
C.只由非金属元素形成的化合物也可能是离子化合物,如,故B正确;??
D.稀有气体是单原子分子,则分子中不存在化学键,故D正确;
故选A。
10.【答案】D
【解析】
【分析】
本题考查化学键相关知识点,需能正确判断化学键的类型、掌握离子化合物的定义,题目难度不大。
【解答】
A.铵根离子和氯离子之间存在离子键、原子之间存在极性键,故A正确;
B.此反应过程中既有铵根离子和氯离子之间的离子键、原子之间的极性键断裂,也有钙离子和氯离子之间的离子键和原子之间极性键形成,故B正确;
C.氢氧化钙中氧原子与氢原子之间形成共价键,则含2mol“”极性键;氨气分子中氮原子与氢原子形成共价键,含3mol“”极性键,故C正确;
D.含金属元素的化合物不一定属于离子化合物,如属于共价化合物,故D错误;
故选D。
11.【答案】A
【解析】
【分析】
本题主要考查的是共价键和离子键形成和判断,题目难度不大,掌握构成离子键、共价键的元素的特点和理解离子化合物、共价化合物的概念是解题的关键。
【解答】
A.离子化合物可能含有共价键,如、等,共价化合物只含共价键,不可能含有离子键,A正确;
B.稀有气体单质分子中不含任何化学键,B错误;
C.常见的铵盐都是仅由非金属元素形成的化合物,含有离子键,C错误;
D.是由不同元素形成的多原子分子,其中含有非极性键,D错误。
故选A。
12.【答案】C
【解析】
【分析】
本题考查了化学键和化合物的关系,难度不大,注意:离子化合物中可能含有共价键,但共价化合物中一定不含离子键。
【解答】
A、中只含极性共价键,故A错误;
B、氯气是单质,故B错误;
C、中含有极性键和非极性键,属于含有非极性键的共价化合物,故C正确;
D、中含有离子键和非极性键,属于含有非极性键的离子化合物,故D错误;
故选:C。
13.【答案】AB
【解析】
【分析】
本题考查配合物成键情况与杂化方式判断,注意b为配离子,内界没有离子键,难度不大。
【解答】
A.a中N原子形成3个键、含有1对孤对电子,而b中N原子形成4个键、没有孤对电子,N原子杂化轨道数目均为4,N原子均采取杂化,故A正确;
B.b为配离子,钙离子与N、O原子之间形成配位键,b中的配位数为6,故B正确;
C.虽然乙二胺四乙酸的分子比较大,但仍未进入高分子的相对分子质量的范围,所以叶绿素乙二胺四乙酸不属于高分子化合物,故C错误;
D.b为配离子,钙离子与N、O原子之间形成配位键,其它原子之间形成共价键,不含离子键,故D错误。
14.【答案】AC
【解析】
【分析】
本题考查氧化还原反应、共价键及其反应自发判断等,侧重于学生的分析能力的考查,注意把握氧化还原反应中元素化合价的变化,难度不大。
【解答】
A.反应中,,,所以在任何情况下,都能自发进行,故A错误;
B.根据的结构式,含有11mol共价键,故B正确;
C.反应中中N元素的化合价由价降低为0价,偏二甲肼中N元素的化合价由价升高为0价,中C元素的化合价有价升高为价,所以氧化产物为和,还原产物为,故C错误;
D.反应中中N元素的化合价由价降低0价,所以反应共转移,生成,则生成1mol?时,转移8?mol?,故D正确。
15.【答案】ABC
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断是为解答的关键,并注意利用实例来分析解答,侧重分析与应用能力的考查,题目难度不大。
【解答】
A.因为化学反应的本质为旧键的断裂和新键的形成,化学键断裂吸收能量,生成化学键释放能量,所以化学反应都会伴随着能量变化,故A正确;
B.氯化氢溶于水,发生电离,共价键破坏,故B正确;
C.化学键断裂吸收能量,生成化学键释放能量,化学反应的实质为化学键的断裂和形成,则化学键的断裂和形成是化学反应能量变化的主要原因,故C正确;
D.铵盐为离子化合物,但不含金属元素,氯化铝含金属元素为共价化合物,故D错误;
故选:ABC。
16.【答案】BD
【解析】
【分析】
本题考查了离子键和共价键的判断,根据物质的构成微粒及微粒间作用力分析解答,注意二者区别,铵盐中存在离子键,且铵根离子中存在配位键,配位键属于共价键。
【解答】
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐和金属氧化物中含有离子键,多原子非金属单质、酸、部分非金属氧化物、部分碱、部分盐中含有共价键。
A.氯化钙中钙离子和氯离子之间存在离子键,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键,O原子和H原子之间存在共价键,故B正确;
C.水分子中H原子和O原子之间只存在共价键,故C错误;
D.氟化铵中铵根离子和氟离子之间存在离子键、N原子和H原子之间存在共价键,故D正确。
故选BD。
17.【答案】CD
【解析】
【分析】
本题考查物质结构知识,较为基础。侧重考查物质中所含化学键类型以及晶体类型相关知识,掌握成键类型是解答关键。
【解答】
A.NaCl含离子键,为离子晶体;HCl含共价键,为分子晶体,故A错误;
B.含共价键,为分子晶体;含共价键,为原子晶体,故B错误;
C.和都含共价键,都为分子晶体,故C正确;
D.NaOH和都含共价键,离子键,都为离子晶体,故D正确。
故选CD。
18.【答案】;;;?
;;
【解析】
【分析】本题考查了化学键的相关知识,试题难度较易。
【解答】
水分子中含有极性共价键,
氨气分子中含有极性共价键,
中含有离子键和极性共价键,
过氧化钠中含有离子键和非极性共价键,
氯化镁中含有离子键,
稀有气体单质为单原子分子,不存在化学键。
所以不存在化学键的是Ne;只存在离子键的是氯化镁;全部由共价键形成的化合物是共价化合物,则属于共价化合物的是水和氨气;含非极性键的离子化合物是过氧化钠。
碘的升华是物理变化,化学键没有被破坏;
固体溶于水电离出阴离子和阳离子,离子键被破坏;
溶于水是物理变化,化学键没有被破坏;
气体溶于水电离出阴离子和阳离子,共价键被破坏;
烧碱熔化电离出阴离子和阳离子,离子键被破坏;
氯化铵受热分解发生化学变化,生成氨气和氯化氢,离子键和共价键均被破坏,
则化学键没有被破坏的是和;仅破坏离子键的是和;仅破坏共价键的是。
19.【答案】;;
;;?
?
;;?
?
离子键和共价;
;
?
离子;?
?
【解析】
【分析】
本题考查了物质和化学键的关系,为高频考点,根据物质的构成微粒确定化学键,知道离子键和共价键的区别,注意稀有气体中不存在化学键为易错点,题目难度不大.
【解答】
中O原子之间只存在非极性共价键,为单质;
金刚石中碳原子之间只存在非极性共价键;
中钠离子和溴离子之间只存在离子键,为离子化合物;
中S原子和O原子、O原子和H原子之间存在极性共价键,为共价化合物;
中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,为离子化合物;
中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
中钠离子和硫酸氢根离子之间存在离子键、S原子和O原子之间存在共价键,为离子化合物;
中不存在化学键;
中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,为离子化合物;
中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性键,为离子化合物;
只含有共价键的是;只含有离子键的是;既含共价键又含离子键的是,不存在化学键的是;
故答案为:;;;;
只含共价键的化合物是共价化合物,属于共价化合物的是,含有离子键的化合物是离子化合物,为,
故答案为:;;
是强酸强碱酸式盐,属强电解质,完全电离,电离出钠离子、氢离子和硫酸根离子,离子方程式为,所以破坏了中的离子键和共价键,在熔融状态下电离,破坏了离子键,电离方程式为,
故答案为:离子键和共价;;离子;.
20.【答案】
;
;NaCl;
、NaOH。
【解析】
【分析】
本题考查了化学键和化合物的判断,根据物质的构成微粒及微粒间的作用力来分析解答,题目难度不大。
【解答】
一般活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;稀有气体为单原子分子,不存在化学键。
稀有气体为单原子分子,不存在化学键,则不存在化学键的是Ne;
故答案为:Ne;
非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,则属于共价化合物的是HCl、;
故答案为:HCl、;
一般活泼金属和活泼非金属元素之间易形成离子键,铵盐中存在离子键,则属于离子化合物的是NaOH、NaCl、;
故答案为:NaOH、NaCl、;
氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起,N元素与H元素之间存在共价键,则氢氧化钠与既含离子键又含共价键。
故答案为:、NaOH。
21.【答案】第四周期ⅣB族;
;
温度计、冷凝管;
;
否;是共价化合物,熔融态不导电。
【解析】
【分析】
本题主要考查的是制备钛的工艺流程,意在考查学生的分析能力和知识应用能力,解题时根据原料的成分和所加试剂、操作方法判断各步骤操作的作用和涉及的反应。
【解答】
元素在周期表中的位置是第四周期ⅣB族;
故答案为:第四周期ⅣB族;
由题干信息可知,该步反应的反应物是、焦炭和氯气,生成物是、CO、,其中CO和在方程式中的计量系数之比为,则该步反应的化学方程式为;
故答案为:;
实验室进行蒸馏提纯时所用的玻璃仪器有蒸馏烧瓶、酒精灯、牛角管、锥形瓶、温度计、冷凝管;
故答案为:温度计、冷凝管;
镁是活泼金属,高温条件下能与、、反应,则用金属镁还原过程中需要用惰性气体作保护气,故c正确,
故答案为:c;
该同学提出的设想不能实现,因为是共价化合物,熔融态不导电。
故答案为:否;是共价化合物,熔融态不导电。
22.【答案】长颈漏斗;BD;
除去氯气中的氯化氢并作安全瓶;
??
;共价键、离子键;?;
未排除对溴、碘的非金属性的强弱实验的干扰?;
打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c振荡?。
【解析】
【分析】
本题考查氯气的制备实验及性质实验,为高频考点,把握实验装置的作用、物质的性质及非金属性比较的方法为解答的关键,侧重分析与实验能力的考查,注意实验中对比方法及干扰因素的分析,题目难度中等。
【解答】
Ⅱ仪器a的名称是长颈漏斗;装置CⅡ处加的试剂干燥氯气,且为固体,A可以吸收氯气无法进行实验,只有BD符合,故答案为:长颈漏斗;BD;
生成的氯气中混有HCl,则装置B的作用是除去氯气中的氯化氢并作安全瓶,
故答案为:除去氯气中的氯化氢并作安全瓶;
为离子化合物,电子式为;中S与O之间存在共价键,钠离子与硫代硫酸根离子之间存在离子键,所以硫代硫酸钠中所含的化学键类型为共价键、离子键;中硫显价,被氯气氧化为,则装置F中相应的离子反应方程式为,
故答案为:??
;共价键、离子键;;
Ⅲ由于在D中生成了,也可能有过量的,当滴入KI溶液中时,也可能是氧化生成的,干扰溴、碘非金属性强弱的判断,
故答案为:未排除对溴、碘的非金属性的强弱实验的干扰?;
改进的实验步骤为打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c振荡,发生溴与KI的反应,
故答案为:打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c振荡。
23.【答案】解:为离子化合物,含有离子键,且分子中存在、键,为非极性键,
答:中含有非极性键、离子键;
由、构成,则含有的离子数目为,
答:含有的离子数目为;
中每个C与其它3个C成键,形成3个键,为杂化,
答:碳的杂化方式为杂化.
【解析】为离子化合物,含有离子键,且分子中存在、键;
由、构成;
中每个C与其它3个C成键,形成3个键.
本题以信息考查化学键,为高频考点,明确盐的组成、化学键的形成是解答本题的关键,注意阴离子为形成的阴离子,为学生解答中的难点和易错点,题目难度不大.
第2页,共19页
第1页,共19页
