湖北省黄冈麻城第二高中2020-2021学年高二上学期期中考试化学试题 含答案
文档属性
| 名称 | 湖北省黄冈麻城第二高中2020-2021学年高二上学期期中考试化学试题 含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 291.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-10 00:00:00 | ||
图片预览


文档简介
1035050011849100麻城二中2020年秋高二期中考试
化 学 试 题
考时:90分钟 分值:100分
第Ⅰ卷
选择题:本题共18个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求。
1.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转化为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
2.下列说法不正确的是 ( )
A.电解质溶液导电的过程实际上就是电解的过程
B.利用电解饱和食盐水所得的产物可以生产盐酸
C.铜在酸性环境中易发生析氢腐蚀
D.氢氧燃料电池的负极通入的是氢气
3.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6 mol·L-1的溶液
C.c(H+)水=c(OH-) 水的溶液
D.酸与碱恰好完全反应生成正盐的溶液
4.下列四种溶液中,水的电离程度最大的是( )
A.pH=5的NH4Cl溶液 B.pH=5的NaHSO4溶液
C.pH=8的CH3COONa溶液 D.pH=8的NaOH溶液
5.氢氰酸(HCN)的下列性质中,不能说明它是弱电解质的是( )
A.1 mol·L-1氢氰酸溶液的pH约为3
B.同浓度的盐酸比HCN溶液导电性强
C.同浓度同体积的HCN溶液和NaOH溶液混合,溶液呈碱性
D.10 mL 1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
6.下列叙述正确的是( )
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol·L-1的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
7.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
C.粗铜精炼时与电源正极相连的是纯铜,电极反应式:Cu--2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
8.关于下图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向CuSO4溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++e-===H2↑
9.下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO
B.H2SO3的电离方程式:H2SO32H++SO
C.CO的水解方程式:CO+H2OHCO+OH-
D.HCO3-的水解方程式:HCO3-+H2O CO+H3O+
10.下列说法中,不正确的是( )
A.电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-===Cl2↑
B.酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-===4OH-
C.精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-===Cu
D.钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+
11.下列有关叙述正确的是( )
A.在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液
B.进行中和滴定操作时,眼睛要始终注视滴定管内溶液液面的变化
C.用标准液滴定待测液时,最后仰视读数,结果偏小
D.滴定过程中,溶液颜色发生变化,既达到了滴定终点
12.下列与盐类水解有关的叙述不正确的是( )
A.对于0.1 mol·L-1Na2SO3溶液,升高温度,溶液碱性增强
B.在NH4Cl溶液中加入镁条会产生气泡
C.直接加热蒸干MgCl2、Al(NO3)3、Fe2(SO4)3三种物质的溶液,均不能得到原溶质
D.配制FeCl3溶液时,要在溶液中加入少量盐酸
13.现有室温下两种溶液,有关叙述正确的是( )
编号
①
②
pH
12
2
溶液
氢氧化钠溶液
醋酸溶液
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度:c(NaOH)>c(CH3COOH)
C.两种溶液等体积混合后:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加水稀释相同倍数后:c(Na+)>c(CH3COO-)
14.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
选项
A
B
C
D
电极材料
Zn
Fe
Cu
Al
电极材料
Cu
Zn
Ag
Sn
电解质溶液
CuCl2
溶液
H2SO4
溶液
CuSO4
溶液
NaOH
溶液
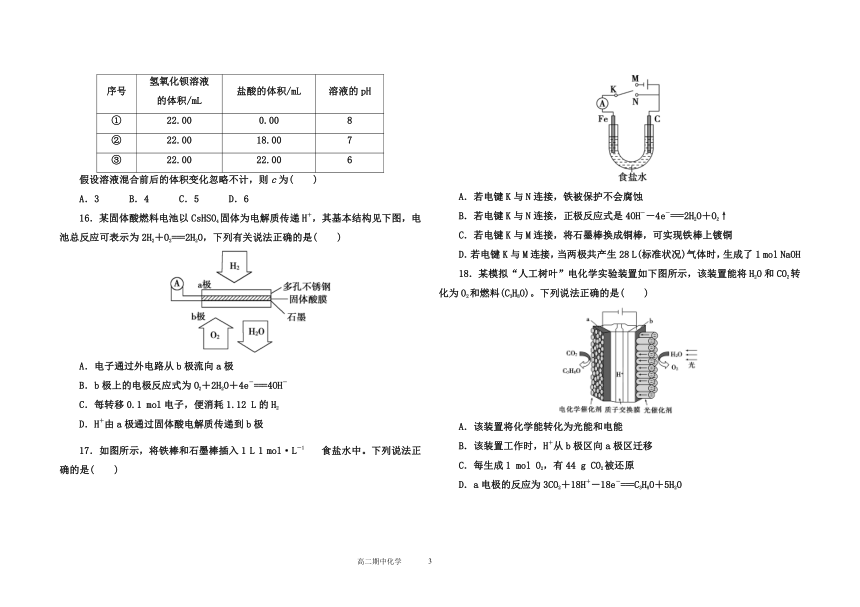
15.在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号
氢氧化钡溶液
的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积变化忽略不计,则c为( )
A.3 B.4 C.5 D.6
16.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-===4OH-
C.每转移0.1 mol电子,便消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
17.如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
18.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e-===C3H8O+5H2O
第Ⅱ卷
二、非选择题(本题包括4个小题,共46分)
19.(10分)25 ℃,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离的c(OH-)分别是:
①NaOH溶液中________;②Na2CO3溶液中________。
③在1 L水中加入上述溶液中的________会使水的电离程度减小。
(2)各取10 mL上述两种溶液,分别加水稀释到100 mL,pH变化较大的是________(填化学式)溶液。
(3)为探究纯碱溶液呈碱性是由CO引起的,请你设计一个简单的实验方案___________________。
20.(12分)某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是______ →______ →______ →D→______(均用字母填写)。
(2)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是___________________________________________________。
(3)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(4)该烧碱样品纯度的计算式为________________________。
21.(12分)下列四种装置中,①盛200 mL硫酸铜溶液 ②盛200 mL 0.01 mol·L-1硫酸溶液 ③盛200 mL氯化锌溶液 ④盛200 mL氯化钾溶液
(1)上述装置中①为________池,反应一段时间溶液浓度基本不变的是________。装置①中两电极的电极反应式分别是_________________、__________________ (注明电极名称)。
(2)用离子方程式回答:通电时装置④中的总反应是_________________________________________________溶液中可能发生的副反应是_______________________________________________________。
(3)若将装置④中的外加电源拆去,用导线将两个电极连接,则Fe极上发生的反应是__________________________
22.(12分)如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
(1)p为_____极,A极发生了________反应。
(2)C为____极,试管里收集到的气体是____;D为____极,试管里收集到的气体是_____。
(3)C极的电极反应方程式为_____________________________。
(4)当反应进行一段时间后,A、B电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(5)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为______
高二化学期中答案
1-18:CCBAD CBACB ACACB DDB
19:(每空2分,共10分)
(1)①1.0×10-11 mol/L ②1.0×10-3 mol/L ③NaOH溶液
(2)NaOH
(3)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO引起的
20:(前四空每空1分,其他每空2分,共12分)
(1)C A B E
(2)4.4 由黄色变为橙色 (3)偏高
(4)%(注意:V的单位为 mL)
21:(前两空每空1分,其他每空2分,共12分)
(1)电解 ③
阴极:2Cu2++4e-===2Cu
阳极:4OH--4e-===O2↑+2H2O
(2)2Cl-+2H2OH2↑+Cl2↑+2OH-
Cl2+2OH-===Cl-+ClO-+H2O
(3)Fe-2e-===Fe2+
22:(前六空每空1分,其他每空2分,共12分)
(1)正 氧化 (2)阳 氧气 阴 氢气
(3)4OH--4e-===O2↑+2H2O (4)不变
(5)64 g/mol
化 学 试 题
考时:90分钟 分值:100分
第Ⅰ卷
选择题:本题共18个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求。
1.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转化为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
2.下列说法不正确的是 ( )
A.电解质溶液导电的过程实际上就是电解的过程
B.利用电解饱和食盐水所得的产物可以生产盐酸
C.铜在酸性环境中易发生析氢腐蚀
D.氢氧燃料电池的负极通入的是氢气
3.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6 mol·L-1的溶液
C.c(H+)水=c(OH-) 水的溶液
D.酸与碱恰好完全反应生成正盐的溶液
4.下列四种溶液中,水的电离程度最大的是( )
A.pH=5的NH4Cl溶液 B.pH=5的NaHSO4溶液
C.pH=8的CH3COONa溶液 D.pH=8的NaOH溶液
5.氢氰酸(HCN)的下列性质中,不能说明它是弱电解质的是( )
A.1 mol·L-1氢氰酸溶液的pH约为3
B.同浓度的盐酸比HCN溶液导电性强
C.同浓度同体积的HCN溶液和NaOH溶液混合,溶液呈碱性
D.10 mL 1 mol·L-1HCN恰好与10 mL 1 mol·L-1 NaOH溶液完全反应
6.下列叙述正确的是( )
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol·L-1的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
7.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
C.粗铜精炼时与电源正极相连的是纯铜,电极反应式:Cu--2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
8.关于下图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向CuSO4溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++e-===H2↑
9.下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO
B.H2SO3的电离方程式:H2SO32H++SO
C.CO的水解方程式:CO+H2OHCO+OH-
D.HCO3-的水解方程式:HCO3-+H2O CO+H3O+
10.下列说法中,不正确的是( )
A.电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-===Cl2↑
B.酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-===4OH-
C.精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-===Cu
D.钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+
11.下列有关叙述正确的是( )
A.在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液
B.进行中和滴定操作时,眼睛要始终注视滴定管内溶液液面的变化
C.用标准液滴定待测液时,最后仰视读数,结果偏小
D.滴定过程中,溶液颜色发生变化,既达到了滴定终点
12.下列与盐类水解有关的叙述不正确的是( )
A.对于0.1 mol·L-1Na2SO3溶液,升高温度,溶液碱性增强
B.在NH4Cl溶液中加入镁条会产生气泡
C.直接加热蒸干MgCl2、Al(NO3)3、Fe2(SO4)3三种物质的溶液,均不能得到原溶质
D.配制FeCl3溶液时,要在溶液中加入少量盐酸
13.现有室温下两种溶液,有关叙述正确的是( )
编号
①
②
pH
12
2
溶液
氢氧化钠溶液
醋酸溶液
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度:c(NaOH)>c(CH3COOH)
C.两种溶液等体积混合后:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加水稀释相同倍数后:c(Na+)>c(CH3COO-)
14.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
选项
A
B
C
D
电极材料
Zn
Fe
Cu
Al
电极材料
Cu
Zn
Ag
Sn
电解质溶液
CuCl2
溶液
H2SO4
溶液
CuSO4
溶液
NaOH
溶液
15.在t ℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号
氢氧化钡溶液
的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积变化忽略不计,则c为( )
A.3 B.4 C.5 D.6
16.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-===4OH-
C.每转移0.1 mol电子,便消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
17.如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
18.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e-===C3H8O+5H2O
第Ⅱ卷
二、非选择题(本题包括4个小题,共46分)
19.(10分)25 ℃,NaOH和Na2CO3两溶液的pH均为11。
(1)两溶液中,由水电离的c(OH-)分别是:
①NaOH溶液中________;②Na2CO3溶液中________。
③在1 L水中加入上述溶液中的________会使水的电离程度减小。
(2)各取10 mL上述两种溶液,分别加水稀释到100 mL,pH变化较大的是________(填化学式)溶液。
(3)为探究纯碱溶液呈碱性是由CO引起的,请你设计一个简单的实验方案___________________。
20.(12分)某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是______ →______ →______ →D→______(均用字母填写)。
(2)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是___________________________________________________。
(3)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(4)该烧碱样品纯度的计算式为________________________。
21.(12分)下列四种装置中,①盛200 mL硫酸铜溶液 ②盛200 mL 0.01 mol·L-1硫酸溶液 ③盛200 mL氯化锌溶液 ④盛200 mL氯化钾溶液
(1)上述装置中①为________池,反应一段时间溶液浓度基本不变的是________。装置①中两电极的电极反应式分别是_________________、__________________ (注明电极名称)。
(2)用离子方程式回答:通电时装置④中的总反应是_________________________________________________溶液中可能发生的副反应是_______________________________________________________。
(3)若将装置④中的外加电源拆去,用导线将两个电极连接,则Fe极上发生的反应是__________________________
22.(12分)如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
(1)p为_____极,A极发生了________反应。
(2)C为____极,试管里收集到的气体是____;D为____极,试管里收集到的气体是_____。
(3)C极的电极反应方程式为_____________________________。
(4)当反应进行一段时间后,A、B电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(5)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为______
高二化学期中答案
1-18:CCBAD CBACB ACACB DDB
19:(每空2分,共10分)
(1)①1.0×10-11 mol/L ②1.0×10-3 mol/L ③NaOH溶液
(2)NaOH
(3)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去;这可以说明纯碱溶液呈碱性是由CO引起的
20:(前四空每空1分,其他每空2分,共12分)
(1)C A B E
(2)4.4 由黄色变为橙色 (3)偏高
(4)%(注意:V的单位为 mL)
21:(前两空每空1分,其他每空2分,共12分)
(1)电解 ③
阴极:2Cu2++4e-===2Cu
阳极:4OH--4e-===O2↑+2H2O
(2)2Cl-+2H2OH2↑+Cl2↑+2OH-
Cl2+2OH-===Cl-+ClO-+H2O
(3)Fe-2e-===Fe2+
22:(前六空每空1分,其他每空2分,共12分)
(1)正 氧化 (2)阳 氧气 阴 氢气
(3)4OH--4e-===O2↑+2H2O (4)不变
(5)64 g/mol
同课章节目录
