10-11高中化学课时讲练通课件:111 化学反应中的热效应(苏教版选修4)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:111 化学反应中的热效应(苏教版选修4) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 00:00:00 | ||
图片预览











文档简介
(共65张PPT)
1.请思考分析是否所有的化学反应都有能量的变化?
提示:所有的化学反应都有能量的变化。因为化学反应的实质是旧化学键的断裂和新化学键的形成。断裂旧化学键要吸收能量,形成新化学键要放出能量,一个化学反应中断键吸收的能量与成键放出的能量不可能完全相等,故每个化学反应都会有能量的变化。
2.请结合已有知识思考,是否只有化学变化才会有能量变化?
提示:不是。有许多物理变化也常伴随着能量变化,如物质熔化、汽化、升华都要吸热,液化、凝固都会放热,物质在水中的溶解也有吸热或放热现象,这些都是物理变化。
3.化学反应中的能量变化是否都是以热能的形式表现?
提示:不是。化学反应中的能量变化有些是以热能的形式表现,也有些以其他能量的形式表现,如光能、电能等。
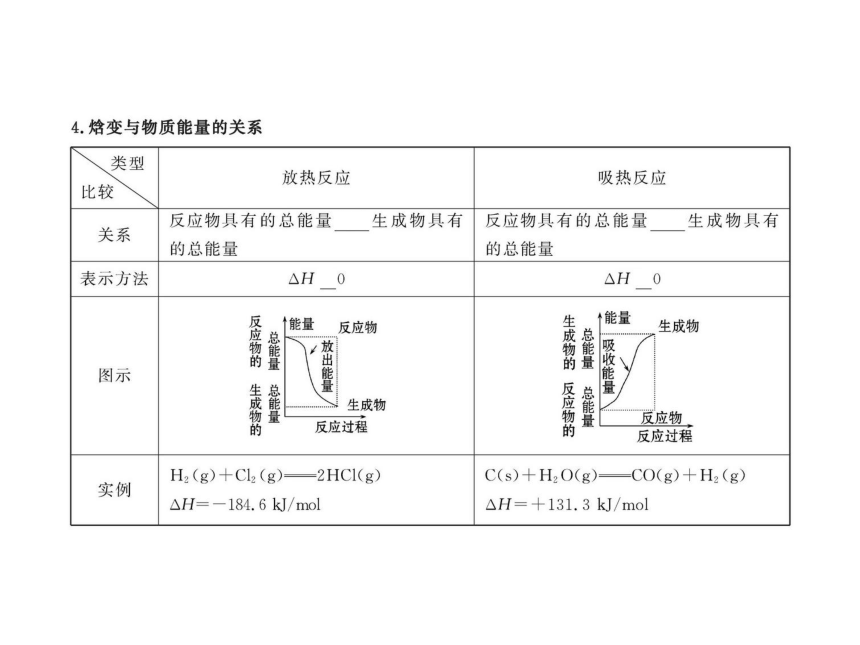
4.请结合已有知识,思考常见的放热反应有哪些?
提示:常见的放热反应有:①燃烧反应 ②中和反应
③活泼金属与酸或盐溶液的反应
④碱性氧化物与水的反应 ⑤铝热反应等。
5.探究反应条件与吸热反应、放热反应的关系:
(1)加热条件下进行的反应是否一定是吸热反应?不需
加热就能进行的反应是否一定是放热反应?
提示:不一定。加热条件下进行的反应不一定是吸热反
应,如2Na+O2 Na2O2是放热反应。不需加热就能进
行的反应不一定是放热反应,如NH4Cl与Ba(OH)2·8H2O
反应是吸热反应,常温下即可发生,不需加热。
△
====
(2)放热反应是否一定不需加热?吸热反应是否一定必须加热?
提示:根据上面的两个例子:2Na+O2 Na2O2和NH4Cl与Ba(OH)2·8H2O反应可知,放热反应可能需要加热,吸热反应也可能不需要加热。因此化学反应是吸热反应还是放热反应与反应条件无关,而是决定于反应物的总能量与生成物的总能量的相对大小。
△
====
【典例1】如图所示,把试管放入
盛有25 ℃饱和澄清石灰水的烧杯
中,试管中开始放入几小块镁片,
再用滴管滴5 mL稀盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是_____
__________________________________________。
(2)产生上述现象的原因是___________________。
(3)写出有关反应的离子方程式________________。
(4)由实验推知MgCl2溶液和H2的总能量_____(填“大于”、“小于”或“等于”)镁片和稀盐酸的总能量。
【思路点拨】(1)镁与稀盐酸的反应是放热反应;
(2)Ca(OH)2的溶解度随温度升高而降低。
【自主解答】本题考查了反应中能量变化的实质及实际应用。镁片与稀盐酸的反应是放热反应,是由于反应物(Mg和HCl)的总能量高于生成物(MgCl2和H2)的总能量。放出的热量通过小试管传递给饱和石灰水溶液,使Ca(OH)2的溶解度降低而析出Ca(OH)2晶体。
答案:(1)镁片上有大量气泡产生,镁片逐渐溶解;烧杯中溶液变浑浊
(2)镁与稀盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体
(3)Mg+2H+====Mg2++H2↑ (4)小于
1.请讨论如何理解热化学方程式中的ΔH的单位kJ·mol-1?
提示:ΔH的单位是kJ·mol-1,但不一定是1 mol反应物反应吸收或放出的热量,如反应
①H2(g)+ O2(g)====H2O(l) ΔH1=-a kJ·mol-1
②2H2(g)+O2(g)====2H2O(l) ΔH2=-b kJ·mol-1
反应①中指1 mol H2(g)燃烧放出a kJ的热量,而②指2 mol H2(g)燃烧放出b kJ的热量。
2.请思考热化学方程式与普通化学方程式有什么区别?
提示:(1)热化学方程式,需要注明反应的焓变ΔH,正值为吸热,负值为放热,单位是kJ·mol-1。普通化学方程式不用注明。
(2)热化学方程式需要注明各物质的聚集状态。普通化学方程式不用注明,只是在生成物中标出“↓”或“↑”即可。
(3)热化学方程式需注明反应时的温度和压强(常温、常压时可不标),普通化学方程式不用注明。
(4)热化学方程式中,物质前的化学计量数只表示物质的量,故可用分数表示;普通化学方程式也表示微粒个数,不能用分数。
3.为什么书写热化学方程式时,必须注明各物质的聚集状态和反应时的温度和压强?
提示:因为物质在发生三态变化时,也有能量的变化。故物质的聚集状态影响反应的热效应。另外温度和压强也影响着物质的能量,所以书写热化学方程式时,需要注明物质的聚集状态和反应时的温度和压强。
【典例2】(2010·杭州高二检测)工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)====2NH3(l)
ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)====2NH3(g)
ΔH=2(b-a) kJ·mol-1
C. N2(g)+ H2(g)====NH3(l)
ΔH=(b+c-a) kJ·mol-1
D. N2(g)+ H2(g)====NH3(g)
ΔH=(a+b) kJ·mol-1
【思路点拨】(1)生成物的聚集状态;
(2)根据反应物的总能量与生成物的总能量的相对大小确定ΔH的“+”或“-”。
【自主解答】选A。由图可知, mol N2(g)+ mol H2(g)
的总能量比1 mol NH3(g)的总能量高(b-a) kJ,故
N2(g)+ H2(g)====NH3(g)的ΔH=-(b-a) kJ·mol-1
=(a-b) kJ·mol-1,D错误;N2(g)+3H2(g)====2NH3(g)
ΔH=2(a-b) kJ·mol-1,B错误; mol N2(g)+ mol
H2(g)的总能量比1 mol NH3(l)的总能量高(b+c-a) kJ,
故 N2(g)+ H2(g)====NH3(l)的 ΔH=-(b+c
-a) kJ·mol-1=(a-b-c) kJ·mol-1,C错误;
N2(g)+3H2(g)====2NH3(l) ΔH=2(a-b-
c) kJ·mol-1,A正确。
知识点一:焓变、反应热
1.下列对化学反应的认识错误的是( )
A.必然会引起化学键的变化
B.必然会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
【解析】选C。有新物质生成的反应是化学反应,其实质是旧化学键的断裂和新化学键的形成,故A、B正确;在化学反应中伴随着能量的变化,通常表现为热量的变化,D正确;在化学反应中物质状态不一定变化,如2CO+O2 2CO2,C错误。
点燃
====
2.已知反应X+Y====M+N为放热反应,下列对该反应的说法中正确的是( )
A.X和Y的总能量一定高于M和N的总能量
B.Y的能量一定高于N
C.X的能量一定高于M
D.因该反应为放热反应,故不必加热就可以发生反应
【解析】选A。放热反应说明反应物的总能量大于生成物的总能量,故A正确;但无法说明单一反应物与单一生成物的能量大小,所以B、C不正确;放热反应有时需加热才能引发,故D不正确。
知识点二:热化学方程式
3.(2010·梅州高二检测)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+3/2O2(g)====CO2(g)+2H2O(l)
ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=+1 452 kJ·mol-1
【解析】选B。本题考查热化学方程式的书写,首先应
准确计算1 mol甲醇完全燃烧时的反应热效应。1 mol
甲醇完全燃烧时放热22.68 kJ× ≈725.8 kJ,即
甲醇燃烧的焓变为ΔH=-725.8 kJ·mol-1,A项中
ΔH=+725.8 kJ·mol-1,错误;C、D两项中2 mol 甲
醇完全燃烧焓变为ΔH=-1 452 kJ·mol-1,故C、D错
误。
4. 分析图中的能量变化情况,下列判断正确的是( )
A.2A+B====2C ΔH<0
B.2C====2A+B ΔH<0
C.2A(g)+B(g)====2C(g) ΔH>0
D.2A(g)+B(g)====2C(g) ΔH<0
【解析】选C。表示化学反应的能量变化,必须注明物质的聚集状态,故选项A、B错误;从物质储存的能量高低来看,若2A(g)和B(g)为反应物,C(g)为生成物,则该反应是吸热反应,ΔH大于0,故C正确。
5.在一定条件下,A和B反应可生成C和D,其能量变化如下:
(1)下列有关反应A+B====C+D的说法正确的是____。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需加热反应就一定能自发进行
D.反应物的总质量与生成物的总质量一定相等,且遵循能量守恒
(2)若E1”、“<”或“=”)反应物的总能量,该反应为_____(填“吸热”或“放热”)反应。
【解析】化学反应既遵循质量守恒,又遵循能量守恒,在能量变化上体现为吸热反应或放热反应,任何化学反应都伴随着能量变化。当E1>E2时为放热反应,当E1答案:(1)A、D (2)> 吸热
一、选择题(本题包括4小题,每小题4分,共16分)
1.(2010·西安高二检测)下列说法中,不正确的是
( )
A.ΔH的大小与热化学方程式的化学计量数有关
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为放热反应
C.生成物的总焓大于反应物的总焓时,反应放热,ΔH<0
D.在化学反应过程中,发生物质变化的同时一定发生能量变化
【解析】选C。本题考查化学变化与能量变化的关系及物质能量、化学键、焓变的关系。化学反应过程中,在发生物质变化的同时,还伴随有能量变化;因为形成化学键放出能量,破坏化学键吸收能量,故破坏生成物全部化学键所需的能量大于破坏反应物全部化学键所需要的能量时,反应放出热量;ΔH的大小与化学反应中物质的状态、反应所处的状况及物质的量多少等有关,即ΔH大小与热化学方程式的化学计量数有关。
2.热化学方程式中,化学式前的化学计量数表示的是
( )
A.分子个数 B.原子个数
C.物质质量 D.物质的量
【解析】选D。热化学方程式中,化学式前的化学计量数只表示物质的量,因此可以是分数也可以是整数,这区别于一般的化学方程式,一般的化学方程式的化学计量数表示的是分子个数和物质的量,因此只能是整数。
3.热化学方程式C(s)+H2O(g)====CO(g)+H2(g)
ΔH=+131.3 kJ/mol表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
【解析】选C。依据反应热的概念,反应热表示按照热化学方程式中化学计量数的物质的量反应时,吸收或放出的热量,单位是kJ/mol,该热化学方程式表示:
1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收131.3 kJ的热量。特别要指明水的状态。
4.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。下列说法中不正确的是( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下难以发生反应
D.生成物硫化亚铁的总能量低于反应物铁粉和硫粉的总能量
【解析】选A。待反应一发生即停止加热,反应仍可持续进行,说明反应放热,放出的热量即可维持反应的进行,A错误,B、D正确;铁粉和硫粉混合后加热才能反应,说明此反应常温下难以发生,C正确。
二、非选择题(本题包括2小题,共14分)
5.(6分)(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下
1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是
___________________________________________。
(2)13 g C2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659 kJ的热量,该反应的热化学方程式为______
___________________________________________。
【解析】(1)甲硅烷自燃的化学方程式为SiH4+2O2====
SiO2+2H2O,1 g甲硅烷自燃放出热量44.6 kJ,则1 mol SiH4自燃放出热量44.6 kJ×32=1 427.2 kJ,故SiH4(g)
+2O2(g)====SiO2(s)+2H2O(l)的ΔH=-1 427.2 kJ/mol;
(2)C2H2(g)完全燃烧的化学方程式为2C2H2+5O2====
4CO2+2H2O,13 g C2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659 kJ的热量,则2 mol C2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659 kJ×4=2 636 kJ的热量,故2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)的ΔH=
-2 636 kJ/mol。
答案:(1)SiH4(g)+2O2(g)====SiO2(s)+2H2O(l)
ΔH=-1 427.2 kJ/mol
(2)2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)
ΔH=-2 636 kJ/mol
6.(8分)(1)已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol H2中的化学键消耗的能量为
Q1 kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2 kJ,
形成1 mol HCl中的化学键释放的能量为Q3 kJ,下列关系式正确的是______。
A.Q1+Q2>Q3 B.Q1+Q2C.Q1+Q2>2Q3 D.Q1+Q2<2Q3
(2)生成1 mol HCl需要_______(填“放出”或“吸收”)_______kJ的能量。
【解析】正确理解化学反应中化学键的断裂和形成与反应热的关系。H2+Cl2====2HCl,形成化学键放出的能量为2Q3 kJ,断裂化学键吸收的能量为(Q1+Q2) kJ,因为此反应是放热反应,故Q1+Q2<2Q3。生成1 mol HCl放出的能量为形成化学键放出的能量和断裂化学键吸收的能量的差,即Q3-1/2(Q1+Q2)。
答案:(1)D (2)放出 Q3-1/2(Q1+Q2)
1.(5分)2010年中国国际新能源展览会于11月在南京举行,氢能技术及产品成为展览会上一大亮点。氢能最大的优点是热值高、无污染,其中1 g H2完全燃烧生成液态水放出142.9 kJ热量,下列反应的热化学方程式正确的是( )
A.2H2+O2====2H2O ΔH=-571.6 kJ/mol
B.H2(g)+1/2O2(g)====H2O(l) ΔH=-142.9 kJ/mol
C.H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ/mol
D.2H2(g)+O2(g)====2H2O(g) ΔH=-571.6 kJ/mol
【解析】选C。1 g H2即0.5 mol H2完全燃烧生成液态水放出142.9 kJ热量,故1 mol H2完全燃烧生成液态水放出285.8 kJ热量,2 mol H2完全燃烧生成液态水放出571.6 kJ热量,B、D错误,C正确,A项中的物质没有标明状态,错误。
2.(15分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量
变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)
的ΔH=-99 kJ·mol-1
请回答下列问题:
(1)该反应属于____反应(填“放热”或“吸热”)。
(2)图中A、C分别表示______、______。
(3)从化学键的角度分析,E、F、ΔH分别代表什么意义?
E______;F______;ΔH______。
(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小。E的大小对该反应的反应热有无影响?
___________________________________________。
(5)图中ΔH=______kJ·mol-1。
(6)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH′=
-Q kJ·mol-1,则ΔH______ΔH′,Q______99(填“>”、“<”或“=”)。
【解析】(1)因ΔH=-99 kJ·mol-1<0,故为放热反应。
(2)分析图像,纵坐标为能量变化,横坐标为反应过程,则A代表起始能量(即反应物的总能量),C代表终态能量(即生成物的总能量)。
(3)从化学键的角度分析化学反应的实质是旧化学键的断裂和新化学键的形成,故E代表断裂旧键吸收的能量,F表示形成新键释放的能量,ΔH表示断裂旧键吸收的能量与形成新键释放的能量差即反应的热效应。
(4)ΔH=生成物的总能量-反应物的总能量,由于E值改变时A和C并不发生变化,故对反应热无影响。
(5)图中ΔH应表示2 mol SO2(g)完全转化为2 mol SO3(g)时的焓变,即ΔH=-99 kJ·mol-1×2=-198 kJ·mol-1。
(6)比较ΔH大小时,要连同“+”、“-”号比较,类似于数学上的正负数比较,如果只比较反应放出或吸收热量的多少,则只比较数值大小,与“+”、“-”无关。由题意可知SO3的状态不同,则反应的ΔH也不相同。因为SO3(g)在转化为SO3(l)时会放热,即1 mol SO2(g)生成
1 mol SO3(l)释放的能量比生成1 mol SO3(g)释放的能量多,即Q>99,但ΔH>ΔH′。
答案:(1)放热
(2)反应物的总能量 生成物的总能量
(3)断裂旧键吸收的能量 形成新键释放的能量
2 mol SO2(g)完全氧化为2 mol SO3(g)时的焓变
(4)无影响 (5)-198 (6)> >
1.请思考分析是否所有的化学反应都有能量的变化?
提示:所有的化学反应都有能量的变化。因为化学反应的实质是旧化学键的断裂和新化学键的形成。断裂旧化学键要吸收能量,形成新化学键要放出能量,一个化学反应中断键吸收的能量与成键放出的能量不可能完全相等,故每个化学反应都会有能量的变化。
2.请结合已有知识思考,是否只有化学变化才会有能量变化?
提示:不是。有许多物理变化也常伴随着能量变化,如物质熔化、汽化、升华都要吸热,液化、凝固都会放热,物质在水中的溶解也有吸热或放热现象,这些都是物理变化。
3.化学反应中的能量变化是否都是以热能的形式表现?
提示:不是。化学反应中的能量变化有些是以热能的形式表现,也有些以其他能量的形式表现,如光能、电能等。
4.请结合已有知识,思考常见的放热反应有哪些?
提示:常见的放热反应有:①燃烧反应 ②中和反应
③活泼金属与酸或盐溶液的反应
④碱性氧化物与水的反应 ⑤铝热反应等。
5.探究反应条件与吸热反应、放热反应的关系:
(1)加热条件下进行的反应是否一定是吸热反应?不需
加热就能进行的反应是否一定是放热反应?
提示:不一定。加热条件下进行的反应不一定是吸热反
应,如2Na+O2 Na2O2是放热反应。不需加热就能进
行的反应不一定是放热反应,如NH4Cl与Ba(OH)2·8H2O
反应是吸热反应,常温下即可发生,不需加热。
△
====
(2)放热反应是否一定不需加热?吸热反应是否一定必须加热?
提示:根据上面的两个例子:2Na+O2 Na2O2和NH4Cl与Ba(OH)2·8H2O反应可知,放热反应可能需要加热,吸热反应也可能不需要加热。因此化学反应是吸热反应还是放热反应与反应条件无关,而是决定于反应物的总能量与生成物的总能量的相对大小。
△
====
【典例1】如图所示,把试管放入
盛有25 ℃饱和澄清石灰水的烧杯
中,试管中开始放入几小块镁片,
再用滴管滴5 mL稀盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是_____
__________________________________________。
(2)产生上述现象的原因是___________________。
(3)写出有关反应的离子方程式________________。
(4)由实验推知MgCl2溶液和H2的总能量_____(填“大于”、“小于”或“等于”)镁片和稀盐酸的总能量。
【思路点拨】(1)镁与稀盐酸的反应是放热反应;
(2)Ca(OH)2的溶解度随温度升高而降低。
【自主解答】本题考查了反应中能量变化的实质及实际应用。镁片与稀盐酸的反应是放热反应,是由于反应物(Mg和HCl)的总能量高于生成物(MgCl2和H2)的总能量。放出的热量通过小试管传递给饱和石灰水溶液,使Ca(OH)2的溶解度降低而析出Ca(OH)2晶体。
答案:(1)镁片上有大量气泡产生,镁片逐渐溶解;烧杯中溶液变浑浊
(2)镁与稀盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体
(3)Mg+2H+====Mg2++H2↑ (4)小于
1.请讨论如何理解热化学方程式中的ΔH的单位kJ·mol-1?
提示:ΔH的单位是kJ·mol-1,但不一定是1 mol反应物反应吸收或放出的热量,如反应
①H2(g)+ O2(g)====H2O(l) ΔH1=-a kJ·mol-1
②2H2(g)+O2(g)====2H2O(l) ΔH2=-b kJ·mol-1
反应①中指1 mol H2(g)燃烧放出a kJ的热量,而②指2 mol H2(g)燃烧放出b kJ的热量。
2.请思考热化学方程式与普通化学方程式有什么区别?
提示:(1)热化学方程式,需要注明反应的焓变ΔH,正值为吸热,负值为放热,单位是kJ·mol-1。普通化学方程式不用注明。
(2)热化学方程式需要注明各物质的聚集状态。普通化学方程式不用注明,只是在生成物中标出“↓”或“↑”即可。
(3)热化学方程式需注明反应时的温度和压强(常温、常压时可不标),普通化学方程式不用注明。
(4)热化学方程式中,物质前的化学计量数只表示物质的量,故可用分数表示;普通化学方程式也表示微粒个数,不能用分数。
3.为什么书写热化学方程式时,必须注明各物质的聚集状态和反应时的温度和压强?
提示:因为物质在发生三态变化时,也有能量的变化。故物质的聚集状态影响反应的热效应。另外温度和压强也影响着物质的能量,所以书写热化学方程式时,需要注明物质的聚集状态和反应时的温度和压强。
【典例2】(2010·杭州高二检测)工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是
A.N2(g)+3H2(g)====2NH3(l)
ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)====2NH3(g)
ΔH=2(b-a) kJ·mol-1
C. N2(g)+ H2(g)====NH3(l)
ΔH=(b+c-a) kJ·mol-1
D. N2(g)+ H2(g)====NH3(g)
ΔH=(a+b) kJ·mol-1
【思路点拨】(1)生成物的聚集状态;
(2)根据反应物的总能量与生成物的总能量的相对大小确定ΔH的“+”或“-”。
【自主解答】选A。由图可知, mol N2(g)+ mol H2(g)
的总能量比1 mol NH3(g)的总能量高(b-a) kJ,故
N2(g)+ H2(g)====NH3(g)的ΔH=-(b-a) kJ·mol-1
=(a-b) kJ·mol-1,D错误;N2(g)+3H2(g)====2NH3(g)
ΔH=2(a-b) kJ·mol-1,B错误; mol N2(g)+ mol
H2(g)的总能量比1 mol NH3(l)的总能量高(b+c-a) kJ,
故 N2(g)+ H2(g)====NH3(l)的 ΔH=-(b+c
-a) kJ·mol-1=(a-b-c) kJ·mol-1,C错误;
N2(g)+3H2(g)====2NH3(l) ΔH=2(a-b-
c) kJ·mol-1,A正确。
知识点一:焓变、反应热
1.下列对化学反应的认识错误的是( )
A.必然会引起化学键的变化
B.必然会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
【解析】选C。有新物质生成的反应是化学反应,其实质是旧化学键的断裂和新化学键的形成,故A、B正确;在化学反应中伴随着能量的变化,通常表现为热量的变化,D正确;在化学反应中物质状态不一定变化,如2CO+O2 2CO2,C错误。
点燃
====
2.已知反应X+Y====M+N为放热反应,下列对该反应的说法中正确的是( )
A.X和Y的总能量一定高于M和N的总能量
B.Y的能量一定高于N
C.X的能量一定高于M
D.因该反应为放热反应,故不必加热就可以发生反应
【解析】选A。放热反应说明反应物的总能量大于生成物的总能量,故A正确;但无法说明单一反应物与单一生成物的能量大小,所以B、C不正确;放热反应有时需加热才能引发,故D不正确。
知识点二:热化学方程式
3.(2010·梅州高二检测)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+3/2O2(g)====CO2(g)+2H2O(l)
ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=+1 452 kJ·mol-1
【解析】选B。本题考查热化学方程式的书写,首先应
准确计算1 mol甲醇完全燃烧时的反应热效应。1 mol
甲醇完全燃烧时放热22.68 kJ× ≈725.8 kJ,即
甲醇燃烧的焓变为ΔH=-725.8 kJ·mol-1,A项中
ΔH=+725.8 kJ·mol-1,错误;C、D两项中2 mol 甲
醇完全燃烧焓变为ΔH=-1 452 kJ·mol-1,故C、D错
误。
4. 分析图中的能量变化情况,下列判断正确的是( )
A.2A+B====2C ΔH<0
B.2C====2A+B ΔH<0
C.2A(g)+B(g)====2C(g) ΔH>0
D.2A(g)+B(g)====2C(g) ΔH<0
【解析】选C。表示化学反应的能量变化,必须注明物质的聚集状态,故选项A、B错误;从物质储存的能量高低来看,若2A(g)和B(g)为反应物,C(g)为生成物,则该反应是吸热反应,ΔH大于0,故C正确。
5.在一定条件下,A和B反应可生成C和D,其能量变化如下:
(1)下列有关反应A+B====C+D的说法正确的是____。
A.反应前后原子的种类和数目一定不变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需加热反应就一定能自发进行
D.反应物的总质量与生成物的总质量一定相等,且遵循能量守恒
(2)若E1
【解析】化学反应既遵循质量守恒,又遵循能量守恒,在能量变化上体现为吸热反应或放热反应,任何化学反应都伴随着能量变化。当E1>E2时为放热反应,当E1
一、选择题(本题包括4小题,每小题4分,共16分)
1.(2010·西安高二检测)下列说法中,不正确的是
( )
A.ΔH的大小与热化学方程式的化学计量数有关
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为放热反应
C.生成物的总焓大于反应物的总焓时,反应放热,ΔH<0
D.在化学反应过程中,发生物质变化的同时一定发生能量变化
【解析】选C。本题考查化学变化与能量变化的关系及物质能量、化学键、焓变的关系。化学反应过程中,在发生物质变化的同时,还伴随有能量变化;因为形成化学键放出能量,破坏化学键吸收能量,故破坏生成物全部化学键所需的能量大于破坏反应物全部化学键所需要的能量时,反应放出热量;ΔH的大小与化学反应中物质的状态、反应所处的状况及物质的量多少等有关,即ΔH大小与热化学方程式的化学计量数有关。
2.热化学方程式中,化学式前的化学计量数表示的是
( )
A.分子个数 B.原子个数
C.物质质量 D.物质的量
【解析】选D。热化学方程式中,化学式前的化学计量数只表示物质的量,因此可以是分数也可以是整数,这区别于一般的化学方程式,一般的化学方程式的化学计量数表示的是分子个数和物质的量,因此只能是整数。
3.热化学方程式C(s)+H2O(g)====CO(g)+H2(g)
ΔH=+131.3 kJ/mol表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
【解析】选C。依据反应热的概念,反应热表示按照热化学方程式中化学计量数的物质的量反应时,吸收或放出的热量,单位是kJ/mol,该热化学方程式表示:
1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收131.3 kJ的热量。特别要指明水的状态。
4.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。下列说法中不正确的是( )
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下难以发生反应
D.生成物硫化亚铁的总能量低于反应物铁粉和硫粉的总能量
【解析】选A。待反应一发生即停止加热,反应仍可持续进行,说明反应放热,放出的热量即可维持反应的进行,A错误,B、D正确;铁粉和硫粉混合后加热才能反应,说明此反应常温下难以发生,C正确。
二、非选择题(本题包括2小题,共14分)
5.(6分)(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下
1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是
___________________________________________。
(2)13 g C2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659 kJ的热量,该反应的热化学方程式为______
___________________________________________。
【解析】(1)甲硅烷自燃的化学方程式为SiH4+2O2====
SiO2+2H2O,1 g甲硅烷自燃放出热量44.6 kJ,则1 mol SiH4自燃放出热量44.6 kJ×32=1 427.2 kJ,故SiH4(g)
+2O2(g)====SiO2(s)+2H2O(l)的ΔH=-1 427.2 kJ/mol;
(2)C2H2(g)完全燃烧的化学方程式为2C2H2+5O2====
4CO2+2H2O,13 g C2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659 kJ的热量,则2 mol C2H2(g)完全燃烧生成CO2(g)和H2O(l)时,放出659 kJ×4=2 636 kJ的热量,故2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)的ΔH=
-2 636 kJ/mol。
答案:(1)SiH4(g)+2O2(g)====SiO2(s)+2H2O(l)
ΔH=-1 427.2 kJ/mol
(2)2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l)
ΔH=-2 636 kJ/mol
6.(8分)(1)已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol H2中的化学键消耗的能量为
Q1 kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2 kJ,
形成1 mol HCl中的化学键释放的能量为Q3 kJ,下列关系式正确的是______。
A.Q1+Q2>Q3 B.Q1+Q2
(2)生成1 mol HCl需要_______(填“放出”或“吸收”)_______kJ的能量。
【解析】正确理解化学反应中化学键的断裂和形成与反应热的关系。H2+Cl2====2HCl,形成化学键放出的能量为2Q3 kJ,断裂化学键吸收的能量为(Q1+Q2) kJ,因为此反应是放热反应,故Q1+Q2<2Q3。生成1 mol HCl放出的能量为形成化学键放出的能量和断裂化学键吸收的能量的差,即Q3-1/2(Q1+Q2)。
答案:(1)D (2)放出 Q3-1/2(Q1+Q2)
1.(5分)2010年中国国际新能源展览会于11月在南京举行,氢能技术及产品成为展览会上一大亮点。氢能最大的优点是热值高、无污染,其中1 g H2完全燃烧生成液态水放出142.9 kJ热量,下列反应的热化学方程式正确的是( )
A.2H2+O2====2H2O ΔH=-571.6 kJ/mol
B.H2(g)+1/2O2(g)====H2O(l) ΔH=-142.9 kJ/mol
C.H2(g)+1/2O2(g)====H2O(l) ΔH=-285.8 kJ/mol
D.2H2(g)+O2(g)====2H2O(g) ΔH=-571.6 kJ/mol
【解析】选C。1 g H2即0.5 mol H2完全燃烧生成液态水放出142.9 kJ热量,故1 mol H2完全燃烧生成液态水放出285.8 kJ热量,2 mol H2完全燃烧生成液态水放出571.6 kJ热量,B、D错误,C正确,A项中的物质没有标明状态,错误。
2.(15分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量
变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)
的ΔH=-99 kJ·mol-1
请回答下列问题:
(1)该反应属于____反应(填“放热”或“吸热”)。
(2)图中A、C分别表示______、______。
(3)从化学键的角度分析,E、F、ΔH分别代表什么意义?
E______;F______;ΔH______。
(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小。E的大小对该反应的反应热有无影响?
___________________________________________。
(5)图中ΔH=______kJ·mol-1。
(6)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH′=
-Q kJ·mol-1,则ΔH______ΔH′,Q______99(填“>”、“<”或“=”)。
【解析】(1)因ΔH=-99 kJ·mol-1<0,故为放热反应。
(2)分析图像,纵坐标为能量变化,横坐标为反应过程,则A代表起始能量(即反应物的总能量),C代表终态能量(即生成物的总能量)。
(3)从化学键的角度分析化学反应的实质是旧化学键的断裂和新化学键的形成,故E代表断裂旧键吸收的能量,F表示形成新键释放的能量,ΔH表示断裂旧键吸收的能量与形成新键释放的能量差即反应的热效应。
(4)ΔH=生成物的总能量-反应物的总能量,由于E值改变时A和C并不发生变化,故对反应热无影响。
(5)图中ΔH应表示2 mol SO2(g)完全转化为2 mol SO3(g)时的焓变,即ΔH=-99 kJ·mol-1×2=-198 kJ·mol-1。
(6)比较ΔH大小时,要连同“+”、“-”号比较,类似于数学上的正负数比较,如果只比较反应放出或吸收热量的多少,则只比较数值大小,与“+”、“-”无关。由题意可知SO3的状态不同,则反应的ΔH也不相同。因为SO3(g)在转化为SO3(l)时会放热,即1 mol SO2(g)生成
1 mol SO3(l)释放的能量比生成1 mol SO3(g)释放的能量多,即Q>99,但ΔH>ΔH′。
答案:(1)放热
(2)反应物的总能量 生成物的总能量
(3)断裂旧键吸收的能量 形成新键释放的能量
2 mol SO2(g)完全氧化为2 mol SO3(g)时的焓变
(4)无影响 (5)-198 (6)> >
