高中化学课时讲练通课件:13 金属的腐蚀与防护(苏教版选修4)
文档属性
| 名称 | 高中化学课时讲练通课件:13 金属的腐蚀与防护(苏教版选修4) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 00:00:00 | ||
图片预览









文档简介
(共62张PPT)
1.请分析比较金属发生化学腐蚀和电化学腐蚀的异同。
提示:
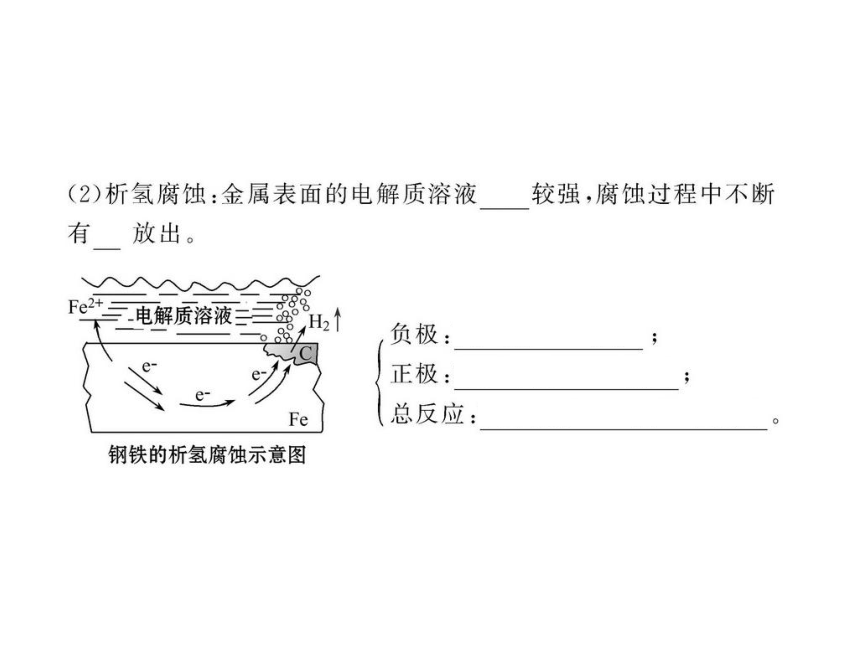
2.请思考金属发生析氢腐蚀和吸氧腐蚀对环境要求有何不同?
提示:金属发生析氢腐蚀是在酸性较强的环境中,而发生吸氧腐蚀是在中性或酸性很弱的环境中。
3.请思考,铁在常温下与O2和H2O反应极其缓慢,为什么钢铁制品很容易生锈?
提示:因为钢铁制品都是铁合金,其中含有一定量的碳元素,在潮湿的空气中,铁、碳和水蒸气中的电解质形成原电池,铁为负极被氧化,故钢铁制品易被腐蚀。
4.根据金属腐蚀的原理,解释以下现象。
(1)相对于在内河行驶的轮船来说,海轮更易被腐蚀。
提示:因为海水中含有较多的盐类,电解质溶液浓度较大,钢铁的电化学腐蚀速率快。
(2)用铜螺丝连接铁板时,铁板与螺丝的连接处腐蚀较快。
提示:铜比铁稳定,连接在一起时,形成原电池,铁做负极,腐蚀较快。
(3)农民使用铁制农具,用完后都要擦干净放在干燥处。
提示:金属在电解质溶液中才容易发生原电池反应被腐蚀,在干燥处,不易形成原电池,腐蚀较慢。
(4)遗留在南极的铁罐头盒很少生锈。
提示:金属在较高温度下才易被腐蚀,南极常年处于
0 ℃以下的低温,金属腐蚀较慢。
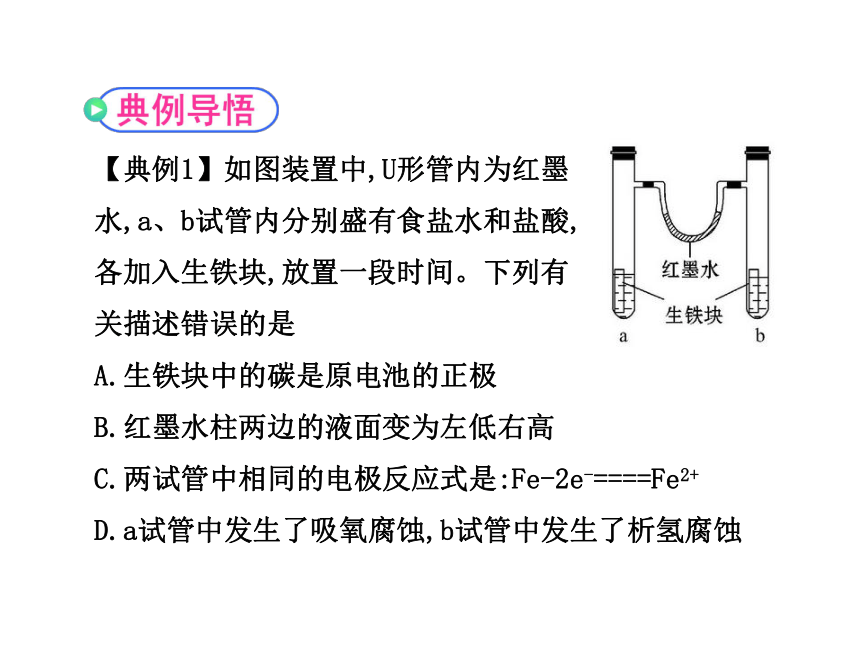
【典例1】如图装置中,U形管内为红墨
水,a、b试管内分别盛有食盐水和盐酸,
各加入生铁块,放置一段时间。下列有
关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-====Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【思路点拨】(1)活泼金属作负极。
(2)中性或弱碱性溶液中发生吸氧腐蚀,酸性溶液中发生析氢腐蚀。
【自主解答】选B。本题考查了电化学腐蚀中的析氢腐蚀和吸氧腐蚀,解答时注意电解质的酸碱性。a为中性环境,发生吸氧腐蚀,氧气被消耗,气体压强减小;b中酸性较强,发生析氢腐蚀,有氢气放出,气体压强增大,所以红墨水柱两边的液面变为左高右低,故B项错。
1.结合金属腐蚀的本质,分析金属防护的本质是什么?
提示:金属腐蚀的本质是金属被氧化剂氧化变成金属阳离子,因此金属防护的本质是避免金属接触氧化剂,或采取措施使金属不被氧化。
2.电镀是防止铁生锈的常用方法,请讨论常见的马口铁(表面镀锡)和白铁皮(表面镀锌)当镀层破损时,哪一种不容易被腐蚀?
提示:镀层破损后,镀层金属和铁在潮湿中的空气中会形成原电池。马口铁镀层破损后,锡、铁形成的原电池,铁为负极,锡为正极,加快铁的腐蚀速率。白铁皮镀层破损后,锌、铁形成的原电池锌为负极,铁为正极,锌被腐蚀,铁不易腐蚀。
3.请分析常用的电化学保护法:牺牲阳极的阴极保护法和外加电流的阴极保护法的实质有何共同之处?
提示:在电化学防护中使被保护的金属作发生还原反应的一极,即原电池的正极或电解池的阴极,不参与电极反应,从而不被氧化。
4.某些金属在表面形成一层致密的氧化膜,也能起到保护金属不被腐蚀的作用。请列举你所知道的该类例子。
提示:铁、铝遇冷的浓硫酸、浓硝酸钝化,铝制品在空气中不易被腐蚀。钢铁的发蓝、发黑。
5.你知道自行车的金属部件采用了什么样的防护措施吗 下面图示的各部件填上适当的防锈方法。
【典例2】(2010·北京高考)下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应式是Fe-3e-====Fe3+
【思路点拨】(1)被保护的金属接电源负极。
(2)Fe被腐蚀时先生成Fe2+。
【自主解答】选B。A中钢管与电源正极连接,成为电解池的阳极而溶解,加速了钢管的腐蚀,故A项不符合题意。铁遇冷浓硝酸表面钝化,形成了一层致密的氧化物保护膜,可保护内部不被腐蚀,故B正确。钢管与铜管露天堆放在一起,潮湿的空气作为电解质溶液,铜管为正极、钢管为负极发生电化学腐蚀,加速了钢管的腐蚀,故C项不合题意。钢铁发生析氢腐蚀时,负极反应式应是Fe-2e-====Fe2+,故D项不合题意。
知识点一:金属的电化学化腐蚀
1.下列关于钢铁析氢腐蚀的说法正确的是( )
A.铁为正极
B.碳为正极
C.溶液中氢离子浓度不变
D.此腐蚀在任何溶液中都发生
【解析】选B。钢铁在水膜酸性较强的环境中发生析氢腐蚀时,铁为负极,发生Fe-2e-====Fe2+,碳为正极,发生2H++2e-====H2↑,故溶液中氢离子浓度减小。只有选项B正确。
2.(2010·三明高二检测)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生的化学反应是( )
A.4Fe(OH)2+2H2O+O2====4Fe(OH)3
B.2Fe+2H2O+O2====2Fe(OH)2
C.2H2O+O2+4e-====4OH-
D.Fe-3e-====Fe3+
【解析】选D。该过程铁锅发生了吸氧腐蚀,负极反应:2Fe-4e-====2Fe2+,正极反应:O2+4e-+2H2O====4OH-,同时还发生:Fe2++2OH-====Fe(OH)2,4Fe(OH)2+O2+2H2O====
4Fe(OH)3,2Fe(OH)3====Fe2O3·xH2O+(3-x)H2O,D错误。
3.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比纯铁芯容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
【解析】选D。A.黄铜(铜锌合金)若发生电化学腐蚀时,被腐蚀的金属应是金属性较活泼的锌而不是铜,故黄铜制作的铜锣不易产生铜绿;B.生铁中含较多的碳,比纯铁芯(几乎是纯铁)在电解质作用下更容易形成原电池,也更容易生锈;C.铁质器件附有铜配件时,在接触电解质溶液时,铁是原电池的负极,易被腐蚀生成铁锈;
D.银质奖牌久置后可能被氧气或H2S氧化成银的化合物而表面变暗,这是化学腐蚀,与电化学腐蚀无关。
知识点二:金属的电化学防护
4.下列各种方法中,能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④ B.①③④⑤ C.①②④⑤ D.全部
【解析】选D。金属的腐蚀主要是电化学腐蚀,题目中①③④⑤的方法都可以起到避免金属和电解质溶液接触形成原电池的目的。②中如在金属中加入某些其他元素改变金属内部结构也可以起到防腐蚀的效果。
5.(2010·温州高二检测)下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不需要用特殊方法保存
D.锌跟稀硫酸反应时,滴加少量硫酸铜溶液后,反应速率加快
【解析】选C。A选项是通过构成Zn-Fe原电池,在船壳上加Zn块构成原电池负极,从而保护船体不被腐蚀;B项中镀锌铁若镀层破损后,则锌为负极,铁为正极,保护了铁。镀锡的铁镀层破损后,铁为负极铁被腐蚀,锡为正极被保护;C选项是靠氧化膜保护铝;D项中Zn与CuSO4溶液反应置换出Cu,形成Cu-Zn原电池,比直接的化学反应快。
6.(2010·营口高二检测)(1)金属腐蚀一般可分为化学腐蚀和______腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀主要属于____(填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应主要属于____腐蚀。
②吸氧腐蚀中,负极的电极反应式为______。铁锈中铁的化合价为______。
(3)如果在铁的表面镀上一层铜,就可以防止铁生锈,则在电镀过程中铁为____极,电极反应式为______,铜为____极,电极反应式为____________。
【解析】(1)金属的腐蚀根据其接触的物质和环境分为化学腐蚀和电化学腐蚀。
(2)铁在酸性条件下发生析氢腐蚀,在中性溶液中发生吸氧腐蚀,金属铁在电化学腐蚀中发生Fe-2e-====Fe2+反应,生成+2价的铁,但是经过一系列的反应生成的铁锈中Fe的化合价为+3价。
(3)电镀时,镀层金属做电解池的阳极,镀件做电解池的阴极,含有镀层金属的阳离子的电解质溶液做电解液。
答案:(1)电化学
(2)①析氢 吸氧 ②Fe-2e-====Fe2+ +3价
(3)阴 Cu2++2e-====Cu 阳 Cu-2e-====Cu2+
一、选择题(本题包括4小题,每小题3分,共12分)
1.下列关于金属腐蚀叙述正确的是( )
A.金属在潮湿情况下的腐蚀其实质是:
M+nH2O====M(OH)n+ H2↑
B.金属的化学腐蚀实质是M+ne-====Mn+,金属得电子被氧化成阳离子
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
【解析】选D。金属在潮湿的空气中易被腐蚀,但并不一定就是金属与水的反应,把金属腐蚀的条件及原理搞错,故A错;化学腐蚀是金属直接与周围接触的物质发生化学反应,金属失电子,被氧化,B不正确;金属发生化学腐蚀,只要有氧化剂即可,C错。
2.(2010·三明高二检测)下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率
B.钢铁在干燥的空气里不易被腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.金属的电化学腐蚀比化学腐蚀更普遍
【解析】选C。锌与CuSO4反应生成的Cu与锌、稀H2SO4构成原电池,加快电子的转移,A正确;干燥的空气中钢铁不易发生腐蚀,B正确;因为铝比铁活泼,发生电化学腐蚀时,铝作负极,铁作正极被保护,C正确;因为金属制品通常所处外部环境干燥度较低,O2又广泛存在,所以电化学腐蚀更普遍,D正确。
3.(2010·泉州高二检测)下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
A.4>2>1>3>5>6 B.4>6>2>1>3>5
C.5>4>2>3>1>6 D.6>3>5>2>4>1
【解析】选B。铁被腐蚀由快到慢顺序:电解池的阳极(4)>原电池的负极(2与6)>吸氧腐蚀(1)>原电池的正极(3)>电解池的阴极(5),故选B。
4.(2009·广东理基)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O====2Fe(OH)2;
②4Fe(OH)2+O2+2H2O====4Fe(OH)3;
③2Fe(OH)3====Fe2O3+3H2O。
下列说法正确的是( )
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
【解析】选A。解题时应依据方程式逐项判断或计算。①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,故A项正确;①中H2O的H、O两元素的化合价没有变,故不是氧化剂,故B项错;铜和钢构成原电池,钢腐蚀速率加快,故C项错;钢铁是铁和碳的混合物,在潮湿的空气中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。
二、非选择题(本题包括2小题,共18分)
5.(10分)如图所示,水槽中试管内有一枚
铁钉,放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于
______(填“化学”或“电化学”)腐蚀。
(2)若试管内液面上升,则原溶液呈______性,发生______腐蚀,电极反应:负极:______________,
正极:_______________。
(3)若试管内液面下降,则原溶液呈______性,发生
______腐蚀,电极反应:负极:________________,正极:________________。
(4)若溶液甲为水,溶液乙为海水,则铁钉在____(填“甲”或“乙”)溶液中腐蚀的速度快。
【解析】(1)铁钉处在水槽中,铁作负极,碳作正极,发生的是电化学腐蚀。
(2)若试管内液面上升,说明试管中的气体(氧气)被消耗了,发生的是吸氧腐蚀,此时溶液呈弱酸性、中性或弱碱性,负极反应是Fe-2e-====Fe2+,正极反应是2H2O+O2
+4e-====4OH-。
(3)若试管内液面下降,说明产生了气体,发生的是析氢腐蚀,此时溶液呈酸性,放出了H2,负极反应是Fe-2e-
====Fe2+,正极反应是2H++2e-====H2↑。
(4)若溶液甲为水,溶液乙为海水,因为海水中电解质溶液的浓度大,腐蚀的速率会加快,故乙快。
答案:(1)电化学 (2)弱酸性、中性或弱碱性 吸氧
Fe-2e-====Fe2+ 2H2O+O2+4e-====4OH-
(3)酸性 析氢 Fe-2e-====Fe2+ 2H++2e-====H2↑
(4)乙
6.(8分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为_____________________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的______极。
【解析】(1)发生吸氧腐蚀时,负极上Fe失电子,正极上O2得到电子。(2)铁闸门上连接一块比铁活泼的金属如锌,则锌会失去电子而溶解,Fe被保护,属于牺牲阳极的阴极保护法。(3)属于外加电流的阴极保护法,需把被保护的铁闸门连接在电源的负极。
答案:(1)负极:2Fe-4e-====2Fe2+,
正极:O2+2H2O+4e-====4OH-
(2)C (3)负
1.(5分)铁生锈是一种常见的自然现
象,其主要的化学反应方程式为:
4Fe+3O2+xH2O====2Fe2O3·xH2O。
如图为一放在水槽中的铁架,水位
高度如图。最容易生锈的铁架横杆是
( )
A.① B.② C.③ D.④
【解析】选C。此处铁生锈属于吸氧腐蚀。④处没有和电解质溶液接触,不能构成原电池,锈蚀速率较慢;①②③处已与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。
2.(15分)(2010·广州高二检测)某探究小组用铁钉被腐蚀的快慢实验来研究防止钢铁腐蚀的方法。所用试剂有:材质相同的无锈铁钉数个、食盐水、碳酸水、植物油各多量,实验温度为298 K、308 K,每次实验取用铁钉的数量相同。液体体积相同且足量,用大小相同的试管实验。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)请根据上述实验,判断下列有关钢铁制品防腐的说法正确的是_________。(填字母)
A.在铁门、铁窗表面涂上油漆
B.自行车各部件因有防护涂层或电镀等防腐措施,所以不需要停放在有遮雨的地方
C.家用铁制厨具每次用完后应擦干放置在干燥处
D.把挡水铁闸门与直流电源的正极连接且构成回路,可减少铁闸门的腐蚀速率
【解析】(1)实验Ⅰ探究不同电解质溶液对铁钉腐蚀快慢的影响,因此保证温度不变(仍为298 K),改变电解质溶液(选用碳酸水)。
实验Ⅱ探究温度对铁钉腐蚀快慢的影响,因此保证电解质溶液不变(仍为食盐水),改变温度(选308 K)。
实验Ⅲ探究铁钉是否接触电解质溶液对铁钉腐蚀快慢的影响。因此保证温度不变(仍为298 K),改变试管内液体(选植物油)。
(2)A项涂油漆保护铁门、铁窗,使铁门、铁窗与周围物质隔开,正确;放在干燥处,不易形成原电池,能降低腐蚀速率,B错误,C正确;D项挡水铁闸门应与直流电源的负极相连,使之作电解池的阴极,才能起到保护作用,D错误。
答案:(1)
(2)A、C
1.请分析比较金属发生化学腐蚀和电化学腐蚀的异同。
提示:
2.请思考金属发生析氢腐蚀和吸氧腐蚀对环境要求有何不同?
提示:金属发生析氢腐蚀是在酸性较强的环境中,而发生吸氧腐蚀是在中性或酸性很弱的环境中。
3.请思考,铁在常温下与O2和H2O反应极其缓慢,为什么钢铁制品很容易生锈?
提示:因为钢铁制品都是铁合金,其中含有一定量的碳元素,在潮湿的空气中,铁、碳和水蒸气中的电解质形成原电池,铁为负极被氧化,故钢铁制品易被腐蚀。
4.根据金属腐蚀的原理,解释以下现象。
(1)相对于在内河行驶的轮船来说,海轮更易被腐蚀。
提示:因为海水中含有较多的盐类,电解质溶液浓度较大,钢铁的电化学腐蚀速率快。
(2)用铜螺丝连接铁板时,铁板与螺丝的连接处腐蚀较快。
提示:铜比铁稳定,连接在一起时,形成原电池,铁做负极,腐蚀较快。
(3)农民使用铁制农具,用完后都要擦干净放在干燥处。
提示:金属在电解质溶液中才容易发生原电池反应被腐蚀,在干燥处,不易形成原电池,腐蚀较慢。
(4)遗留在南极的铁罐头盒很少生锈。
提示:金属在较高温度下才易被腐蚀,南极常年处于
0 ℃以下的低温,金属腐蚀较慢。
【典例1】如图装置中,U形管内为红墨
水,a、b试管内分别盛有食盐水和盐酸,
各加入生铁块,放置一段时间。下列有
关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-====Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【思路点拨】(1)活泼金属作负极。
(2)中性或弱碱性溶液中发生吸氧腐蚀,酸性溶液中发生析氢腐蚀。
【自主解答】选B。本题考查了电化学腐蚀中的析氢腐蚀和吸氧腐蚀,解答时注意电解质的酸碱性。a为中性环境,发生吸氧腐蚀,氧气被消耗,气体压强减小;b中酸性较强,发生析氢腐蚀,有氢气放出,气体压强增大,所以红墨水柱两边的液面变为左高右低,故B项错。
1.结合金属腐蚀的本质,分析金属防护的本质是什么?
提示:金属腐蚀的本质是金属被氧化剂氧化变成金属阳离子,因此金属防护的本质是避免金属接触氧化剂,或采取措施使金属不被氧化。
2.电镀是防止铁生锈的常用方法,请讨论常见的马口铁(表面镀锡)和白铁皮(表面镀锌)当镀层破损时,哪一种不容易被腐蚀?
提示:镀层破损后,镀层金属和铁在潮湿中的空气中会形成原电池。马口铁镀层破损后,锡、铁形成的原电池,铁为负极,锡为正极,加快铁的腐蚀速率。白铁皮镀层破损后,锌、铁形成的原电池锌为负极,铁为正极,锌被腐蚀,铁不易腐蚀。
3.请分析常用的电化学保护法:牺牲阳极的阴极保护法和外加电流的阴极保护法的实质有何共同之处?
提示:在电化学防护中使被保护的金属作发生还原反应的一极,即原电池的正极或电解池的阴极,不参与电极反应,从而不被氧化。
4.某些金属在表面形成一层致密的氧化膜,也能起到保护金属不被腐蚀的作用。请列举你所知道的该类例子。
提示:铁、铝遇冷的浓硫酸、浓硝酸钝化,铝制品在空气中不易被腐蚀。钢铁的发蓝、发黑。
5.你知道自行车的金属部件采用了什么样的防护措施吗 下面图示的各部件填上适当的防锈方法。
【典例2】(2010·北京高考)下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应式是Fe-3e-====Fe3+
【思路点拨】(1)被保护的金属接电源负极。
(2)Fe被腐蚀时先生成Fe2+。
【自主解答】选B。A中钢管与电源正极连接,成为电解池的阳极而溶解,加速了钢管的腐蚀,故A项不符合题意。铁遇冷浓硝酸表面钝化,形成了一层致密的氧化物保护膜,可保护内部不被腐蚀,故B正确。钢管与铜管露天堆放在一起,潮湿的空气作为电解质溶液,铜管为正极、钢管为负极发生电化学腐蚀,加速了钢管的腐蚀,故C项不合题意。钢铁发生析氢腐蚀时,负极反应式应是Fe-2e-====Fe2+,故D项不合题意。
知识点一:金属的电化学化腐蚀
1.下列关于钢铁析氢腐蚀的说法正确的是( )
A.铁为正极
B.碳为正极
C.溶液中氢离子浓度不变
D.此腐蚀在任何溶液中都发生
【解析】选B。钢铁在水膜酸性较强的环境中发生析氢腐蚀时,铁为负极,发生Fe-2e-====Fe2+,碳为正极,发生2H++2e-====H2↑,故溶液中氢离子浓度减小。只有选项B正确。
2.(2010·三明高二检测)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生的化学反应是( )
A.4Fe(OH)2+2H2O+O2====4Fe(OH)3
B.2Fe+2H2O+O2====2Fe(OH)2
C.2H2O+O2+4e-====4OH-
D.Fe-3e-====Fe3+
【解析】选D。该过程铁锅发生了吸氧腐蚀,负极反应:2Fe-4e-====2Fe2+,正极反应:O2+4e-+2H2O====4OH-,同时还发生:Fe2++2OH-====Fe(OH)2,4Fe(OH)2+O2+2H2O====
4Fe(OH)3,2Fe(OH)3====Fe2O3·xH2O+(3-x)H2O,D错误。
3.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比纯铁芯容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
【解析】选D。A.黄铜(铜锌合金)若发生电化学腐蚀时,被腐蚀的金属应是金属性较活泼的锌而不是铜,故黄铜制作的铜锣不易产生铜绿;B.生铁中含较多的碳,比纯铁芯(几乎是纯铁)在电解质作用下更容易形成原电池,也更容易生锈;C.铁质器件附有铜配件时,在接触电解质溶液时,铁是原电池的负极,易被腐蚀生成铁锈;
D.银质奖牌久置后可能被氧气或H2S氧化成银的化合物而表面变暗,这是化学腐蚀,与电化学腐蚀无关。
知识点二:金属的电化学防护
4.下列各种方法中,能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A.①②③④ B.①③④⑤ C.①②④⑤ D.全部
【解析】选D。金属的腐蚀主要是电化学腐蚀,题目中①③④⑤的方法都可以起到避免金属和电解质溶液接触形成原电池的目的。②中如在金属中加入某些其他元素改变金属内部结构也可以起到防腐蚀的效果。
5.(2010·温州高二检测)下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不需要用特殊方法保存
D.锌跟稀硫酸反应时,滴加少量硫酸铜溶液后,反应速率加快
【解析】选C。A选项是通过构成Zn-Fe原电池,在船壳上加Zn块构成原电池负极,从而保护船体不被腐蚀;B项中镀锌铁若镀层破损后,则锌为负极,铁为正极,保护了铁。镀锡的铁镀层破损后,铁为负极铁被腐蚀,锡为正极被保护;C选项是靠氧化膜保护铝;D项中Zn与CuSO4溶液反应置换出Cu,形成Cu-Zn原电池,比直接的化学反应快。
6.(2010·营口高二检测)(1)金属腐蚀一般可分为化学腐蚀和______腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀主要属于____(填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应主要属于____腐蚀。
②吸氧腐蚀中,负极的电极反应式为______。铁锈中铁的化合价为______。
(3)如果在铁的表面镀上一层铜,就可以防止铁生锈,则在电镀过程中铁为____极,电极反应式为______,铜为____极,电极反应式为____________。
【解析】(1)金属的腐蚀根据其接触的物质和环境分为化学腐蚀和电化学腐蚀。
(2)铁在酸性条件下发生析氢腐蚀,在中性溶液中发生吸氧腐蚀,金属铁在电化学腐蚀中发生Fe-2e-====Fe2+反应,生成+2价的铁,但是经过一系列的反应生成的铁锈中Fe的化合价为+3价。
(3)电镀时,镀层金属做电解池的阳极,镀件做电解池的阴极,含有镀层金属的阳离子的电解质溶液做电解液。
答案:(1)电化学
(2)①析氢 吸氧 ②Fe-2e-====Fe2+ +3价
(3)阴 Cu2++2e-====Cu 阳 Cu-2e-====Cu2+
一、选择题(本题包括4小题,每小题3分,共12分)
1.下列关于金属腐蚀叙述正确的是( )
A.金属在潮湿情况下的腐蚀其实质是:
M+nH2O====M(OH)n+ H2↑
B.金属的化学腐蚀实质是M+ne-====Mn+,金属得电子被氧化成阳离子
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
【解析】选D。金属在潮湿的空气中易被腐蚀,但并不一定就是金属与水的反应,把金属腐蚀的条件及原理搞错,故A错;化学腐蚀是金属直接与周围接触的物质发生化学反应,金属失电子,被氧化,B不正确;金属发生化学腐蚀,只要有氧化剂即可,C错。
2.(2010·三明高二检测)下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率
B.钢铁在干燥的空气里不易被腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.金属的电化学腐蚀比化学腐蚀更普遍
【解析】选C。锌与CuSO4反应生成的Cu与锌、稀H2SO4构成原电池,加快电子的转移,A正确;干燥的空气中钢铁不易发生腐蚀,B正确;因为铝比铁活泼,发生电化学腐蚀时,铝作负极,铁作正极被保护,C正确;因为金属制品通常所处外部环境干燥度较低,O2又广泛存在,所以电化学腐蚀更普遍,D正确。
3.(2010·泉州高二检测)下列各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
A.4>2>1>3>5>6 B.4>6>2>1>3>5
C.5>4>2>3>1>6 D.6>3>5>2>4>1
【解析】选B。铁被腐蚀由快到慢顺序:电解池的阳极(4)>原电池的负极(2与6)>吸氧腐蚀(1)>原电池的正极(3)>电解池的阴极(5),故选B。
4.(2009·广东理基)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O====2Fe(OH)2;
②4Fe(OH)2+O2+2H2O====4Fe(OH)3;
③2Fe(OH)3====Fe2O3+3H2O。
下列说法正确的是( )
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
【解析】选A。解题时应依据方程式逐项判断或计算。①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,故A项正确;①中H2O的H、O两元素的化合价没有变,故不是氧化剂,故B项错;铜和钢构成原电池,钢腐蚀速率加快,故C项错;钢铁是铁和碳的混合物,在潮湿的空气中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。
二、非选择题(本题包括2小题,共18分)
5.(10分)如图所示,水槽中试管内有一枚
铁钉,放置数天观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于
______(填“化学”或“电化学”)腐蚀。
(2)若试管内液面上升,则原溶液呈______性,发生______腐蚀,电极反应:负极:______________,
正极:_______________。
(3)若试管内液面下降,则原溶液呈______性,发生
______腐蚀,电极反应:负极:________________,正极:________________。
(4)若溶液甲为水,溶液乙为海水,则铁钉在____(填“甲”或“乙”)溶液中腐蚀的速度快。
【解析】(1)铁钉处在水槽中,铁作负极,碳作正极,发生的是电化学腐蚀。
(2)若试管内液面上升,说明试管中的气体(氧气)被消耗了,发生的是吸氧腐蚀,此时溶液呈弱酸性、中性或弱碱性,负极反应是Fe-2e-====Fe2+,正极反应是2H2O+O2
+4e-====4OH-。
(3)若试管内液面下降,说明产生了气体,发生的是析氢腐蚀,此时溶液呈酸性,放出了H2,负极反应是Fe-2e-
====Fe2+,正极反应是2H++2e-====H2↑。
(4)若溶液甲为水,溶液乙为海水,因为海水中电解质溶液的浓度大,腐蚀的速率会加快,故乙快。
答案:(1)电化学 (2)弱酸性、中性或弱碱性 吸氧
Fe-2e-====Fe2+ 2H2O+O2+4e-====4OH-
(3)酸性 析氢 Fe-2e-====Fe2+ 2H++2e-====H2↑
(4)乙
6.(8分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为_____________________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的______极。
【解析】(1)发生吸氧腐蚀时,负极上Fe失电子,正极上O2得到电子。(2)铁闸门上连接一块比铁活泼的金属如锌,则锌会失去电子而溶解,Fe被保护,属于牺牲阳极的阴极保护法。(3)属于外加电流的阴极保护法,需把被保护的铁闸门连接在电源的负极。
答案:(1)负极:2Fe-4e-====2Fe2+,
正极:O2+2H2O+4e-====4OH-
(2)C (3)负
1.(5分)铁生锈是一种常见的自然现
象,其主要的化学反应方程式为:
4Fe+3O2+xH2O====2Fe2O3·xH2O。
如图为一放在水槽中的铁架,水位
高度如图。最容易生锈的铁架横杆是
( )
A.① B.② C.③ D.④
【解析】选C。此处铁生锈属于吸氧腐蚀。④处没有和电解质溶液接触,不能构成原电池,锈蚀速率较慢;①②③处已与电解质溶液接触,但①②处含O2较少,所以③处腐蚀最快。
2.(15分)(2010·广州高二检测)某探究小组用铁钉被腐蚀的快慢实验来研究防止钢铁腐蚀的方法。所用试剂有:材质相同的无锈铁钉数个、食盐水、碳酸水、植物油各多量,实验温度为298 K、308 K,每次实验取用铁钉的数量相同。液体体积相同且足量,用大小相同的试管实验。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)请根据上述实验,判断下列有关钢铁制品防腐的说法正确的是_________。(填字母)
A.在铁门、铁窗表面涂上油漆
B.自行车各部件因有防护涂层或电镀等防腐措施,所以不需要停放在有遮雨的地方
C.家用铁制厨具每次用完后应擦干放置在干燥处
D.把挡水铁闸门与直流电源的正极连接且构成回路,可减少铁闸门的腐蚀速率
【解析】(1)实验Ⅰ探究不同电解质溶液对铁钉腐蚀快慢的影响,因此保证温度不变(仍为298 K),改变电解质溶液(选用碳酸水)。
实验Ⅱ探究温度对铁钉腐蚀快慢的影响,因此保证电解质溶液不变(仍为食盐水),改变温度(选308 K)。
实验Ⅲ探究铁钉是否接触电解质溶液对铁钉腐蚀快慢的影响。因此保证温度不变(仍为298 K),改变试管内液体(选植物油)。
(2)A项涂油漆保护铁门、铁窗,使铁门、铁窗与周围物质隔开,正确;放在干燥处,不易形成原电池,能降低腐蚀速率,B错误,C正确;D项挡水铁闸门应与直流电源的负极相连,使之作电解池的阴极,才能起到保护作用,D错误。
答案:(1)
(2)A、C
