高中化学全程学习方略课件:阶段质量评估一(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:阶段质量评估一(鲁科版必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 692.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 00:00:00 | ||
图片预览











文档简介
(共44张PPT)
(第1、2章)
(90分钟 100分)
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分)
1.有经验的阿姨在用氯气消毒过的自来水洗有色衣服之前,都会将自来水在日光下晒一段时间,目的是( )
A.使水中的杂质沉淀
B.使水中的HClO分解
C.起到杀菌作用
D.增加水中O2的含量
【解析】选B。氯气消毒过的自来水中含HClO,HClO具有漂白性,可使有色衣服退色,日光晒一段时间,可使HClO分解,2HClO====2HCl+O2↑。
2.(2010·嘉兴高一检测)世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于( )
A.氧化物 B.酸
C.碱 D.盐
【解析】选A。由两种元素组成,且其中一种为氧元素的化合物为氧化物。
3.下列叙述正确的是( )
A.直径介于1 nm~100 nm之间的微粒称为胶体
B.溶液呈电中性,胶体带有电荷
C.利用丁达尔现象可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
【解析】选C。直径在1 nm~100 nm之间的微粒形成的分散系是胶体,故A项错误;胶体中的胶粒带电荷,而胶体呈电中性,故B项错误;丁达尔现象是胶体特有的性质,溶液中无此现象,故C项正确;胶粒虽然很小,但不能透过半透膜,故D项错误。
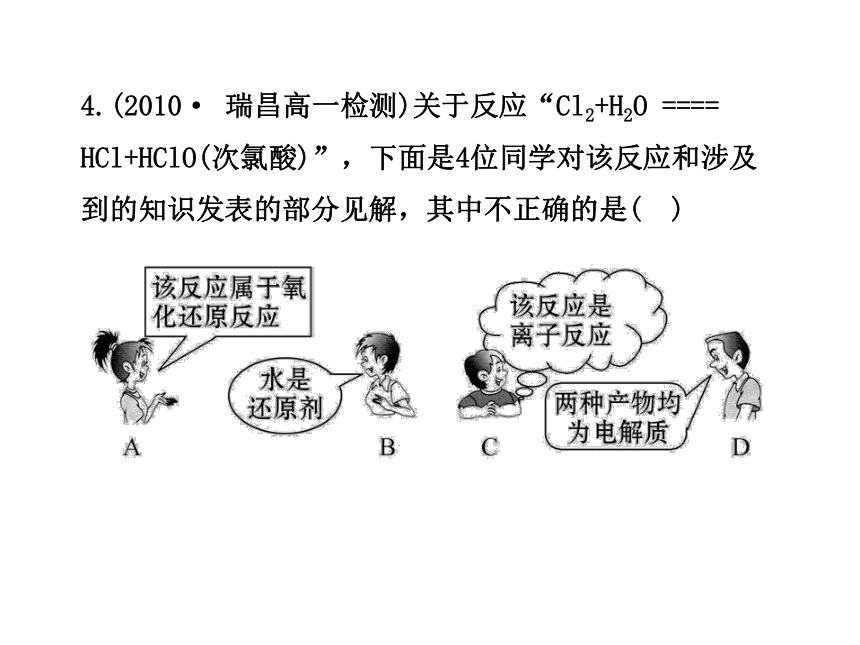
4.(2010· 瑞昌高一检测)关于反应“Cl2+H2O ==== HCl+HClO(次氯酸)”,下面是4位同学对该反应和涉及到的知识发表的部分见解,其中不正确的是( )
【解析】选B。Cl2与H2O反应,反应前后Cl元素的化合价有变化,是氧化还原反应;H2O中H、O两元素的化合价反应前后无变化,故H2O既不是氧化剂也不是还原剂;有离子参加或离子生成的反应是离子反应,该反应有离子生成,是离子反应;酸是电解质,HCl、HClO都是电解质。
5.查阅资料发现,金属钠不仅能够跟氧气和水反应,还能跟很多种其他物质发生反应,其中包括与酒精在常温下的反应,要研究金属钠和酒精反应的性质以及它与金属钠跟水反应的异同点,下列的研究方法中用不着的是
( )
A.分类法 B.观察法 C.实验法 D.比较法
【解析】选A。观察钠与酒精反应的现象,用的是观察法和实验法;对比钠与水反应的异同用的是比较法。故没有用到的方法是分类法。
6.能用H++OH-====H2O来表示的化学反应是( )
A.CuO溶于稀硫酸
B.澄清石灰水和HNO3溶液反应
C.KOH溶液和碳酸溶液反应
D.Ba(OH)2溶液和H2SO4溶液反应
【解析】选B。离子方程式H++OH-====H2O所表示的含义是可溶性强碱和强酸反应生成可溶性盐的反应。A选项中CuO是难溶性物质;C选项中碳酸是弱电解质;D选项中Ba(OH)2溶液和H2SO4溶液反应生成的BaSO4是难溶性物质。
7.为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选
用( )
A.烧碱溶液 B.浓氨水 C.镁粉 D.铁粉
【解析】选D。A、B项,可使Fe2+、Fe3+、Cu2+全部沉淀而无法除去杂质;C项,可引入Mg2+新杂质;D项,Fe2(SO4)3+Fe====3FeSO4,CuSO4+Fe====FeSO4+Cu,既可除去杂质,又未引入新杂质,故选D。
8.用NA表示阿伏加德罗常数的值,下列说法不正确的
是( )
A.4.4 g CO2中含有0.2NA个氧原子
B.3.9 g钾变为钾离子时失去电子数为0.1NA
C.18 g H2O中所含的电子数为10NA
D.在常温常压下,11.2 L氯气含有的分子数为0.5NA
【解析】选D。A项:4.4 g CO2的物质的量为4.4 g÷
44 g·mol-1=0.1 mol,其中含氧原子0.2 mol即0.2NA,正确;B项:3.9 g钾的物质的量为3.9 g÷
39 g·mol-1=0.1 mol,根据K → K++e-,即1 mol K变
为K+失去1 mol电子,则0.1 mol K变为K+时失去电子为0.1 mol,即0.1NA,正确;C项:18 g H2O其物质的量为18 g÷18 g·mol-1=1 mol,其中含电子数为10NA,正确;D项:常温常压不是标准状况,则11.2 L氯气的物质的量不为0.5 mol,所以所含分子数不是0.5NA,错误。
9.(2010·沂源高一检测)下列各组离子在无色水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl-、 SO42-
B.Ca2+、 HCO3- 、Cl-、K+
C.Mg2+、Cu2+、 NO3- 、Cl-
D.H+、Cl-、Na+、 CO32-
【解析】选B。A项,Ba2+与SO42-生成沉淀BaSO4,不能
大量共存;C项,Cu2+为蓝色;D项,H+与CO32-生成CO2
气体和H2O,不能大量共存。
10.(2010·南昌高一检测)下列分类标准不正确的是
( )
A.化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行)
B.分散系分为:溶液、胶体、浊液(标准:分散质粒子的大小)
C.化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化)
D.化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电)
【解析】选A。是否是离子反应,是根据反应中有无离子参加或生成划分的,离子反应不一定在水溶液中进行,也可在熔融状态下进行。
11.设NA为阿伏加德罗常数的值,标准状况下某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
【解析】
12.(双选)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+====2Fe3++2H2O
2Fe3++H2O2====2Fe2++O2↑+2H+
下列说法正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的酸性增强
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
【解析】选C、D。结合A、B两个方程式根据氧化性、还原性强弱比较规律:得H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,A错;2H2O2 ==== 2H2O+
O2↑,分解过程中,Fe2+作催化剂,溶液酸性不变,
B错,H2O2分解Fe3+或 Fe2+作催化剂,所以总量不变。
因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混
入Fe2+,D正确。
13.下面三种方法都可以制得Cl2。
①16HCl(浓)+2KMnO4====2KCl+2MnCl2+8H2O+5Cl2↑
②4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑
③O2+4HCl(气) 2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4
B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2
D.O2>KMnO4>MnO2
△
====
【解析】选B。上述三个反应中,还原剂都是HCl,氧化产物都是Cl2。而氧化剂分别是KMnO4、MnO2、O2。①式中KMnO4不需要条件可把HCl中的氯离子氧化成氯原子。②式中MnO2需要在加热条件下才能完成。③式中O2不仅需要加热,而且还需要CuCl2作催化剂才能完成。由此我们可以得出结论:氧化性KMnO4>MnO2>O2。
14.(2010·绍兴高一检测)若某氖原子的质量是a g,12C的原子质量是b g,NA表示阿伏加德罗常数,下列说法正确的是( )
A.该氖原子的相对原子质量一定是12b/a
B.该氖原子的摩尔质量是aNA g
C.W g该氖原子的物质的量一定是W/(aNA) mol
D.W g该氖原子所含质子数是W/a
【解析】选C。氖原子的相对原子质量
;摩尔质量以g·mol-1为单位
时,在数值上等于1 mol该物质的质量(以g为单位),
1 mol氖含 NA 个氖原子,1 mol氖的质量为a NA g,
但摩尔质量的单位是g·mol-1,故氖原子的摩尔质量为
a NA g·mol-1,C正确;W/a为W g氖中含氖原子的个数,
W g氖所含质子数为10W/a。
15.在KClO3+6HCl(浓) ====KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数比为( )
A.1∶6 B.6∶1 C.1∶5 D.5∶1
【解析】选D。同种元素的不同价态间发生氧化还原反应时,高价态和低价态相互反应变为它们相邻的中间价态(即“两头变中间,只靠拢,不交叉”)。因此,KClO3中的氯元素由+5价被还原为0价。HCl中氯元素由
-1价被氧化成0价,由得失电子守恒可知被氧化的氯原子和被还原的氯原子个数之比为5∶1。
第Ⅱ卷(非选择题 共55分)
二、非选择题(本题包括6小题,共55分)
16.(8分)看下面的漫画《金属钠的“避难所”》,回答下列问题:
(1)由此可知,金属钠“害怕”_________(填名称),其原因用化学方程式可以表示为_________。
(2)金属钠应该保存在______中,其原因是______。
(3)金属钠若露置于空气中,最终会成为________。
(4)金属钠在空气中加热时能生成___________,
该生成物的重要用途是用于呼吸面具上作为O2的来源,写出该反应的化学方程式_________________。
【解析】金属钠能与水和O2反应,所以金属钠通常保存在煤油中,金属钠在空气中变化的过程为:Na→Na2O
→NaOH→Na2CO3;钠与O2加热时生成Na2O2,Na2O2可与人呼出的CO2反应生成O2。
答案:(1)水
2Na+2H2O ==== 2NaOH+H2↑
(2)煤油 钠的密度比煤油的密度大,故钠沉在煤油底部,可以隔绝空气和水蒸气
(3)Na2CO3 (4)Na2O2
2Na2O2+2CO2 ==== 2Na2CO3+O2
17.(8分)有下列物质:①氢氧化钠固体;②铜丝;
③氯化氢气体;④稀硫酸;⑤二氧化碳气体;
⑥氨水;⑦碳酸钠粉末;⑧蔗糖晶体;⑨熔融氯化钠;⑩CuSO4·5H2O晶体
请用序号填空:
(1)上述状态下可导电的是_________。
(2)属于电解质的是_______________。
(3)属于非电解质的是_____________。
(4)上述状态下的电解质不能导电的是___________。
【解析】氢氧化钠固体、氯化氢气体、碳酸钠粉末、CuSO4·5H2O晶体不能导电,但它们溶于水或熔融状态下可导电,属于电解质;铜丝、稀硫酸、氨水、熔融氯化钠可以导电,但铜是单质,氨水、稀硫酸是混合物,它们既不是电解质也不是非电解质;二氧化碳气体和蔗糖晶体是非电解质,二氧化碳的水溶液虽然能导电,但由于发生电离的是二氧化碳与水反应生成的碳酸,二氧化碳并未发生电离,故二氧化碳是非电解质。
答案:(1)②④⑥⑨ (2)①③⑦⑨⑩ (3)⑤⑧
(4)①③⑦⑩
18.(8分)(2010·运城高一检测)2009年8月,一场“严查酒后驾驶”行动在全国展开,交警所用的酒精测试仪装有用硫酸酸化的三氧化铬(CrO3),遇司机呼出的酒精蒸气后,其颜色由红色变为蓝绿色,用这种现象可测得司机是否是酒后驾车。反应如下:2CrO3+3C2H5OH+3H2SO4
====Cr2(SO4)3+3CH3CHO+6H2O 此反应中的氧化剂是________。酒精的化学名称为乙醇,其结构简式为CH3CH2OH,其分子式为C2H6O,摩尔质量为_________。
检测人的血液中酒精的含量,参考指标常以两种计量单位表示。即“mmol/L”和“mg/100 mL”。以“mmol/L”
表示时,司机醉驾认定标准为血液中的酒精浓度达到17.4 mmol/L以上。若某司机血液酒精浓度检测结果为133 mg/100 mL。他(她)是否为醉酒驾车________(填“是”或“否”)。有一瓶500 mL的白酒含乙醇184 g,这瓶白酒中酒精的物质的量浓度为________mol/L。
【解析】反应方程式中Cr元素化合价由CrO3中的+6价被
还原到Cr2(SO4)3中的+3价,CrO3作氧化剂,C2H6O的摩尔
质量为(12×2+6+16)g·mol-1=46 g·mol-1;
133 mg/100 mL= =28.9 mmol/L
>17.4 mmol/L,是醉酒驾驶;500 mL白酒中的酒精的物
质的量浓度为 =8 mol·L-1。
答案:CrO3 46 g/mol 是 8
19.(12分)实验室要配制100 mL 1.0 mol·L-1的NaCl溶液,试回答下列各题。
(1)经计算,应该用托盘天平称取NaCl固体_____g。
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是________(填序号)。
A.锥形瓶,B.200 mL容量瓶,C.烧杯,D.胶头滴管,E.药匙,F.托盘天平,G.洗瓶
(3)若要实施配制,除上述仪器外,尚缺的仪器或用品是_____、_______。
(4)容量瓶上除有刻度线外还应标有_______、______,在使用前必须检查容量瓶是否________。
(5)配制过程有以下操作:A.移液,B.称量,C.洗涤,
D.定容,E.溶解,F.摇匀。
其正确的操作顺序应是_________(填序号)。
(6)下列四项错误操作会导致所得溶液浓度偏高的是_________(填序号)。
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线处
【解析】(1)所需NaCl的质量为m(NaCl)=0.1 L×
1.0 mol·L-1×58.5 g·mol-1=5.85 g,托盘天平只能
称准到0.1 g,所以应称5.9 g NaCl。
(2)配制NaCl溶液的步骤为:称量、溶解、移液、洗涤、定容、 摇匀,依次用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、100 mL容量瓶、胶头滴管。洗瓶可用于蒸馏水洗涤烧杯时。
(4)容量瓶上标温度、容积,使用前检查容量瓶是否漏水,因为配完溶液需倒转摇匀。
(6)选B。定容时仰视刻度线,加水太多,浓度偏低,俯视刻度线,加水太少,浓度偏高;C项,未洗涤,溶质损失,浓度偏低;D项,加水过多,浓度偏低。
答案:(1)5.9 (2)A、B
(3)玻璃棒 100 mL容量瓶
(4)温度 容积 漏水
(5)B、E、A、C、D、F
(6)B
20.(6分)已知反应:2H2CrO4+3H2O2 ====2Cr(OH)3+3O2↑
+2H2O。该反应中H2O2只发生如下变化过程:H2O2 → O2。
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是__________。
(3)在反应方程式中用双线桥法标明电子转移的方向和数目:2H2CrO4+3H2O2====2Cr(OH)3+3O2↑+2H2O
(4)若反应中转移了0.3 mol电子,则产生的气体在标准状况下体积为__________。
【解析】(1)分析该反应中元素化合价,发生变化的是Cr
与O,化合价升高的为O,则还原剂是H2O2。
(2)氧化剂H2CrO4发生还原反应,其过程为
H2CrO4 Cr(OH)3。
答案:(1)H2O2
(2)H2CrO4 Cr(OH)3
(3)
(4)3.36 L
21.(13分)A~H分别表示中学化学中常见的一种物质,它们之间的相互转化关系如图所示(部分反应物、生成物未列出)。
已知:C、D、E、F、G五种物质中均含有同一种元素;A为淡黄色固体化合物;G为红褐色固体;C为黑色固体。
(1)写出化学式:
A:________、C:__________、F:____________。
(2)写出反应的化学方程式:
②_______________________。
⑥_______________________。
(3)写出离子方程式:
③_______________________。
⑤_______________________。
(4)检验E中阳离子的最佳试剂是____________。
【解析】由F在空气中放置生成G,G为红褐色固体可推
知:G为Fe(OH)3,则F必为Fe(OH)2;而C、D、E、F、G
含同一种元素,所含元素应为Fe,则D中含Fe2+,E中含
Fe3+,由E与H反应生成Fe(OH)3可推知,H为碱;由C能转
化为Fe2+和Fe3+知,C只能为Fe3O4,则B为O2。而A为淡黄
色固体化合物,且能转化为O2和碱,则A为Na2O2,那么H
为NaOH。至于D、E具体为何种盐,可不必推测。
答案:(1)Na2O2 Fe3O4 Fe(OH)2
(2)②3Fe+2O2 Fe3O4
⑥4Fe(OH)2+O2+2H2O ====4Fe(OH)3
(3)③Fe3O4+8H+ ====Fe2++2Fe3++4H2O
⑤Fe3++3OH- ==== Fe(OH)3↓
(4)KSCN溶液
点燃
====
(第1、2章)
(90分钟 100分)
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分)
1.有经验的阿姨在用氯气消毒过的自来水洗有色衣服之前,都会将自来水在日光下晒一段时间,目的是( )
A.使水中的杂质沉淀
B.使水中的HClO分解
C.起到杀菌作用
D.增加水中O2的含量
【解析】选B。氯气消毒过的自来水中含HClO,HClO具有漂白性,可使有色衣服退色,日光晒一段时间,可使HClO分解,2HClO====2HCl+O2↑。
2.(2010·嘉兴高一检测)世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于( )
A.氧化物 B.酸
C.碱 D.盐
【解析】选A。由两种元素组成,且其中一种为氧元素的化合物为氧化物。
3.下列叙述正确的是( )
A.直径介于1 nm~100 nm之间的微粒称为胶体
B.溶液呈电中性,胶体带有电荷
C.利用丁达尔现象可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
【解析】选C。直径在1 nm~100 nm之间的微粒形成的分散系是胶体,故A项错误;胶体中的胶粒带电荷,而胶体呈电中性,故B项错误;丁达尔现象是胶体特有的性质,溶液中无此现象,故C项正确;胶粒虽然很小,但不能透过半透膜,故D项错误。
4.(2010· 瑞昌高一检测)关于反应“Cl2+H2O ==== HCl+HClO(次氯酸)”,下面是4位同学对该反应和涉及到的知识发表的部分见解,其中不正确的是( )
【解析】选B。Cl2与H2O反应,反应前后Cl元素的化合价有变化,是氧化还原反应;H2O中H、O两元素的化合价反应前后无变化,故H2O既不是氧化剂也不是还原剂;有离子参加或离子生成的反应是离子反应,该反应有离子生成,是离子反应;酸是电解质,HCl、HClO都是电解质。
5.查阅资料发现,金属钠不仅能够跟氧气和水反应,还能跟很多种其他物质发生反应,其中包括与酒精在常温下的反应,要研究金属钠和酒精反应的性质以及它与金属钠跟水反应的异同点,下列的研究方法中用不着的是
( )
A.分类法 B.观察法 C.实验法 D.比较法
【解析】选A。观察钠与酒精反应的现象,用的是观察法和实验法;对比钠与水反应的异同用的是比较法。故没有用到的方法是分类法。
6.能用H++OH-====H2O来表示的化学反应是( )
A.CuO溶于稀硫酸
B.澄清石灰水和HNO3溶液反应
C.KOH溶液和碳酸溶液反应
D.Ba(OH)2溶液和H2SO4溶液反应
【解析】选B。离子方程式H++OH-====H2O所表示的含义是可溶性强碱和强酸反应生成可溶性盐的反应。A选项中CuO是难溶性物质;C选项中碳酸是弱电解质;D选项中Ba(OH)2溶液和H2SO4溶液反应生成的BaSO4是难溶性物质。
7.为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选
用( )
A.烧碱溶液 B.浓氨水 C.镁粉 D.铁粉
【解析】选D。A、B项,可使Fe2+、Fe3+、Cu2+全部沉淀而无法除去杂质;C项,可引入Mg2+新杂质;D项,Fe2(SO4)3+Fe====3FeSO4,CuSO4+Fe====FeSO4+Cu,既可除去杂质,又未引入新杂质,故选D。
8.用NA表示阿伏加德罗常数的值,下列说法不正确的
是( )
A.4.4 g CO2中含有0.2NA个氧原子
B.3.9 g钾变为钾离子时失去电子数为0.1NA
C.18 g H2O中所含的电子数为10NA
D.在常温常压下,11.2 L氯气含有的分子数为0.5NA
【解析】选D。A项:4.4 g CO2的物质的量为4.4 g÷
44 g·mol-1=0.1 mol,其中含氧原子0.2 mol即0.2NA,正确;B项:3.9 g钾的物质的量为3.9 g÷
39 g·mol-1=0.1 mol,根据K → K++e-,即1 mol K变
为K+失去1 mol电子,则0.1 mol K变为K+时失去电子为0.1 mol,即0.1NA,正确;C项:18 g H2O其物质的量为18 g÷18 g·mol-1=1 mol,其中含电子数为10NA,正确;D项:常温常压不是标准状况,则11.2 L氯气的物质的量不为0.5 mol,所以所含分子数不是0.5NA,错误。
9.(2010·沂源高一检测)下列各组离子在无色水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl-、 SO42-
B.Ca2+、 HCO3- 、Cl-、K+
C.Mg2+、Cu2+、 NO3- 、Cl-
D.H+、Cl-、Na+、 CO32-
【解析】选B。A项,Ba2+与SO42-生成沉淀BaSO4,不能
大量共存;C项,Cu2+为蓝色;D项,H+与CO32-生成CO2
气体和H2O,不能大量共存。
10.(2010·南昌高一检测)下列分类标准不正确的是
( )
A.化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行)
B.分散系分为:溶液、胶体、浊液(标准:分散质粒子的大小)
C.化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化)
D.化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电)
【解析】选A。是否是离子反应,是根据反应中有无离子参加或生成划分的,离子反应不一定在水溶液中进行,也可在熔融状态下进行。
11.设NA为阿伏加德罗常数的值,标准状况下某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积应是( )
【解析】
12.(双选)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+====2Fe3++2H2O
2Fe3++H2O2====2Fe2++O2↑+2H+
下列说法正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的酸性增强
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
【解析】选C、D。结合A、B两个方程式根据氧化性、还原性强弱比较规律:得H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,A错;2H2O2 ==== 2H2O+
O2↑,分解过程中,Fe2+作催化剂,溶液酸性不变,
B错,H2O2分解Fe3+或 Fe2+作催化剂,所以总量不变。
因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混
入Fe2+,D正确。
13.下面三种方法都可以制得Cl2。
①16HCl(浓)+2KMnO4====2KCl+2MnCl2+8H2O+5Cl2↑
②4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑
③O2+4HCl(气) 2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4
B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2
D.O2>KMnO4>MnO2
△
====
【解析】选B。上述三个反应中,还原剂都是HCl,氧化产物都是Cl2。而氧化剂分别是KMnO4、MnO2、O2。①式中KMnO4不需要条件可把HCl中的氯离子氧化成氯原子。②式中MnO2需要在加热条件下才能完成。③式中O2不仅需要加热,而且还需要CuCl2作催化剂才能完成。由此我们可以得出结论:氧化性KMnO4>MnO2>O2。
14.(2010·绍兴高一检测)若某氖原子的质量是a g,12C的原子质量是b g,NA表示阿伏加德罗常数,下列说法正确的是( )
A.该氖原子的相对原子质量一定是12b/a
B.该氖原子的摩尔质量是aNA g
C.W g该氖原子的物质的量一定是W/(aNA) mol
D.W g该氖原子所含质子数是W/a
【解析】选C。氖原子的相对原子质量
;摩尔质量以g·mol-1为单位
时,在数值上等于1 mol该物质的质量(以g为单位),
1 mol氖含 NA 个氖原子,1 mol氖的质量为a NA g,
但摩尔质量的单位是g·mol-1,故氖原子的摩尔质量为
a NA g·mol-1,C正确;W/a为W g氖中含氖原子的个数,
W g氖所含质子数为10W/a。
15.在KClO3+6HCl(浓) ====KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数比为( )
A.1∶6 B.6∶1 C.1∶5 D.5∶1
【解析】选D。同种元素的不同价态间发生氧化还原反应时,高价态和低价态相互反应变为它们相邻的中间价态(即“两头变中间,只靠拢,不交叉”)。因此,KClO3中的氯元素由+5价被还原为0价。HCl中氯元素由
-1价被氧化成0价,由得失电子守恒可知被氧化的氯原子和被还原的氯原子个数之比为5∶1。
第Ⅱ卷(非选择题 共55分)
二、非选择题(本题包括6小题,共55分)
16.(8分)看下面的漫画《金属钠的“避难所”》,回答下列问题:
(1)由此可知,金属钠“害怕”_________(填名称),其原因用化学方程式可以表示为_________。
(2)金属钠应该保存在______中,其原因是______。
(3)金属钠若露置于空气中,最终会成为________。
(4)金属钠在空气中加热时能生成___________,
该生成物的重要用途是用于呼吸面具上作为O2的来源,写出该反应的化学方程式_________________。
【解析】金属钠能与水和O2反应,所以金属钠通常保存在煤油中,金属钠在空气中变化的过程为:Na→Na2O
→NaOH→Na2CO3;钠与O2加热时生成Na2O2,Na2O2可与人呼出的CO2反应生成O2。
答案:(1)水
2Na+2H2O ==== 2NaOH+H2↑
(2)煤油 钠的密度比煤油的密度大,故钠沉在煤油底部,可以隔绝空气和水蒸气
(3)Na2CO3 (4)Na2O2
2Na2O2+2CO2 ==== 2Na2CO3+O2
17.(8分)有下列物质:①氢氧化钠固体;②铜丝;
③氯化氢气体;④稀硫酸;⑤二氧化碳气体;
⑥氨水;⑦碳酸钠粉末;⑧蔗糖晶体;⑨熔融氯化钠;⑩CuSO4·5H2O晶体
请用序号填空:
(1)上述状态下可导电的是_________。
(2)属于电解质的是_______________。
(3)属于非电解质的是_____________。
(4)上述状态下的电解质不能导电的是___________。
【解析】氢氧化钠固体、氯化氢气体、碳酸钠粉末、CuSO4·5H2O晶体不能导电,但它们溶于水或熔融状态下可导电,属于电解质;铜丝、稀硫酸、氨水、熔融氯化钠可以导电,但铜是单质,氨水、稀硫酸是混合物,它们既不是电解质也不是非电解质;二氧化碳气体和蔗糖晶体是非电解质,二氧化碳的水溶液虽然能导电,但由于发生电离的是二氧化碳与水反应生成的碳酸,二氧化碳并未发生电离,故二氧化碳是非电解质。
答案:(1)②④⑥⑨ (2)①③⑦⑨⑩ (3)⑤⑧
(4)①③⑦⑩
18.(8分)(2010·运城高一检测)2009年8月,一场“严查酒后驾驶”行动在全国展开,交警所用的酒精测试仪装有用硫酸酸化的三氧化铬(CrO3),遇司机呼出的酒精蒸气后,其颜色由红色变为蓝绿色,用这种现象可测得司机是否是酒后驾车。反应如下:2CrO3+3C2H5OH+3H2SO4
====Cr2(SO4)3+3CH3CHO+6H2O 此反应中的氧化剂是________。酒精的化学名称为乙醇,其结构简式为CH3CH2OH,其分子式为C2H6O,摩尔质量为_________。
检测人的血液中酒精的含量,参考指标常以两种计量单位表示。即“mmol/L”和“mg/100 mL”。以“mmol/L”
表示时,司机醉驾认定标准为血液中的酒精浓度达到17.4 mmol/L以上。若某司机血液酒精浓度检测结果为133 mg/100 mL。他(她)是否为醉酒驾车________(填“是”或“否”)。有一瓶500 mL的白酒含乙醇184 g,这瓶白酒中酒精的物质的量浓度为________mol/L。
【解析】反应方程式中Cr元素化合价由CrO3中的+6价被
还原到Cr2(SO4)3中的+3价,CrO3作氧化剂,C2H6O的摩尔
质量为(12×2+6+16)g·mol-1=46 g·mol-1;
133 mg/100 mL= =28.9 mmol/L
>17.4 mmol/L,是醉酒驾驶;500 mL白酒中的酒精的物
质的量浓度为 =8 mol·L-1。
答案:CrO3 46 g/mol 是 8
19.(12分)实验室要配制100 mL 1.0 mol·L-1的NaCl溶液,试回答下列各题。
(1)经计算,应该用托盘天平称取NaCl固体_____g。
(2)若用NaCl固体配制溶液,下列仪器中,不需要用到的是________(填序号)。
A.锥形瓶,B.200 mL容量瓶,C.烧杯,D.胶头滴管,E.药匙,F.托盘天平,G.洗瓶
(3)若要实施配制,除上述仪器外,尚缺的仪器或用品是_____、_______。
(4)容量瓶上除有刻度线外还应标有_______、______,在使用前必须检查容量瓶是否________。
(5)配制过程有以下操作:A.移液,B.称量,C.洗涤,
D.定容,E.溶解,F.摇匀。
其正确的操作顺序应是_________(填序号)。
(6)下列四项错误操作会导致所得溶液浓度偏高的是_________(填序号)。
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线处
【解析】(1)所需NaCl的质量为m(NaCl)=0.1 L×
1.0 mol·L-1×58.5 g·mol-1=5.85 g,托盘天平只能
称准到0.1 g,所以应称5.9 g NaCl。
(2)配制NaCl溶液的步骤为:称量、溶解、移液、洗涤、定容、 摇匀,依次用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、100 mL容量瓶、胶头滴管。洗瓶可用于蒸馏水洗涤烧杯时。
(4)容量瓶上标温度、容积,使用前检查容量瓶是否漏水,因为配完溶液需倒转摇匀。
(6)选B。定容时仰视刻度线,加水太多,浓度偏低,俯视刻度线,加水太少,浓度偏高;C项,未洗涤,溶质损失,浓度偏低;D项,加水过多,浓度偏低。
答案:(1)5.9 (2)A、B
(3)玻璃棒 100 mL容量瓶
(4)温度 容积 漏水
(5)B、E、A、C、D、F
(6)B
20.(6分)已知反应:2H2CrO4+3H2O2 ====2Cr(OH)3+3O2↑
+2H2O。该反应中H2O2只发生如下变化过程:H2O2 → O2。
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是__________。
(3)在反应方程式中用双线桥法标明电子转移的方向和数目:2H2CrO4+3H2O2====2Cr(OH)3+3O2↑+2H2O
(4)若反应中转移了0.3 mol电子,则产生的气体在标准状况下体积为__________。
【解析】(1)分析该反应中元素化合价,发生变化的是Cr
与O,化合价升高的为O,则还原剂是H2O2。
(2)氧化剂H2CrO4发生还原反应,其过程为
H2CrO4 Cr(OH)3。
答案:(1)H2O2
(2)H2CrO4 Cr(OH)3
(3)
(4)3.36 L
21.(13分)A~H分别表示中学化学中常见的一种物质,它们之间的相互转化关系如图所示(部分反应物、生成物未列出)。
已知:C、D、E、F、G五种物质中均含有同一种元素;A为淡黄色固体化合物;G为红褐色固体;C为黑色固体。
(1)写出化学式:
A:________、C:__________、F:____________。
(2)写出反应的化学方程式:
②_______________________。
⑥_______________________。
(3)写出离子方程式:
③_______________________。
⑤_______________________。
(4)检验E中阳离子的最佳试剂是____________。
【解析】由F在空气中放置生成G,G为红褐色固体可推
知:G为Fe(OH)3,则F必为Fe(OH)2;而C、D、E、F、G
含同一种元素,所含元素应为Fe,则D中含Fe2+,E中含
Fe3+,由E与H反应生成Fe(OH)3可推知,H为碱;由C能转
化为Fe2+和Fe3+知,C只能为Fe3O4,则B为O2。而A为淡黄
色固体化合物,且能转化为O2和碱,则A为Na2O2,那么H
为NaOH。至于D、E具体为何种盐,可不必推测。
答案:(1)Na2O2 Fe3O4 Fe(OH)2
(2)②3Fe+2O2 Fe3O4
⑥4Fe(OH)2+O2+2H2O ====4Fe(OH)3
(3)③Fe3O4+8H+ ====Fe2++2Fe3++4H2O
⑤Fe3++3OH- ==== Fe(OH)3↓
(4)KSCN溶液
点燃
====
