高中化学全程学习方略课件:231 氧化剂和还原剂(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:231 氧化剂和还原剂(鲁科版必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 00:00:00 | ||
图片预览











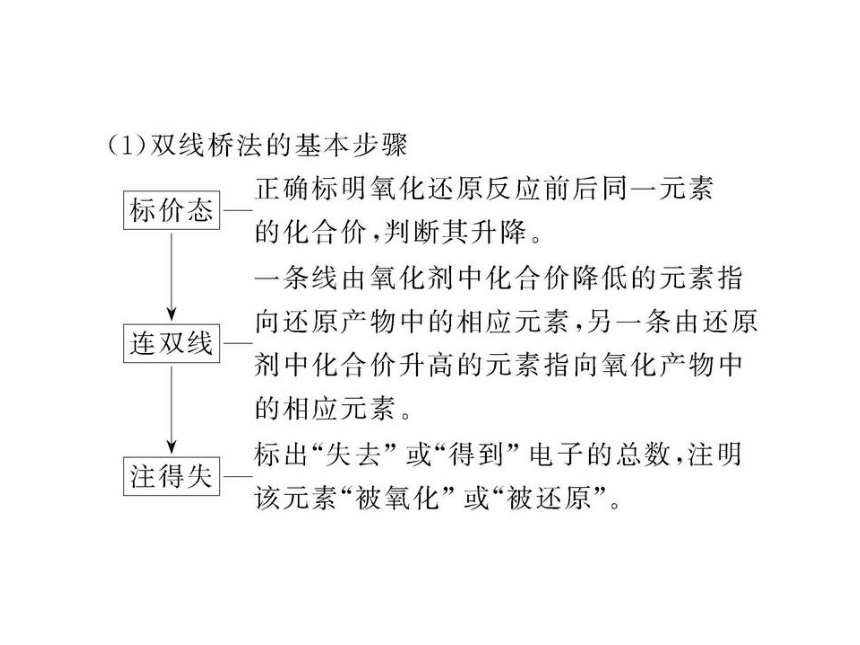
文档简介
(共66张PPT)
【例1】(2009·福建高考)下列类型的反应,一定发生电子转移的是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
【自主解答】选C。置换反应为一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,反应中单质元素的化合价一定发生了变化,故一定发生了电子的转移。
【变式训练】(2010·淮安高一检测)判断下列反应属于氧化还原反应的是( )
A.Fe+CuSO4====FeSO4+Cu
B.H2O+CaO====Ca(OH)2
C.AgNO3+NaCl====AgCl↓+NaNO3
D.2NaHCO3 △ Na2CO3+CO2↑+H2O
【解析】选A。A项,Fe被氧化,化合价升高,Cu元素被还原,化合价降低,是氧化还原反应;B项、C项、D项反应前后化合价无变化,不是氧化还原反应。
====
【例2】(2010·金山高一检测)溶液中氧化剂XO3-的含量有1.5×10-2 mol,与300 mL 0.1 mol/L亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物中元素X的价态是
A.+2 B.-2 C.+1 D.0
【规范解答】选C。n(Na2SO3)=0.3 L×0.1 mol·L-1
=0.03 mol,Na2SO3被氧化为Na2SO4,化合价升高总数为[+6-(+4)]×0.03 mol;设X被还原后的价态为y,则化合价降低总数为(+5-y)×1.5×10-2 mol,由化合价升高总数等于降低总数:(6-4)×0.03=(5-y)×1.5×10-2,
y=+1。
【变式训练】(2010·武汉高一检测)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量之比为3∶1,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的原子个数之比为( )
A.1∶4 B.1∶2 C.4∶1 D.2∶1
【解析】选D。Cl2与NaOH反应时,Cl2被氧化为ClO-和ClO3-,被还原为Cl-,根据化合价升高总数等于降低总数,设ClO-、ClO3-、Cl-的物质的量分别为3 mol、
1 mol、x,3 mol×1+1 mol×5=x·1,x=8 mol,被还原的氯元素与被氧化的氯元素的原子个数比为2∶1。
1.(2010·淮安高一检测)氧化还原反应的判断依据
是( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或电子对的偏移
D.氧原子的得失
【解析】选A。氧化还原反应的特征是反应过程中元素化合价有变化,所以应依据化合价的升降判断氧化还原反应。
2.下图为反应Fe+CuSO4====Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。Fe与CuSO4反应,Fe失电子被氧化,+2价Cu得电子被还原。
3.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的
是( )
A.木已成舟 B.铁杵成针
C.蜡炬成灰 D.滴水成冰
【解析】选C。蜡烛燃烧属氧化还原反应,木头做成舟,铁杵磨成针、滴水成冰都是物理变化。
4.下列有关氧化还原反应的叙述中,正确的是( )
A.化学反应中不一定所有元素的化合价都发生变化
B.氧化还原反应前后一定存在氧的得失
C.置换反应不一定属于氧化还原反应
D.化合反应和复分解反应不可能是氧化还原反应
【解析】选A。氧化还原反应不一定有氧参与,因而不一定存在氧的得失,如Na与Cl2反应生成NaCl;氧化还原反应中有元素的化合价发生变化,但不一定所有元素的化合价都发生变化,如Cl2与NaOH溶液反应,其中Na、O、H元素的化合价就没有改变,只有Cl元素的化合价发生改变;化合反应有单质参加时就是氧化还原反应,如H2与O2化合生成水。
5.已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;②Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O。
试回答下列问题:
(1)反应①中______元素被氧化,还原产物为______;反应②中______作还原剂,_____元素被还原。(填元素符号)
(2)当反应①生成2 g H2时,消耗H2SO4的质量是____g。
(3)反应②中生成32 g SO2气体时,消耗H2SO4的质量是_____g,其中有____g H2SO4被还原,转移电子____mol。
====
【解析】反应①中Fe元素化合价升高被氧化,发生氧化反应,对应氧化产物,H2SO4中氢元素化合价降低,被还原,发生还原反应,对应H2为还原产物;反应②中铜元素化合价升高,作还原剂,硫酸中S元素化合价降低被还原;反应①当有2 g H2生成时,消耗H2SO4的质量m(H2SO4)=n(H2SO4)·98 g·mol-1=n(H2)·98 g·mol-1
= ×98 g· mol-1=98 g;反应②中,生成的n(SO2)= =0.5 mol,消耗n(H2SO4)=2n(SO2)
=1 mol,m(H2SO4)=98 g,其中有一半的H2SO4即49 g H2SO4被还原,转移电子n(e-)=n(SO2)×2=1 mol。
答案:(1)Fe H2 Cu S (2)98 (3)98 49 1
A组
(30分钟 50分)
一、选择题(本题包括4小题,每小题6分,共24分)
1.氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
【解析】选A。金属冶炼都是将金属化合物还原成金属单质;燃放鞭炮属燃烧反应,是氧化还原反应;食物腐烂是有机物的氧化变质。配制生理盐水不发生化学变化。
2.下列氧化还原反应发生在同种元素之间的是( )
A.Zn+2HCl====ZnCl2+H2↑
B.2H2S+SO2====3S+2H2O
C.H2+CuO △ Cu+H2O
D.2H2O 通电 2H2↑+O2↑
【解析】选B。A项,Zn将H+还原;B项,H2S中-2价S将SO2中+4价S还原;C项,H2将CuO中+2价Cu还原;D项,H2O中+1价H将-2价O氧化。
====
====
3.(2010·兴仁高一检测)用下列方法:①2KMnO4====
K2MnO4+MnO2+O2↑ ②2KClO3====2KCl+3O2↑
③2H2O2 MnO2 2H2O+O2↑④2Na2O2+2H2O====4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
A.3∶2∶1∶4 B.1∶1∶1∶1
C.1∶2∶1∶2 D.2∶2∶1∶1
MnO2
△
====
【解析】选D。①2KMnO4 △ K2MnO4+MnO2+O2↑,每生成1 mol O2,转移4 mol电子;
②2KClO3====2KCl+3O2↑,生成1 mol O2,转移4 mol 电子;③、④中O2都是从-1价O氧化得来,每生成1 mol O2,转移2 mol电子。
====
MnO2
△
4.下列有关氧化还原反应的说法正确的是( )
A.化合价升高的物质发生氧化反应,被还原,作还原剂
B.化合价降低的物质发生还原反应,被还原,作氧化剂
C.失电子的物质发生还原反应,被氧化,作还原剂
D.得电子的物质发生还原反应,被氧化,作氧化剂
【解析】选B。失电子,化合价升高,发生氧化反应,被氧化,作还原剂;得电子,化合价降低,发生还原反应,被还原,作氧化剂,A、C、D均不完全正确,只有B正确。
二、非选择题(本题包括2小题,共26分)
5.(12分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH+18H2O====10Na[Al(OH)4]
+3N2↑。请回答下列问题:
(1)上述反应中,_____元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而____元素的化合价降低,则该元素的原子被_______(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的电子总数为_______。
【解析】Al元素化合价由0价升高到Na[Al(OH)4]中的+3价,1 mol Al失3 mol电子,10个Al原子反应转移电子数为30。N元素化合价由NaNO3中+5价降低到N2中的0价,该元素被还原。
答案:(1)Al 失去 N 还原
(2)30
6.(14分)(2010·金山高一检测)实验室里用二氧化锰与
浓盐酸反应来制取适量的氯气,反应方程式为MnO2
+4HCl(浓) △ MnCl2+Cl2↑+2H2O。现用100 mL的浓
盐酸与二氧化锰反应,生成的氯气在标准状况时的体积
为5.6 L,计算:
(1)用双线桥标出电子的转移。
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
====
【解析】(1)MnO2中Mn+4价,HCl中Cl-1价,MnCl2中Mn+2价,Cl2中Cl 0价,Mn由+4价到+2价,得2e-,Cl由-1价到0价,生成1 mol Cl2失2 mol 电子。
(2)n(Cl2)= =0.25 mol,
MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O
1 mol 1 mol
n(MnO2) 0.25 mol
n(MnO2)=0.25 mol,m(MnO2)=87 g·mol-1×0.25 mol
=21.75 g。
(3)每2 mol HCl被氧化生成1 mol Cl2,被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.25 mol=0.5 mol。
m(HCl)=36.5 g·mol-1×0.5 mol=18.25 g。
答案:(1)
(2)21.75 g (3)18.25 g
B组
1.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2
MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3-
C.MnO4- D.HNO2
【解析】选B。根据得失电子总数相等的原则,1 mol H2O2、IO3-、MnO4-、HNO2分别得2 mol、5 mol、5 mol、
1 mol电子,分别能氧化KI而得到I2为1 mol、2.5 mol、
2.5 mol、0.5 mol,而IO3-本身被还原能产生0.5 mol I2。
2.在加热氯酸钾的分解反应中,二氧化锰用做催化剂的问题,到目前还没有肯定的解释。鉴于制得的氧气里有氯气的气味,生成的氯化钾带紫红色,认为反应过程如下:
①2KClO3+2MnO2 △ 2A+B↑+C↑
②2A △ D+MnO2+C↑
③B+D △ 2KCl+MnO2+C↑
====
====
====
(1)写出A、B、C、D的化学式:A_____,B______,C__________,D_________。
(2)第①步反应中,被还原的元素是(填元素符号)______,第②步中氧化剂是_____,还原剂是______。
(3)写出第③步反应的化学方程式:___________。
【解析】由反应①得,B、C为O2、Cl2中的一种(但不能确定具体物质),则A中必含K、Mn两元素,根据反应②得,A为KMnO4,则D为K2MnO4,C为O2,所以B为Cl2,因反应②是氧化还原反应,且反应物只有一种,故氧化剂、还原剂都是KMnO4。对应的化学方程式为:
①2KClO3+2MnO2 △ 2KMnO4+Cl2↑+O2↑,
②2KMnO4 △ K2MnO4+MnO2+O2↑,
③Cl2+K2MnO4 △ 2KCl+MnO2+O2↑。
====
====
====
答案:(1)KMnO4 Cl2 O2 K2MnO4
(2)Cl KMnO4 KMnO4
(3)Cl2+K2MnO4 △ 2KCl+MnO2+O2↑
====
在配平H2O2、KMnO4、H2SO4三者反应的化学方程式时,出现多套配平系数,如
a.7H2O2+2KMnO4+3H2SO4====2MnSO4+6O2↑+K2SO4+10H2O
b.5H2O2+2KMnO4+3H2SO4====2MnSO4+5O2↑+K2SO4+8H2O
c.9H2O2+2KMnO4+3H2SO4====2MnSO4+7O2↑+K2SO4+12H2O
用H218O2进行示踪实验,(18O为示踪氧原子),证实生成的氧气全部是18O,根据这一实验事实,回答下列问题:
(1)该类反应遵循哪些守恒?另一部分18O在哪里?
(2)H2O2仅发生失电子的是哪个反应?
(3)可以将上述反应拆分成何反应?
(4)写出符合该规律的一个新的化学方程式。
【解析】(1)该类反应遵循元素守恒(质量守恒)、得失电子守恒、化合价升降守恒。另一部分18O在H2O中,因为2H218O2====2H218O+18O2↑。
(2)最简单的是b,H2O2只发生失电子的反应。
(3)比较三个反应,差别就是2H2O2====2H2O+O2↑,因此可拆分为2H2O2====2H2O+O2↑和反应b。
(4)按加合规律,写出化学方程式,如11H2O2+2KMnO4+3H2SO4====2MnSO4+8O2↑+K2SO4+14H2O。
答案:(1)元素守恒(质量守恒)、得失电子守恒、化合价升降守恒 H2O (2)b
(3)2H2O2====2H2O+O2↑和5H2O2+2KMnO4+3H2SO4====2MnSO4+5O2↑+K2SO4+8H2O
(4)11H2O2+2KMnO4+3H2SO4====2MnSO4+8O2↑+K2SO4+14H2O
1.在下列反应中,有气体产生,但不是氧化还原反应的是( )
A.过氧化钠与水反应 B.锌与稀硫酸反应
C.大理石与稀盐酸反应 D.氧化钠与水反应
【解析】选C。A项,2Na2O2+2H2O====4NaOH+O2↑,有气体产生,且是氧化还原反应;B项,Zn+H2SO4====
ZnSO4+H2↑,有气体产生,且是氧化还原反应;C项,CaCO3+2HCl====CaCl2+H2O+CO2↑,有气体产生,但不是氧化还原反应;D项,Na2O+H2O====2NaOH,无气体产生。
2.下列反应中不属于四种基本反应类型的是( )
A.2F2+2H2O====4HF+O2↑
B.AgNO3+NaCl====AgCl↓+NaNO3
C.3CO+Fe2O3 高温 2Fe+3CO2
D.MgCl2(熔融) 通电 Mg+Cl2↑
【解析】选C。四种基本反应类型包括:化合反应、分解反应、置换反应、复分解反应。A项属置换反应,B项属复分解反应,D项属分解反应。
====
====
3.Na2S2O3可做脱氯剂,已知25.0 mL 0.100 mol/L的Na2S2O3溶液可恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O32-将转化成( )
A.S2- B.S
C.SO32- D.SO42-
【解析】选D。标准状况下,224 mL Cl2即0.01 mol Cl2,全部转化成Cl-时得0.02 mol 电子,这些电子将由0.025 L×0.100 mol/L=0.002 5 mol Na2S2O3提供,设转化后S元素的化合价为x,则有关系式:0.002 5 mol
×2×(x-2)=0.02 mol,解得:x=+6。
4.相等物质的量的KClO3分别发生下述反应:①有MnO2存在时受热分解得到氧气;②无催化剂时,加热到470 ℃左右,得到KClO4和KCl、O2,下列关于①和②的说法中,不正确的是( )
A.都属于氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
【解析】选D。根据题意,反应①为2KClO3==== 2KCl
+3O2↑,反应②为2KClO3 470 ℃ KClO4+KCl+O2↑。可以
看出这两个反应都是氧化还原反应,被还原的元素都是
氯元素,而发生氧化反应的元素反应①是氧,反应②是
氯和氧。
MnO2
△
=====
5.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是( )
A.化合反应一定是氧化还原反应
B.分解反应一定是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
【解析】选C。化合反应不一定是氧化还原反应,如
CaO+H2O====Ca(OH)2;分解反应不一定是氧化还原反应,
如CaCO3 高温 CaO+CO2;复分解反应一定,不是氧化还
原反应。
====
6.(2010·黔西南高一检测)有以下反应方程式:
A.CuO+H2 △ Cu+H2O
B.2KClO3 △ 2KCl+3O2↑
C.Cl2+2NaOH====NaCl+NaClO+H2O
D.2FeBr2+3Cl2====2FeCl3+2Br2
E.MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O
F.2NaBr+Cl2====2NaCl+Br2
G.KClO3+6HCl(浓)====KCl+3Cl2↑+3H2O
H.HgS+O2====Hg+SO2
====
====
====
按要求将上述化学方程式序号填入相应括号内:
(1)一种单质使一种化合物中的一种元素被还原( )
(2)一种单质使一种化合物中的一种元素被氧化( )
(3)同一种物质中一种元素氧化另一种元素( )
(4)同一种物质中,同种元素间发生氧化还原反应( )
(5)不同物质的同种元素间发生氧化还原反应( )
(6)发生在不同物质间,只有部分元素被氧化或只有部分元素被还原的反应( )
(7)所有元素均参加氧化还原反应的是( )
【解析】A中,单质H2将化合物CuO还原;B中,KClO3中+5价Cl将-2价O氧化;C中,Cl2发生自身氧化还原,被还原成NaCl中-1价Cl,被氧化成NaClO中+1价Cl;D中,Cl2将FeBr2中+2价Fe和-1价Br氧化,所有元素发生氧化还原反应;E中,MnO2中+4价Mn将HCl中部分-1价Cl氧化;F中,Cl2将NaBr中-1价Br氧化;G中,KClO3中+5价Cl将HCl中-1价Cl氧化,属不同物质的同种元素间发生氧化还原反应;H中,O2将-2价S氧化成SO2中+4价S,Hg元素化合价由+2价变成0价。
答案:(1)A (2)F (3)B (4)C (5)G (6)E (7)D、H
【例1】(2009·福建高考)下列类型的反应,一定发生电子转移的是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
【自主解答】选C。置换反应为一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,反应中单质元素的化合价一定发生了变化,故一定发生了电子的转移。
【变式训练】(2010·淮安高一检测)判断下列反应属于氧化还原反应的是( )
A.Fe+CuSO4====FeSO4+Cu
B.H2O+CaO====Ca(OH)2
C.AgNO3+NaCl====AgCl↓+NaNO3
D.2NaHCO3 △ Na2CO3+CO2↑+H2O
【解析】选A。A项,Fe被氧化,化合价升高,Cu元素被还原,化合价降低,是氧化还原反应;B项、C项、D项反应前后化合价无变化,不是氧化还原反应。
====
【例2】(2010·金山高一检测)溶液中氧化剂XO3-的含量有1.5×10-2 mol,与300 mL 0.1 mol/L亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物中元素X的价态是
A.+2 B.-2 C.+1 D.0
【规范解答】选C。n(Na2SO3)=0.3 L×0.1 mol·L-1
=0.03 mol,Na2SO3被氧化为Na2SO4,化合价升高总数为[+6-(+4)]×0.03 mol;设X被还原后的价态为y,则化合价降低总数为(+5-y)×1.5×10-2 mol,由化合价升高总数等于降低总数:(6-4)×0.03=(5-y)×1.5×10-2,
y=+1。
【变式训练】(2010·武汉高一检测)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量之比为3∶1,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的原子个数之比为( )
A.1∶4 B.1∶2 C.4∶1 D.2∶1
【解析】选D。Cl2与NaOH反应时,Cl2被氧化为ClO-和ClO3-,被还原为Cl-,根据化合价升高总数等于降低总数,设ClO-、ClO3-、Cl-的物质的量分别为3 mol、
1 mol、x,3 mol×1+1 mol×5=x·1,x=8 mol,被还原的氯元素与被氧化的氯元素的原子个数比为2∶1。
1.(2010·淮安高一检测)氧化还原反应的判断依据
是( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或电子对的偏移
D.氧原子的得失
【解析】选A。氧化还原反应的特征是反应过程中元素化合价有变化,所以应依据化合价的升降判断氧化还原反应。
2.下图为反应Fe+CuSO4====Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。Fe与CuSO4反应,Fe失电子被氧化,+2价Cu得电子被还原。
3.成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的
是( )
A.木已成舟 B.铁杵成针
C.蜡炬成灰 D.滴水成冰
【解析】选C。蜡烛燃烧属氧化还原反应,木头做成舟,铁杵磨成针、滴水成冰都是物理变化。
4.下列有关氧化还原反应的叙述中,正确的是( )
A.化学反应中不一定所有元素的化合价都发生变化
B.氧化还原反应前后一定存在氧的得失
C.置换反应不一定属于氧化还原反应
D.化合反应和复分解反应不可能是氧化还原反应
【解析】选A。氧化还原反应不一定有氧参与,因而不一定存在氧的得失,如Na与Cl2反应生成NaCl;氧化还原反应中有元素的化合价发生变化,但不一定所有元素的化合价都发生变化,如Cl2与NaOH溶液反应,其中Na、O、H元素的化合价就没有改变,只有Cl元素的化合价发生改变;化合反应有单质参加时就是氧化还原反应,如H2与O2化合生成水。
5.已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;②Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O。
试回答下列问题:
(1)反应①中______元素被氧化,还原产物为______;反应②中______作还原剂,_____元素被还原。(填元素符号)
(2)当反应①生成2 g H2时,消耗H2SO4的质量是____g。
(3)反应②中生成32 g SO2气体时,消耗H2SO4的质量是_____g,其中有____g H2SO4被还原,转移电子____mol。
====
【解析】反应①中Fe元素化合价升高被氧化,发生氧化反应,对应氧化产物,H2SO4中氢元素化合价降低,被还原,发生还原反应,对应H2为还原产物;反应②中铜元素化合价升高,作还原剂,硫酸中S元素化合价降低被还原;反应①当有2 g H2生成时,消耗H2SO4的质量m(H2SO4)=n(H2SO4)·98 g·mol-1=n(H2)·98 g·mol-1
= ×98 g· mol-1=98 g;反应②中,生成的n(SO2)= =0.5 mol,消耗n(H2SO4)=2n(SO2)
=1 mol,m(H2SO4)=98 g,其中有一半的H2SO4即49 g H2SO4被还原,转移电子n(e-)=n(SO2)×2=1 mol。
答案:(1)Fe H2 Cu S (2)98 (3)98 49 1
A组
(30分钟 50分)
一、选择题(本题包括4小题,每小题6分,共24分)
1.氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
【解析】选A。金属冶炼都是将金属化合物还原成金属单质;燃放鞭炮属燃烧反应,是氧化还原反应;食物腐烂是有机物的氧化变质。配制生理盐水不发生化学变化。
2.下列氧化还原反应发生在同种元素之间的是( )
A.Zn+2HCl====ZnCl2+H2↑
B.2H2S+SO2====3S+2H2O
C.H2+CuO △ Cu+H2O
D.2H2O 通电 2H2↑+O2↑
【解析】选B。A项,Zn将H+还原;B项,H2S中-2价S将SO2中+4价S还原;C项,H2将CuO中+2价Cu还原;D项,H2O中+1价H将-2价O氧化。
====
====
3.(2010·兴仁高一检测)用下列方法:①2KMnO4====
K2MnO4+MnO2+O2↑ ②2KClO3====2KCl+3O2↑
③2H2O2 MnO2 2H2O+O2↑④2Na2O2+2H2O====4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
A.3∶2∶1∶4 B.1∶1∶1∶1
C.1∶2∶1∶2 D.2∶2∶1∶1
MnO2
△
====
【解析】选D。①2KMnO4 △ K2MnO4+MnO2+O2↑,每生成1 mol O2,转移4 mol电子;
②2KClO3====2KCl+3O2↑,生成1 mol O2,转移4 mol 电子;③、④中O2都是从-1价O氧化得来,每生成1 mol O2,转移2 mol电子。
====
MnO2
△
4.下列有关氧化还原反应的说法正确的是( )
A.化合价升高的物质发生氧化反应,被还原,作还原剂
B.化合价降低的物质发生还原反应,被还原,作氧化剂
C.失电子的物质发生还原反应,被氧化,作还原剂
D.得电子的物质发生还原反应,被氧化,作氧化剂
【解析】选B。失电子,化合价升高,发生氧化反应,被氧化,作还原剂;得电子,化合价降低,发生还原反应,被还原,作氧化剂,A、C、D均不完全正确,只有B正确。
二、非选择题(本题包括2小题,共26分)
5.(12分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH+18H2O====10Na[Al(OH)4]
+3N2↑。请回答下列问题:
(1)上述反应中,_____元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而____元素的化合价降低,则该元素的原子被_______(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的电子总数为_______。
【解析】Al元素化合价由0价升高到Na[Al(OH)4]中的+3价,1 mol Al失3 mol电子,10个Al原子反应转移电子数为30。N元素化合价由NaNO3中+5价降低到N2中的0价,该元素被还原。
答案:(1)Al 失去 N 还原
(2)30
6.(14分)(2010·金山高一检测)实验室里用二氧化锰与
浓盐酸反应来制取适量的氯气,反应方程式为MnO2
+4HCl(浓) △ MnCl2+Cl2↑+2H2O。现用100 mL的浓
盐酸与二氧化锰反应,生成的氯气在标准状况时的体积
为5.6 L,计算:
(1)用双线桥标出电子的转移。
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
====
【解析】(1)MnO2中Mn+4价,HCl中Cl-1价,MnCl2中Mn+2价,Cl2中Cl 0价,Mn由+4价到+2价,得2e-,Cl由-1价到0价,生成1 mol Cl2失2 mol 电子。
(2)n(Cl2)= =0.25 mol,
MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O
1 mol 1 mol
n(MnO2) 0.25 mol
n(MnO2)=0.25 mol,m(MnO2)=87 g·mol-1×0.25 mol
=21.75 g。
(3)每2 mol HCl被氧化生成1 mol Cl2,被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.25 mol=0.5 mol。
m(HCl)=36.5 g·mol-1×0.5 mol=18.25 g。
答案:(1)
(2)21.75 g (3)18.25 g
B组
1.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2
MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO3-
C.MnO4- D.HNO2
【解析】选B。根据得失电子总数相等的原则,1 mol H2O2、IO3-、MnO4-、HNO2分别得2 mol、5 mol、5 mol、
1 mol电子,分别能氧化KI而得到I2为1 mol、2.5 mol、
2.5 mol、0.5 mol,而IO3-本身被还原能产生0.5 mol I2。
2.在加热氯酸钾的分解反应中,二氧化锰用做催化剂的问题,到目前还没有肯定的解释。鉴于制得的氧气里有氯气的气味,生成的氯化钾带紫红色,认为反应过程如下:
①2KClO3+2MnO2 △ 2A+B↑+C↑
②2A △ D+MnO2+C↑
③B+D △ 2KCl+MnO2+C↑
====
====
====
(1)写出A、B、C、D的化学式:A_____,B______,C__________,D_________。
(2)第①步反应中,被还原的元素是(填元素符号)______,第②步中氧化剂是_____,还原剂是______。
(3)写出第③步反应的化学方程式:___________。
【解析】由反应①得,B、C为O2、Cl2中的一种(但不能确定具体物质),则A中必含K、Mn两元素,根据反应②得,A为KMnO4,则D为K2MnO4,C为O2,所以B为Cl2,因反应②是氧化还原反应,且反应物只有一种,故氧化剂、还原剂都是KMnO4。对应的化学方程式为:
①2KClO3+2MnO2 △ 2KMnO4+Cl2↑+O2↑,
②2KMnO4 △ K2MnO4+MnO2+O2↑,
③Cl2+K2MnO4 △ 2KCl+MnO2+O2↑。
====
====
====
答案:(1)KMnO4 Cl2 O2 K2MnO4
(2)Cl KMnO4 KMnO4
(3)Cl2+K2MnO4 △ 2KCl+MnO2+O2↑
====
在配平H2O2、KMnO4、H2SO4三者反应的化学方程式时,出现多套配平系数,如
a.7H2O2+2KMnO4+3H2SO4====2MnSO4+6O2↑+K2SO4+10H2O
b.5H2O2+2KMnO4+3H2SO4====2MnSO4+5O2↑+K2SO4+8H2O
c.9H2O2+2KMnO4+3H2SO4====2MnSO4+7O2↑+K2SO4+12H2O
用H218O2进行示踪实验,(18O为示踪氧原子),证实生成的氧气全部是18O,根据这一实验事实,回答下列问题:
(1)该类反应遵循哪些守恒?另一部分18O在哪里?
(2)H2O2仅发生失电子的是哪个反应?
(3)可以将上述反应拆分成何反应?
(4)写出符合该规律的一个新的化学方程式。
【解析】(1)该类反应遵循元素守恒(质量守恒)、得失电子守恒、化合价升降守恒。另一部分18O在H2O中,因为2H218O2====2H218O+18O2↑。
(2)最简单的是b,H2O2只发生失电子的反应。
(3)比较三个反应,差别就是2H2O2====2H2O+O2↑,因此可拆分为2H2O2====2H2O+O2↑和反应b。
(4)按加合规律,写出化学方程式,如11H2O2+2KMnO4+3H2SO4====2MnSO4+8O2↑+K2SO4+14H2O。
答案:(1)元素守恒(质量守恒)、得失电子守恒、化合价升降守恒 H2O (2)b
(3)2H2O2====2H2O+O2↑和5H2O2+2KMnO4+3H2SO4====2MnSO4+5O2↑+K2SO4+8H2O
(4)11H2O2+2KMnO4+3H2SO4====2MnSO4+8O2↑+K2SO4+14H2O
1.在下列反应中,有气体产生,但不是氧化还原反应的是( )
A.过氧化钠与水反应 B.锌与稀硫酸反应
C.大理石与稀盐酸反应 D.氧化钠与水反应
【解析】选C。A项,2Na2O2+2H2O====4NaOH+O2↑,有气体产生,且是氧化还原反应;B项,Zn+H2SO4====
ZnSO4+H2↑,有气体产生,且是氧化还原反应;C项,CaCO3+2HCl====CaCl2+H2O+CO2↑,有气体产生,但不是氧化还原反应;D项,Na2O+H2O====2NaOH,无气体产生。
2.下列反应中不属于四种基本反应类型的是( )
A.2F2+2H2O====4HF+O2↑
B.AgNO3+NaCl====AgCl↓+NaNO3
C.3CO+Fe2O3 高温 2Fe+3CO2
D.MgCl2(熔融) 通电 Mg+Cl2↑
【解析】选C。四种基本反应类型包括:化合反应、分解反应、置换反应、复分解反应。A项属置换反应,B项属复分解反应,D项属分解反应。
====
====
3.Na2S2O3可做脱氯剂,已知25.0 mL 0.100 mol/L的Na2S2O3溶液可恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O32-将转化成( )
A.S2- B.S
C.SO32- D.SO42-
【解析】选D。标准状况下,224 mL Cl2即0.01 mol Cl2,全部转化成Cl-时得0.02 mol 电子,这些电子将由0.025 L×0.100 mol/L=0.002 5 mol Na2S2O3提供,设转化后S元素的化合价为x,则有关系式:0.002 5 mol
×2×(x-2)=0.02 mol,解得:x=+6。
4.相等物质的量的KClO3分别发生下述反应:①有MnO2存在时受热分解得到氧气;②无催化剂时,加热到470 ℃左右,得到KClO4和KCl、O2,下列关于①和②的说法中,不正确的是( )
A.都属于氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
【解析】选D。根据题意,反应①为2KClO3==== 2KCl
+3O2↑,反应②为2KClO3 470 ℃ KClO4+KCl+O2↑。可以
看出这两个反应都是氧化还原反应,被还原的元素都是
氯元素,而发生氧化反应的元素反应①是氧,反应②是
氯和氧。
MnO2
△
=====
5.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是( )
A.化合反应一定是氧化还原反应
B.分解反应一定是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
【解析】选C。化合反应不一定是氧化还原反应,如
CaO+H2O====Ca(OH)2;分解反应不一定是氧化还原反应,
如CaCO3 高温 CaO+CO2;复分解反应一定,不是氧化还
原反应。
====
6.(2010·黔西南高一检测)有以下反应方程式:
A.CuO+H2 △ Cu+H2O
B.2KClO3 △ 2KCl+3O2↑
C.Cl2+2NaOH====NaCl+NaClO+H2O
D.2FeBr2+3Cl2====2FeCl3+2Br2
E.MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O
F.2NaBr+Cl2====2NaCl+Br2
G.KClO3+6HCl(浓)====KCl+3Cl2↑+3H2O
H.HgS+O2====Hg+SO2
====
====
====
按要求将上述化学方程式序号填入相应括号内:
(1)一种单质使一种化合物中的一种元素被还原( )
(2)一种单质使一种化合物中的一种元素被氧化( )
(3)同一种物质中一种元素氧化另一种元素( )
(4)同一种物质中,同种元素间发生氧化还原反应( )
(5)不同物质的同种元素间发生氧化还原反应( )
(6)发生在不同物质间,只有部分元素被氧化或只有部分元素被还原的反应( )
(7)所有元素均参加氧化还原反应的是( )
【解析】A中,单质H2将化合物CuO还原;B中,KClO3中+5价Cl将-2价O氧化;C中,Cl2发生自身氧化还原,被还原成NaCl中-1价Cl,被氧化成NaClO中+1价Cl;D中,Cl2将FeBr2中+2价Fe和-1价Br氧化,所有元素发生氧化还原反应;E中,MnO2中+4价Mn将HCl中部分-1价Cl氧化;F中,Cl2将NaBr中-1价Br氧化;G中,KClO3中+5价Cl将HCl中-1价Cl氧化,属不同物质的同种元素间发生氧化还原反应;H中,O2将-2价S氧化成SO2中+4价S,Hg元素化合价由+2价变成0价。
答案:(1)A (2)F (3)B (4)C (5)G (6)E (7)D、H
