高中化学全程学习方略课件:单元质量评估二(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:单元质量评估二(鲁科版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 18:28:22 | ||
图片预览









文档简介
(共41张PPT)
第2章 元素与物质世界
(45分钟 100分)
一、选择题(本题包括12小题,
每小题4分,共48分)
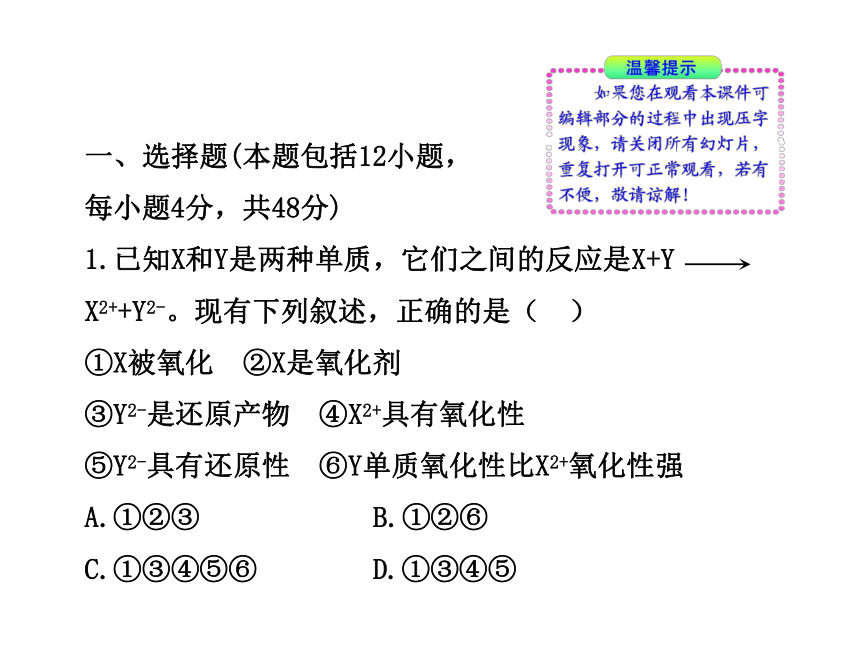
1.已知X和Y是两种单质,它们之间的反应是X+Y
X2++Y2-。现有下列叙述,正确的是( )
①X被氧化 ②X是氧化剂
③Y2-是还原产物 ④X2+具有氧化性
⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥
C.①③④⑤⑥ D.①③④⑤
是氧化剂,X2+是氧化产物,Y2-是还原产物。在X2+中X价态高于零价。所以X2+具有氧化性,Y2-中Y为-2价,在一定条件下可升高,所以具有还原性,因此①③④⑤判断是正确的,又因为氧化还原反应是强氧化剂和强还原剂反应,生成弱氧化剂和弱还原剂,所以Y的氧化性比X2+氧化性强。
【解析】
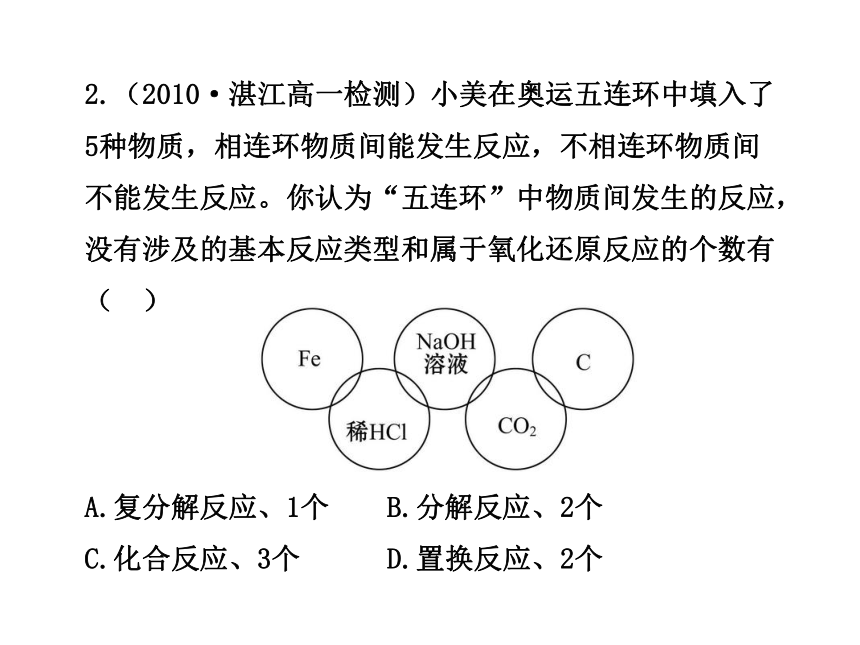
2.(2010·湛江高一检测)小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
A.复分解反应、1个 B.分解反应、2个
C.化合反应、3个 D.置换反应、2个
【解析】选B。Fe+2HCl====FeCl2+H2↑是置换反应,属于氧化还原反应;HCl+NaOH====NaCl+H2O是复分解反
应,不属于氧化还原反应;2NaOH+CO2====Na2CO3+H2O,不属于氧化还原反应,C+CO2====2CO是化合反应,属于氧化还原反应,没有涉及的基本反应类型是分解反应,氧化还原反应有2个。
3.下列说法正确的是( )
A.金属铜虽然易导电,但金属铜属于非电解质
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中电离的方程式可表示为:
Na2SO4====2Na++S6++4O2-
【解析】选B。金属铜是单质,既不是电解质,也不是非电解质。选项A说法错误;硫酸钡虽难溶于水,但硫酸钡溶于水的部分是完全电离的,因此硫酸钡属于强电解质,选项B说法正确;二氧化碳溶于水生成的碳酸能部分电离,碳酸是弱电解质,而二氧化碳是非电解质,选项C说法错误;硫酸钠在水中的电离方程式应为Na2SO4====2Na++SO42-,选项D错误。
4.下列反应可用离子方程式“Ba2++SO42-====BaSO4”表示的是( )
A.碳酸钡与稀硫酸
B.氢氧化钡与稀硫酸
C.氯化钡与硫酸钠
D.碳酸钡与硫酸氢钠
【解析】选C。A项中也有碳酸根离子与氢离子的反应,并且写离子方程式时BaCO3不能分开写;B项中也有氢氧根离子与氢离子的反应;D项中也有碳酸根离子与氢离子的反应,并且写离子方程式时BaCO3不能分开写,故答案为C。
5.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子能透过滤纸
C.“钴酞菁”分子所形成的分散系带电荷
D.此项工作可广泛应用于光电器件、生物技术等方面
【解析】选C。“钴酞菁”分子直径1.3×10-9 m,颗粒直径介于1 nm~100 nm之间,属于胶体,具有丁达尔效应,能透过滤纸。“钴酞菁”分子呈电中性,所形成的分散系中分散质颗粒能吸附电荷。
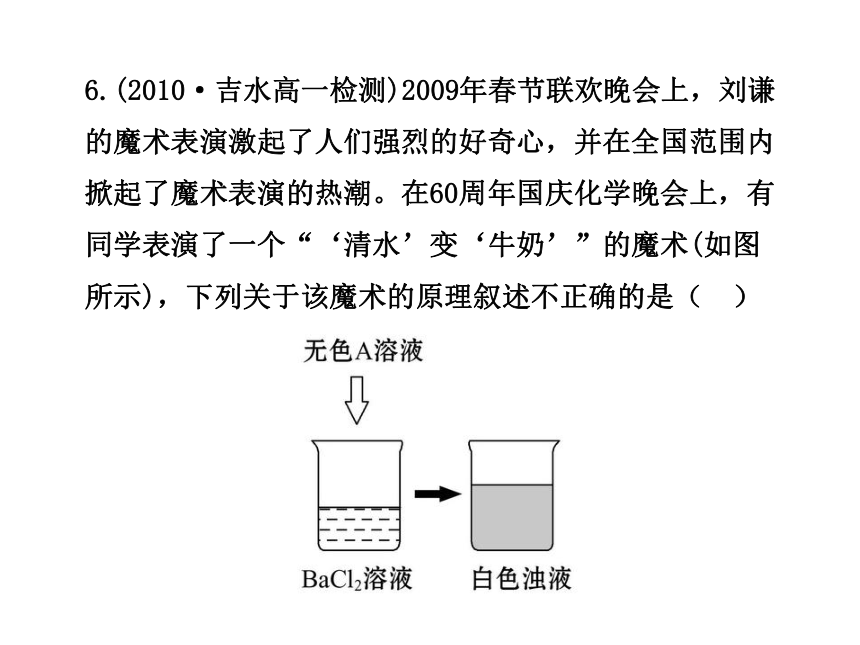
6.(2010·吉水高一检测)2009年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮。在60周年国庆化学晚会上,有同学表演了一个“‘清水’变‘牛奶’”的魔术(如图所示),下列关于该魔术的原理叙述不正确的是( )
A.无色A溶液可能是AgNO3溶液
B.无色A溶液可能是NaOH溶液
C.白色浊液的分散质可能是BaCO3
D.如A为硫酸,则反应不是氧化还原反应
【解析】选B。“清水”变“牛奶”的原理是生成白色沉淀,A项,2AgNO3+BaCl2====2AgCl↓+Ba(NO3)2;B项,NaOH与BaCl2不反应;若白色浊液的分散质是BaCO3,则A可为可溶性的碳酸盐,如Na2CO3等,C正确;若A为H2SO4,H2SO4+BaCl2====BaSO4↓+2HCl,符合。
7.下列实验可行的是( )
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
【解析】选A。选项B,除去Na2SO4的同时引入新的杂质BaCl2;选项C,KSCN溶液用于检验Fe3+而不是Fe2+,可用NaOH溶液来检验Fe2+;选项D,因CaCl2、NaCl均易溶于水,不能用溶解、过滤的方法来分离它们。
8.(2010·运城高一检测)厨房中的化学知识很多,下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.豆浆久置变质腐败
D.用分液法分离食用花生油中混有的水
【解析】选D。铁锅上的铁锈是铁发生氧化反应后的产物,主要成分是Fe2O3;CH4燃烧是与O2发生的氧化还原反应;豆浆腐败变质是有机物被氧化;花生油和水互不相溶,分离它们不是化学变化。
9.由相同条件下的三个反应:
2A-+B2====2B-+A2
2C-+A2====2A-+C2
2B-+D2====2D-+B2
判断下列说法正确的是( )
A.氧化性:A2>B2>C2>D2
B.还原性:A->B->C->D-
C.2A-+D2====2D-+A2反应可以进行
D.2C-+B2====2B-+C2反应不能进行
【解析】选C。氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,所以氧化性由强到弱的顺序是:D2>B2>A2>C2,还原性由强到弱的顺序是:C->A->B->D-,故A、B、D均错,C正确。
10.在强酸或强碱溶液中都能大量共存的是( )
A.K+、Cl-、NO3-、CO32-
B.K+、Fe2+、I-、SO42-
C.Na+、Cl-、NO3-、SO42-
D.Na+、Ca2+、Cl-、HCO3-
【解析】选C。A中的CO32-不能在强酸性溶液中存在;B中的Fe2+不能在强碱性溶液中存在;D中的HCO3-既不能在强酸性溶液中存在也不能在强碱性溶液中存在。
11.(2010·大连高一检测)M2O7x-和S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+====2M3++3S↓+7H2O,则
M2O7x-中M元素的化合价是( )
A.+2 B.+3 C.+4 D.+6
【解析】选D。设M2O7x-中M元素的化合价为a,根据氧化还原反应中化合价升高总数等于降低总数得2(a-3)=
3[0-(-2)],a=+6。
12.某学生设计了如图中的方法对A盐进行鉴定:
由此分析,下列结论中,正确的是( )
A.A中一定有Fe3+
B.C中一定有Fe3+
C.B为AgI沉淀
D.A一定为FeBr2溶液
【解析】选B。加入AgNO3溶液,生成淡黄色沉淀,说明有AgBr沉淀产生,即A溶液中有Br-。C中加KSCN溶液显红色,说明C溶液中有Fe3+,但是不能说明A溶液中一定有Fe3+,因为若A溶液中含有Fe2+,则加入酸化的AgNO3溶液后,酸性的NO3-可以将Fe2+氧化成Fe3+,而出现相同的现象,所以A溶液为FeBr2或FeBr3溶液。
二、非选择题(本题包括4小题,共52分)
13.(8分)A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。(阴阳离子均不重复)
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1)、(2)实验事实可推断它们的化学式为:
A________、B________、C_________、D________。
【解析】因A、B、C、D都是可溶性盐,故Ba2+不能与SO42-、CO32-组合;Ag+只能与NO3-组合;Cu2+不能与CO32-组合。
由(1)可知,C盐为铜盐。
由(2)可知,B盐为AgNO3。D盐含CO32-,而在溶液中CO32-与Ba2+、Ag+、Cu2+均不能大量共存,故D盐只可能为Na2CO3。余下的阳离子为Ba2+,故A盐含之;余下的阴离子为SO42-、Cl-,而在溶液中Ba2+与SO42-不能大量共存,故A盐只可能是BaCl2。因而C盐为CuSO4。
答案:BaCl2 AgNO3 CuSO4 Na2CO3
14.(16分)工业上制印刷电路板时常用FeCl3溶液作“腐蚀液”,发生的反应为
Cu+2FeCl3====CuCl2+2FeCl2
(1)在上述方程式上标出电子转移的方向和数目。
(2)该反应中被氧化的物质与被还原的物质的物质的量之比是_____。
(3)某同学取适量Fe2O3粉末(红棕色)加入适量盐酸,即得到了棕黄色的这种“腐蚀液”,发生的化学反应方程式为______。
用此溶液分别做如下实验。
①该同学取少量FeCl3溶液于试管中,滴入几滴NaOH溶液,生成红褐色沉淀,发生反应的离子方程式为
_____________。
②该同学取少量FeCl3溶液,加入过量铁粉,溶液由棕黄色变成浅绿色,经检验生成了FeCl2,写出反应的离子方程式___________________。
③该同学在小烧杯中加入20 mL蒸馏水,煮沸后,滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体。用激光笔照射烧杯中的液体,可以观察到液体中___________________________。
(4)使用过的“腐蚀液”会失效,但还可以回收利用,其中有一步反应需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是______(填序号)。
A.氯水 B.铁 C.铜 D.稀硫酸
【解析】Cu与FeCl3反应,1 mol Cu失2 mol e-被氧化,FeCl3得电子被还原。Fe2O3与HCl反应生成FeCl3和H2O,反应方程式为:Fe2O3+6HCl====2FeCl3+3H2O。FeCl3与NaOH反应生成Fe(OH)3和NaCl,反应方程式为FeCl3
+3NaOH====Fe(OH)3↓+3NaCl;FeCl3可被Fe还原,反应的离子方程式为:2Fe3++Fe====3Fe2+;可见光束通过Fe(OH)3胶体时,可观察到丁达尔现象;要将Fe2+氧化为Fe3+,应选氧化剂氯水。
答案:(1)
(2)1∶2
(3)Fe2O3+6HCl====2FeCl3+3H2O
①Fe3++3OH-====Fe(OH)3↓
②2Fe3++Fe====3Fe2+
③有一条光亮的通路(或有光路、或有丁达尔现象)
(4)A
15.(16分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,反应的化学方程式为3Fe+4H2O(g) 高温 Fe3O4+4H2。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
====
请回答该实验中的问题。
(1)该反应属于______(四种基本反应类型);并指明该氧化还原反应的还原剂是______,还原产物是_____。
(2)实验前第一步操作是_____________。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是
___________________________________________;
烧瓶底部放置了几片碎瓷片,碎瓷片的作用是______
_______________________。
(4)酒精灯和酒精喷灯点燃的顺序是______________,
为什么?____________________________。
(5)干燥管中盛装的物质是______,作用是______。
(6)试管中收集的气体是____,如果要在玻璃管A处点燃该气体,则必须对该气体进行_____________,方法是____________________________________________。
这一操作的目的是_____________________________。
【解析】(1)从反应方程式及反应中各元素化合价变化可知,该反应为置换反应,Fe为还原剂,H2为还原产物。
(2)实验前第一步操作是检查装置气密性。
(3)烧瓶中的水为Fe与H2O反应提供原料,加入碎瓷片防止暴沸。
(4)为了防止Fe与O2反应,先点燃酒精灯,排尽空气后再点燃酒精喷灯。
(5)干燥管中主要盛放固体干燥剂,如CaCl2、P2O5等。
(6)点燃H2前要验纯,防止发生危险。
答案:(1)置换反应 Fe H2
(2)检查装置气密性
(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸
(4)先点燃酒精灯,产生水蒸气排尽空气后,再点燃酒精喷灯 防止先点燃酒精喷灯所导致的Fe与O2的反应
(5)碱石灰干燥剂(答案不惟一) 除去反应产生的H2中的水蒸气
(6)H2 验纯 用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明产生的氢气不纯(含有氧气),如果是“噗”的声音,则证明是纯净的氢气 防止点燃时,氢气因含有氧气而爆炸
16.(12分)在500 mL 0.1 mol·L-1的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液,加入足量的AgNO3溶液,共得到2.009 g沉淀。问:原溶液中的Fe2+是否完全被氧化?若未完全氧化,试求Fe2+被氧化的质量分数(不考虑Cl2与H2O的反应)。
【解析】设被氧化的Fe2+的物质的量为x。
2Fe2++Cl2====2Fe3++2Cl-
2 mol 2 mol
x -0.1×0.5×2 mol
x=0.04 mol
被氧化的Fe2+: ×100%=80%
剩余的Fe2+:0.1 mol·L-1×0.5 L-0.04 mol=0.01 mol。
答案:没有完全氧化 80%
第2章 元素与物质世界
(45分钟 100分)
一、选择题(本题包括12小题,
每小题4分,共48分)
1.已知X和Y是两种单质,它们之间的反应是X+Y
X2++Y2-。现有下列叙述,正确的是( )
①X被氧化 ②X是氧化剂
③Y2-是还原产物 ④X2+具有氧化性
⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥
C.①③④⑤⑥ D.①③④⑤
是氧化剂,X2+是氧化产物,Y2-是还原产物。在X2+中X价态高于零价。所以X2+具有氧化性,Y2-中Y为-2价,在一定条件下可升高,所以具有还原性,因此①③④⑤判断是正确的,又因为氧化还原反应是强氧化剂和强还原剂反应,生成弱氧化剂和弱还原剂,所以Y的氧化性比X2+氧化性强。
【解析】
2.(2010·湛江高一检测)小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
A.复分解反应、1个 B.分解反应、2个
C.化合反应、3个 D.置换反应、2个
【解析】选B。Fe+2HCl====FeCl2+H2↑是置换反应,属于氧化还原反应;HCl+NaOH====NaCl+H2O是复分解反
应,不属于氧化还原反应;2NaOH+CO2====Na2CO3+H2O,不属于氧化还原反应,C+CO2====2CO是化合反应,属于氧化还原反应,没有涉及的基本反应类型是分解反应,氧化还原反应有2个。
3.下列说法正确的是( )
A.金属铜虽然易导电,但金属铜属于非电解质
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中电离的方程式可表示为:
Na2SO4====2Na++S6++4O2-
【解析】选B。金属铜是单质,既不是电解质,也不是非电解质。选项A说法错误;硫酸钡虽难溶于水,但硫酸钡溶于水的部分是完全电离的,因此硫酸钡属于强电解质,选项B说法正确;二氧化碳溶于水生成的碳酸能部分电离,碳酸是弱电解质,而二氧化碳是非电解质,选项C说法错误;硫酸钠在水中的电离方程式应为Na2SO4====2Na++SO42-,选项D错误。
4.下列反应可用离子方程式“Ba2++SO42-====BaSO4”表示的是( )
A.碳酸钡与稀硫酸
B.氢氧化钡与稀硫酸
C.氯化钡与硫酸钠
D.碳酸钡与硫酸氢钠
【解析】选C。A项中也有碳酸根离子与氢离子的反应,并且写离子方程式时BaCO3不能分开写;B项中也有氢氧根离子与氢离子的反应;D项中也有碳酸根离子与氢离子的反应,并且写离子方程式时BaCO3不能分开写,故答案为C。
5.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。“钴酞菁”分子的结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子能透过滤纸
C.“钴酞菁”分子所形成的分散系带电荷
D.此项工作可广泛应用于光电器件、生物技术等方面
【解析】选C。“钴酞菁”分子直径1.3×10-9 m,颗粒直径介于1 nm~100 nm之间,属于胶体,具有丁达尔效应,能透过滤纸。“钴酞菁”分子呈电中性,所形成的分散系中分散质颗粒能吸附电荷。
6.(2010·吉水高一检测)2009年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮。在60周年国庆化学晚会上,有同学表演了一个“‘清水’变‘牛奶’”的魔术(如图所示),下列关于该魔术的原理叙述不正确的是( )
A.无色A溶液可能是AgNO3溶液
B.无色A溶液可能是NaOH溶液
C.白色浊液的分散质可能是BaCO3
D.如A为硫酸,则反应不是氧化还原反应
【解析】选B。“清水”变“牛奶”的原理是生成白色沉淀,A项,2AgNO3+BaCl2====2AgCl↓+Ba(NO3)2;B项,NaOH与BaCl2不反应;若白色浊液的分散质是BaCO3,则A可为可溶性的碳酸盐,如Na2CO3等,C正确;若A为H2SO4,H2SO4+BaCl2====BaSO4↓+2HCl,符合。
7.下列实验可行的是( )
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
【解析】选A。选项B,除去Na2SO4的同时引入新的杂质BaCl2;选项C,KSCN溶液用于检验Fe3+而不是Fe2+,可用NaOH溶液来检验Fe2+;选项D,因CaCl2、NaCl均易溶于水,不能用溶解、过滤的方法来分离它们。
8.(2010·运城高一检测)厨房中的化学知识很多,下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.豆浆久置变质腐败
D.用分液法分离食用花生油中混有的水
【解析】选D。铁锅上的铁锈是铁发生氧化反应后的产物,主要成分是Fe2O3;CH4燃烧是与O2发生的氧化还原反应;豆浆腐败变质是有机物被氧化;花生油和水互不相溶,分离它们不是化学变化。
9.由相同条件下的三个反应:
2A-+B2====2B-+A2
2C-+A2====2A-+C2
2B-+D2====2D-+B2
判断下列说法正确的是( )
A.氧化性:A2>B2>C2>D2
B.还原性:A->B->C->D-
C.2A-+D2====2D-+A2反应可以进行
D.2C-+B2====2B-+C2反应不能进行
【解析】选C。氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,所以氧化性由强到弱的顺序是:D2>B2>A2>C2,还原性由强到弱的顺序是:C->A->B->D-,故A、B、D均错,C正确。
10.在强酸或强碱溶液中都能大量共存的是( )
A.K+、Cl-、NO3-、CO32-
B.K+、Fe2+、I-、SO42-
C.Na+、Cl-、NO3-、SO42-
D.Na+、Ca2+、Cl-、HCO3-
【解析】选C。A中的CO32-不能在强酸性溶液中存在;B中的Fe2+不能在强碱性溶液中存在;D中的HCO3-既不能在强酸性溶液中存在也不能在强碱性溶液中存在。
11.(2010·大连高一检测)M2O7x-和S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+====2M3++3S↓+7H2O,则
M2O7x-中M元素的化合价是( )
A.+2 B.+3 C.+4 D.+6
【解析】选D。设M2O7x-中M元素的化合价为a,根据氧化还原反应中化合价升高总数等于降低总数得2(a-3)=
3[0-(-2)],a=+6。
12.某学生设计了如图中的方法对A盐进行鉴定:
由此分析,下列结论中,正确的是( )
A.A中一定有Fe3+
B.C中一定有Fe3+
C.B为AgI沉淀
D.A一定为FeBr2溶液
【解析】选B。加入AgNO3溶液,生成淡黄色沉淀,说明有AgBr沉淀产生,即A溶液中有Br-。C中加KSCN溶液显红色,说明C溶液中有Fe3+,但是不能说明A溶液中一定有Fe3+,因为若A溶液中含有Fe2+,则加入酸化的AgNO3溶液后,酸性的NO3-可以将Fe2+氧化成Fe3+,而出现相同的现象,所以A溶液为FeBr2或FeBr3溶液。
二、非选择题(本题包括4小题,共52分)
13.(8分)A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。(阴阳离子均不重复)
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1)、(2)实验事实可推断它们的化学式为:
A________、B________、C_________、D________。
【解析】因A、B、C、D都是可溶性盐,故Ba2+不能与SO42-、CO32-组合;Ag+只能与NO3-组合;Cu2+不能与CO32-组合。
由(1)可知,C盐为铜盐。
由(2)可知,B盐为AgNO3。D盐含CO32-,而在溶液中CO32-与Ba2+、Ag+、Cu2+均不能大量共存,故D盐只可能为Na2CO3。余下的阳离子为Ba2+,故A盐含之;余下的阴离子为SO42-、Cl-,而在溶液中Ba2+与SO42-不能大量共存,故A盐只可能是BaCl2。因而C盐为CuSO4。
答案:BaCl2 AgNO3 CuSO4 Na2CO3
14.(16分)工业上制印刷电路板时常用FeCl3溶液作“腐蚀液”,发生的反应为
Cu+2FeCl3====CuCl2+2FeCl2
(1)在上述方程式上标出电子转移的方向和数目。
(2)该反应中被氧化的物质与被还原的物质的物质的量之比是_____。
(3)某同学取适量Fe2O3粉末(红棕色)加入适量盐酸,即得到了棕黄色的这种“腐蚀液”,发生的化学反应方程式为______。
用此溶液分别做如下实验。
①该同学取少量FeCl3溶液于试管中,滴入几滴NaOH溶液,生成红褐色沉淀,发生反应的离子方程式为
_____________。
②该同学取少量FeCl3溶液,加入过量铁粉,溶液由棕黄色变成浅绿色,经检验生成了FeCl2,写出反应的离子方程式___________________。
③该同学在小烧杯中加入20 mL蒸馏水,煮沸后,滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体。用激光笔照射烧杯中的液体,可以观察到液体中___________________________。
(4)使用过的“腐蚀液”会失效,但还可以回收利用,其中有一步反应需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是______(填序号)。
A.氯水 B.铁 C.铜 D.稀硫酸
【解析】Cu与FeCl3反应,1 mol Cu失2 mol e-被氧化,FeCl3得电子被还原。Fe2O3与HCl反应生成FeCl3和H2O,反应方程式为:Fe2O3+6HCl====2FeCl3+3H2O。FeCl3与NaOH反应生成Fe(OH)3和NaCl,反应方程式为FeCl3
+3NaOH====Fe(OH)3↓+3NaCl;FeCl3可被Fe还原,反应的离子方程式为:2Fe3++Fe====3Fe2+;可见光束通过Fe(OH)3胶体时,可观察到丁达尔现象;要将Fe2+氧化为Fe3+,应选氧化剂氯水。
答案:(1)
(2)1∶2
(3)Fe2O3+6HCl====2FeCl3+3H2O
①Fe3++3OH-====Fe(OH)3↓
②2Fe3++Fe====3Fe2+
③有一条光亮的通路(或有光路、或有丁达尔现象)
(4)A
15.(16分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,反应的化学方程式为3Fe+4H2O(g) 高温 Fe3O4+4H2。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
====
请回答该实验中的问题。
(1)该反应属于______(四种基本反应类型);并指明该氧化还原反应的还原剂是______,还原产物是_____。
(2)实验前第一步操作是_____________。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是
___________________________________________;
烧瓶底部放置了几片碎瓷片,碎瓷片的作用是______
_______________________。
(4)酒精灯和酒精喷灯点燃的顺序是______________,
为什么?____________________________。
(5)干燥管中盛装的物质是______,作用是______。
(6)试管中收集的气体是____,如果要在玻璃管A处点燃该气体,则必须对该气体进行_____________,方法是____________________________________________。
这一操作的目的是_____________________________。
【解析】(1)从反应方程式及反应中各元素化合价变化可知,该反应为置换反应,Fe为还原剂,H2为还原产物。
(2)实验前第一步操作是检查装置气密性。
(3)烧瓶中的水为Fe与H2O反应提供原料,加入碎瓷片防止暴沸。
(4)为了防止Fe与O2反应,先点燃酒精灯,排尽空气后再点燃酒精喷灯。
(5)干燥管中主要盛放固体干燥剂,如CaCl2、P2O5等。
(6)点燃H2前要验纯,防止发生危险。
答案:(1)置换反应 Fe H2
(2)检查装置气密性
(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气 防止暴沸
(4)先点燃酒精灯,产生水蒸气排尽空气后,再点燃酒精喷灯 防止先点燃酒精喷灯所导致的Fe与O2的反应
(5)碱石灰干燥剂(答案不惟一) 除去反应产生的H2中的水蒸气
(6)H2 验纯 用试管收集一试管气体,靠近酒精灯火焰,如果发出的声音是“啪”的爆鸣声,则证明产生的氢气不纯(含有氧气),如果是“噗”的声音,则证明是纯净的氢气 防止点燃时,氢气因含有氧气而爆炸
16.(12分)在500 mL 0.1 mol·L-1的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液,加入足量的AgNO3溶液,共得到2.009 g沉淀。问:原溶液中的Fe2+是否完全被氧化?若未完全氧化,试求Fe2+被氧化的质量分数(不考虑Cl2与H2O的反应)。
【解析】设被氧化的Fe2+的物质的量为x。
2Fe2++Cl2====2Fe3++2Cl-
2 mol 2 mol
x -0.1×0.5×2 mol
x=0.04 mol
被氧化的Fe2+: ×100%=80%
剩余的Fe2+:0.1 mol·L-1×0.5 L-0.04 mol=0.01 mol。
答案:没有完全氧化 80%
