高中化学全程学习方略课件:331 硫的转化(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:331 硫的转化(鲁科版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 18:28:22 | ||
图片预览









文档简介
(共61张PPT)
【例】(双选)关于硫的叙述正确的是
A.黑火药爆炸的反应中,硫元素化合价降低,显还原
性,硫与金属或非金属反应均作氧化剂
B.分离黑火药中的硝酸钾、炭、硫要用到二硫化碳、水
以及过滤操作
C.洗涤试管内壁上附着的硫黄,可用酒精洗涤,也可用
热的NaOH溶液清洗
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化物
【规范解答】选B、D。黑火药爆炸的反应中,硫单质得
电子,生成K2S,化合价降低,显氧化性。当硫单质与
金属反应时,硫作氧化剂;与非金属反应时应具体分析
硫的价态变化,如在S+O2 SO2中S作还原剂,在S+H2
H2S中S作氧化剂,A选项不正确。分离黑火药中的
三组分可利用它们溶解性的差异。先用CS2处理,使硫
溶解。
点燃
====
△
====
滤渣再用水处理,溶解硝酸钾,过滤,滤渣为炭粉。滤液蒸发、浓缩、结晶,得到硝酸钾,B选项正确。洗涤试管内壁上附着的硫,可用CS2洗涤,不能用酒精,也可用热碱液洗涤,故C项不正确。
Cu与S反应时
2Cu + S Cu2S
2×64 32 160
6.4 g 1.6 g 8.0 g 即6.4 g Cu和1.6 g S恰好反应生成8.0 g Cu2S,D选项正确。
△
====
【变式训练】(2010·三明高一检测)下列化合物不能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S
⑥FeCl2 ⑦H2S
A.②⑤⑦ B.①④⑥ C.③④ D.④⑥
【解析】选B。硫与具有可变化合价的金属反应时,只
能将其氧化至较低价态,所以金属Fe和Cu在加热条件下
与硫单质反应时,只能生成FeS和Cu2S,而不是Fe2S3和
CuS。而氯气的氧化性很强,在与Fe反应时可将其氧化
为高价态,故反应产物为FeCl3,而不是FeCl2。硫在与其
他非金属反应时,若该元素的非金属性弱于硫,则硫表
现出氧化性,在生成物中硫为-2价,如H2+S H2S;
若该元素的非金属性强于硫,则硫将被氧化,表现出还
原性,在生成物中硫将显正价,如S与氧气点燃时生成
二氧化硫。
高温
====
1.下列反应中,硫表现还原性的是( )
A.硫与氧气 B.硫与氢气
C.硫与铁 D.硫与铜
【解析】选A。硫与铁、氢气及铜反应时,硫都得到电
子生成-2价的硫的化合物,表现氧化性,只有硫与氧气
反应生成的SO2中硫显+4价,表现还原性,故正确答案
为A。
2.下列关于硫的说法中,不正确的是( )
A.硫是一种淡黄色的不溶于水的固体
B.硫的化学性质与氧气相同
C.硫在空气中燃烧时,火焰呈微弱的淡蓝色;在氧气中
燃烧时,火焰呈明亮的蓝紫色
D.硫在一定条件下能与某些金属反应,生成金属硫化物
【解析】选B。由于氧元素通常不显正价,所以氧气通常条件下只表现氧化性。而硫元素的化合价有-2、0、+4、+6,硫单质中硫的化合价为0,处于中间价态,所以硫既具有氧化性又具有还原性。可见B选项的叙述不正确。其余选项均正确。
3.0.05 mol某单质与0.8 g硫在一定条件下完全反应,该单质可能是( )
①H2 ②O2 ③K
④Zn ⑤Fe ⑥Cu
A.①② B.③④ C.③⑤ D.③⑥
【解析】选D。n(S)= =0.025 mol,该单质
与硫的物质的量之比是2∶1,所以该单质为K或Cu。反
应的方程式为:2Cu+S Cu2S、2K+S K2S。
△
====
△
====
4.能够说明硫的氧化性比氯弱的事实有( )
①通常状况下硫为固体,氯气为气体
②与金属单质反应,硫被还原为-2价,氯被还原为-1价
③Cl2与铁反应生成FeCl3,S与铁反应生成FeS
④将Cl2通入氢硫酸(H2S)中可置换出硫
A.①②③ B.②④ C.②③④ D.③④
【解析】选D。①为物理物质,①错。氧化性强弱是指
得电子能力强弱,氧化性强弱与得电子多少无直接关
系,②错。③④均能说明Cl2得电子能力比S强,③④对。
5.在空气中加热S粉和Fe粉的混合物,可观察到下列现象,请写出有关反应的化学方程式。
(1)有淡蓝色火焰,且生成有刺激性气味的气体_____。
(2)混合粉末变红,放出热量,最后变为黑色固体____。
(3)不时有火星从混合物中射出______。
【解析】Fe粉与S粉反应时,会伴随其他反应的发生,
有淡蓝色火焰,说明S在空气中燃烧生成了SO2。Fe+S
FeS,FeS是黑色固体,且反应放热。有火星从混
合物中射出,说明Fe粉与空气中的O2反应生成Fe3O4。
答案:(1)S+O2 SO2 (2)Fe+S FeS
(3)3Fe+2O2 Fe3O4
△
====
△
====
点燃
====
点燃
====
A组
(30分钟 50分)
一、选择题(本题包括4小题,每小题6分,共24分)
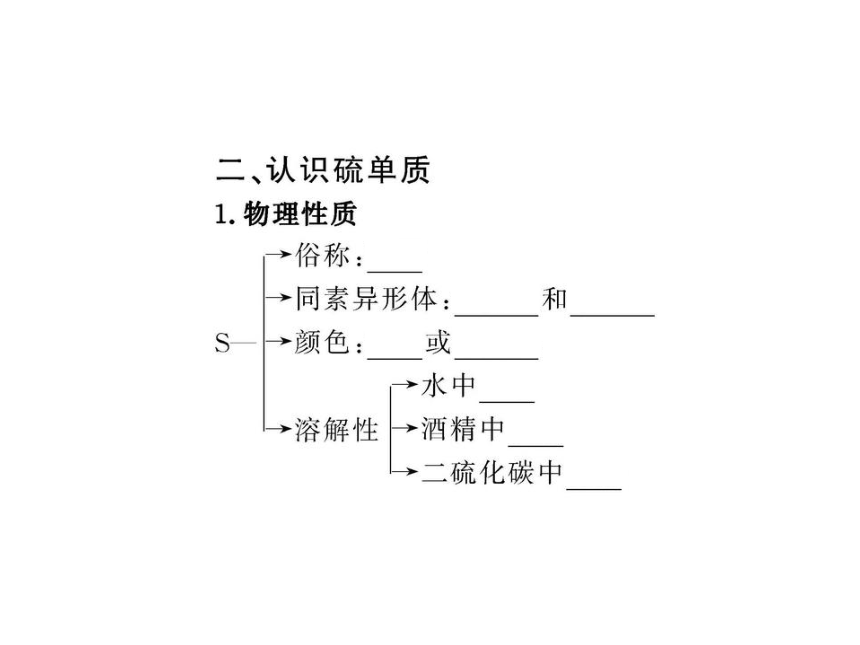
1.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S2、S4、S6、S8互称同位素
D.把硫单质在空气中加热到750 ℃即得S2
【解析】选B。硫单质之间的转化为化学变化,相互间称为同素异形体,燃烧的产物为SO2,硫单质在空气中加热会燃烧,不可能相互转化。
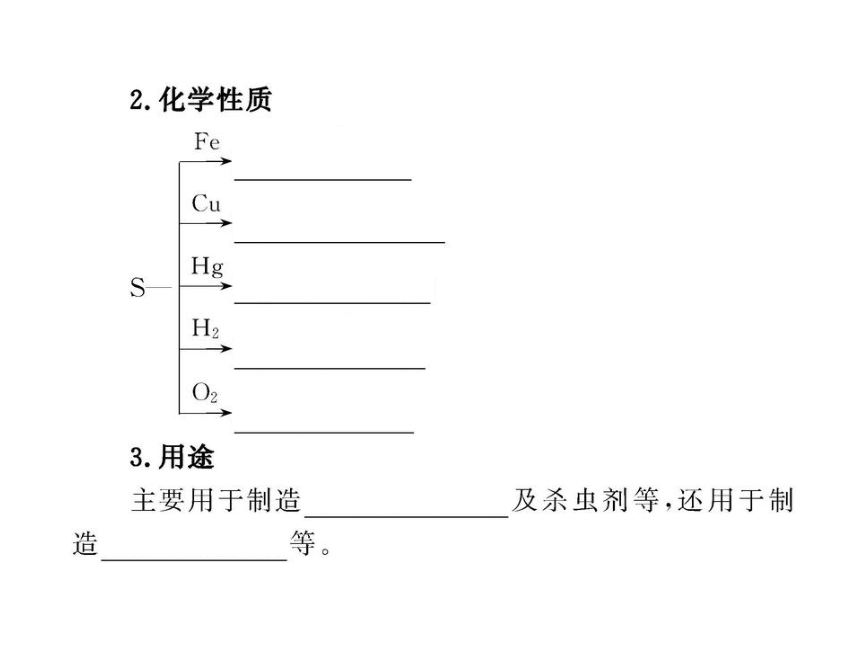
2.下列物质可以由对应的单质直接化合生成的是( )
A.SO3 B.FeS C.CuS D.FeCl2
【解析】选B。S与O2、Cu分别生成SO2和Cu2S,Fe与Cl2生
成FeCl3,S与Fe生成FeS。
3.下列①~④组各混合物中把硫粉分离出来共同的方法是( )
①砂粒和硫粉
②硫酸钠和硫粉
③铁屑和硫粉
④木炭和硫粉
A.用水溶解 B.加热使硫升华
C.用CS2溶解 D.用盐酸溶解
【解析】选C。硫不溶于水易溶于CS2,且砂粒、硫酸钠、铁屑、木炭不溶于CS2,若用加热法铁粉与硫粉反应生成FeS而不能分离。
4.(双选)取一定量的铁粉和硫粉的混合物隔绝空气加热,充分反应后冷却,再加入足量的稀盐酸,标准状况下生成2.24 L气体,下列说法正确的是( )
A.原混合物中可能含3.2 g硫粉
B.原混合物的质量不可能大于8.8 g
C.原混合物中一定含有5.6 g铁粉
D.2.24 L气体的质量可能大于3.4 g
【解析】选A、C。Fe+S FeS,若S过量,则与盐酸反
应的只有FeS,FeS+2HCl ==== FeCl2+H2S↑,由此可见
n(H2S)=n(FeS)=n(Fe),则
n(Fe)=n(H2S)= =0.1 mol,
m(Fe)=56 g·mol-1×0.1 mol=5.6 g 。
若Fe过量,则与盐酸反应的物质是FeS及剩余的Fe。
FeS+2HCl ==== FeCl2+H2S↑
Fe+2HCl ==== FeCl2+H2↑
△
====
分析以上两个方程式可知不论Fe与S反应是谁过量,生
成气体的物质的量与原混合物中Fe的物质的量相等。已
知生成标准状况下2.24 L气体,则一定有0.1 mol
Fe(5.6 g)存在,C正确。当5.6 g铁粉恰好与3.2 g硫粉
反应,生成8.8 g FeS;若硫粉过量,则硫粉的质量大于
3.2 g,混合物的质量大于8.8 g,B错误,A正确。2.24 L
气体都是H2S气体,则H2S气体的质量等于3.4 g,若2.24L
气体是H2S与H2的混合气体,则气体的质量小于3.4g,
D错误。
二、非选择题(本题包括2小题,共26分)
5.(12分)为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(1)为什么反应在“惰性气体环境”中进行__。
(2)操作②的作用是___,还可以改用___。操作③的化学方程式是_______。
(3)混合粉末A中需硫粉过量,原因是如果铁过量_____。
(4)如何说明溶液D中含有Fe2+而不含有Fe3+?_____。
【解析】首先要搞清实验的设计目的和原理,结合Fe与S的反应特点,要防止空气中O2的氧化性等问题即可解决。加入过量硫是为了保证Fe完全反应,防止Fe过量,与H2SO4反应生成Fe2+干扰实验。在惰性气体环境中反应是防止空气中O2参与反应。Fe2+检验要避免被氧化成Fe3+,用SCN-检验和区别Fe2+和Fe3+。
答案:(1)防止空气中的O2参与反应
(2)除去混合物中的硫粉 CS2
FeS+H2SO4 ==== FeSO4+H2S↑
(3)铁粉与H2SO4反应产生的Fe2+干扰实验结果
(4)加入煮沸的KSCN溶液,如果溶液变红则含Fe3+,不变红则含Fe2+
6.(14分)某同学为了探究硫与氧
气的反应情况,装配好如图所示的
装置,待内外空气压强不变时标注
出水银液面的刻度(用红漆)。取
下橡皮塞,在玻璃燃烧匙中加入硫
粉,用酒精灯点燃迅速移入锥形瓶
中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢地回到原先标定的刻度。简要回答下列问题:
(1)水银柱推向左管是否一定说明生成气体的量一定大于反应气体的量,说明原因。________。
(2)硫粉未燃尽时火焰就熄灭了,说明_____。
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论?________。
(4)根据反应方程式S+O2 SO2和上述结论又可推导
出什么?(或证明什么?)_______。
点燃
====
【解析】本题联系物理学中气体压强知识,考查基本化
学反应。水银柱的存在,将锥形瓶中气体隔为一密闭体
系。当水银柱推向左管时,说明锥形瓶中气体膨胀,由
反应S+O2 SO2可看出反应前后气体体积没有变化,
因此惟一的可能就是该反应放热。
当过一段时间后,锥形瓶中气体通过容器壁与外界进行
了热传递,恢复到原来温度,这时气体的体积与原来的
体积一样,即压强没有改变,因此水银柱又回到原先标
定的刻度。
点燃
====
答案:(1)不一定。①该反应是放热反应;②气体受热膨胀
(2)瓶内氧气已耗尽
(3)同温、同压下,反应消耗的氧气与生成的SO2体积相同
(4)同温、同压下,相同数目的气体分子占有相同的体积
B组
1.CuS和Cu2S都能溶于硝酸,它们高温下灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
( )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温下灼烧,区别残留固
体的质量
D.取两种同质量的样品分别在高温下灼烧,区别残留固
体的颜色
【解析】选C。两种样品溶于硝酸后都生成Cu(NO3)2和NO气体,溶液均显蓝色,气体在空气中都会变成红棕色NO2,故A、B均不正确;两样品灼烧后生成固体CuO,颜色相同,D项不正确;同质量的CuS和Cu2S所含Cu的质量不同,故生成CuO的质量也不相同,残留固体质量大的为Cu2S,故C选项正确。
2.如图是硫粉与铁粉反应的实验装置。
完成实验操作步骤,并回答下列问题。
Ⅰ.实验操作步骤如下:
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)__________。
(4)将混合物均匀地放在硬质玻璃管内,并将5块小磁铁吸在玻璃管的下端。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
Ⅱ.问题:
(1)关闭电源后,反应仍继续进行的原因是__。
(2)观察到的现象有_____。
(3)盛有NaOH溶液的装置的作用是______。
(4)如果将盛有NaOH溶液的瓶中A、B导管位置反接是否可以,为什么?
【解析】本题考查了Fe与S的反应,S除了与Fe反应外,
还会与O2反应生成SO2,Fe与S反应放热亦有可能把硫气
化。NaOH溶液的目的就是要除去生成的SO2及硫蒸气。
若导管反接,NaOH溶液会被倒吸入硬质玻璃管中而炸裂
玻璃管。
答案:Ⅰ.(3)检验装置的气密性
Ⅱ.(1)Fe粉与S粉反应是放热的,且放出的热量使反应继续进行至反应完全
(2)混合物从左向右产生红热现象,玻璃管下端小磁铁从左至右逐个落了下来,玻璃管内壁和导管内壁附着一层淡黄色物质
(3)吸收反应过程中生成的SO2和未反应的硫蒸气
(4)不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图所示装置。
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中的溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)。
(已知CuSO4可用来检验H2S,反应为H2S+CuSO4 ==== CuS↓+H2SO4,CuS为黑色固体)。由上述实验事实可知:
(1)如何检验装置的气密性_______。
(2)B增重说明了固体中有__;量气管中气体为
__,说明固体中含有__。
(3)B中反应的离子方程式为_______;如果没有B,C装置中产生的现象是_______。
(4)通过进一步实验,测得固体M中各种成分的质量和小于反应前铁粉和硫粉的质量之和,如果排除气密性和操作的原因,产生这种现象的原因可能是_____。
【解析】(1)先在D中加入水,加热A装置验证即可。
(2)因参与反应的固体与稀H2SO4作用产生的气体能使B
装置增重,所以产生了H2S气体,说明M中有FeS,又因
气体通过B、C后还收集到V mL气体,该气体只能是H2,
说明原M中还剩余Fe。
(3)从整个装置的设计来看实验者的目的是先让混合气体通过B洗气瓶除去H2S,化学反应方程式为2OH-+H2S ==== 2H2O+S2-,然后再用CuSO4溶液来检验H2S是否除尽,化学反应方程式为Cu2++H2S ==== CuS↓+2H+,只要观察C中是否产生黑色(CuS)沉淀即可。
(4)排除了气密性和操作的原因,可能的原因就只能是气体没有被完全吸收或排出。
答案:(1)在D中加入水,加热A,D装置中量气管液面 下降,冷却后恢复到原刻度,说明气密性良好
(2)FeS H2 Fe
(3)2OH-+H2S ==== 2H2O+S2-
有黑色沉淀生成
(4)A装置中留有反应生成的气体
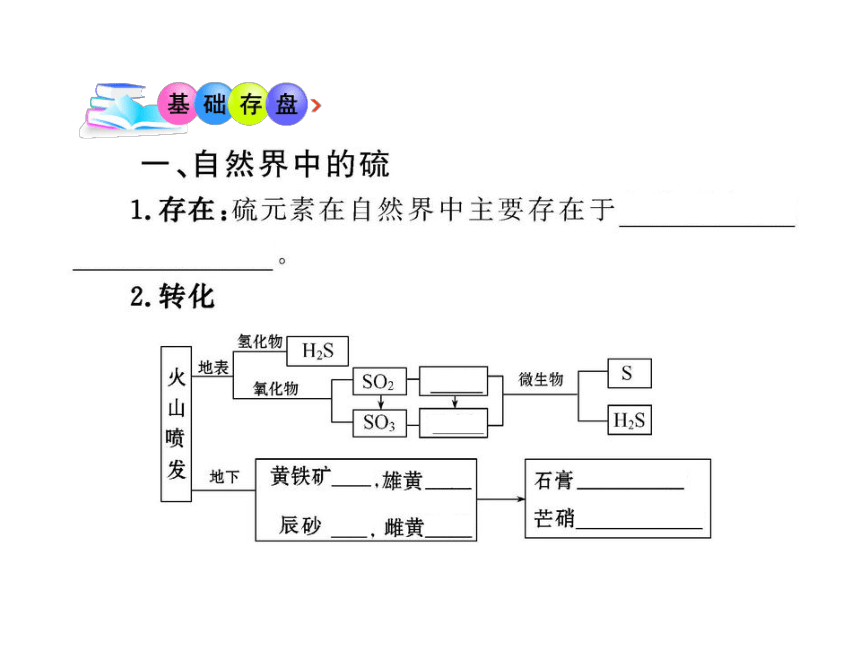
1.(双选)在自然界中既能以游离态形式又能以化合态形式存在的元素是( )
A.氯 B.钠 C.氧 D.硫
【解析】选C、D。元素在自然界中的存在形态与元素活
泼性有关,但活泼性强的元素在自然界中也有游离态
(如O2)。
2.(双选)下列叙述中错误的是( )
A.消除散落在地面上的汞珠的方法是撒上硫粉
B.铜丝擦亮后伸入硫蒸气中产物是CuS
C.硫与金属或非金属反应均作氧化剂
D.可以用热浓NaOH溶液除去附在试管内壁上的硫
【解析】选B、C。汞与硫粉反应能直接生成HgS,A对。
2Cu+S Cu2S,B错。硫与金属反应做氧化剂,与非金
属H2反应时做氧化剂,与非金属O2反应时做还原剂,C
错。硫能与热的NaOH溶液反应生成可溶性盐,D对。
△
====
3.实验室常用热的NaOH溶液洗去试管上沾有的硫,其反
应如下:6NaOH+3S 2Na2S+Na2SO3+3H2O,在此反应
中,氧化剂与还原剂的质量比是( )
A.2∶1 B.1∶2 C.5∶6 D.6∶5
【解析】选A。氧化剂是指反应中化合价降低的物质,
还原剂是指反应中化合价升高的物质。从化学方程式
看,反应中只有硫元素的化合价变化,且3个S中有2个
化合价降低,一个化合价升高。
△
====
4.已知硫有多种形式的单质,其中一种分子为S6,则下列说法中正确的是( )
A.此物质与单斜硫为同素异形体
B.1 mol这种硫单质与阿伏加德罗常数个水分子所含的
原子数相等
C.这种分子的摩尔质量是192 g
D.在标准状况下,1 mol这种硫单质的体积约为22.4 L
【解析】选A。同素异形体指由同种元素形成的不同单质,A对。1 mol S6和H2O分别含有6 mol和3 mol原子,B错。摩尔质量的单位为g·mol-1,C错。在标准状况下S6为固体,不能用气体摩尔体积计算,D错。
5.汞蒸气有毒,人在汞蒸气浓度为10-5 kg/m3的空气中停留1~2天就会出现汞中毒的症状。某同学做实验时不小心将温度计打碎了,他首先将大个的汞珠收集起来,然后在碎汞上面撒了一层硫粉。过了一会儿,将其扫起,一起处理掉。请问:
(1)这位同学在处理洒落的汞的方法中应用了硫单质的什么性质?
(2)写出所发生反应的化学方程式。
(3)硫与铁反应和硫与汞反应有什么不同?
【解析】这是化学知识的一个具体应用。硫与金属反应,体现硫的氧化性。Hg与S在常温下即可反应,并且生成高价汞,但硫与其他变价金属反应时,变价金属常显低价态,且一般需要加热。
答案:(1)氧化性 (2)Hg+S ==== HgS (3)铁与硫反应生成FeS,铁显低价态+2价,而汞与硫反应生成HgS,汞显高价+2价,另外硫与汞常温下反应,而硫与铁加热才反应。
【例】(双选)关于硫的叙述正确的是
A.黑火药爆炸的反应中,硫元素化合价降低,显还原
性,硫与金属或非金属反应均作氧化剂
B.分离黑火药中的硝酸钾、炭、硫要用到二硫化碳、水
以及过滤操作
C.洗涤试管内壁上附着的硫黄,可用酒精洗涤,也可用
热的NaOH溶液清洗
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化物
【规范解答】选B、D。黑火药爆炸的反应中,硫单质得
电子,生成K2S,化合价降低,显氧化性。当硫单质与
金属反应时,硫作氧化剂;与非金属反应时应具体分析
硫的价态变化,如在S+O2 SO2中S作还原剂,在S+H2
H2S中S作氧化剂,A选项不正确。分离黑火药中的
三组分可利用它们溶解性的差异。先用CS2处理,使硫
溶解。
点燃
====
△
====
滤渣再用水处理,溶解硝酸钾,过滤,滤渣为炭粉。滤液蒸发、浓缩、结晶,得到硝酸钾,B选项正确。洗涤试管内壁上附着的硫,可用CS2洗涤,不能用酒精,也可用热碱液洗涤,故C项不正确。
Cu与S反应时
2Cu + S Cu2S
2×64 32 160
6.4 g 1.6 g 8.0 g 即6.4 g Cu和1.6 g S恰好反应生成8.0 g Cu2S,D选项正确。
△
====
【变式训练】(2010·三明高一检测)下列化合物不能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S
⑥FeCl2 ⑦H2S
A.②⑤⑦ B.①④⑥ C.③④ D.④⑥
【解析】选B。硫与具有可变化合价的金属反应时,只
能将其氧化至较低价态,所以金属Fe和Cu在加热条件下
与硫单质反应时,只能生成FeS和Cu2S,而不是Fe2S3和
CuS。而氯气的氧化性很强,在与Fe反应时可将其氧化
为高价态,故反应产物为FeCl3,而不是FeCl2。硫在与其
他非金属反应时,若该元素的非金属性弱于硫,则硫表
现出氧化性,在生成物中硫为-2价,如H2+S H2S;
若该元素的非金属性强于硫,则硫将被氧化,表现出还
原性,在生成物中硫将显正价,如S与氧气点燃时生成
二氧化硫。
高温
====
1.下列反应中,硫表现还原性的是( )
A.硫与氧气 B.硫与氢气
C.硫与铁 D.硫与铜
【解析】选A。硫与铁、氢气及铜反应时,硫都得到电
子生成-2价的硫的化合物,表现氧化性,只有硫与氧气
反应生成的SO2中硫显+4价,表现还原性,故正确答案
为A。
2.下列关于硫的说法中,不正确的是( )
A.硫是一种淡黄色的不溶于水的固体
B.硫的化学性质与氧气相同
C.硫在空气中燃烧时,火焰呈微弱的淡蓝色;在氧气中
燃烧时,火焰呈明亮的蓝紫色
D.硫在一定条件下能与某些金属反应,生成金属硫化物
【解析】选B。由于氧元素通常不显正价,所以氧气通常条件下只表现氧化性。而硫元素的化合价有-2、0、+4、+6,硫单质中硫的化合价为0,处于中间价态,所以硫既具有氧化性又具有还原性。可见B选项的叙述不正确。其余选项均正确。
3.0.05 mol某单质与0.8 g硫在一定条件下完全反应,该单质可能是( )
①H2 ②O2 ③K
④Zn ⑤Fe ⑥Cu
A.①② B.③④ C.③⑤ D.③⑥
【解析】选D。n(S)= =0.025 mol,该单质
与硫的物质的量之比是2∶1,所以该单质为K或Cu。反
应的方程式为:2Cu+S Cu2S、2K+S K2S。
△
====
△
====
4.能够说明硫的氧化性比氯弱的事实有( )
①通常状况下硫为固体,氯气为气体
②与金属单质反应,硫被还原为-2价,氯被还原为-1价
③Cl2与铁反应生成FeCl3,S与铁反应生成FeS
④将Cl2通入氢硫酸(H2S)中可置换出硫
A.①②③ B.②④ C.②③④ D.③④
【解析】选D。①为物理物质,①错。氧化性强弱是指
得电子能力强弱,氧化性强弱与得电子多少无直接关
系,②错。③④均能说明Cl2得电子能力比S强,③④对。
5.在空气中加热S粉和Fe粉的混合物,可观察到下列现象,请写出有关反应的化学方程式。
(1)有淡蓝色火焰,且生成有刺激性气味的气体_____。
(2)混合粉末变红,放出热量,最后变为黑色固体____。
(3)不时有火星从混合物中射出______。
【解析】Fe粉与S粉反应时,会伴随其他反应的发生,
有淡蓝色火焰,说明S在空气中燃烧生成了SO2。Fe+S
FeS,FeS是黑色固体,且反应放热。有火星从混
合物中射出,说明Fe粉与空气中的O2反应生成Fe3O4。
答案:(1)S+O2 SO2 (2)Fe+S FeS
(3)3Fe+2O2 Fe3O4
△
====
△
====
点燃
====
点燃
====
A组
(30分钟 50分)
一、选择题(本题包括4小题,每小题6分,共24分)
1.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的是( )
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S2、S4、S6、S8互称同位素
D.把硫单质在空气中加热到750 ℃即得S2
【解析】选B。硫单质之间的转化为化学变化,相互间称为同素异形体,燃烧的产物为SO2,硫单质在空气中加热会燃烧,不可能相互转化。
2.下列物质可以由对应的单质直接化合生成的是( )
A.SO3 B.FeS C.CuS D.FeCl2
【解析】选B。S与O2、Cu分别生成SO2和Cu2S,Fe与Cl2生
成FeCl3,S与Fe生成FeS。
3.下列①~④组各混合物中把硫粉分离出来共同的方法是( )
①砂粒和硫粉
②硫酸钠和硫粉
③铁屑和硫粉
④木炭和硫粉
A.用水溶解 B.加热使硫升华
C.用CS2溶解 D.用盐酸溶解
【解析】选C。硫不溶于水易溶于CS2,且砂粒、硫酸钠、铁屑、木炭不溶于CS2,若用加热法铁粉与硫粉反应生成FeS而不能分离。
4.(双选)取一定量的铁粉和硫粉的混合物隔绝空气加热,充分反应后冷却,再加入足量的稀盐酸,标准状况下生成2.24 L气体,下列说法正确的是( )
A.原混合物中可能含3.2 g硫粉
B.原混合物的质量不可能大于8.8 g
C.原混合物中一定含有5.6 g铁粉
D.2.24 L气体的质量可能大于3.4 g
【解析】选A、C。Fe+S FeS,若S过量,则与盐酸反
应的只有FeS,FeS+2HCl ==== FeCl2+H2S↑,由此可见
n(H2S)=n(FeS)=n(Fe),则
n(Fe)=n(H2S)= =0.1 mol,
m(Fe)=56 g·mol-1×0.1 mol=5.6 g 。
若Fe过量,则与盐酸反应的物质是FeS及剩余的Fe。
FeS+2HCl ==== FeCl2+H2S↑
Fe+2HCl ==== FeCl2+H2↑
△
====
分析以上两个方程式可知不论Fe与S反应是谁过量,生
成气体的物质的量与原混合物中Fe的物质的量相等。已
知生成标准状况下2.24 L气体,则一定有0.1 mol
Fe(5.6 g)存在,C正确。当5.6 g铁粉恰好与3.2 g硫粉
反应,生成8.8 g FeS;若硫粉过量,则硫粉的质量大于
3.2 g,混合物的质量大于8.8 g,B错误,A正确。2.24 L
气体都是H2S气体,则H2S气体的质量等于3.4 g,若2.24L
气体是H2S与H2的混合气体,则气体的质量小于3.4g,
D错误。
二、非选择题(本题包括2小题,共26分)
5.(12分)为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(1)为什么反应在“惰性气体环境”中进行__。
(2)操作②的作用是___,还可以改用___。操作③的化学方程式是_______。
(3)混合粉末A中需硫粉过量,原因是如果铁过量_____。
(4)如何说明溶液D中含有Fe2+而不含有Fe3+?_____。
【解析】首先要搞清实验的设计目的和原理,结合Fe与S的反应特点,要防止空气中O2的氧化性等问题即可解决。加入过量硫是为了保证Fe完全反应,防止Fe过量,与H2SO4反应生成Fe2+干扰实验。在惰性气体环境中反应是防止空气中O2参与反应。Fe2+检验要避免被氧化成Fe3+,用SCN-检验和区别Fe2+和Fe3+。
答案:(1)防止空气中的O2参与反应
(2)除去混合物中的硫粉 CS2
FeS+H2SO4 ==== FeSO4+H2S↑
(3)铁粉与H2SO4反应产生的Fe2+干扰实验结果
(4)加入煮沸的KSCN溶液,如果溶液变红则含Fe3+,不变红则含Fe2+
6.(14分)某同学为了探究硫与氧
气的反应情况,装配好如图所示的
装置,待内外空气压强不变时标注
出水银液面的刻度(用红漆)。取
下橡皮塞,在玻璃燃烧匙中加入硫
粉,用酒精灯点燃迅速移入锥形瓶
中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢地回到原先标定的刻度。简要回答下列问题:
(1)水银柱推向左管是否一定说明生成气体的量一定大于反应气体的量,说明原因。________。
(2)硫粉未燃尽时火焰就熄灭了,说明_____。
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论?________。
(4)根据反应方程式S+O2 SO2和上述结论又可推导
出什么?(或证明什么?)_______。
点燃
====
【解析】本题联系物理学中气体压强知识,考查基本化
学反应。水银柱的存在,将锥形瓶中气体隔为一密闭体
系。当水银柱推向左管时,说明锥形瓶中气体膨胀,由
反应S+O2 SO2可看出反应前后气体体积没有变化,
因此惟一的可能就是该反应放热。
当过一段时间后,锥形瓶中气体通过容器壁与外界进行
了热传递,恢复到原来温度,这时气体的体积与原来的
体积一样,即压强没有改变,因此水银柱又回到原先标
定的刻度。
点燃
====
答案:(1)不一定。①该反应是放热反应;②气体受热膨胀
(2)瓶内氧气已耗尽
(3)同温、同压下,反应消耗的氧气与生成的SO2体积相同
(4)同温、同压下,相同数目的气体分子占有相同的体积
B组
1.CuS和Cu2S都能溶于硝酸,它们高温下灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
( )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温下灼烧,区别残留固
体的质量
D.取两种同质量的样品分别在高温下灼烧,区别残留固
体的颜色
【解析】选C。两种样品溶于硝酸后都生成Cu(NO3)2和NO气体,溶液均显蓝色,气体在空气中都会变成红棕色NO2,故A、B均不正确;两样品灼烧后生成固体CuO,颜色相同,D项不正确;同质量的CuS和Cu2S所含Cu的质量不同,故生成CuO的质量也不相同,残留固体质量大的为Cu2S,故C选项正确。
2.如图是硫粉与铁粉反应的实验装置。
完成实验操作步骤,并回答下列问题。
Ⅰ.实验操作步骤如下:
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)__________。
(4)将混合物均匀地放在硬质玻璃管内,并将5块小磁铁吸在玻璃管的下端。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
Ⅱ.问题:
(1)关闭电源后,反应仍继续进行的原因是__。
(2)观察到的现象有_____。
(3)盛有NaOH溶液的装置的作用是______。
(4)如果将盛有NaOH溶液的瓶中A、B导管位置反接是否可以,为什么?
【解析】本题考查了Fe与S的反应,S除了与Fe反应外,
还会与O2反应生成SO2,Fe与S反应放热亦有可能把硫气
化。NaOH溶液的目的就是要除去生成的SO2及硫蒸气。
若导管反接,NaOH溶液会被倒吸入硬质玻璃管中而炸裂
玻璃管。
答案:Ⅰ.(3)检验装置的气密性
Ⅱ.(1)Fe粉与S粉反应是放热的,且放出的热量使反应继续进行至反应完全
(2)混合物从左向右产生红热现象,玻璃管下端小磁铁从左至右逐个落了下来,玻璃管内壁和导管内壁附着一层淡黄色物质
(3)吸收反应过程中生成的SO2和未反应的硫蒸气
(4)不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图所示装置。
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中的溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)。
(已知CuSO4可用来检验H2S,反应为H2S+CuSO4 ==== CuS↓+H2SO4,CuS为黑色固体)。由上述实验事实可知:
(1)如何检验装置的气密性_______。
(2)B增重说明了固体中有__;量气管中气体为
__,说明固体中含有__。
(3)B中反应的离子方程式为_______;如果没有B,C装置中产生的现象是_______。
(4)通过进一步实验,测得固体M中各种成分的质量和小于反应前铁粉和硫粉的质量之和,如果排除气密性和操作的原因,产生这种现象的原因可能是_____。
【解析】(1)先在D中加入水,加热A装置验证即可。
(2)因参与反应的固体与稀H2SO4作用产生的气体能使B
装置增重,所以产生了H2S气体,说明M中有FeS,又因
气体通过B、C后还收集到V mL气体,该气体只能是H2,
说明原M中还剩余Fe。
(3)从整个装置的设计来看实验者的目的是先让混合气体通过B洗气瓶除去H2S,化学反应方程式为2OH-+H2S ==== 2H2O+S2-,然后再用CuSO4溶液来检验H2S是否除尽,化学反应方程式为Cu2++H2S ==== CuS↓+2H+,只要观察C中是否产生黑色(CuS)沉淀即可。
(4)排除了气密性和操作的原因,可能的原因就只能是气体没有被完全吸收或排出。
答案:(1)在D中加入水,加热A,D装置中量气管液面 下降,冷却后恢复到原刻度,说明气密性良好
(2)FeS H2 Fe
(3)2OH-+H2S ==== 2H2O+S2-
有黑色沉淀生成
(4)A装置中留有反应生成的气体
1.(双选)在自然界中既能以游离态形式又能以化合态形式存在的元素是( )
A.氯 B.钠 C.氧 D.硫
【解析】选C、D。元素在自然界中的存在形态与元素活
泼性有关,但活泼性强的元素在自然界中也有游离态
(如O2)。
2.(双选)下列叙述中错误的是( )
A.消除散落在地面上的汞珠的方法是撒上硫粉
B.铜丝擦亮后伸入硫蒸气中产物是CuS
C.硫与金属或非金属反应均作氧化剂
D.可以用热浓NaOH溶液除去附在试管内壁上的硫
【解析】选B、C。汞与硫粉反应能直接生成HgS,A对。
2Cu+S Cu2S,B错。硫与金属反应做氧化剂,与非金
属H2反应时做氧化剂,与非金属O2反应时做还原剂,C
错。硫能与热的NaOH溶液反应生成可溶性盐,D对。
△
====
3.实验室常用热的NaOH溶液洗去试管上沾有的硫,其反
应如下:6NaOH+3S 2Na2S+Na2SO3+3H2O,在此反应
中,氧化剂与还原剂的质量比是( )
A.2∶1 B.1∶2 C.5∶6 D.6∶5
【解析】选A。氧化剂是指反应中化合价降低的物质,
还原剂是指反应中化合价升高的物质。从化学方程式
看,反应中只有硫元素的化合价变化,且3个S中有2个
化合价降低,一个化合价升高。
△
====
4.已知硫有多种形式的单质,其中一种分子为S6,则下列说法中正确的是( )
A.此物质与单斜硫为同素异形体
B.1 mol这种硫单质与阿伏加德罗常数个水分子所含的
原子数相等
C.这种分子的摩尔质量是192 g
D.在标准状况下,1 mol这种硫单质的体积约为22.4 L
【解析】选A。同素异形体指由同种元素形成的不同单质,A对。1 mol S6和H2O分别含有6 mol和3 mol原子,B错。摩尔质量的单位为g·mol-1,C错。在标准状况下S6为固体,不能用气体摩尔体积计算,D错。
5.汞蒸气有毒,人在汞蒸气浓度为10-5 kg/m3的空气中停留1~2天就会出现汞中毒的症状。某同学做实验时不小心将温度计打碎了,他首先将大个的汞珠收集起来,然后在碎汞上面撒了一层硫粉。过了一会儿,将其扫起,一起处理掉。请问:
(1)这位同学在处理洒落的汞的方法中应用了硫单质的什么性质?
(2)写出所发生反应的化学方程式。
(3)硫与铁反应和硫与汞反应有什么不同?
【解析】这是化学知识的一个具体应用。硫与金属反应,体现硫的氧化性。Hg与S在常温下即可反应,并且生成高价汞,但硫与其他变价金属反应时,变价金属常显低价态,且一般需要加热。
答案:(1)氧化性 (2)Hg+S ==== HgS (3)铁与硫反应生成FeS,铁显低价态+2价,而汞与硫反应生成HgS,汞显高价+2价,另外硫与汞常温下反应,而硫与铁加热才反应。
