高中化学全程学习方略课件:341 海水中的元素(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:341 海水中的元素(鲁科版必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 18:28:22 | ||
图片预览










文档简介
(共52张PPT)
【例】(2010·南平高一检测)海水是一个非常丰富的化学资源。
(1)下列物质主要从海水中提取的是(填序号)_。
①Al ②Fe ③Na ④Mg ⑤Br2 ⑥Si ⑦Cu
⑧S ⑨N2
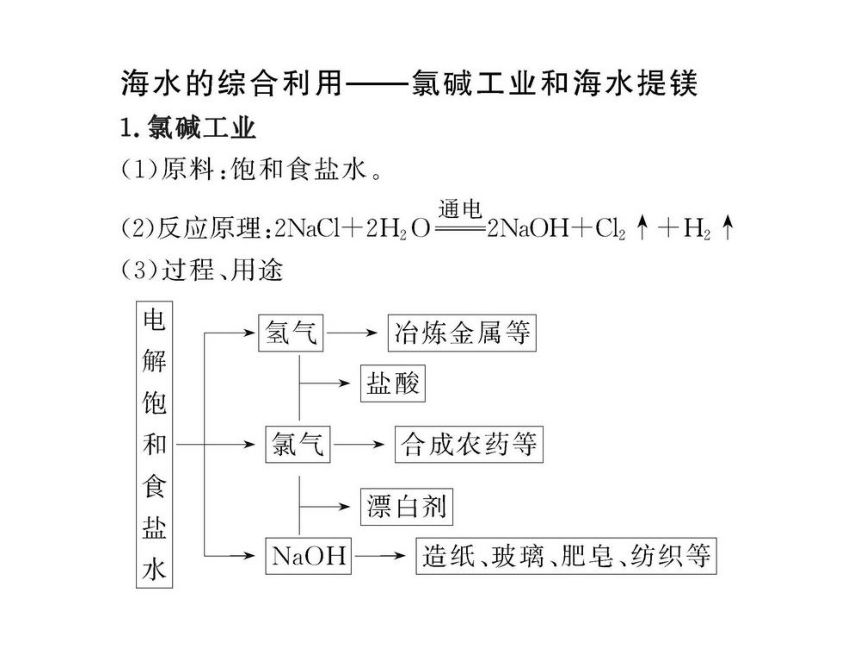
(2)工业上用电解饱和食盐水的方法制取氢氧化钠、氯气和氢气。但电解前要进行粗盐精制。试回答下列问题:
①选择试剂以除去下表所列的可溶性杂质。
②精制过程既要将杂质离子Ca2+、Mg2+、SO42-完全沉淀,又要保证不引入新的杂质。为此你认为加入所选沉淀剂的合理顺序为:Ⅱ、__、__(填序号)。
③最后加适量的盐酸以调节溶液至中性并除去过量的CO32-。其中盐酸除去CO32-的离子方程式为_____。
(3)将氯气通入碱液,可制得84消毒液(有效成分是次氯酸钠),写出制取过程的化学方程式_____。
【规范解答】(1)Na、Mg、Br都是海水中的常量元素,其单质的获得主要通过海水提取,Al、Fe、Si、Cu、S主要从矿石中获得,而N2从空气中获得。
(2)由溶解性知,除Ca2+应选用CO32-,使之生成CaCO3沉淀除去,除Mg2+应选用OH-,使之生成Mg(OH)2沉淀除去;除SO42-应选用Ba2+,使之生成BaSO4沉淀除去,精制过程中不能引入新的杂质离子,所以应选用Na2CO3、NaOH、BaCl2,且Na2CO3必须加在BaCl2之后以除去过量的Ba2+,最后加入盐酸,除去过量的OH-和CO32-。
(3)Cl2与NaOH反应可制得具有漂白作用的NaClO。
答案:(1)③④⑤
(2)①Ⅰ:Na2CO3 Ⅱ:NaOH Ⅲ:BaCl2
②Ⅲ Ⅰ
③CO32-+2H+ ==== CO2↑+H2O
(3)Cl2+2NaOH ==== NaCl+NaClO+H2O
【变式训练】海水资源的利用将走综合开发的道路,一次提取海水,同时提取多种物质。如图是某工厂对海水资源综合利用的示意图。
试回答下列问题:
(1)上述流程图①~⑦步骤中,属于氧化还原反应的是__(填序号)。
(2)对精制饱和食盐水进行电解的化学方程式是______。
(3)提纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是______;
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是______。
③电解氯化镁的化学方程式是______;
从氧化还原反应的角度分析,该反应中的还原剂是_____。
【解析】(1)逐步分析各步骤的变化,判断答案:
①蒸发、结晶、过滤属于物理变化。
②粗盐精制是用Na2CO3溶液和NaOH溶液、BaCl2溶液除去
粗盐中的Ca2+、Mg2+、SO42-,不发生氧化还原反应。
③电解饱和食盐水是氧化还原反应。
④、⑤两个步骤是先用熟石灰沉淀Mg2+,后加盐酸制取
MgCl2,均不是氧化还原反应。
⑦电解MgCl2制金属Mg是氧化还原反应。
(2)题中已经说明,饱和NaCl溶液电解生成烧碱、氯气和氢气。
(3)①Mg(OH)2难溶于水,Ca(OH)2微溶于水。在K+、Na+、Mg2+等阳离子中,Mg2+与石灰乳提供的OH-反应生成Mg(OH)2沉淀。
②“充分利用当地海洋化学资源”,它暗示的是利用贝壳中的CaCO3生产生石灰。
③在MgCl2 Mg+Cl2↑的反应中,镁元素的化合价降
低,氯元素的化合价升高,MgCl2既是氧化剂又是还原
剂。
答案:(1)③⑦
(2)2NaCl+2H2O 2NaOH+Cl2↑+H2↑
(3)①沉淀Mg2+[或制取Mg(OH)2]
②贝壳 ③MgCl2 Mg+Cl2↑ MgCl2
通电
====
通电
====
通电
====
1.(2010·巴中高一检测)正在燃烧的镁条,放入下列气体中时,不能继续燃烧的是( )
A.CO2 B.Cl2 C.O2 D.He
【解析】选D。Mg在点燃时与CO2、Cl2、O2都能反应。
2.下列属于海水中的微量元素的是( )
①Cl ②Na ③Br ④I ⑤Mg ⑥U
A. ①②⑤ B.④⑥ C.①②③④ D.③④⑤⑥
【解析】选B。每升海水中含量低于1 mg的元素称为微
量元素,海水中的微量元素有Li、I、U等。
3.(双选)为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
【解析】选C、D。加过量NaOH溶液是为使Mg2+转化为
Mg(OH)2)沉淀从而除去;加过量Na2CO3溶液是为使Ca2+转化为CaCO3沉淀除去;加过量BaCl2溶液是为使SO42-转化为BaSO4沉淀除去,但在除杂过程中不能引入新的杂质离子,所以Na2CO3溶液必须加在BaCl2溶液之后以除去过量的Ba2+,最后加入适量盐酸除去过量的OH-、CO32-。
4.(2010·宜昌高一检测)由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
【解析】选D。本题是由海水制备无水氯化镁,主要步骤是先将海水中的成分氯化镁转变为氢氧化镁即②步为第一步骤,④过滤,得到氢氧化镁,再用③加盐酸的方法,将其变为氯化镁溶液,浓缩结晶,在一定条件下脱水干燥即可得到无水氯化镁。
5.下列框图中,G有强氧化性,F可以循环利用。
请回答:
(1)写出A、B、C、D、E、F、G的化学式。
A:___;B:___;C:___;D:___;
E:___;F:___;G:___。
(2)写出下列反应的离子方程式。
饱和食盐水→A+B+C:______。
B+C→E+F:______。
【解析】电解饱和食盐水发生:2NaCl+2H2O
H2↑+Cl2↑+2NaOH会产生NaOH、Cl2、H2,而Cl2与NaOH会
反应:Cl2+2NaOH ==== NaClO+NaCl+H2O,Cl2与H2反应:
Cl2+H2 2HCl;HCl与NaClO会反应生成具有强氧化性
的HClO,因此:
A为H2,B为Cl2,C为NaOH,D为HCl,E为NaClO,F为
NaCl,G为HClO。
通电
====
点燃
====
答案:(1)H2 Cl2 NaOH HCl NaClO NaCl HClO
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
Cl2+2OH- ==== Cl-+ClO-+H2O
通电
====
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2 Mg3N2;
③2Mg+CO2 2MgO+C;
④Mg+H2O MgO+H2↑;
⑤Mg3N2+6H2O ==== 3Mg(OH)2↓+2NH3↑。
可供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
△
====
△
====
△
====
△
====
请回答下列问题
(1)空气通入装置A前,应如何处理___,选用的装置为___。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)__;
(3)通气后,A、F装置的酒精灯应先点__处,再点__处。其原因是_______。
(4)请设计一个实验,验证产物是氮化镁:___。
【解析】由题目所提供的信息可知:Mg能与O2、CO2、H2O反应,空气中都含有这些气体,所以在Mg与N2反应前先除去以上三种气体,顺序为先除CO2(D装置),再除H2O(B装置),最后除O2(F装置)。在连接洗气装置时,要注意气体流向(长进短出)。Fe与O2反应时应在加热条件(或温度较高)下进行,若铁粉没有达到反应温度,不能与O2反应,导致O2除不尽。根据反应⑤可知Mg3N2的水解产物有NH3,可通过测定水解产物中NH3的存在推出产物是Mg3N2。
答案:(1)除去空气中的水蒸气、O2和CO2 B、D、F
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)F A 如果装置F中的还原铁粉没有达到反应温度,氧气不能除尽,导致O2同镁反应,而使氮化镁中混入氧化镁
(4)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
1.(2010·湛江高一检测)目前,世界上生产的镁有60%来自海水。从海水中提取镁,最基本的方法就是往海水里加石灰乳使镁沉淀出来,然后经过一系列处理,最终得到单质镁。试判断:在海水提镁的过程中,不可能发生的反应是( )
A.2MgO 2Mg+O2
B.MgCl2 Mg+Cl2↑
C.Mg(OH)2+2HCl ==== MgCl2+2H2O
D.Mg2++2OH- ==== Mg(OH)2↓
通电
====
通电
====
【解析】选A。海水中加入Ca(OH)2后,发生反应:
Mg2++2OH- ==== Mg(OH)2↓;再加入盐酸溶解Mg(OH)2,发
生反应:Mg(OH)2+2HCl ==== MgCl2+2H2O;得到无水MgCl2
后,电解熔融MgCl2,发生反应:MgCl2 Mg+Cl2↑。
通电
====
2.镁在CO2气体中燃烧说明( )
A.CO2是一种强氧化剂
B.CO2不能做灭火剂
C.燃烧不一定都需要氧气
D.酸性氧化物都能跟金属镁起反应
【解析】选C。燃烧是指剧烈的发光发热的化学反应,燃烧不一定有O2参加。
3.镁粉是做焰火、闪光粉、鞭炮的不可缺少的原料,工业制造镁蒸气要在某气体中冷却。下列可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①和② B.②和③ C.③和④ D.④和⑤
【解析】选C。镁蒸气在某气体中冷却,则该气体必须
在高温下不与镁反应。而高温下O2、N2、CO2都能与镁发
生反应。
4.下列关于海水中的元素,对其用途的说法中不正确的是( )
A.锂作为热核反应的重要材料
B.碘用于医药制碘酒
C.铀用于制氢弹
D.镁用于制造飞机、汽车
【解析】选C。铀用于制造核弹,而不是氢弹。
5.下列有关镁的叙述正确的是( )
A.镁条燃烧的火灾可用CO2进行扑灭
B.单质镁因坚硬、轻巧、易于加工,可用来作窗框等
C.镁制容器可用来装浓硝酸
D.镁在空气中燃烧产物并不全是MgO
【解析】选D。镁是很活泼的金属,具有强还原性,燃
着的镁能够夺取二氧化碳中的氧而继续燃烧。单质镁柔
软,镁铝合金坚硬、轻巧。镁在空气中燃烧时不仅跟氧
气化合生成氧化镁,还有少量与氮气化合:3Mg+N2
Mg3N2。常温下铝遇浓硝酸表面钝化,镁无钝化现象,因
此镁制容器不能用以装浓硝酸。故选D项。
点燃
====
6.镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:
A___、C___、D___。
(2)写出下列变化的化学方程式:
①______,
②______。
【解析】镁在空气里燃烧时,主要和氧气反应生成MgO,还可以和氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2和盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D一定是Mg(OH)2,能够使湿润的红色石蕊试纸变蓝的气体是氨气,NH4+能够和NaOH溶液反应放出NH3,所以溶液B中还含有NH4+,即溶液B为MgCl2和NH4Cl的混合溶液。
答案:(1)Mg3N2 NH3 Mg(OH)2
(2)①Mg3N2+8HCl ==== 3MgCl2+2NH4Cl
②MgCl2+2NaOH ==== Mg(OH)2↓+2NaCl,
NH4Cl+NaOH NaCl+H2O+NH3↑
△
====
【例】(2010·南平高一检测)海水是一个非常丰富的化学资源。
(1)下列物质主要从海水中提取的是(填序号)_。
①Al ②Fe ③Na ④Mg ⑤Br2 ⑥Si ⑦Cu
⑧S ⑨N2
(2)工业上用电解饱和食盐水的方法制取氢氧化钠、氯气和氢气。但电解前要进行粗盐精制。试回答下列问题:
①选择试剂以除去下表所列的可溶性杂质。
②精制过程既要将杂质离子Ca2+、Mg2+、SO42-完全沉淀,又要保证不引入新的杂质。为此你认为加入所选沉淀剂的合理顺序为:Ⅱ、__、__(填序号)。
③最后加适量的盐酸以调节溶液至中性并除去过量的CO32-。其中盐酸除去CO32-的离子方程式为_____。
(3)将氯气通入碱液,可制得84消毒液(有效成分是次氯酸钠),写出制取过程的化学方程式_____。
【规范解答】(1)Na、Mg、Br都是海水中的常量元素,其单质的获得主要通过海水提取,Al、Fe、Si、Cu、S主要从矿石中获得,而N2从空气中获得。
(2)由溶解性知,除Ca2+应选用CO32-,使之生成CaCO3沉淀除去,除Mg2+应选用OH-,使之生成Mg(OH)2沉淀除去;除SO42-应选用Ba2+,使之生成BaSO4沉淀除去,精制过程中不能引入新的杂质离子,所以应选用Na2CO3、NaOH、BaCl2,且Na2CO3必须加在BaCl2之后以除去过量的Ba2+,最后加入盐酸,除去过量的OH-和CO32-。
(3)Cl2与NaOH反应可制得具有漂白作用的NaClO。
答案:(1)③④⑤
(2)①Ⅰ:Na2CO3 Ⅱ:NaOH Ⅲ:BaCl2
②Ⅲ Ⅰ
③CO32-+2H+ ==== CO2↑+H2O
(3)Cl2+2NaOH ==== NaCl+NaClO+H2O
【变式训练】海水资源的利用将走综合开发的道路,一次提取海水,同时提取多种物质。如图是某工厂对海水资源综合利用的示意图。
试回答下列问题:
(1)上述流程图①~⑦步骤中,属于氧化还原反应的是__(填序号)。
(2)对精制饱和食盐水进行电解的化学方程式是______。
(3)提纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是______;
②石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是______。
③电解氯化镁的化学方程式是______;
从氧化还原反应的角度分析,该反应中的还原剂是_____。
【解析】(1)逐步分析各步骤的变化,判断答案:
①蒸发、结晶、过滤属于物理变化。
②粗盐精制是用Na2CO3溶液和NaOH溶液、BaCl2溶液除去
粗盐中的Ca2+、Mg2+、SO42-,不发生氧化还原反应。
③电解饱和食盐水是氧化还原反应。
④、⑤两个步骤是先用熟石灰沉淀Mg2+,后加盐酸制取
MgCl2,均不是氧化还原反应。
⑦电解MgCl2制金属Mg是氧化还原反应。
(2)题中已经说明,饱和NaCl溶液电解生成烧碱、氯气和氢气。
(3)①Mg(OH)2难溶于水,Ca(OH)2微溶于水。在K+、Na+、Mg2+等阳离子中,Mg2+与石灰乳提供的OH-反应生成Mg(OH)2沉淀。
②“充分利用当地海洋化学资源”,它暗示的是利用贝壳中的CaCO3生产生石灰。
③在MgCl2 Mg+Cl2↑的反应中,镁元素的化合价降
低,氯元素的化合价升高,MgCl2既是氧化剂又是还原
剂。
答案:(1)③⑦
(2)2NaCl+2H2O 2NaOH+Cl2↑+H2↑
(3)①沉淀Mg2+[或制取Mg(OH)2]
②贝壳 ③MgCl2 Mg+Cl2↑ MgCl2
通电
====
通电
====
通电
====
1.(2010·巴中高一检测)正在燃烧的镁条,放入下列气体中时,不能继续燃烧的是( )
A.CO2 B.Cl2 C.O2 D.He
【解析】选D。Mg在点燃时与CO2、Cl2、O2都能反应。
2.下列属于海水中的微量元素的是( )
①Cl ②Na ③Br ④I ⑤Mg ⑥U
A. ①②⑤ B.④⑥ C.①②③④ D.③④⑤⑥
【解析】选B。每升海水中含量低于1 mg的元素称为微
量元素,海水中的微量元素有Li、I、U等。
3.(双选)为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
【解析】选C、D。加过量NaOH溶液是为使Mg2+转化为
Mg(OH)2)沉淀从而除去;加过量Na2CO3溶液是为使Ca2+转化为CaCO3沉淀除去;加过量BaCl2溶液是为使SO42-转化为BaSO4沉淀除去,但在除杂过程中不能引入新的杂质离子,所以Na2CO3溶液必须加在BaCl2溶液之后以除去过量的Ba2+,最后加入适量盐酸除去过量的OH-、CO32-。
4.(2010·宜昌高一检测)由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
【解析】选D。本题是由海水制备无水氯化镁,主要步骤是先将海水中的成分氯化镁转变为氢氧化镁即②步为第一步骤,④过滤,得到氢氧化镁,再用③加盐酸的方法,将其变为氯化镁溶液,浓缩结晶,在一定条件下脱水干燥即可得到无水氯化镁。
5.下列框图中,G有强氧化性,F可以循环利用。
请回答:
(1)写出A、B、C、D、E、F、G的化学式。
A:___;B:___;C:___;D:___;
E:___;F:___;G:___。
(2)写出下列反应的离子方程式。
饱和食盐水→A+B+C:______。
B+C→E+F:______。
【解析】电解饱和食盐水发生:2NaCl+2H2O
H2↑+Cl2↑+2NaOH会产生NaOH、Cl2、H2,而Cl2与NaOH会
反应:Cl2+2NaOH ==== NaClO+NaCl+H2O,Cl2与H2反应:
Cl2+H2 2HCl;HCl与NaClO会反应生成具有强氧化性
的HClO,因此:
A为H2,B为Cl2,C为NaOH,D为HCl,E为NaClO,F为
NaCl,G为HClO。
通电
====
点燃
====
答案:(1)H2 Cl2 NaOH HCl NaClO NaCl HClO
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
Cl2+2OH- ==== Cl-+ClO-+H2O
通电
====
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2 Mg3N2;
③2Mg+CO2 2MgO+C;
④Mg+H2O MgO+H2↑;
⑤Mg3N2+6H2O ==== 3Mg(OH)2↓+2NH3↑。
可供选择的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
△
====
△
====
△
====
△
====
请回答下列问题
(1)空气通入装置A前,应如何处理___,选用的装置为___。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)__;
(3)通气后,A、F装置的酒精灯应先点__处,再点__处。其原因是_______。
(4)请设计一个实验,验证产物是氮化镁:___。
【解析】由题目所提供的信息可知:Mg能与O2、CO2、H2O反应,空气中都含有这些气体,所以在Mg与N2反应前先除去以上三种气体,顺序为先除CO2(D装置),再除H2O(B装置),最后除O2(F装置)。在连接洗气装置时,要注意气体流向(长进短出)。Fe与O2反应时应在加热条件(或温度较高)下进行,若铁粉没有达到反应温度,不能与O2反应,导致O2除不尽。根据反应⑤可知Mg3N2的水解产物有NH3,可通过测定水解产物中NH3的存在推出产物是Mg3N2。
答案:(1)除去空气中的水蒸气、O2和CO2 B、D、F
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)F A 如果装置F中的还原铁粉没有达到反应温度,氧气不能除尽,导致O2同镁反应,而使氮化镁中混入氧化镁
(4)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
1.(2010·湛江高一检测)目前,世界上生产的镁有60%来自海水。从海水中提取镁,最基本的方法就是往海水里加石灰乳使镁沉淀出来,然后经过一系列处理,最终得到单质镁。试判断:在海水提镁的过程中,不可能发生的反应是( )
A.2MgO 2Mg+O2
B.MgCl2 Mg+Cl2↑
C.Mg(OH)2+2HCl ==== MgCl2+2H2O
D.Mg2++2OH- ==== Mg(OH)2↓
通电
====
通电
====
【解析】选A。海水中加入Ca(OH)2后,发生反应:
Mg2++2OH- ==== Mg(OH)2↓;再加入盐酸溶解Mg(OH)2,发
生反应:Mg(OH)2+2HCl ==== MgCl2+2H2O;得到无水MgCl2
后,电解熔融MgCl2,发生反应:MgCl2 Mg+Cl2↑。
通电
====
2.镁在CO2气体中燃烧说明( )
A.CO2是一种强氧化剂
B.CO2不能做灭火剂
C.燃烧不一定都需要氧气
D.酸性氧化物都能跟金属镁起反应
【解析】选C。燃烧是指剧烈的发光发热的化学反应,燃烧不一定有O2参加。
3.镁粉是做焰火、闪光粉、鞭炮的不可缺少的原料,工业制造镁蒸气要在某气体中冷却。下列可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①和② B.②和③ C.③和④ D.④和⑤
【解析】选C。镁蒸气在某气体中冷却,则该气体必须
在高温下不与镁反应。而高温下O2、N2、CO2都能与镁发
生反应。
4.下列关于海水中的元素,对其用途的说法中不正确的是( )
A.锂作为热核反应的重要材料
B.碘用于医药制碘酒
C.铀用于制氢弹
D.镁用于制造飞机、汽车
【解析】选C。铀用于制造核弹,而不是氢弹。
5.下列有关镁的叙述正确的是( )
A.镁条燃烧的火灾可用CO2进行扑灭
B.单质镁因坚硬、轻巧、易于加工,可用来作窗框等
C.镁制容器可用来装浓硝酸
D.镁在空气中燃烧产物并不全是MgO
【解析】选D。镁是很活泼的金属,具有强还原性,燃
着的镁能够夺取二氧化碳中的氧而继续燃烧。单质镁柔
软,镁铝合金坚硬、轻巧。镁在空气中燃烧时不仅跟氧
气化合生成氧化镁,还有少量与氮气化合:3Mg+N2
Mg3N2。常温下铝遇浓硝酸表面钝化,镁无钝化现象,因
此镁制容器不能用以装浓硝酸。故选D项。
点燃
====
6.镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:
A___、C___、D___。
(2)写出下列变化的化学方程式:
①______,
②______。
【解析】镁在空气里燃烧时,主要和氧气反应生成MgO,还可以和氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2和盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D一定是Mg(OH)2,能够使湿润的红色石蕊试纸变蓝的气体是氨气,NH4+能够和NaOH溶液反应放出NH3,所以溶液B中还含有NH4+,即溶液B为MgCl2和NH4Cl的混合溶液。
答案:(1)Mg3N2 NH3 Mg(OH)2
(2)①Mg3N2+8HCl ==== 3MgCl2+2NH4Cl
②MgCl2+2NaOH ==== Mg(OH)2↓+2NaCl,
NH4Cl+NaOH NaCl+H2O+NH3↑
△
====
