高中化学全程学习方略课件:阶段质量评估三(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:阶段质量评估三(鲁科版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 990.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 18:28:22 | ||
图片预览











文档简介
(共40张PPT)
第3章 自然界中的元素
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体
B.N4是2个N2构成的
C.相同质量的N4和N2所含原子个数比为1∶2
D.N4的摩尔质量是56 g
【解析】选A。一个N4分子是由4个N原子构成的,B错;相同质量的N4和N2所含原子数相同,C错;摩尔质量的单位是g·mol-1。
2.(2009·广东高考)广东正在建设海洋强省。下列说法不正确的是( )
A.从海水中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的
长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的
富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、
Mg、B等金属
【解析】选D。海水中含碘含的是碘离子(I-),要从海水中提取碘单质(I2)必然会涉及到元素化合价的升降,所以一定涉及氧化还原反应,故A正确;赤潮主要是由生活污水和工农业生产的废水任意排放使水中 N、P元素含量增高引起水体富营养化而造成的,故C正确;B不是金属元素,故D不正确。
3.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及判断正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀
D.加热后称量,看质量是否变化
【解析】选C。不管NaHCO3中是否含有Na2CO3,加热均有
气体生成,A错;加入Ca(OH)2均有沉淀生成,B错;
加热后质量一定减少,D错;加入BaCl2如果有沉淀生成
则证明有Na2CO3。
4.下列气体中,只能用排水法收集的是( )
A.CO2 B.NO2 C.NO D.NH3
【解析】选C。CO2、NO2可用向上排空气法收集,NO2不
能用排水法收集,NO与O2易反应,只能用排水法收集,
NH3易溶于水,只能用向下排空气法收集。
5.下列反应中硝酸既表现出酸性又表现出氧化性的是
( )
A.使石蕊试液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
【解析】选B。在上述反应A、C项中硝酸均只表现出酸
性。在B、D项中HNO3中氮元素的化合价均降低,表现出
氧化性,并且在B项中又有Cu(NO3)2和水生成,说明此反
应中硝酸还表现出酸性。
6.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色
D.Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
【解析】选B。汽油的密度比水的小,而且不溶于水,和碘水混合后振荡静置,将会出现分层现象,上层是油状液体,颜色为紫红色;四氯化碳的密度比水的大,而且不溶于水,和碘水混合后振荡静置,也会出现分层现象,下层是油状液体,颜色为紫红色;酒精的密度虽然比水的小,但可以任意比和水互溶,与碘水混合后振荡静置,不会出现分层现象。NaCl溶液和水互溶,也不会出现分层现象,与碘水的成分不反应,不会变为黄绿色。
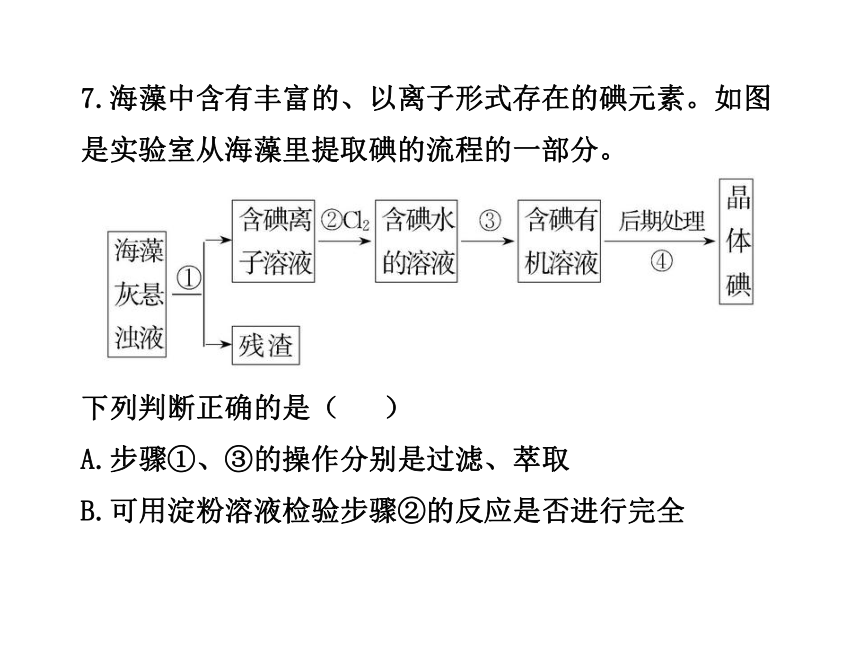
7.海藻中含有丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程的一部分。
下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是汽油或乙醇
D.步骤④的操作是过滤
【解析】选A。固、液分离的操作是过滤,从碘水中提
取碘单质应加入与水相互不溶解的有机溶剂,振荡、静
置后会分层,这一操作为萃取。因此①操作为过滤,③
操作为萃取,A项正确;含碘有机溶液中,有机溶剂易
挥发,步骤④的操作为蒸馏,D项错误;步骤③中加入
的有机溶剂应该与原溶剂相互不溶解,而乙醇与水相互
溶解,不能用作萃取剂,C项错误;在含碘离子溶液中只要通入氯气就会有碘单质生成,加入淀粉溶液后溶液就会变蓝色,不能用淀粉溶液检验步骤②的反应是否进行完全,B项错误。
8.如图所示是气体性质实验的常用装
置,下列有关实验现象的说法正确的
是( )
A.若水槽中是H2O,试管中是Cl2,可看到液面上升、试管中黄绿色退去
B.若水槽中是水,试管中是NO2,可看到液面上升并充满整个试管
C.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并显红色
D.若水槽中是水并滴有几滴紫色石蕊试液,试管中是SO2,可看到液面上升并退为无色
【解析】选C。A项不正确,Cl2与H2O反应并不能完全反
应掉,所以试管中的黄绿色并不能退去;B项错误,若
水槽中是水,试管中是NO2,则应该生成无色的NO气
体,不会充满整个试管;C项正确,若试管中是NH3,可
以看到液面上升并显红色;D错误,应该是试液变红,
液面上升。
9.下列关于空气污染的叙述错误的是( )
A.酸雨主要是雨水与SO3或SO2反应,最终形成的H2SO4、
还有少量的NO2及CO2和水反应生成的HNO3与H2CO3造成
的
B.温室效应是CO2含量过高造成的
C.CO能与血红蛋白形成稳定的化合物,降低血液输送氧
的能力
D.吸烟能制造CO2污染空气
【解析】选D。CO2不是污染空气的气体。
10.(2010·青岛高一检测)下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀
不消失,一定含有SO42-
B.将氢气在某气体中点燃,若产生苍白色火焰,则该气
体为氯气
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊
试纸变蓝的气体生成,则原溶液中一定含有NH4+
D.待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32-
【解析】选A。加入BaCl2溶液有白色沉淀生成,再加稀
硝酸,沉淀不消失,也可能是Ag+,故A项错误;氢气只
有在氯气中燃烧才产生苍白色火焰,B项正确;加入
NaOH溶液加热后产生能使湿润的红色石蕊试纸变蓝的气
体,说明原溶液一定含NH4+,C项正确;待检液加BaCl2溶液有白色沉淀生成,可能含SO42-、Ag+、CO32-、
SO32-,而加入盐酸沉淀消失且产生无色无味的气体,只能是CO32-,故D项正确。
11.下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应:
HCO3-+Ca2++OH- ==== CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:
NH4++OH- H2O+NH3↑
C.氢氧化镁与稀硫酸反应:H++OH- ==== H2O
D.单质铜与稀硝酸反应:
Cu+2H++2NO3- ==== Cu2++2NO↑+H2O
△
====
【解析】选B。在书写与“量”有关的离子方程式时,应该按不足量的物质的组成来写,A选项中的Ca2+与OH-离子物质的量比应该为1∶2;B项考查铵盐的性质,该离子方程式正确;C项中氢氧化镁为难溶物,不应拆开写;D项没有配平。
12.镁条在空气中燃烧生成氧化镁和氮化镁,将燃烧产物溶于60 mL浓度为2 mol/L的盐酸中,以20 mL
0.5 mol/L NaOH溶液中和多余的盐酸,然后在溶液中加入过量NaOH溶液,并加热使NH3全部逸出,再用稀盐酸吸收NH3,结果盐酸增重0.17 g,则镁条的质量是( )
A.0.6 g B.1.2 g C.2.4 g D.3.6 g
【解析】选B。依题意知:60 mL 2 mol/L盐酸与氧化
镁、氮化镁、氢氧化钠完全反应,溶液中只有氯化镁、氯化铵和氯化钠。根据电荷守恒则有:2n(Mg2+)+n(NH4+)+n(Na+)=n(Cl-);又知:n(Na+)=
0.02 L×0.5 mol/L=0.01 mol,n(NH4+)=0.17 g÷
17 g/mol=0.01 mol;n(Cl-)=0.06 L×2 mol/L=
0.12 mol;可推知n(Mg2+)=0.05 mol;从而得知镁条的质量为1.2 g。
二、非选择题(本题包括4小题,共52分)
13.(12分)某位同学为验证SO2的化学性质,完成下列实验要求:
用铜与浓硫酸反应制得SO2,化学方程式为___。
(1)将SO2通入氢硫酸中,现象___,化学反应方程式为_______,这说明SO2具有___性。
(2)将SO2通入溴水中,现象___,化学反应方程式为_______。说明SO2具有___性。
(3)将SO2通入品红溶液,现象___,将生成的溶液加热煮沸,现象___,原因是_______。
(4)将SO2通入NaOH溶液(含有酚酞指示剂)中,现象____,化学方程式为______________,
这说明SO2具有___性氧化物的性质。
【解析】本题以实验形式考查了SO2的化学性质。从化
合价分析SO2中S处于+4价中间价态,因此既有氧化性又
有还原性,同时,SO2还具有酸性氧化物的性质及漂白
性。
答案:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(1)溶液中有浅黄色沉淀生成 2H2S+SO2 ==== 3S↓+2H2O 氧化
(2)橙黄色退去 SO2+Br2+2H2O ==== 2HBr+H2SO4 还原
(3)红色退去 红色又恢复 SO2与有色物质结合成无色物质,加热分解,又恢复原来颜色
(4)红色退去 SO2+2NaOH ==== Na2SO3+H2O(或SO2+NaOH ==== NaHSO3 ) 酸
△
====
14.(14分)(2010·天门高一检测)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
试回答:
(1)若用[Ⅰ]制取SO2气体,b瓶加入的液体一般为__。在选取试剂正确且适量的前提下,反应开始后,当关闭活塞K时如若发现c中液面上升不明显,你分析可能的原因是____,简单的检查方法是____。
(2)装置[Ⅰ]中b~c部分能防止多余气体逸散的原因是___。
(3)当选用液体相同时,装置[Ⅱ]可否代替装置[Ⅰ]中的b~c部分?__(填“是”或“否”),理由是______。
(4)当选用液体相同时,装置[Ⅲ]可否代替装置[Ⅰ]中的b~c部分?__(填“是”或“否”),理由是_____。
【解析】(1)SO2可用排饱和NaHSO3溶液收集,不产生压强差,只能是漏气;可用湿润的品红试纸靠近各接口处检验。
(2)关闭活塞后,气体仍产生,压强增大,将液体压入c中,气体被储存在b中,不会有气体逸出。
(3)Ⅱ与Ⅰ中b、c装置原理相同,可代替。
(4)因Ⅲ中c瓶密闭,体积不能改变,压强增大时有危险。
答案:(1)饱和NaHSO3溶液 装置漏气 用湿润的红色品红试纸靠近各接口处检验,漏气处红色试纸被漂白
(2)关闭活塞后,若a中仍有气体产生,则装置中气压增大,将b中液体压入c中,整个装置成为储气装置,不会有气体逸出
(3)是 原理与装置Ⅰ相同
(4)否 因c瓶密闭,体积不能改变,压强增大时有
15.(13分)将红热固体非金属单质甲投入黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据如图所示变化填空。
(1)写出下列物质的名称:甲是__,乙是__,丙是__;
(2)混合气体A的主要成分是____;
(3)气体B是__,蓝色溶液是__。
(4)写出固体甲与溶液乙反应的化学方程式:__。
(5)若将气体A依次通过澄清石灰水和Ba(OH)2溶液的洗气瓶,发现气体经过石灰水时颜色消失,并无沉淀生成,气体通过Ba(OH)2溶液时,产生白色沉淀,写出通过石灰水的洗气瓶时发生反应的化学方程式:______。
【解析】本题的“题眼”是蓝色溶液→含Cu2+溶液→单质丙为铜。能与铜反应即为强氧化性酸溶液HNO3,气体B为NO,A中的一种成分能与H2O反应生成HNO3和NO,则A中含有NO2。能使澄清石灰水变浑浊的气体为CO2,进一步说明单质甲为碳,A为NO2与CO2的混合气体,显黄色的溶液乙为溶有NO2的浓硝酸。
答案:(1)碳 浓硝酸 铜
(2)CO2、NO2 (3)NO Cu(NO3)2溶液
(4)C+4HNO3(浓) CO2+4NO2+2H2O
(5)3NO2+H2O ==== 2HNO3+NO
△
====
16.(13分)(2010·杭州高一检测)镁能在二氧化碳中燃烧,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。
(1)该装置中饱和碳酸氢钠溶液的作用是___,浓硫酸的作用是___。
(2)从试剂瓶中取出的金属钠,必须经过必要的操作,方可进行后续的实验,该必要的操作是____。
(3)放进试管中的金属钠在加热之前,必须进行的操作是____。
(4)用酒精灯在试管底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现,则试管壁上附着的白色物质是___。
(5)据(4)中现象,试写出钠与二氧化碳反应的化学方程式:_______。
【解析】(1)因钠可与HCl、水蒸气反应,所以应先将石灰石与稀盐酸制得的CO2(内含杂质HCl、水蒸气)除杂,以防干扰实验。
(2)钠通常保存在煤油中,取钠后应先擦干煤油,而且钠极易被氧化,所以应先将表层被氧化的部分切掉。
(3)因试管中有空气,钠在加热时可与氧气反应,所以应先通CO2排尽空气。
(4)钠与CO2反应产生的黑色固体为C,白色固体不可能是钠的氧化物(可与CO2反应),所以应是Na2CO3。
答案:(1)除去CO2中混有的HCl 干燥CO2气体
(2)用滤纸吸干表面的煤油,并用小刀切去表层
(3)打开活塞,让产生的二氧化碳排尽试管内的空
气,并继续通入二氧化碳
(4)Na2CO3 (5)4Na+3CO2 2Na2CO3+C
△
====
第3章 自然界中的元素
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体
B.N4是2个N2构成的
C.相同质量的N4和N2所含原子个数比为1∶2
D.N4的摩尔质量是56 g
【解析】选A。一个N4分子是由4个N原子构成的,B错;相同质量的N4和N2所含原子数相同,C错;摩尔质量的单位是g·mol-1。
2.(2009·广东高考)广东正在建设海洋强省。下列说法不正确的是( )
A.从海水中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的
长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的
富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、
Mg、B等金属
【解析】选D。海水中含碘含的是碘离子(I-),要从海水中提取碘单质(I2)必然会涉及到元素化合价的升降,所以一定涉及氧化还原反应,故A正确;赤潮主要是由生活污水和工农业生产的废水任意排放使水中 N、P元素含量增高引起水体富营养化而造成的,故C正确;B不是金属元素,故D不正确。
3.为了检验NaHCO3固体中是否含有Na2CO3,下列实验及判断正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加石灰水,看有无沉淀
C.溶于水后加BaCl2溶液,看有无沉淀
D.加热后称量,看质量是否变化
【解析】选C。不管NaHCO3中是否含有Na2CO3,加热均有
气体生成,A错;加入Ca(OH)2均有沉淀生成,B错;
加热后质量一定减少,D错;加入BaCl2如果有沉淀生成
则证明有Na2CO3。
4.下列气体中,只能用排水法收集的是( )
A.CO2 B.NO2 C.NO D.NH3
【解析】选C。CO2、NO2可用向上排空气法收集,NO2不
能用排水法收集,NO与O2易反应,只能用排水法收集,
NH3易溶于水,只能用向下排空气法收集。
5.下列反应中硝酸既表现出酸性又表现出氧化性的是
( )
A.使石蕊试液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与S单质混合共热时生成H2SO4和NO2
【解析】选B。在上述反应A、C项中硝酸均只表现出酸
性。在B、D项中HNO3中氮元素的化合价均降低,表现出
氧化性,并且在B项中又有Cu(NO3)2和水生成,说明此反
应中硝酸还表现出酸性。
6.取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色
B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色
D.Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
【解析】选B。汽油的密度比水的小,而且不溶于水,和碘水混合后振荡静置,将会出现分层现象,上层是油状液体,颜色为紫红色;四氯化碳的密度比水的大,而且不溶于水,和碘水混合后振荡静置,也会出现分层现象,下层是油状液体,颜色为紫红色;酒精的密度虽然比水的小,但可以任意比和水互溶,与碘水混合后振荡静置,不会出现分层现象。NaCl溶液和水互溶,也不会出现分层现象,与碘水的成分不反应,不会变为黄绿色。
7.海藻中含有丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程的一部分。
下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加入的有机溶剂是汽油或乙醇
D.步骤④的操作是过滤
【解析】选A。固、液分离的操作是过滤,从碘水中提
取碘单质应加入与水相互不溶解的有机溶剂,振荡、静
置后会分层,这一操作为萃取。因此①操作为过滤,③
操作为萃取,A项正确;含碘有机溶液中,有机溶剂易
挥发,步骤④的操作为蒸馏,D项错误;步骤③中加入
的有机溶剂应该与原溶剂相互不溶解,而乙醇与水相互
溶解,不能用作萃取剂,C项错误;在含碘离子溶液中只要通入氯气就会有碘单质生成,加入淀粉溶液后溶液就会变蓝色,不能用淀粉溶液检验步骤②的反应是否进行完全,B项错误。
8.如图所示是气体性质实验的常用装
置,下列有关实验现象的说法正确的
是( )
A.若水槽中是H2O,试管中是Cl2,可看到液面上升、试管中黄绿色退去
B.若水槽中是水,试管中是NO2,可看到液面上升并充满整个试管
C.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并显红色
D.若水槽中是水并滴有几滴紫色石蕊试液,试管中是SO2,可看到液面上升并退为无色
【解析】选C。A项不正确,Cl2与H2O反应并不能完全反
应掉,所以试管中的黄绿色并不能退去;B项错误,若
水槽中是水,试管中是NO2,则应该生成无色的NO气
体,不会充满整个试管;C项正确,若试管中是NH3,可
以看到液面上升并显红色;D错误,应该是试液变红,
液面上升。
9.下列关于空气污染的叙述错误的是( )
A.酸雨主要是雨水与SO3或SO2反应,最终形成的H2SO4、
还有少量的NO2及CO2和水反应生成的HNO3与H2CO3造成
的
B.温室效应是CO2含量过高造成的
C.CO能与血红蛋白形成稳定的化合物,降低血液输送氧
的能力
D.吸烟能制造CO2污染空气
【解析】选D。CO2不是污染空气的气体。
10.(2010·青岛高一检测)下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀
不消失,一定含有SO42-
B.将氢气在某气体中点燃,若产生苍白色火焰,则该气
体为氯气
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊
试纸变蓝的气体生成,则原溶液中一定含有NH4+
D.待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32-
【解析】选A。加入BaCl2溶液有白色沉淀生成,再加稀
硝酸,沉淀不消失,也可能是Ag+,故A项错误;氢气只
有在氯气中燃烧才产生苍白色火焰,B项正确;加入
NaOH溶液加热后产生能使湿润的红色石蕊试纸变蓝的气
体,说明原溶液一定含NH4+,C项正确;待检液加BaCl2溶液有白色沉淀生成,可能含SO42-、Ag+、CO32-、
SO32-,而加入盐酸沉淀消失且产生无色无味的气体,只能是CO32-,故D项正确。
11.下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应:
HCO3-+Ca2++OH- ==== CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:
NH4++OH- H2O+NH3↑
C.氢氧化镁与稀硫酸反应:H++OH- ==== H2O
D.单质铜与稀硝酸反应:
Cu+2H++2NO3- ==== Cu2++2NO↑+H2O
△
====
【解析】选B。在书写与“量”有关的离子方程式时,应该按不足量的物质的组成来写,A选项中的Ca2+与OH-离子物质的量比应该为1∶2;B项考查铵盐的性质,该离子方程式正确;C项中氢氧化镁为难溶物,不应拆开写;D项没有配平。
12.镁条在空气中燃烧生成氧化镁和氮化镁,将燃烧产物溶于60 mL浓度为2 mol/L的盐酸中,以20 mL
0.5 mol/L NaOH溶液中和多余的盐酸,然后在溶液中加入过量NaOH溶液,并加热使NH3全部逸出,再用稀盐酸吸收NH3,结果盐酸增重0.17 g,则镁条的质量是( )
A.0.6 g B.1.2 g C.2.4 g D.3.6 g
【解析】选B。依题意知:60 mL 2 mol/L盐酸与氧化
镁、氮化镁、氢氧化钠完全反应,溶液中只有氯化镁、氯化铵和氯化钠。根据电荷守恒则有:2n(Mg2+)+n(NH4+)+n(Na+)=n(Cl-);又知:n(Na+)=
0.02 L×0.5 mol/L=0.01 mol,n(NH4+)=0.17 g÷
17 g/mol=0.01 mol;n(Cl-)=0.06 L×2 mol/L=
0.12 mol;可推知n(Mg2+)=0.05 mol;从而得知镁条的质量为1.2 g。
二、非选择题(本题包括4小题,共52分)
13.(12分)某位同学为验证SO2的化学性质,完成下列实验要求:
用铜与浓硫酸反应制得SO2,化学方程式为___。
(1)将SO2通入氢硫酸中,现象___,化学反应方程式为_______,这说明SO2具有___性。
(2)将SO2通入溴水中,现象___,化学反应方程式为_______。说明SO2具有___性。
(3)将SO2通入品红溶液,现象___,将生成的溶液加热煮沸,现象___,原因是_______。
(4)将SO2通入NaOH溶液(含有酚酞指示剂)中,现象____,化学方程式为______________,
这说明SO2具有___性氧化物的性质。
【解析】本题以实验形式考查了SO2的化学性质。从化
合价分析SO2中S处于+4价中间价态,因此既有氧化性又
有还原性,同时,SO2还具有酸性氧化物的性质及漂白
性。
答案:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(1)溶液中有浅黄色沉淀生成 2H2S+SO2 ==== 3S↓+2H2O 氧化
(2)橙黄色退去 SO2+Br2+2H2O ==== 2HBr+H2SO4 还原
(3)红色退去 红色又恢复 SO2与有色物质结合成无色物质,加热分解,又恢复原来颜色
(4)红色退去 SO2+2NaOH ==== Na2SO3+H2O(或SO2+NaOH ==== NaHSO3 ) 酸
△
====
14.(14分)(2010·天门高一检测)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
试回答:
(1)若用[Ⅰ]制取SO2气体,b瓶加入的液体一般为__。在选取试剂正确且适量的前提下,反应开始后,当关闭活塞K时如若发现c中液面上升不明显,你分析可能的原因是____,简单的检查方法是____。
(2)装置[Ⅰ]中b~c部分能防止多余气体逸散的原因是___。
(3)当选用液体相同时,装置[Ⅱ]可否代替装置[Ⅰ]中的b~c部分?__(填“是”或“否”),理由是______。
(4)当选用液体相同时,装置[Ⅲ]可否代替装置[Ⅰ]中的b~c部分?__(填“是”或“否”),理由是_____。
【解析】(1)SO2可用排饱和NaHSO3溶液收集,不产生压强差,只能是漏气;可用湿润的品红试纸靠近各接口处检验。
(2)关闭活塞后,气体仍产生,压强增大,将液体压入c中,气体被储存在b中,不会有气体逸出。
(3)Ⅱ与Ⅰ中b、c装置原理相同,可代替。
(4)因Ⅲ中c瓶密闭,体积不能改变,压强增大时有危险。
答案:(1)饱和NaHSO3溶液 装置漏气 用湿润的红色品红试纸靠近各接口处检验,漏气处红色试纸被漂白
(2)关闭活塞后,若a中仍有气体产生,则装置中气压增大,将b中液体压入c中,整个装置成为储气装置,不会有气体逸出
(3)是 原理与装置Ⅰ相同
(4)否 因c瓶密闭,体积不能改变,压强增大时有
15.(13分)将红热固体非金属单质甲投入黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据如图所示变化填空。
(1)写出下列物质的名称:甲是__,乙是__,丙是__;
(2)混合气体A的主要成分是____;
(3)气体B是__,蓝色溶液是__。
(4)写出固体甲与溶液乙反应的化学方程式:__。
(5)若将气体A依次通过澄清石灰水和Ba(OH)2溶液的洗气瓶,发现气体经过石灰水时颜色消失,并无沉淀生成,气体通过Ba(OH)2溶液时,产生白色沉淀,写出通过石灰水的洗气瓶时发生反应的化学方程式:______。
【解析】本题的“题眼”是蓝色溶液→含Cu2+溶液→单质丙为铜。能与铜反应即为强氧化性酸溶液HNO3,气体B为NO,A中的一种成分能与H2O反应生成HNO3和NO,则A中含有NO2。能使澄清石灰水变浑浊的气体为CO2,进一步说明单质甲为碳,A为NO2与CO2的混合气体,显黄色的溶液乙为溶有NO2的浓硝酸。
答案:(1)碳 浓硝酸 铜
(2)CO2、NO2 (3)NO Cu(NO3)2溶液
(4)C+4HNO3(浓) CO2+4NO2+2H2O
(5)3NO2+H2O ==== 2HNO3+NO
△
====
16.(13分)(2010·杭州高一检测)镁能在二氧化碳中燃烧,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。
(1)该装置中饱和碳酸氢钠溶液的作用是___,浓硫酸的作用是___。
(2)从试剂瓶中取出的金属钠,必须经过必要的操作,方可进行后续的实验,该必要的操作是____。
(3)放进试管中的金属钠在加热之前,必须进行的操作是____。
(4)用酒精灯在试管底部加热,钠在充满二氧化碳气体的试管里剧烈地燃烧,产生大量的白烟。试管底部有黑色物质生成。试管冷却后,试管壁上附着一层白色物质。往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。往滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现,则试管壁上附着的白色物质是___。
(5)据(4)中现象,试写出钠与二氧化碳反应的化学方程式:_______。
【解析】(1)因钠可与HCl、水蒸气反应,所以应先将石灰石与稀盐酸制得的CO2(内含杂质HCl、水蒸气)除杂,以防干扰实验。
(2)钠通常保存在煤油中,取钠后应先擦干煤油,而且钠极易被氧化,所以应先将表层被氧化的部分切掉。
(3)因试管中有空气,钠在加热时可与氧气反应,所以应先通CO2排尽空气。
(4)钠与CO2反应产生的黑色固体为C,白色固体不可能是钠的氧化物(可与CO2反应),所以应是Na2CO3。
答案:(1)除去CO2中混有的HCl 干燥CO2气体
(2)用滤纸吸干表面的煤油,并用小刀切去表层
(3)打开活塞,让产生的二氧化碳排尽试管内的空
气,并继续通入二氧化碳
(4)Na2CO3 (5)4Na+3CO2 2Na2CO3+C
△
====
