高中化学全程学习方略课件:411 硅 无机非金属材料(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:411 硅 无机非金属材料(鲁科版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 00:00:00 | ||
图片预览










文档简介
(共42张PPT)
(1)写出A、C的名称:A:______、C:______。
(2)写出B→A的化学方程式:____________________。
(3)写出下列反应的离子方程式:
A→D:_______________________________________;
B→D:_______________________________________。
【规范解答】由图分析:A与O2反应生成B,而B与碳在高温下反应生成A可推知A是单质,B是氧化物,而A、B均能与NaOH溶液反应,应确认A是硅,B是二氧化硅,则D是硅酸钠,C是硅酸。
答案:(1)硅 硅酸
(2)SiO2+2C Si+2CO↑
(3)Si+2OH-+H2O====SiO32-+2H2↑
SiO2+2OH-====SiO32-+H2O
高温
====
【例2】(2009·广东理基)下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
【规范解答】选C。光导纤维的成分是SiO2,③错;
水晶的主要成分是SiO2,而不是硅酸盐,②错。硅
酸盐是一些岩石的成分,①对,陶瓷的主要成分为
硅酸盐,④对。
1.对于碳和硅元素的说法,下列叙述中不正确的是
( )
A.SiO2和CO2均由原子直接组成
B.C、Si的最外层电子数相同,而次外层电子数不同
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.碳和硅元素的主要化合价分别是+4和+2
【解析】选A。CO2由CO2分子构成,SiO2由硅原子和氧原子构成,所以A错。碳原子的次外层有2个电子,硅原子次外层有8个电子,B对。CO2、SiO2均能与CaO反应生成盐,C对。碳、硅化合价常见的分别为+2、+4价,D对。
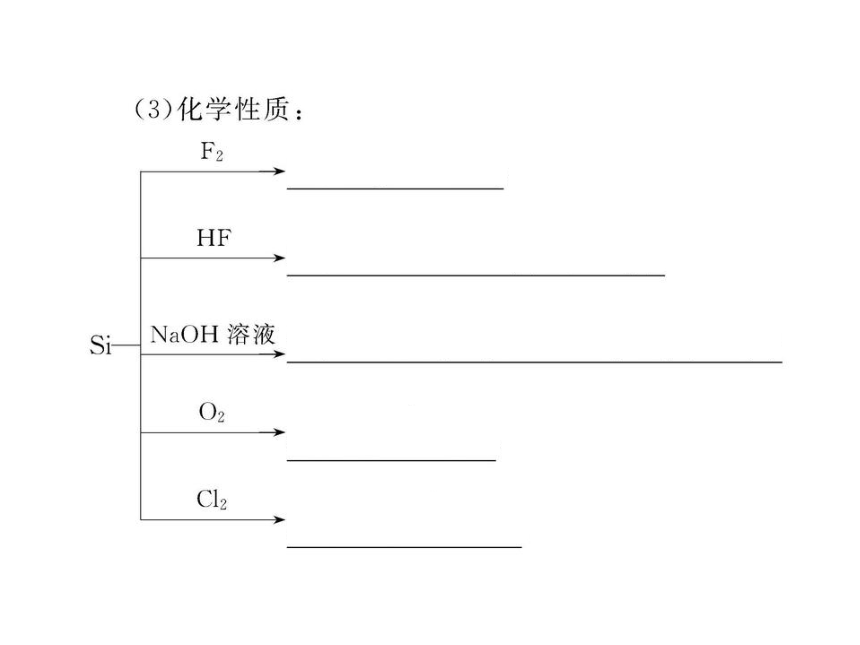
2.常温下能与硅发生反应的气体是 ( )
A.O2 B.H2 C.F2 D.Cl2
【解析】选C。常温下能与硅发生反应的气体只有F2,在高温条件下可与O2、Cl2等气体反应。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;镁和钠的化学性质也有一定的相似性。氧化铜和氧化铁是碱性氧化物,化学性质相似。
该研究性学习小组用如图所示的装置进行镁与二氧化硫反应的实验。
3.光导纤维被认为是20世纪最伟大的发明之一,它使信息科学迅猛发展。光导纤维的主要成分是 ( )
A.CaCO3 B.SiO2 C.Na2SiO3 D.CaSiO3
【解析】选B。光导纤维的主要成分为SiO2。
4.在一定条件下,下列物质与硅、二氧化硅均不反应的是 ( )
A.氢氟酸 B.浓H2SO4 C.烧碱 D.氟气
【解析】选B。硅、二氧化硅均能和F2、氢氟酸、NaOH溶液反应,而硅、二氧化硅与浓H2SO4均不反应。
5.下列反应中SiO2表现的是什么性质或作用?在①~③中选出正确的答案填空(均填序号)。
①酸性氧化物;②弱氧化性;③作为玻璃的成分与氢氟酸反应雕刻玻璃
(1)SiO2+4HF====SiF4↑+2H2O___________________
(2)SiO2+2NaOH====Na2SiO3+H2O__________________
(3)SiO2+2C Si(粗硅)+2CO↑_____________
高温
====
【解析】物质的性质决定物质的存在、用途和制法。二氧化硅是一种酸性氧化物,常温下能与强碱反应,加热时可以与碱性氧化物反应,不能与水和酸(除HF外)反应,用C还原SiO2制取粗硅。
答案:(1)③ (2)① (3)②
(1)实验室制取二氧化硫类似于制取二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:______。
A.10%的硫酸 B.80%的硫酸
C.浓盐酸 D.稀硝酸
E.亚硫酸钠固体 F.亚硫酸钙固体
G.饱和亚硫酸钠溶液
(2)反应后,发现B管壁有淡黄色粉末产生,取反应后B中固体溶于稀盐酸中产生具有臭鸡蛋气味的气体,写出B管中发生的有关化学反应方程式:_____________
_____________________________________________。
(3)你认为该装置是否有不足之处?______。如果有,请写出改进方法:_________________________
_____________________________________________。
【解析】(1)实验室用固体CaCO3和盐酸来制取CO2,类似的方法应用固体Na2SO3和浓硫酸制取SO2。
(2)淡黄色固体为硫,加入稀盐酸产生臭鸡蛋气味的气体是H2S,说明SO2和Mg反应生成S、MgS和MgO。
(3)由装置可知加酸应用分液漏斗,需要干燥SO2,所以对产生的气体应干燥,吸收尾气装置不能密封。
答案:(1)B、E
(2)2Mg+SO2 2MgO+S,Mg+S MgS
(3)有 ①长颈漏斗需换成分液漏斗;
②C试管的塞子换成双孔塞,另一孔插入一根直导管;
③在A、B之间加一个干燥管
△
====
△
====
1.CO2通入下列溶液中,不可能产生沉淀的是 ( )
A.CaCl2和Ba(NO3)2的混合液
B.BaCl2和NaOH的混合液
C.Na2CO3饱和溶液
D.Na2SiO3水溶液
2.(双选)工业上由粗硅制取高纯硅有如下反应:
①Si(s)+3HCl(g) SiHCl3(g)+H2(g)(放热381 kJ)
②SiHCl3(g)+H2(g) Si(s)+3HCl(g)
对上述反应的说法,正确的是 ( )
A.均为置换反应和氧化还原反应
B.反应①、②实际上互为可逆反应
C.由于反应①放热,则反应②一定吸热
D.由上述反应可知硅的还原性比氢气强
高温
====
950 ℃
====
【解析】选A。A项中,弱酸(CO2水溶液)不能与强
酸盐[CaCl2、Ba(NO3)2]发生复分解反应;B项中,CO2是酸性氧化物,它可与碱Ba(OH)2发生如下反应:Ba(OH)2+CO2====BaCO3↓+H2O,从而产生白色沉淀BaCO3;C项中,会发生反应Na2CO3+CO2+H2O====
2NaHCO3↓,因在相同条件(温度)下,NaHCO3的溶解
度小于Na2CO3,故会析出NaHCO3晶体;D项中,碳酸的
酸性强于硅酸,有Na2SiO3+CO2+H2O====H2SiO3↓+
Na2CO3,而H2SiO3是一种白色的胶状沉淀。
【解析】选A、C。从两反应分析,均为置换反应,也必然是氧化还原反应。两反应条件不同,所以不是可逆反应。①放热,相反反应②必吸热。由方程式可知并不能比较出H2和硅还原性的强弱。
3.(双选)下列关于碳和硅的叙述中,不正确的是
( )
A.氧化物都能与NaOH溶液反应
B.单质在加热时都能与氧气反应
C.氧化物都能溶于水生成相应的酸
D.常温下,碳和硅的单质化学性质都不活泼
【解析】选A、C。CO与NaOH溶液不反应,故A项错;碳、硅与氧气在加热时都反应,B项对;SiO2与水不反应,CO与水也不反应,C项错;碳、硅的化学性质在常温下比较稳定,D项对。
4.下列说法正确的是 ( )
A.SiO2溶于水显酸性
B.二氧化碳通入水玻璃中可以得到白色沉淀
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
【解析】选B。SiO2是酸酐,但它不溶于水,酸性氧化物不溶于酸,但SiO2的特性是:它能溶于氢氟酸。判断酸性强弱是在溶液中进行的,故C不能作为判定酸性强弱的条件。
5.对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确的是 ( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为2∶1
【解析】选C。从反应方程式可以看出,只有碳元素化合价发生了变化,在反应中碳既是氧化剂又是还原剂,且氧化剂和还原剂质量比为1∶2。
高温
====
6.将2.8 g硅粉与2.3 g钠同时放入足量水中,采用恰当的方法收集反应过程中产生的气体(全部收集),这些气体在标准状况下的体积为 ( )
A.1.12 L B.4.48 L C.5.6 L D.3.36 L
【解析】选D。本题重点是考查钠与水、硅与碱溶液的反应的有关计算。
2Na+2H2O====2NaOH + H2↑
2×23 g 2 mol 22.4 L
2.3 g 0.1 mol 1.12 L
Si + 2NaOH+H2O====Na2SiO3+2H2↑
28 g 2 mol 2×22.4 L
1.4 g 0.1 mol 2.24 L
反应后硅有剩余,V(H2)=1.12 L+2.24 L=3.36 L。
(1)写出A、C的名称:A:______、C:______。
(2)写出B→A的化学方程式:____________________。
(3)写出下列反应的离子方程式:
A→D:_______________________________________;
B→D:_______________________________________。
【规范解答】由图分析:A与O2反应生成B,而B与碳在高温下反应生成A可推知A是单质,B是氧化物,而A、B均能与NaOH溶液反应,应确认A是硅,B是二氧化硅,则D是硅酸钠,C是硅酸。
答案:(1)硅 硅酸
(2)SiO2+2C Si+2CO↑
(3)Si+2OH-+H2O====SiO32-+2H2↑
SiO2+2OH-====SiO32-+H2O
高温
====
【例2】(2009·广东理基)下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
【规范解答】选C。光导纤维的成分是SiO2,③错;
水晶的主要成分是SiO2,而不是硅酸盐,②错。硅
酸盐是一些岩石的成分,①对,陶瓷的主要成分为
硅酸盐,④对。
1.对于碳和硅元素的说法,下列叙述中不正确的是
( )
A.SiO2和CO2均由原子直接组成
B.C、Si的最外层电子数相同,而次外层电子数不同
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.碳和硅元素的主要化合价分别是+4和+2
【解析】选A。CO2由CO2分子构成,SiO2由硅原子和氧原子构成,所以A错。碳原子的次外层有2个电子,硅原子次外层有8个电子,B对。CO2、SiO2均能与CaO反应生成盐,C对。碳、硅化合价常见的分别为+2、+4价,D对。
2.常温下能与硅发生反应的气体是 ( )
A.O2 B.H2 C.F2 D.Cl2
【解析】选C。常温下能与硅发生反应的气体只有F2,在高温条件下可与O2、Cl2等气体反应。
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;镁和钠的化学性质也有一定的相似性。氧化铜和氧化铁是碱性氧化物,化学性质相似。
该研究性学习小组用如图所示的装置进行镁与二氧化硫反应的实验。
3.光导纤维被认为是20世纪最伟大的发明之一,它使信息科学迅猛发展。光导纤维的主要成分是 ( )
A.CaCO3 B.SiO2 C.Na2SiO3 D.CaSiO3
【解析】选B。光导纤维的主要成分为SiO2。
4.在一定条件下,下列物质与硅、二氧化硅均不反应的是 ( )
A.氢氟酸 B.浓H2SO4 C.烧碱 D.氟气
【解析】选B。硅、二氧化硅均能和F2、氢氟酸、NaOH溶液反应,而硅、二氧化硅与浓H2SO4均不反应。
5.下列反应中SiO2表现的是什么性质或作用?在①~③中选出正确的答案填空(均填序号)。
①酸性氧化物;②弱氧化性;③作为玻璃的成分与氢氟酸反应雕刻玻璃
(1)SiO2+4HF====SiF4↑+2H2O___________________
(2)SiO2+2NaOH====Na2SiO3+H2O__________________
(3)SiO2+2C Si(粗硅)+2CO↑_____________
高温
====
【解析】物质的性质决定物质的存在、用途和制法。二氧化硅是一种酸性氧化物,常温下能与强碱反应,加热时可以与碱性氧化物反应,不能与水和酸(除HF外)反应,用C还原SiO2制取粗硅。
答案:(1)③ (2)① (3)②
(1)实验室制取二氧化硫类似于制取二氧化碳,在下列物质中选择合适的试剂制取二氧化硫:______。
A.10%的硫酸 B.80%的硫酸
C.浓盐酸 D.稀硝酸
E.亚硫酸钠固体 F.亚硫酸钙固体
G.饱和亚硫酸钠溶液
(2)反应后,发现B管壁有淡黄色粉末产生,取反应后B中固体溶于稀盐酸中产生具有臭鸡蛋气味的气体,写出B管中发生的有关化学反应方程式:_____________
_____________________________________________。
(3)你认为该装置是否有不足之处?______。如果有,请写出改进方法:_________________________
_____________________________________________。
【解析】(1)实验室用固体CaCO3和盐酸来制取CO2,类似的方法应用固体Na2SO3和浓硫酸制取SO2。
(2)淡黄色固体为硫,加入稀盐酸产生臭鸡蛋气味的气体是H2S,说明SO2和Mg反应生成S、MgS和MgO。
(3)由装置可知加酸应用分液漏斗,需要干燥SO2,所以对产生的气体应干燥,吸收尾气装置不能密封。
答案:(1)B、E
(2)2Mg+SO2 2MgO+S,Mg+S MgS
(3)有 ①长颈漏斗需换成分液漏斗;
②C试管的塞子换成双孔塞,另一孔插入一根直导管;
③在A、B之间加一个干燥管
△
====
△
====
1.CO2通入下列溶液中,不可能产生沉淀的是 ( )
A.CaCl2和Ba(NO3)2的混合液
B.BaCl2和NaOH的混合液
C.Na2CO3饱和溶液
D.Na2SiO3水溶液
2.(双选)工业上由粗硅制取高纯硅有如下反应:
①Si(s)+3HCl(g) SiHCl3(g)+H2(g)(放热381 kJ)
②SiHCl3(g)+H2(g) Si(s)+3HCl(g)
对上述反应的说法,正确的是 ( )
A.均为置换反应和氧化还原反应
B.反应①、②实际上互为可逆反应
C.由于反应①放热,则反应②一定吸热
D.由上述反应可知硅的还原性比氢气强
高温
====
950 ℃
====
【解析】选A。A项中,弱酸(CO2水溶液)不能与强
酸盐[CaCl2、Ba(NO3)2]发生复分解反应;B项中,CO2是酸性氧化物,它可与碱Ba(OH)2发生如下反应:Ba(OH)2+CO2====BaCO3↓+H2O,从而产生白色沉淀BaCO3;C项中,会发生反应Na2CO3+CO2+H2O====
2NaHCO3↓,因在相同条件(温度)下,NaHCO3的溶解
度小于Na2CO3,故会析出NaHCO3晶体;D项中,碳酸的
酸性强于硅酸,有Na2SiO3+CO2+H2O====H2SiO3↓+
Na2CO3,而H2SiO3是一种白色的胶状沉淀。
【解析】选A、C。从两反应分析,均为置换反应,也必然是氧化还原反应。两反应条件不同,所以不是可逆反应。①放热,相反反应②必吸热。由方程式可知并不能比较出H2和硅还原性的强弱。
3.(双选)下列关于碳和硅的叙述中,不正确的是
( )
A.氧化物都能与NaOH溶液反应
B.单质在加热时都能与氧气反应
C.氧化物都能溶于水生成相应的酸
D.常温下,碳和硅的单质化学性质都不活泼
【解析】选A、C。CO与NaOH溶液不反应,故A项错;碳、硅与氧气在加热时都反应,B项对;SiO2与水不反应,CO与水也不反应,C项错;碳、硅的化学性质在常温下比较稳定,D项对。
4.下列说法正确的是 ( )
A.SiO2溶于水显酸性
B.二氧化碳通入水玻璃中可以得到白色沉淀
C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
【解析】选B。SiO2是酸酐,但它不溶于水,酸性氧化物不溶于酸,但SiO2的特性是:它能溶于氢氟酸。判断酸性强弱是在溶液中进行的,故C不能作为判定酸性强弱的条件。
5.对于化学方程式SiO2+3C SiC+2CO↑,有关叙述正确的是 ( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为2∶1
【解析】选C。从反应方程式可以看出,只有碳元素化合价发生了变化,在反应中碳既是氧化剂又是还原剂,且氧化剂和还原剂质量比为1∶2。
高温
====
6.将2.8 g硅粉与2.3 g钠同时放入足量水中,采用恰当的方法收集反应过程中产生的气体(全部收集),这些气体在标准状况下的体积为 ( )
A.1.12 L B.4.48 L C.5.6 L D.3.36 L
【解析】选D。本题重点是考查钠与水、硅与碱溶液的反应的有关计算。
2Na+2H2O====2NaOH + H2↑
2×23 g 2 mol 22.4 L
2.3 g 0.1 mol 1.12 L
Si + 2NaOH+H2O====Na2SiO3+2H2↑
28 g 2 mol 2×22.4 L
1.4 g 0.1 mol 2.24 L
反应后硅有剩余,V(H2)=1.12 L+2.24 L=3.36 L。
