高中化学全程学习方略课件:单元质量评估四(鲁科版必修1)
文档属性
| 名称 | 高中化学全程学习方略课件:单元质量评估四(鲁科版必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 00:00:00 | ||
图片预览











文档简介
(共43张PPT)
第4章 材料家族中的元素
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.(双选)下列物质中,属于新型无机非金属材料的是
( )
A.钢化玻璃 B.碳化硅陶瓷
C.光导纤维 D.有色玻璃
【解析】选B、C。钢化玻璃与普通玻璃的成分相同,制造过程不同;有色玻璃是在原料中加入某些金属氧化物制成的。
2.世界著名的科技史专家李约瑟博士考证说:“中国至少在距今3 000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是 ( )
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
C.玻璃在加热熔化时有固定的熔点
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
【解析】选C。玻璃的成分主要是Na2SiO3、CaSiO3和SiO2,属于混合物,因此,玻璃没有固定的熔点,故
C不正确。
3.下列有关材料的说法不正确的是 ( )
A.航天飞机使用的隔热陶瓷瓦为复合材料
B.复合材料由基体和增强体组成
C.复合材料既保持原有材料的特点,又有优于原材料的特性
D.纯金属的性能一般优于合金
【解析】选D。合金的性能一般优于纯金属。
4.某无色溶液中放入铝片后有大量 H2产生,则在该溶液中一定可以大量存在的离子组是 ( )
A.Na+、Cl-、K+、Br-
B.Fe2+、Cl-、K+、CO32-
C.Na+、SO42-、Mg2+、Br-
D.HCO3-、Cl-、Ba2+、Na+
【解析】选A。加入铝片产生大量H2,说明溶液为强碱性或酸性溶液。B项,Fe2+为浅绿色,且CO32-在酸性溶液中不能大量存在;C项,Mg2+在碱性溶液中不能大量存在;D项,HCO3-在酸性或碱性溶液中均不能大量存在。
5.将镁、铝、硅的混合物分为等质量的两份。一份与足量的NaOH溶液反应,另一份与足量的盐酸反应,最后生成的氢气一样多。则镁与硅的物质的量之比为 ( )
A.2∶1 B.4∶1 C.1∶1 D.3∶1
【解析】选A。Al与NaOH溶液和盐酸都反应且生成H2的量相等,在与NaOH溶液反应时Si也反应,与盐酸反应时Mg也反应,两者产生的H2一样多。根据关系式Mg~H2,
Si~2H2,n(Mg)∶n(Si)=2∶1。
6.属于铝热反应的是 ( )
A.Al+HCl B.Al+H2SO4
C.Al+MgO D.Al+WO3
【解析】选D。A、B项是活泼金属与酸反应,C项Mg比
Al活泼,不能发生反应,由于W熔点高,故用Al冶炼。
7.下列复合材料中,关于增强体说法正确的是 ( )
A.陶瓷中的SiO2 B.生铁中的铁
C.碳纤维中的合成树脂 D.混凝土中的水泥
【解析】选D。陶瓷、生铁都不是复合材料,碳纤维中的合成树脂是基体,不是增强体。
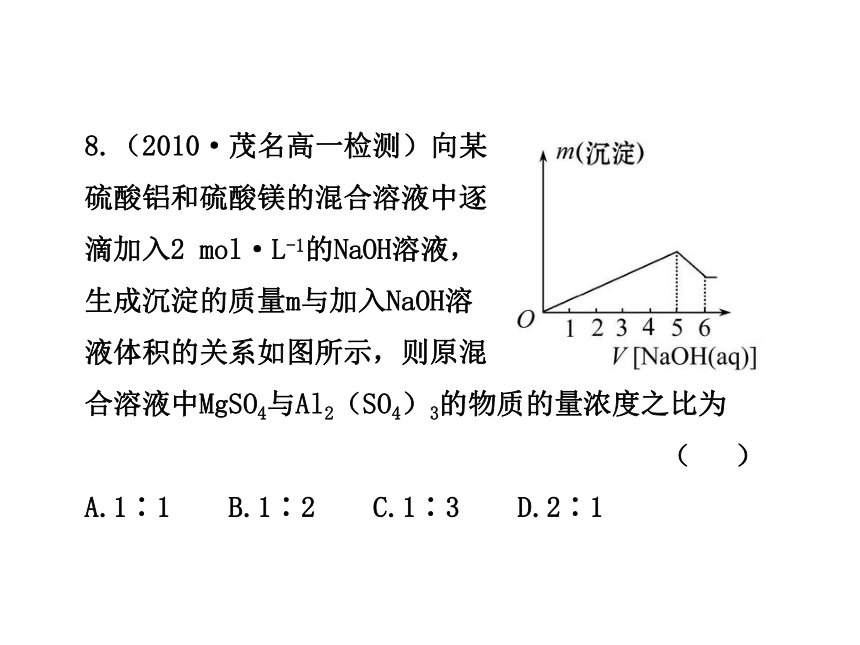
8.(2010·茂名高一检测)向某
硫酸铝和硫酸镁的混合溶液中逐
滴加入2 mol·L-1的NaOH溶液,
生成沉淀的质量m与加入NaOH溶
液体积的关系如图所示,则原混
合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为
( )
A.1∶1 B.1∶2 C.1∶3 D.2∶1
【解析】选D。根据题意可知,完全沉淀Mg2+、Al3+消耗
NaOH溶液5单位体积,而溶解Al(OH)3消耗NaOH溶液1单
位体积,则沉淀Al3+用去NaOH溶液3单位体积,沉淀Mg2+
用去2单位体积。按Al3++3OH-====Al(OH)3↓,Mg2++2OH-
====Mg(OH)2↓可知n(Al3+)∶n(Mg2+)=1∶1,则MgSO4和
Al2(SO4)3的物质的量之比为:n(MgSO4)∶[Al2(SO4)3]
因此在同一溶液中MgSO4与
Al2(SO4)3的物质的量浓度之比为2∶1。
9.向明矾[KAl(SO4)2·12H2O]溶液中滴入Ba(OH)2溶液时,当SO42-沉淀完全时,铝元素的存在形式是( )
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以[Al(OH)4]-存在于溶液中
【解析】选D。明矾为KAl(SO4)2·12H2O,其水溶液中Al3+与SO42-的物质的量之比为1∶2,即Al3+为1 mol时,SO42-为2 mol,当SO42-沉淀完全时,需Ba(OH)2 2 mol;而此时由于Al3++4OH-====[Al(OH)4]-,故Al3+全部转化成[Al(OH)4]-。
10.能鉴别Na2SiO3、CaCO3、SiO2三种白色粉末的试剂
是 ( )
A.苛性钠溶液 B.水
C.氢氟酸 D.稀盐酸
【解析】选D。Na2SiO3能与酸反应生成沉淀;CaCO3与酸反应生成气体,SiO2与HF反应生成气体,综上可知选用稀盐酸。
11.汉代器物上的颜料“汉紫”至今尚没有发现其自
然存在的记载。20世纪80年代科学家进行超导材料研
究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法
中不正确的是 ( )
A.用盐的形式表示:BaSiO3·CuSiO3
B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱
D.性质稳定,不易退色
【解析】选C。根据化合物中正负化合价的代数和等于零可知,A、B正确。硅酸盐只溶于强酸不溶于强碱,
C错。从题给信息:汉代器物上的颜料“汉紫”可知,“汉紫”性质稳定,不易退色,D正确。
12.有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1
AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶
液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是 ( )
A.现象相同,沉淀量相等
B.现象不同,沉淀量不等
C.现象相同,沉淀量不等
D.现象不同,沉淀量相等
【解析】选D。将NaOH溶液分多次加到AlCl3溶液中,发生以下反应:
Al3+ + 3OH-====Al(OH)3↓
0.1 mol 0.3 mol 0.1 mol
将AlCl3溶液分多次加入NaOH溶液中,发生以下反应:
Al3+ + 4OH-====[Al(OH)4]-
0.075 mol 0.3 mol 0.075 mol
继续滴加,发生如下反应:
Al3+ + 3[Al(OH)4]-====4Al(OH)3↓
0.025 mol 0.075 mol 0.1 mol
以上两实验的现象不同,但最终沉淀量相等。
二、非选择题(本题包括4小题,共52分)
13.(12分)某科研小组,用含有少量的CaO和Fe2O3的高
岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加
热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液
用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即
是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为a.______;
b.Al2O3+Na2CO3 2NaAlO2+CO2↑。(提示:NaAlO2易溶于水并转化为Na[Al(OH)4])
(2)最后得到的沉淀物是______________________。生成沉淀的离子方程式为_______________________。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用______坩埚。
高温
====
【解析】这是一道信息给予题,根据题示情境分析:
①高岭土熔化时,其成分中的SiO2和Al2O3与Na2CO3反应生成Na2SiO3和NaAlO2。②熔块加水使Na2SiO3和NaAlO2
溶解与其他杂质分离,在过滤后的滤液中加入盐酸则使Na2SiO3、Na[Al(OH)4]分别与过量的盐酸反应,生成H4SiO4沉淀和AlCl3溶液,过滤得滤液即为净水剂。③因为瓷坩埚中含有SiO2,氧化铝坩埚主要成分是Al2O3,它们都能与Na2CO3在高温下发生反应,故熔融样品时只能用铁坩埚。
答案:(1)SiO2+Na2CO3 Na2SiO3+CO2↑
(2)H4SiO4 2H++SiO32-+H2O====H4SiO4↓
(3)铁
高温
====
14.(12分)(2010·沈阳高一检测)某无色溶液由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]-、CO32-、SO32-、SO42-、MnO4-中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有无色无味气体生成,并得到溶液。
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
③在②所得溶液中加入过量氢氧化钡溶液,也有气体生成,并有白色沉淀乙析出。
根据上述现象回答下列问题:
(1)溶液中一定存在的离子是__________________;
(2)一定不存在的离子是______________________;
(3)证明白色沉淀甲是两性氢氧化物的有关离子方程式是_________________________________________;
(4)判断沉淀乙的实验方法是:________________。
【解析】无色溶液中肯定无MnO4-,加入盐酸有无色无味气体生成,说明有CO32-、无SO32-、Ag+、Ba2+、Al3+。加盐酸后的溶液再加入NH4HCO3至过量,有白色沉淀生成,证明原溶液中有[Al(OH)4]-。另外从溶液呈电中性考虑,原溶液中一定有Na+。
答案:(1)Na+、[Al(OH)4]-、CO32-
(2)Ag+、Ba2+、Al3+、SO32-、MnO4-
(3)Al(OH)3+3H+====Al3++3H2O,
Al(OH)3+OH-====[Al(OH)4]-+2H2O
(4)取沉淀乙置于试管,加入足量盐酸,若沉淀全部溶解且有气体生成,则沉淀为BaCO3;若有气体产生,沉淀不完全溶解,则说明沉淀为BaCO3和BaSO4;若沉淀不溶解,也无气体产生,则说明沉淀为BaSO4
15.(12分)如图是各单质与化合物之间的转化关系。
根据上述关系判断:
(1)单质A只可能是______,这是因为__________
____________________________________________。
(2)单质B一定是金属还是非金属?____________,
这是因为____________________________________。
(3)写出有关反应的离子方程式:
①单质A与NaOH溶液反应:_____________________。
②化合物甲与NaOH溶液反应:__________________。
【解析】(1)硅,短周期元素单质与NaOH溶液反应
生成H2的只有Al和Si,
而
可见A为硅时更符合题意。
(2)由含氧酸可失水生成酸酐,可知化合物丙为H2O,故B为O2,是非金属单质。
(3)Si与NaOH溶液反应,参加反应的是Si、NaOH和H2O;SiO2为酸性氧化物与NaOH溶液反应生成盐和水。
答案:(1)硅 短周期元素单质与NaOH溶液反应生
成H2的只有Al和Si,
而
可见A为硅时更符合题意
(2)非金属化合物丁为H2SiO3则丙应为水,故B单质
为O2,为非金属
(3)①Si+2OH-+H2O====SiO32-+2H2↑
②SiO2+2OH-====SiO32-+H2O
16.(16分)(2010·南通高一检测)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Ⅰ. (1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:______(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是______(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发
生氧化还原反应时,硝酸的
浓度越稀,对应还原产物中
氮元素的化合价越低。某同
学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式____________________;上述现象说明溶液中______结合OH-的能力比______强(填离子符号)。
(3)B与A的差值为______mol。B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为______mL。
【解析】Ⅰ.(1)铝热反应放出大量的热,可以使铁熔化,而铁的熔点又比铝的熔点高,所以未反应的铝也会熔化,得到的熔融物应是铁铝合金。他的解释是合理的。
(2)铁与NaOH溶液不反应,而铝与NaOH溶液反应,选NaOH溶液可以证明所得的块状熔融物中含有金属铝。
(3)在常温下铁、铝遇到浓硫酸会钝化,不会溶解;稀硝酸溶解铁、铝后会产生污染性气体;氢氧化钠溶液不能溶解铁。所以选稀硫酸。
Ⅱ.(1)稀硝酸与熔融物反应,稀硝酸过量,加入氢
氧化钠溶液后发生酸碱中和反应。
(2)CD段会使Al3+、Fe3+发生沉淀反应,DE段沉淀的
量不再增加,发生反应:NH4++OH-====NH3·H2O ;
H+最先和OH-反应,其次是Al3+、Fe3+,最后是NH4+,所以Al3+、Fe3+、 H+结合OH-的能力比NH4+强。
(3)EF段发生反应:Al(OH)3 +OH-====[Al (OH)4]-,消耗氢氧化钠的物质的量为0.008 mol,所以Al(OH)3的物质的量为0.008 mol, 则B与A的差值为0.008 mol;据DE段知,NH4+的物质的量为0.012 mol,由于稀硝酸过量,铁、铝都变成三价,设铁、铝的物质的量和为x,根据氧化还原反应中电子守恒知: 3x=0.012 mol×
[5-(-3)],解得:x=0.032 mol,所以B点对应的沉淀的物质的量为0.032 mol;又由于CD段会消耗氢氧化钠0.096 mol,体积为0.096 mol÷4 mol·L-1=0.024 L,即24 mL,所以C点对应的氢氧化钠溶液的体积为31 mL-24 mL=7 mL。
答案 :Ⅰ. (1)合理 (2)NaOH溶液 2Al+2OH-+6H2O====2[Al (OH)4]-+3H2↑ (3)B
Ⅱ.(1)H++OH-====H2O (2)NH4++OH-====NH3·H2O
Al3+、Fe3+、 H+ NH4+
(3)0.008 0.032 7
第4章 材料家族中的元素
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,共48分)
1.(双选)下列物质中,属于新型无机非金属材料的是
( )
A.钢化玻璃 B.碳化硅陶瓷
C.光导纤维 D.有色玻璃
【解析】选B、C。钢化玻璃与普通玻璃的成分相同,制造过程不同;有色玻璃是在原料中加入某些金属氧化物制成的。
2.世界著名的科技史专家李约瑟博士考证说:“中国至少在距今3 000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是 ( )
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
C.玻璃在加热熔化时有固定的熔点
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
【解析】选C。玻璃的成分主要是Na2SiO3、CaSiO3和SiO2,属于混合物,因此,玻璃没有固定的熔点,故
C不正确。
3.下列有关材料的说法不正确的是 ( )
A.航天飞机使用的隔热陶瓷瓦为复合材料
B.复合材料由基体和增强体组成
C.复合材料既保持原有材料的特点,又有优于原材料的特性
D.纯金属的性能一般优于合金
【解析】选D。合金的性能一般优于纯金属。
4.某无色溶液中放入铝片后有大量 H2产生,则在该溶液中一定可以大量存在的离子组是 ( )
A.Na+、Cl-、K+、Br-
B.Fe2+、Cl-、K+、CO32-
C.Na+、SO42-、Mg2+、Br-
D.HCO3-、Cl-、Ba2+、Na+
【解析】选A。加入铝片产生大量H2,说明溶液为强碱性或酸性溶液。B项,Fe2+为浅绿色,且CO32-在酸性溶液中不能大量存在;C项,Mg2+在碱性溶液中不能大量存在;D项,HCO3-在酸性或碱性溶液中均不能大量存在。
5.将镁、铝、硅的混合物分为等质量的两份。一份与足量的NaOH溶液反应,另一份与足量的盐酸反应,最后生成的氢气一样多。则镁与硅的物质的量之比为 ( )
A.2∶1 B.4∶1 C.1∶1 D.3∶1
【解析】选A。Al与NaOH溶液和盐酸都反应且生成H2的量相等,在与NaOH溶液反应时Si也反应,与盐酸反应时Mg也反应,两者产生的H2一样多。根据关系式Mg~H2,
Si~2H2,n(Mg)∶n(Si)=2∶1。
6.属于铝热反应的是 ( )
A.Al+HCl B.Al+H2SO4
C.Al+MgO D.Al+WO3
【解析】选D。A、B项是活泼金属与酸反应,C项Mg比
Al活泼,不能发生反应,由于W熔点高,故用Al冶炼。
7.下列复合材料中,关于增强体说法正确的是 ( )
A.陶瓷中的SiO2 B.生铁中的铁
C.碳纤维中的合成树脂 D.混凝土中的水泥
【解析】选D。陶瓷、生铁都不是复合材料,碳纤维中的合成树脂是基体,不是增强体。
8.(2010·茂名高一检测)向某
硫酸铝和硫酸镁的混合溶液中逐
滴加入2 mol·L-1的NaOH溶液,
生成沉淀的质量m与加入NaOH溶
液体积的关系如图所示,则原混
合溶液中MgSO4与Al2(SO4)3的物质的量浓度之比为
( )
A.1∶1 B.1∶2 C.1∶3 D.2∶1
【解析】选D。根据题意可知,完全沉淀Mg2+、Al3+消耗
NaOH溶液5单位体积,而溶解Al(OH)3消耗NaOH溶液1单
位体积,则沉淀Al3+用去NaOH溶液3单位体积,沉淀Mg2+
用去2单位体积。按Al3++3OH-====Al(OH)3↓,Mg2++2OH-
====Mg(OH)2↓可知n(Al3+)∶n(Mg2+)=1∶1,则MgSO4和
Al2(SO4)3的物质的量之比为:n(MgSO4)∶[Al2(SO4)3]
因此在同一溶液中MgSO4与
Al2(SO4)3的物质的量浓度之比为2∶1。
9.向明矾[KAl(SO4)2·12H2O]溶液中滴入Ba(OH)2溶液时,当SO42-沉淀完全时,铝元素的存在形式是( )
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以[Al(OH)4]-存在于溶液中
【解析】选D。明矾为KAl(SO4)2·12H2O,其水溶液中Al3+与SO42-的物质的量之比为1∶2,即Al3+为1 mol时,SO42-为2 mol,当SO42-沉淀完全时,需Ba(OH)2 2 mol;而此时由于Al3++4OH-====[Al(OH)4]-,故Al3+全部转化成[Al(OH)4]-。
10.能鉴别Na2SiO3、CaCO3、SiO2三种白色粉末的试剂
是 ( )
A.苛性钠溶液 B.水
C.氢氟酸 D.稀盐酸
【解析】选D。Na2SiO3能与酸反应生成沉淀;CaCO3与酸反应生成气体,SiO2与HF反应生成气体,综上可知选用稀盐酸。
11.汉代器物上的颜料“汉紫”至今尚没有发现其自
然存在的记载。20世纪80年代科学家进行超导材料研
究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法
中不正确的是 ( )
A.用盐的形式表示:BaSiO3·CuSiO3
B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱
D.性质稳定,不易退色
【解析】选C。根据化合物中正负化合价的代数和等于零可知,A、B正确。硅酸盐只溶于强酸不溶于强碱,
C错。从题给信息:汉代器物上的颜料“汉紫”可知,“汉紫”性质稳定,不易退色,D正确。
12.有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1
AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶
液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是 ( )
A.现象相同,沉淀量相等
B.现象不同,沉淀量不等
C.现象相同,沉淀量不等
D.现象不同,沉淀量相等
【解析】选D。将NaOH溶液分多次加到AlCl3溶液中,发生以下反应:
Al3+ + 3OH-====Al(OH)3↓
0.1 mol 0.3 mol 0.1 mol
将AlCl3溶液分多次加入NaOH溶液中,发生以下反应:
Al3+ + 4OH-====[Al(OH)4]-
0.075 mol 0.3 mol 0.075 mol
继续滴加,发生如下反应:
Al3+ + 3[Al(OH)4]-====4Al(OH)3↓
0.025 mol 0.075 mol 0.1 mol
以上两实验的现象不同,但最终沉淀量相等。
二、非选择题(本题包括4小题,共52分)
13.(12分)某科研小组,用含有少量的CaO和Fe2O3的高
岭土(主要成分:Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加
热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液
用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即
是净水剂。
(1)土样和纯碱混合均匀,加热熔融时,土样中的主要成分与纯碱反应的化学方程式为a.______;
b.Al2O3+Na2CO3 2NaAlO2+CO2↑。(提示:NaAlO2易溶于水并转化为Na[Al(OH)4])
(2)最后得到的沉淀物是______________________。生成沉淀的离子方程式为_______________________。
(3)实验室中常备的坩埚有瓷坩埚,氧化铝坩埚和铁坩埚,本实验熔融土样时应选用______坩埚。
高温
====
【解析】这是一道信息给予题,根据题示情境分析:
①高岭土熔化时,其成分中的SiO2和Al2O3与Na2CO3反应生成Na2SiO3和NaAlO2。②熔块加水使Na2SiO3和NaAlO2
溶解与其他杂质分离,在过滤后的滤液中加入盐酸则使Na2SiO3、Na[Al(OH)4]分别与过量的盐酸反应,生成H4SiO4沉淀和AlCl3溶液,过滤得滤液即为净水剂。③因为瓷坩埚中含有SiO2,氧化铝坩埚主要成分是Al2O3,它们都能与Na2CO3在高温下发生反应,故熔融样品时只能用铁坩埚。
答案:(1)SiO2+Na2CO3 Na2SiO3+CO2↑
(2)H4SiO4 2H++SiO32-+H2O====H4SiO4↓
(3)铁
高温
====
14.(12分)(2010·沈阳高一检测)某无色溶液由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]-、CO32-、SO32-、SO42-、MnO4-中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有无色无味气体生成,并得到溶液。
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
③在②所得溶液中加入过量氢氧化钡溶液,也有气体生成,并有白色沉淀乙析出。
根据上述现象回答下列问题:
(1)溶液中一定存在的离子是__________________;
(2)一定不存在的离子是______________________;
(3)证明白色沉淀甲是两性氢氧化物的有关离子方程式是_________________________________________;
(4)判断沉淀乙的实验方法是:________________。
【解析】无色溶液中肯定无MnO4-,加入盐酸有无色无味气体生成,说明有CO32-、无SO32-、Ag+、Ba2+、Al3+。加盐酸后的溶液再加入NH4HCO3至过量,有白色沉淀生成,证明原溶液中有[Al(OH)4]-。另外从溶液呈电中性考虑,原溶液中一定有Na+。
答案:(1)Na+、[Al(OH)4]-、CO32-
(2)Ag+、Ba2+、Al3+、SO32-、MnO4-
(3)Al(OH)3+3H+====Al3++3H2O,
Al(OH)3+OH-====[Al(OH)4]-+2H2O
(4)取沉淀乙置于试管,加入足量盐酸,若沉淀全部溶解且有气体生成,则沉淀为BaCO3;若有气体产生,沉淀不完全溶解,则说明沉淀为BaCO3和BaSO4;若沉淀不溶解,也无气体产生,则说明沉淀为BaSO4
15.(12分)如图是各单质与化合物之间的转化关系。
根据上述关系判断:
(1)单质A只可能是______,这是因为__________
____________________________________________。
(2)单质B一定是金属还是非金属?____________,
这是因为____________________________________。
(3)写出有关反应的离子方程式:
①单质A与NaOH溶液反应:_____________________。
②化合物甲与NaOH溶液反应:__________________。
【解析】(1)硅,短周期元素单质与NaOH溶液反应
生成H2的只有Al和Si,
而
可见A为硅时更符合题意。
(2)由含氧酸可失水生成酸酐,可知化合物丙为H2O,故B为O2,是非金属单质。
(3)Si与NaOH溶液反应,参加反应的是Si、NaOH和H2O;SiO2为酸性氧化物与NaOH溶液反应生成盐和水。
答案:(1)硅 短周期元素单质与NaOH溶液反应生
成H2的只有Al和Si,
而
可见A为硅时更符合题意
(2)非金属化合物丁为H2SiO3则丙应为水,故B单质
为O2,为非金属
(3)①Si+2OH-+H2O====SiO32-+2H2↑
②SiO2+2OH-====SiO32-+H2O
16.(16分)(2010·南通高一检测)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Ⅰ. (1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:______(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是______(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发
生氧化还原反应时,硝酸的
浓度越稀,对应还原产物中
氮元素的化合价越低。某同
学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式____________________;上述现象说明溶液中______结合OH-的能力比______强(填离子符号)。
(3)B与A的差值为______mol。B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为______mL。
【解析】Ⅰ.(1)铝热反应放出大量的热,可以使铁熔化,而铁的熔点又比铝的熔点高,所以未反应的铝也会熔化,得到的熔融物应是铁铝合金。他的解释是合理的。
(2)铁与NaOH溶液不反应,而铝与NaOH溶液反应,选NaOH溶液可以证明所得的块状熔融物中含有金属铝。
(3)在常温下铁、铝遇到浓硫酸会钝化,不会溶解;稀硝酸溶解铁、铝后会产生污染性气体;氢氧化钠溶液不能溶解铁。所以选稀硫酸。
Ⅱ.(1)稀硝酸与熔融物反应,稀硝酸过量,加入氢
氧化钠溶液后发生酸碱中和反应。
(2)CD段会使Al3+、Fe3+发生沉淀反应,DE段沉淀的
量不再增加,发生反应:NH4++OH-====NH3·H2O ;
H+最先和OH-反应,其次是Al3+、Fe3+,最后是NH4+,所以Al3+、Fe3+、 H+结合OH-的能力比NH4+强。
(3)EF段发生反应:Al(OH)3 +OH-====[Al (OH)4]-,消耗氢氧化钠的物质的量为0.008 mol,所以Al(OH)3的物质的量为0.008 mol, 则B与A的差值为0.008 mol;据DE段知,NH4+的物质的量为0.012 mol,由于稀硝酸过量,铁、铝都变成三价,设铁、铝的物质的量和为x,根据氧化还原反应中电子守恒知: 3x=0.012 mol×
[5-(-3)],解得:x=0.032 mol,所以B点对应的沉淀的物质的量为0.032 mol;又由于CD段会消耗氢氧化钠0.096 mol,体积为0.096 mol÷4 mol·L-1=0.024 L,即24 mL,所以C点对应的氢氧化钠溶液的体积为31 mL-24 mL=7 mL。
答案 :Ⅰ. (1)合理 (2)NaOH溶液 2Al+2OH-+6H2O====2[Al (OH)4]-+3H2↑ (3)B
Ⅱ.(1)H++OH-====H2O (2)NH4++OH-====NH3·H2O
Al3+、Fe3+、 H+ NH4+
(3)0.008 0.032 7
