浙江省桐乡市第一中学2011-2012学年高二上学期期中考试化学(文)试题
文档属性
| 名称 | 浙江省桐乡市第一中学2011-2012学年高二上学期期中考试化学(文)试题 | 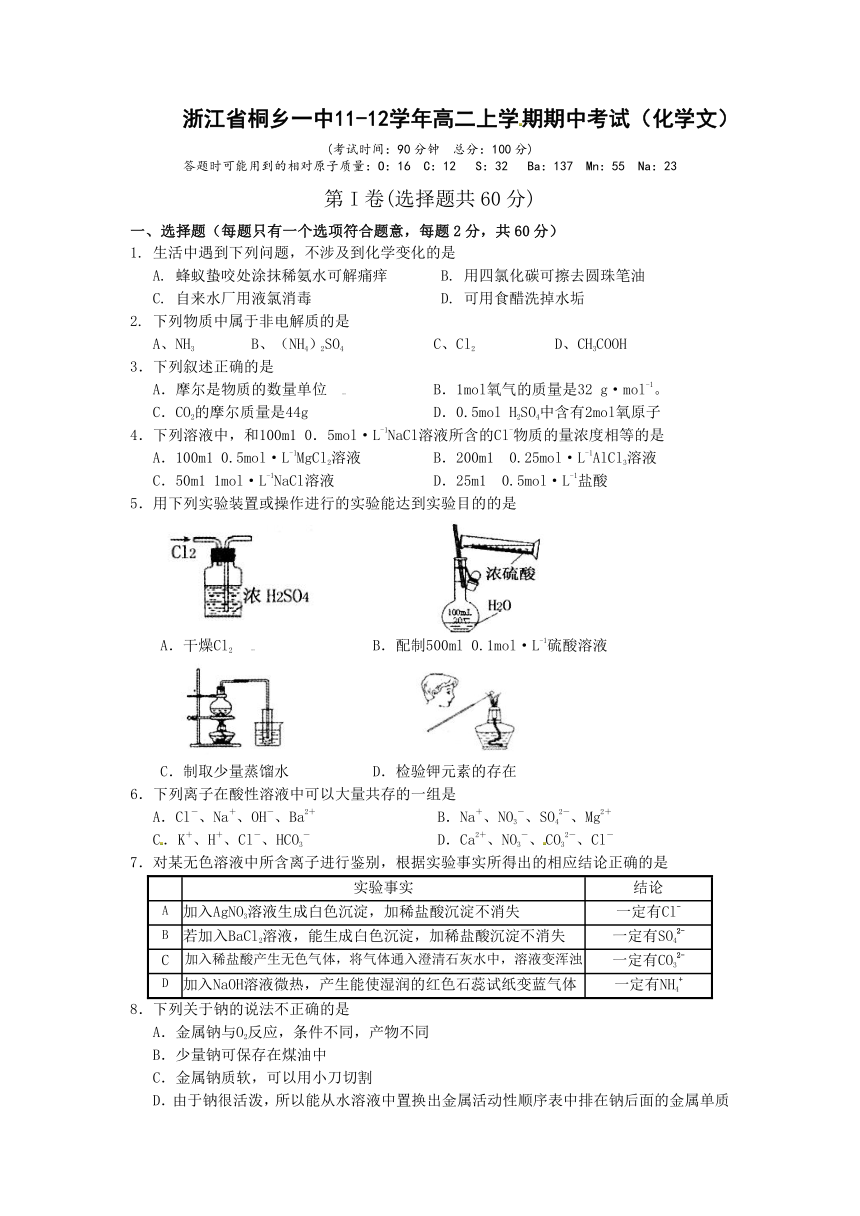 | |
| 格式 | zip | ||
| 文件大小 | 165.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-10 18:46:34 | ||
图片预览



文档简介
浙江省桐乡一中11-12学年高二上学期期中考试(化学文)
(考试时间:90分钟 总分:100分)
答题时可能用到的相对原子质量:O:16 C:12 S:32 Ba:137 Mn:55 Na:23
第I卷(选择题共60分)
一、选择题(每题只有一个选项符合题意,每题2分,共60分)
1. 生活中遇到下列问题,不涉及到化学变化的是
A. 蜂蚁蛰咬处涂抹稀氨水可解痛痒 B. 用四氯化碳可擦去圆珠笔油
C. 自来水厂用液氯消毒 D. 可用食醋洗掉水垢
2. 下列物质中属于非电解质的是
A、NH3 B、(NH4)2 SO4 C、Cl2 D、CH3COOH
3.下列叙述正确的是
A.摩尔是物质的数量单位 B.1mol氧气的质量是32 g·mol-1。
C.CO2的摩尔质量是44g D.0.5mol H2SO4中含有2mol氧原子
4.下列溶液中,和100m1 0.5mol·L-1NaCl溶液所含的Cl-物质的量浓度相等的是
A.100m1 0.5mol·L-1MgCl2溶液 B.200m1 0.25mol·L-1AlCl3溶液
C.50m1 1mol·L-1NaCl溶液 D.25m1 0.5mol·L-1盐酸
5.用下列实验装置或操作进行的实验能达到实验目的的是
A.干燥Cl2 B.配制500ml 0.1mol·L-1硫酸溶液
C.制取少量蒸馏水 D.检验钾元素的存在
6.下列离子在酸性溶液中可以大量共存的一组是
A.Cl-、Na+、OH-、Ba2+ B.Na+、NO3-、SO42-、Mg2+
C.K+、H+、Cl-、HCO3- D.Ca2+、NO3-、CO32-、Cl-
7.对某无色溶液中所含离子进行鉴别,根据实验事实所得出的相应结论正确的是
实验事实 结论
A 加入AgNO3溶液生成白色沉淀,加稀盐酸沉淀不消失 一定有Cl-
B 若加入BaCl2溶液,能生成白色沉淀,加稀盐酸沉淀不消失 一定有SO42-
C 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊 一定有CO32-
D 加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝气体 一定有NH4+
8.下列关于钠的说法不正确的是
A.金属钠与O2反应,条件不同,产物不同
B.少量钠可保存在煤油中
C.金属钠质软,可以用小刀切割
D.由于钠很活泼,所以能从水溶液中置换出金属活动性顺序表中排在钠后面的金属单质
9.关于氯气及氯水的叙述中,下列正确的是
A.氯气是一种黄绿色、有毒的气体
B.久置氯水加AgNO3溶液不能生成白色沉淀
C.氯气不能溶解于水,所以可用排水法收集氯气
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
10.将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液中含有大量的阳离子是
A.Cu2+和Fe2+ B.Fe2+和Mg2+ C.Fe3+和Fe2+ D.H+和Cu2+
11.向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后,混合液出现血红色。那么,由此得出下列的结论正确的是
A.该晶体中没有SCN- B.Fe3+的氧化性比Cl2的氧化性强
C.Fe2+被Cl2氧化为Fe3+ D.Fe2+ 与SCN-形成血红色的化合物
12.在工业生产中,硫酸不能用于
A.制化肥 B.制漂白粉 C.酸洗 D.医药、制炸药、农药
13.下列能达到实验目的的是
A.用NaOH溶液除去CO2中混有的HCl气体
B.用分液漏斗分离四氯化碳和水的混合物;
C. 加入盐酸以除去硫酸钠中的少许碳酸钠杂质
D.配制一定浓度的氯化钾溶液1000mL,准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容
14.日常生活中,常用到化学知识。下列说法不正确的是
A.某些铁盐溶于水生成的Fe(OH)3胶体,可除去水中的悬浮颗粒等杂质
B.维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜
C.构成人体蛋白质的20多种氨基酸都能通过人体自身合成
D.可用燃烧的方法鉴别真丝围巾和合成纤维围巾
15.下列情况会对人体健康造成危害的是
A.用SO2漂白食品 B.用食醋清洗热水瓶胆内壁附着的水垢
C.提倡广泛使用铁锅 D.用小苏打发酵面团制作馒头
16.用NA表示阿伏加德罗常数,下列说法正确的是
A.通常状况下,NA个二氧化碳分子占有的体积为22.4L
B.18g水所含的分子数为NA
C.标准状况下,22.4L氢气所含的原子数目为NA
D.NA个硫酸分子共有6mol原子
17.在通常条件下,能由两种单质直接化合而成的物质是
A.CuO B.NaOH C.FeCl2 D.SO3
18.“垃圾是放错了地方的资源”,应分类回收利用。生活中废弃的塑料袋、废纸、旧橡胶制品等属于
A无机物 B.有机物 C.盐类 D. 糖类
19.大多数水生生物只能在一定的PH范围内的水中生存,你认为这PH范围是
A.1-5 B.5-6.5 C.6.5-9.5 D.9-14
20.在第二次世界大战中,拯救了成千上万士兵的生命,当时被誉为与原子弹、雷达齐名的三大发明之一的抗生素是
A.青霉素 B.阿司匹林 C.红霉素 D.吗啡
21.下列反应可用于测定患糖尿病者尿液中含葡萄糖的是
A.加入金属钠看是否放出H2
B.与新制碱性Cu(OH)2悬浊液混合煮沸看是否有红色沉淀
C.放置后看是否有白色晶体生成
D.加苯振荡、静置后,看是否分层
22.只用食盐、食醋、纯碱三种家庭厨房中的常见物质,你无法完成的实验是
A.检验自来水中是否含氯离子 B.鉴别食盐和纯碱
C.检验鸡蛋壳能否溶于酸 D.除去热水瓶中的水垢
23.关于维生素C的下列说法中不正确的是
A.易溶于水,水溶液显酸性 B.维生素C也称为抗坏血酸,在人体内有重要功能
C.在水溶液中容易被还原 D.新鲜的水果和蔬菜中含有大量维生素C
24.下列食品添加剂与类别对应正确的一组是
A.着色剂-亚硝酸盐 B.疏松剂—碳酸氢铵
C.调味剂-苯甲酸钠 D.防腐剂-醋酸
25.如图所示,在一熟苹果切片上分别滴上1滴碘水和银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断正确的是
A.熟透的苹果中含有脂肪
B.熟透的苹果中不含淀粉
C.熟透的苹果中含有还原性的糖
D.熟透的苹果中不含还原性的糖
26.据媒体报道,近年来,我国许多城市实施汽车“油改气”工程,即将燃料由汽油改为液化石油气(含C、H元素),目的是改善城市的空气质量。你认为这项举措可以减少下列哪种气体对空气的污染:①SO2;②CO;③CO2;④NO2。
A.①② B.②④ C.①③ D.①④
27.下列试剂或方法不能将硬水软化的是
A.明矾 B.磺化酶 C.加热煮沸法 D.离子交换法
28. 飘尘是物质燃烧时产生的颗粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2、O2接触时会部分转化为SO3,,使空气的酸度增加。飘尘所起的作用是
A.氧化剂 B.还原剂 C.催化剂 D.净化剂
29.随着人们生活质量的不断提高,对废电池必须进行集中处理的问题被提到议事日程,其首要原因
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土地和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品
D.回收其中的石墨电池
30.在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)== 2MnCl2+5Cl2↑+2KCl+8H2O下列叙述中正确的是
A.反应中KMnO4被氧化
B.氧化剂与还原剂的物质的量之比为5:1
C.每生成1 mol Cl2时,反应中转移的电子为2 mol
D.每消耗16 mol HCl时,其中做氧化剂的HCl是16 mol
第Ⅱ卷(非选择题 共40分)
二、填空题(共计34分)
31.(4分)方程式书写:
(1)镁条在二氧化碳中燃烧的反应:
(2)小块钠投入到水中的离子反应:
32.(6分)下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合初中化学和生物学科的知识,回答下列问题。
配料表 精制海盐、碘酸钾
含碘量 20~40mg/kg
卫生许可证号 ××卫碘字(1999)第001号
分装日期 见封底
储藏方法 密封、避光、防潮
食用方法 烹调时,待食品熟后加入碘盐
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患( )
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是 (填元素、原子或单质)。
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为____________。
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易______ ____。
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+==3I2+3H2O)。现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质_______________(填序号)。
33.(6分)简要回答下列问题。
(1)居室装修完毕,通常要开窗通风一段时间后才能入住,其原因是 。
(2)可以用铁罐盛装浓硫酸或浓硝酸的原因是 。
(3)医疗上,胃舒平[主要成分Al(OH)3]常用作治疗胃酸(含盐酸)过多的药剂,其理由是 。
34.(8分)实验室需要0.1 mol/L NaOH溶液450 mL。根据这种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号), 本实验所需玻璃仪器E规格为 mL。
(2)下列有关容量瓶的说法中,不正确的有 (填序号)。
A.能配制一定体积准确浓度的标准溶液 B.可长期贮存溶液
C.能用来加热溶解固体溶质 D.使用前必须检查是否漏水
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度
0.1 mol/L(填“大于”“等于”或“小于”)。
35.(10分)某学生设计了如下的实验装置图用于制备干燥纯净的氯气。
(1)指出上述装置图中的错误(有几处答几处)
①铁架台上少酒精灯____________________ ②________________________________
③____________________________________ ④________________________________
⑤____________________________________ ⑥_________________________________
(2)改正后的装置图中,洗气瓶中的饱和食盐水、浓硫酸以及氢氧化钠溶液各起什么作用?
①饱和食盐水的作用_________________; ②浓硫酸的作用____________________;
③氢氧化钠溶液的作用_______________________________。
(3)写出烧瓶中发生反应的化学方程式并注明反应条件:_____________________________
三、计算题(6分)
36.取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成1.12 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。(要求写出解题过程)
浙江省桐乡一中11-12学年高二上学期期中考试(化学文答卷)
第I卷(选择题,共60分)
一、选择题(每小题只有一个选项符合题意,共60分)
题序 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
题序 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
答案
第II卷(非选择题,共40分)
二、填空题(共计34分)
31.(4分)(1)
(2)
32.(6分)
(1)( ) (2)( )(3) (填元素、原子或单质)。(4)____________。
(5)______ ____ ___。(6)_________________(填序号)。
33.(6分)简要回答下列问题。
(1) 。
(2) 。
(3) 。
34.(8分)
(1) (填序号), mL。 (2) (填序号)。(3)
35.(10分)
(1)①铁架台上少酒精灯____________________ ②________________________________
③____________________________________ ④________________________________
⑤____________________________________ ⑥________________________________
(2) ①_______________________; ②_______________; ③_________________________。
(3)____________________________________________
三、计算题(6分)(要求写出解题过程)
36.
浙江省桐乡一中11-12学年高二上学期期中考试(化学文答案)
第I卷(选择题,共60分)
选择题(每小题只有一个选项符合题意,共60分)
第II卷(非选择题,共40分)
二、填空题(共计34分)
31.(4分)(1) 2Mg+CO2==2MgO+C
(2) 2Na+2H2O==2Na++2OH-+H2
32.(6分)
(1)( B ) (2)( C )(3) 元素 (填、原子或单质)。(4)____+5______。
(5)______分解 _ ___。(6)_①③④______(填序号)。
33.(6分)简要回答下列问题。
(1) 释放甲醛、苯等有机物 。
(2) 发生钝化 。
(3)Al(OH)3 能中和胃酸 。
34.(8分)
(1) AC (填序号), 500 mL。 (2) BC (填序号)。(3) 小于
35.(10分)
(1)①铁架台上少酒精灯___________________ ②_少石棉网________________
③_稀盐酸改成浓盐酸___________________ ④_长颈漏斗改成分液漏斗_____
⑤_AB装置互换________________________ ⑥_A中导管长进短出____
(2) ①_除去氯气中混有的氯化氢气体_; ②干燥氯气; ③尾气处理,防止空气污染。
(3)MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O
三、计算题(6分)
36.nNa2CO3 =0.05mol nNa2SO4=0.01mol
(考试时间:90分钟 总分:100分)
答题时可能用到的相对原子质量:O:16 C:12 S:32 Ba:137 Mn:55 Na:23
第I卷(选择题共60分)
一、选择题(每题只有一个选项符合题意,每题2分,共60分)
1. 生活中遇到下列问题,不涉及到化学变化的是
A. 蜂蚁蛰咬处涂抹稀氨水可解痛痒 B. 用四氯化碳可擦去圆珠笔油
C. 自来水厂用液氯消毒 D. 可用食醋洗掉水垢
2. 下列物质中属于非电解质的是
A、NH3 B、(NH4)2 SO4 C、Cl2 D、CH3COOH
3.下列叙述正确的是
A.摩尔是物质的数量单位 B.1mol氧气的质量是32 g·mol-1。
C.CO2的摩尔质量是44g D.0.5mol H2SO4中含有2mol氧原子
4.下列溶液中,和100m1 0.5mol·L-1NaCl溶液所含的Cl-物质的量浓度相等的是
A.100m1 0.5mol·L-1MgCl2溶液 B.200m1 0.25mol·L-1AlCl3溶液
C.50m1 1mol·L-1NaCl溶液 D.25m1 0.5mol·L-1盐酸
5.用下列实验装置或操作进行的实验能达到实验目的的是
A.干燥Cl2 B.配制500ml 0.1mol·L-1硫酸溶液
C.制取少量蒸馏水 D.检验钾元素的存在
6.下列离子在酸性溶液中可以大量共存的一组是
A.Cl-、Na+、OH-、Ba2+ B.Na+、NO3-、SO42-、Mg2+
C.K+、H+、Cl-、HCO3- D.Ca2+、NO3-、CO32-、Cl-
7.对某无色溶液中所含离子进行鉴别,根据实验事实所得出的相应结论正确的是
实验事实 结论
A 加入AgNO3溶液生成白色沉淀,加稀盐酸沉淀不消失 一定有Cl-
B 若加入BaCl2溶液,能生成白色沉淀,加稀盐酸沉淀不消失 一定有SO42-
C 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊 一定有CO32-
D 加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝气体 一定有NH4+
8.下列关于钠的说法不正确的是
A.金属钠与O2反应,条件不同,产物不同
B.少量钠可保存在煤油中
C.金属钠质软,可以用小刀切割
D.由于钠很活泼,所以能从水溶液中置换出金属活动性顺序表中排在钠后面的金属单质
9.关于氯气及氯水的叙述中,下列正确的是
A.氯气是一种黄绿色、有毒的气体
B.久置氯水加AgNO3溶液不能生成白色沉淀
C.氯气不能溶解于水,所以可用排水法收集氯气
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
10.将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液中含有大量的阳离子是
A.Cu2+和Fe2+ B.Fe2+和Mg2+ C.Fe3+和Fe2+ D.H+和Cu2+
11.向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后,混合液出现血红色。那么,由此得出下列的结论正确的是
A.该晶体中没有SCN- B.Fe3+的氧化性比Cl2的氧化性强
C.Fe2+被Cl2氧化为Fe3+ D.Fe2+ 与SCN-形成血红色的化合物
12.在工业生产中,硫酸不能用于
A.制化肥 B.制漂白粉 C.酸洗 D.医药、制炸药、农药
13.下列能达到实验目的的是
A.用NaOH溶液除去CO2中混有的HCl气体
B.用分液漏斗分离四氯化碳和水的混合物;
C. 加入盐酸以除去硫酸钠中的少许碳酸钠杂质
D.配制一定浓度的氯化钾溶液1000mL,准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容
14.日常生活中,常用到化学知识。下列说法不正确的是
A.某些铁盐溶于水生成的Fe(OH)3胶体,可除去水中的悬浮颗粒等杂质
B.维生素C高温时容易被破坏,所以不宜热锅爆炒蔬菜
C.构成人体蛋白质的20多种氨基酸都能通过人体自身合成
D.可用燃烧的方法鉴别真丝围巾和合成纤维围巾
15.下列情况会对人体健康造成危害的是
A.用SO2漂白食品 B.用食醋清洗热水瓶胆内壁附着的水垢
C.提倡广泛使用铁锅 D.用小苏打发酵面团制作馒头
16.用NA表示阿伏加德罗常数,下列说法正确的是
A.通常状况下,NA个二氧化碳分子占有的体积为22.4L
B.18g水所含的分子数为NA
C.标准状况下,22.4L氢气所含的原子数目为NA
D.NA个硫酸分子共有6mol原子
17.在通常条件下,能由两种单质直接化合而成的物质是
A.CuO B.NaOH C.FeCl2 D.SO3
18.“垃圾是放错了地方的资源”,应分类回收利用。生活中废弃的塑料袋、废纸、旧橡胶制品等属于
A无机物 B.有机物 C.盐类 D. 糖类
19.大多数水生生物只能在一定的PH范围内的水中生存,你认为这PH范围是
A.1-5 B.5-6.5 C.6.5-9.5 D.9-14
20.在第二次世界大战中,拯救了成千上万士兵的生命,当时被誉为与原子弹、雷达齐名的三大发明之一的抗生素是
A.青霉素 B.阿司匹林 C.红霉素 D.吗啡
21.下列反应可用于测定患糖尿病者尿液中含葡萄糖的是
A.加入金属钠看是否放出H2
B.与新制碱性Cu(OH)2悬浊液混合煮沸看是否有红色沉淀
C.放置后看是否有白色晶体生成
D.加苯振荡、静置后,看是否分层
22.只用食盐、食醋、纯碱三种家庭厨房中的常见物质,你无法完成的实验是
A.检验自来水中是否含氯离子 B.鉴别食盐和纯碱
C.检验鸡蛋壳能否溶于酸 D.除去热水瓶中的水垢
23.关于维生素C的下列说法中不正确的是
A.易溶于水,水溶液显酸性 B.维生素C也称为抗坏血酸,在人体内有重要功能
C.在水溶液中容易被还原 D.新鲜的水果和蔬菜中含有大量维生素C
24.下列食品添加剂与类别对应正确的一组是
A.着色剂-亚硝酸盐 B.疏松剂—碳酸氢铵
C.调味剂-苯甲酸钠 D.防腐剂-醋酸
25.如图所示,在一熟苹果切片上分别滴上1滴碘水和银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断正确的是
A.熟透的苹果中含有脂肪
B.熟透的苹果中不含淀粉
C.熟透的苹果中含有还原性的糖
D.熟透的苹果中不含还原性的糖
26.据媒体报道,近年来,我国许多城市实施汽车“油改气”工程,即将燃料由汽油改为液化石油气(含C、H元素),目的是改善城市的空气质量。你认为这项举措可以减少下列哪种气体对空气的污染:①SO2;②CO;③CO2;④NO2。
A.①② B.②④ C.①③ D.①④
27.下列试剂或方法不能将硬水软化的是
A.明矾 B.磺化酶 C.加热煮沸法 D.离子交换法
28. 飘尘是物质燃烧时产生的颗粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2、O2接触时会部分转化为SO3,,使空气的酸度增加。飘尘所起的作用是
A.氧化剂 B.还原剂 C.催化剂 D.净化剂
29.随着人们生活质量的不断提高,对废电池必须进行集中处理的问题被提到议事日程,其首要原因
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土地和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品
D.回收其中的石墨电池
30.在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)== 2MnCl2+5Cl2↑+2KCl+8H2O下列叙述中正确的是
A.反应中KMnO4被氧化
B.氧化剂与还原剂的物质的量之比为5:1
C.每生成1 mol Cl2时,反应中转移的电子为2 mol
D.每消耗16 mol HCl时,其中做氧化剂的HCl是16 mol
第Ⅱ卷(非选择题 共40分)
二、填空题(共计34分)
31.(4分)方程式书写:
(1)镁条在二氧化碳中燃烧的反应:
(2)小块钠投入到水中的离子反应:
32.(6分)下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合初中化学和生物学科的知识,回答下列问题。
配料表 精制海盐、碘酸钾
含碘量 20~40mg/kg
卫生许可证号 ××卫碘字(1999)第001号
分装日期 见封底
储藏方法 密封、避光、防潮
食用方法 烹调时,待食品熟后加入碘盐
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患( )
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是 (填元素、原子或单质)。
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为____________。
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易______ ____。
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+==3I2+3H2O)。现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质_______________(填序号)。
33.(6分)简要回答下列问题。
(1)居室装修完毕,通常要开窗通风一段时间后才能入住,其原因是 。
(2)可以用铁罐盛装浓硫酸或浓硝酸的原因是 。
(3)医疗上,胃舒平[主要成分Al(OH)3]常用作治疗胃酸(含盐酸)过多的药剂,其理由是 。
34.(8分)实验室需要0.1 mol/L NaOH溶液450 mL。根据这种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号), 本实验所需玻璃仪器E规格为 mL。
(2)下列有关容量瓶的说法中,不正确的有 (填序号)。
A.能配制一定体积准确浓度的标准溶液 B.可长期贮存溶液
C.能用来加热溶解固体溶质 D.使用前必须检查是否漏水
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度
0.1 mol/L(填“大于”“等于”或“小于”)。
35.(10分)某学生设计了如下的实验装置图用于制备干燥纯净的氯气。
(1)指出上述装置图中的错误(有几处答几处)
①铁架台上少酒精灯____________________ ②________________________________
③____________________________________ ④________________________________
⑤____________________________________ ⑥_________________________________
(2)改正后的装置图中,洗气瓶中的饱和食盐水、浓硫酸以及氢氧化钠溶液各起什么作用?
①饱和食盐水的作用_________________; ②浓硫酸的作用____________________;
③氢氧化钠溶液的作用_______________________________。
(3)写出烧瓶中发生反应的化学方程式并注明反应条件:_____________________________
三、计算题(6分)
36.取一定量的Na2CO3和Na2SO4混合物溶液与过量盐酸反应,生成1.12 L CO2(标准状况),然后加入足量的Ba(OH)2溶液,得到沉淀的质量为2.33g。试计算混合物中Na2CO3和Na2SO4的物质的量分别为多少。(要求写出解题过程)
浙江省桐乡一中11-12学年高二上学期期中考试(化学文答卷)
第I卷(选择题,共60分)
一、选择题(每小题只有一个选项符合题意,共60分)
题序 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
题序 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
答案
第II卷(非选择题,共40分)
二、填空题(共计34分)
31.(4分)(1)
(2)
32.(6分)
(1)( ) (2)( )(3) (填元素、原子或单质)。(4)____________。
(5)______ ____ ___。(6)_________________(填序号)。
33.(6分)简要回答下列问题。
(1) 。
(2) 。
(3) 。
34.(8分)
(1) (填序号), mL。 (2) (填序号)。(3)
35.(10分)
(1)①铁架台上少酒精灯____________________ ②________________________________
③____________________________________ ④________________________________
⑤____________________________________ ⑥________________________________
(2) ①_______________________; ②_______________; ③_________________________。
(3)____________________________________________
三、计算题(6分)(要求写出解题过程)
36.
浙江省桐乡一中11-12学年高二上学期期中考试(化学文答案)
第I卷(选择题,共60分)
选择题(每小题只有一个选项符合题意,共60分)
第II卷(非选择题,共40分)
二、填空题(共计34分)
31.(4分)(1) 2Mg+CO2==2MgO+C
(2) 2Na+2H2O==2Na++2OH-+H2
32.(6分)
(1)( B ) (2)( C )(3) 元素 (填、原子或单质)。(4)____+5______。
(5)______分解 _ ___。(6)_①③④______(填序号)。
33.(6分)简要回答下列问题。
(1) 释放甲醛、苯等有机物 。
(2) 发生钝化 。
(3)Al(OH)3 能中和胃酸 。
34.(8分)
(1) AC (填序号), 500 mL。 (2) BC (填序号)。(3) 小于
35.(10分)
(1)①铁架台上少酒精灯___________________ ②_少石棉网________________
③_稀盐酸改成浓盐酸___________________ ④_长颈漏斗改成分液漏斗_____
⑤_AB装置互换________________________ ⑥_A中导管长进短出____
(2) ①_除去氯气中混有的氯化氢气体_; ②干燥氯气; ③尾气处理,防止空气污染。
(3)MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O
三、计算题(6分)
36.nNa2CO3 =0.05mol nNa2SO4=0.01mol
同课章节目录
