第十一单元 盐 化肥 酸碱盐相关实验复习学案
文档属性
| 名称 | 第十一单元 盐 化肥 酸碱盐相关实验复习学案 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-12 16:35:14 | ||
图片预览


文档简介
酸碱盐相关实验(讲义)
??知识点睛
1.?探究酸碱盐反应后溶液的成分
(1)酸碱中和反应实验
①证明酸碱中和反应的发生
有现象的,可直接观察;
无明显现象的,通常加入指示剂观察。
②探究酸碱中和反应后溶液的成分
?????例:向氢氧化钠溶液中滴加稀盐酸,探究反应后溶液的成分,并设计方案进行验证。
?????????三种情况:恰好完全反应(NaCl)
酸过量(NaCl和HCl)
碱过量(NaCl和NaOH)
?????????验证方案:
a.滴加酸碱指示剂观察颜色变化
如滴加紫色石蕊溶液,溶液变红,证明酸过量。
???b.加入其他试剂观察产生的现象(气体、沉淀等)
如加入Na2CO3溶液,有气体产生,证明酸过量。
(2)其他酸碱盐反应实验
其探究方法可类比酸碱中和反应后溶液的成分探究。
2.?碱的变质
(1)NaOH、Ca(OH)2变质的原因
和空气中的_____反应,NaOH转化为________,Ca(OH)2转化为__________。
(2)探究是否变质及变质程度
①探究碱是否变质,需检验是否存在CO32-。
检验方法:
a.滴加足量酸,有气体产生;
b.滴加含Ca2+或Ba2+的可溶性碱或盐,有白色沉淀产生。
②探究碱的变质程度(部分变质或全部变质),需检验是否存在OH-。
检验方法:
先滴加足量的含Ca2+或Ba2+的可溶性盐使CO32-变成沉淀,过滤后向滤液中(或静置后向上层清液中)滴加酸碱指示剂,观察颜色变化。
??精讲精练
1.?某兴趣小组的同学为证明稀盐酸与NaOH溶液发生了中和反应,从不同角度设计了如下两个实验方案,并进行实验。
【方案一】先向装有一定量NaOH溶液的试管中滴加酚酞溶液,再逐滴滴加稀盐酸并不断振荡,若观察到______________
____________,则证明稀盐酸与NaOH溶液发生了中和反应。
【方案二】先用pH试纸测定NaOH溶液的pH,再逐滴滴加稀盐酸并不断振荡,同时测定混合溶液的pH,若测得的pH逐渐变_____(填“大”或“小”)且最终______(填“大于”或“小于”)7,则证明稀盐酸与NaOH溶液发生了中和反应。
2.?某实验小组的同学用氢氧化钙和盐酸进行酸碱中和反应时,向烧杯中的氢氧化钙溶液中加入稀盐酸,实验结束后,同学们发现忘了滴加指示剂。于是,他们决定对烧杯内溶液中的溶质成分进行探究。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想假设】猜想一:Ca(OH)2和CaCl2;
猜想二:CaCl2;
猜想三:__________________。
???【查阅资料】CaCl2溶液显中性。
???【进行实验】
????实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,若________________,说明猜想一不正确。
????实验二:另取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液,若______________,说明猜想二不正确,猜想三正确。
????实验三:另取少量烧杯内的溶液于试管中,下列物质中也能说明猜想三正确的是________(填序号)。
????????????A.紫色石蕊溶液
?????????B.氢氧化钠溶液
???
C.硝酸银溶液
???????????D.锌
??【反思与拓展】
???①在分析化学反应后所得物质成分时,除考虑生成物外还需
考虑__________________________。
???②要处理烧杯内的溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的_____________。
3.?小明将一定量的氢化钙(CaH2)加入到一定量的Na2CO3溶液中,充分反应后过滤,分离出滤液和滤渣。
【提出问题】滤液中的溶质的成分是什么?
【查阅资料】CaH2遇水迅速反应生成Ca(OH)2和H2。反应的化学方程式为___________________________。
【结论推理】滤液中溶质一定有NaOH,可能有Na2CO3或____________。
实验方法
实验现象
实验结论
取滤液少许,向其中滴加Na2CO3溶液
无明显现象
(1)__________
(2)______________________________
有气体放出
滤液中有Na2CO3
【反思拓展】
(1)如果要从上述滤液中以最小的成本获得大量的NaOH,应该向滤液中加入适量的_________溶液。
(2)小明认为CaH2和水反应是复分解反应,谈谈你的看法并说明理由。
?
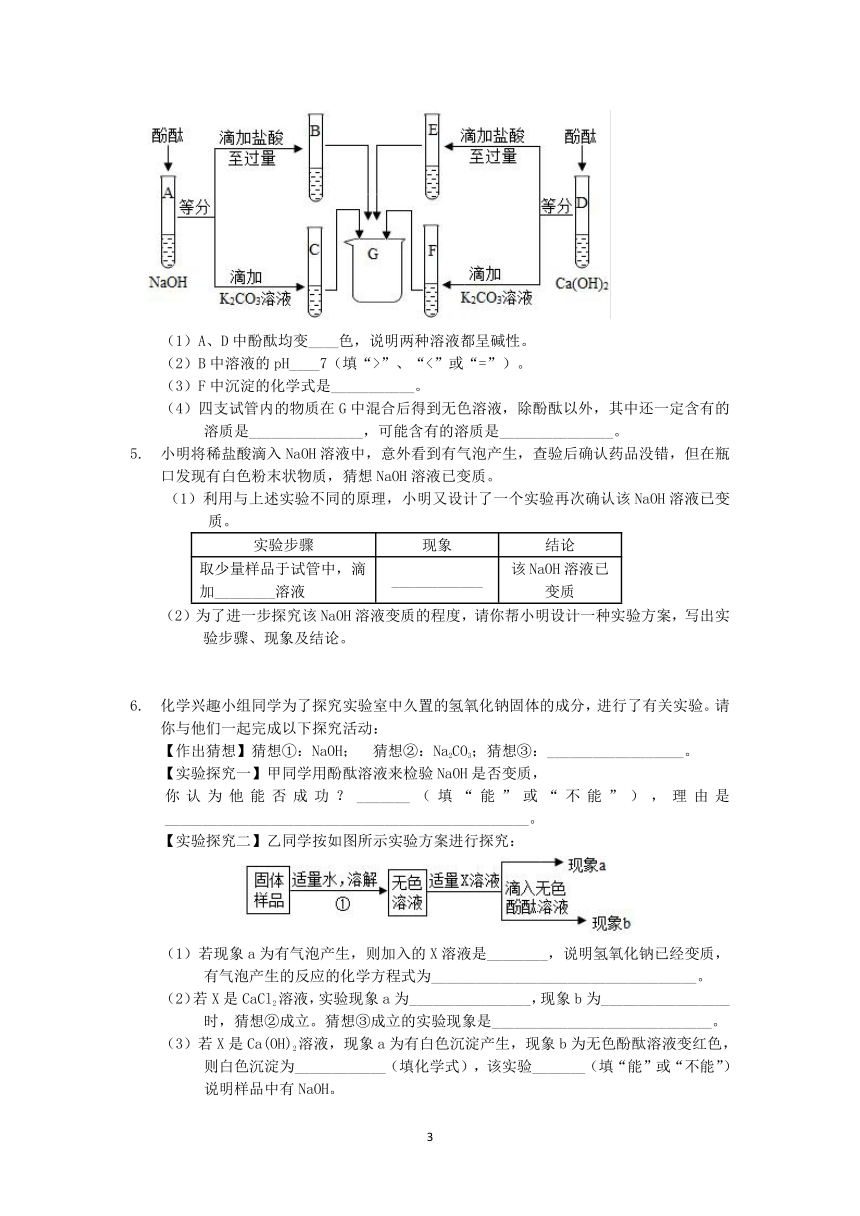
4.?为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行了如下实验。
?
(1)A、D中酚酞均变____色,说明两种溶液都呈碱性。
(2)B中溶液的pH____7(填“>”、“<”或“=”)。
(3)F中沉淀的化学式是___________。
(4)四支试管内的物质在G中混合后得到无色溶液,除酚酞以外,其中还一定含有的溶质是_______________,可能含有的溶质是_______________。
5.?小明将稀盐酸滴入NaOH溶液中,意外看到有气泡产生,查验后确认药品没错,但在瓶口发现有白色粉末状物质,猜想NaOH溶液已变质。
(1)利用与上述实验不同的原理,小明又设计了一个实验再次确认该NaOH溶液已变质。
实验步骤
现象
结论
取少量样品于试管中,滴加________溶液
____________
该NaOH溶液已变质
(2)为了进一步探究该NaOH溶液变质的程度,请你帮小明设计一种实验方案,写出实验步骤、现象及结论。
?
6.?化学兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【作出猜想】猜想①:NaOH;
猜想②:Na2CO3;猜想③:__________________。
【实验探究一】甲同学用酚酞溶液来检验NaOH是否变质,
你认为他能否成功?_______(填“能”或“不能”),理由是________________________________________________。
【实验探究二】乙同学按如图所示实验方案进行探究:
?
(1)若现象a为有气泡产生,则加入的X溶液是________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式为___________________________________。
(2)若X是CaCl2溶液,实验现象a为________________,现象b为_________________时,猜想②成立。猜想③成立的实验现象是_____________________________。
(3)若X是Ca(OH)2溶液,现象a为有白色沉淀产生,现象b为无色酚酞溶液变红色,则白色沉淀为____________(填化学式),该实验_______(填“能”或“不能”)说明样品中有NaOH。
7.?某化学兴趣小组的同学们在实验室发现一盛石灰水的试剂瓶,瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
【作出猜想】
猜想①CaCO3:原因是石灰水与空气中的CO2反应。
猜想②______:原因是溶剂蒸发,石灰水中的溶质结晶析出。
猜想③_______________。
【实验探究】
甲同学取白色粉末于试管中,加少量的水、振荡,发现试管底部有白色固体,于是他得出白色粉末是CaCO3的结论。乙同学认为甲同学的结论不严密,理由是__________________。
为了得出较严密的结论,进行了下表所示实验,请完成表格:
实验步骤
实验现象
实验结论
①取上述试管中的上层清液,滴加1~2滴无色酚酞溶液
溶液呈红色
白色粉末中含有_________
②往上述试管残留的白色固体中滴加______________
___________
白色粉末中含有CaCO3
由上述实验可知,猜想____是正确的。
酸碱盐相关实验(习题)
1.?为探究“酸碱中和反应”,某班同学进行了如下实验,将一定量的稀H2SO4加入盛有NaOH溶液的小烧杯中,该反应的化学方程式为_______________________________。
【提出问题】
反应后溶液中的溶质是什么?
【作出猜想】①Na2SO4?②Na2SO4和H2SO4
③Na2SO4和NaOH
??④Na2SO4、H2SO4和NaOH
不需要证明,就可以排除的猜想是________(填序号)。
【实验探究】
取烧杯中的溶液于试管中,滴加CuSO4溶液后无明显变化,则该溶液中一定没有______________。为了验证其余猜想,同学们进行了如下三个实验探究:
实验方案
测溶液pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作
?
实验现象
试纸变色,对比标准比色卡,pH<7
有气泡产生
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
【结论反思】
(1)通过以上探究,可确定正确的猜想是____(填序号)。
(2)请指出以上实验探究中存在的两处错误。
?
(3)请你再设计一个实验,验证正确猜想,你选用的药品是_________,实验现象是__________________________。
2.?下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应实验。请你与甲、乙同学一起完成下列实验:
?
?
探究环节
甲同学的探究
乙同学的探究
提出问题
A3溶液为什么不变红?
B3溶液中溶质的成分是什么?(酚酞不计)
作出猜想
实验过程中,酚酞变质了
①NaCl②NaCl、HCl
实验验证
(1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想_______(填“成立”或“不成立”)(2)你认为,在常温下A2溶液测出的pH应____7(填“>”、“=”或“<”)。
取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为____________。据此,你认为乙同学的猜想______成立(填序号)。
交流反思
(1)A3溶液未变红,你认为原因是A2溶液中的?????__________较多,加入的NaOH溶液未将其完全中和。(2)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意控制药品的用量。
?
3.?某化学活动小组在一次实验中进行了如图所示实验:
此时观察到的实验现象是____________________________;
实验后,同学们充分振荡U形管,将U形管内的物质过滤后,对滤液成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】滤液中除Na+外,还含有什么离子?
【猜想假设】A同学:含有OH-、Cl-、CO32-;
B同学:含有OH-、Cl-、Ba2+;
C同学:含有____________(填离子符号)。
【实验探究】B同学为了验证自己的猜想,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此B同学得出结论:自己的猜想不成立,A同学的猜想成立。
【评论与交流】请你评价B同学的结论:_________________
___________________________________________________。
同学们经过讨论后一致认为:B同学在验证自己的猜想时,若将所加试剂换成足量的另一种试剂_________(填化学式),既能验证自己的猜想,也能确定滤液中的离子成分。
4.?盛有NaOH溶液的试剂瓶瓶口和橡胶塞上出现了白色粉末。甲、乙两同学对白色粉末的成分进行如下猜想和验证。
猜想:①NaOH
??②Na2CO3???③NaOH与Na2CO3的混合物
(1)甲同学向所取少量粉末中滴加一种溶液后,排除①的可能性。请推测他所加的试剂和观察到的现象。
?
(2)乙同学提议用酚酞溶液来继续鉴定猜想②和③哪个正确,你认为可行吗?请简要说明理由。
?
(3)请你设计一种实验方案进一步验证猜想②和③哪个正确,写出实验步骤、现象及结论。
?
?
5.?某实验小组取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂。小军认为生石灰已变质,试剂瓶中可能含有CaO、Ca(OH)2、CaCO3三种物质,并开展如下探究:?
?
实验操作
实验现象
结论
甲
取试样加入水中,充分搅拌
产生白色浑浊
一定含有CaCO3
乙
取试样加入稀盐酸中
产生无色气泡
一定含有CaCO3
(1)比较甲、乙两种方案,你认为_____方案不够合理,理由是_____________________________________________。
(2)小红认为放置时间过长,可能全部变成了CaCO3,请你?利用实验验证小红的猜想是否正确,写出实验步骤、现象及结论。
?
?
?(3)小林认为不可能全部变成CaCO3,一定还有CaO,请你?利用实验验证小林的猜想否正确,写出实验步骤、现象及结论。
【参考答案】
??知识点睛?
2.?(1)CO2
???Na2CO3
??????CaCO3
(2)Na2CO3和NaOH????????Na2CO3
CaCO3和Ca(OH)2??????CaCO3
??精讲精练
1.?溶液由红色变为无色????小?????小于
2.?CaCl2和HCl
???溶液不变红
??有气泡冒出
??AD
反应物是否过量??碳酸钙(CaCO3)
3.?【查阅资料】CaH2+2H2OCa(OH)2+2H2↑??
【结论推理】Ca(OH)2
?????????????????(1)滤液中无Ca(OH)2
??????????????????????(2)取滤液少许,向其中滴加过量稀盐酸
【反思拓展】(1)Ca(OH)2
????????????????(2)CaH2和水反应不是复分解反应,因为生成物中有单质。
4.?(1)红
(2)<
(3)CaCO3
(4)NaCl、KCl、CaCl2????????HCl
5.?(1)CaCl2或BaCl2等(答案合理即可)???产生白色沉淀
(2)取少量样品于试管中,向其中加入足量的BaCl2溶液,有白色沉淀产生,过滤,向滤液中滴加酚酞溶液。若观察到溶液不变红,则该样品全部变质;若观察到溶液变红,则该样品部分变质。
6.?NaOH和Na2CO3????不能???
NaOH和Na2CO3溶液都显碱性,都能使酚酞溶液变红。
(1)稀盐酸(或稀硫酸)
?
Na2CO3+2HCl2NaCl+CO2↑+H2O?
??(2)有白色沉淀产生
???溶液不变色
???
a为有白色沉淀产生,b为溶液变红色
(3)CaCO3?????不能
?
7.?Ca(OH)2?????Ca(OH)2和CaCO3???????Ca(OH)2微溶于水???
①Ca(OH)2????②稀盐酸
??有气泡产生
??③
?
?
?
?
【参考答案】
1.?2NaOH
+
H2SO4?Na2SO4?+
2H2O
?④
??NaOH
(1)②
(2)两处错误:一是实验操作中,不能将pH试纸直接伸入到待测溶液中;二是实验方案中,滴加BaCl2不能证明溶液中有H2SO4,因为BaCl2与Na2SO4反应也会生成白色沉淀。
(3)铁片
??有气泡产生
2.?实验验证:甲同学???(1)不成立
???(2)<
??????????乙同学????浅绿色?????②
交流反思:(1)盐酸
3.?U形管左、右两端均产生白色沉淀
????OH-、Cl-
B同学的猜想确实不成立,但也无法证明A同学的猜想成立。(答案合理均可)
H2SO4
4.?(1)所加试剂为稀盐酸,观察到有气泡产生。
???
(2)不可行。因为NaOH和Na2CO3溶液均显碱性,都能使
无色酚酞溶液变红。
????(3)取少量粉末于试管中,向其中滴加过量的氯化钙溶液,观察到有白色沉淀,静置,向上层清液中滴加酚酞溶液,若溶液变红,证明猜想③正确,若溶液不变红,证明猜想②正确。
5.?(1)甲
?氢氧化钙溶解度较小,溶于水也可能出现白色沉淀
(2)取试样加入水中,充分搅拌,取上层清液,滴加无色酚
酞溶液,如果呈现红色,说明还有CaO或Ca(OH)2,如不变色,说明全部变成了CaCO3
(3)取试样加入水中,充分搅拌,用手触摸容器外壁,如果
感觉有明显放热,说明其中还含有CaO
??知识点睛
1.?探究酸碱盐反应后溶液的成分
(1)酸碱中和反应实验
①证明酸碱中和反应的发生
有现象的,可直接观察;
无明显现象的,通常加入指示剂观察。
②探究酸碱中和反应后溶液的成分
?????例:向氢氧化钠溶液中滴加稀盐酸,探究反应后溶液的成分,并设计方案进行验证。
?????????三种情况:恰好完全反应(NaCl)
酸过量(NaCl和HCl)
碱过量(NaCl和NaOH)
?????????验证方案:
a.滴加酸碱指示剂观察颜色变化
如滴加紫色石蕊溶液,溶液变红,证明酸过量。
???b.加入其他试剂观察产生的现象(气体、沉淀等)
如加入Na2CO3溶液,有气体产生,证明酸过量。
(2)其他酸碱盐反应实验
其探究方法可类比酸碱中和反应后溶液的成分探究。
2.?碱的变质
(1)NaOH、Ca(OH)2变质的原因
和空气中的_____反应,NaOH转化为________,Ca(OH)2转化为__________。
(2)探究是否变质及变质程度
①探究碱是否变质,需检验是否存在CO32-。
检验方法:
a.滴加足量酸,有气体产生;
b.滴加含Ca2+或Ba2+的可溶性碱或盐,有白色沉淀产生。
②探究碱的变质程度(部分变质或全部变质),需检验是否存在OH-。
检验方法:
先滴加足量的含Ca2+或Ba2+的可溶性盐使CO32-变成沉淀,过滤后向滤液中(或静置后向上层清液中)滴加酸碱指示剂,观察颜色变化。
??精讲精练
1.?某兴趣小组的同学为证明稀盐酸与NaOH溶液发生了中和反应,从不同角度设计了如下两个实验方案,并进行实验。
【方案一】先向装有一定量NaOH溶液的试管中滴加酚酞溶液,再逐滴滴加稀盐酸并不断振荡,若观察到______________
____________,则证明稀盐酸与NaOH溶液发生了中和反应。
【方案二】先用pH试纸测定NaOH溶液的pH,再逐滴滴加稀盐酸并不断振荡,同时测定混合溶液的pH,若测得的pH逐渐变_____(填“大”或“小”)且最终______(填“大于”或“小于”)7,则证明稀盐酸与NaOH溶液发生了中和反应。
2.?某实验小组的同学用氢氧化钙和盐酸进行酸碱中和反应时,向烧杯中的氢氧化钙溶液中加入稀盐酸,实验结束后,同学们发现忘了滴加指示剂。于是,他们决定对烧杯内溶液中的溶质成分进行探究。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想假设】猜想一:Ca(OH)2和CaCl2;
猜想二:CaCl2;
猜想三:__________________。
???【查阅资料】CaCl2溶液显中性。
???【进行实验】
????实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,若________________,说明猜想一不正确。
????实验二:另取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液,若______________,说明猜想二不正确,猜想三正确。
????实验三:另取少量烧杯内的溶液于试管中,下列物质中也能说明猜想三正确的是________(填序号)。
????????????A.紫色石蕊溶液
?????????B.氢氧化钠溶液
???
C.硝酸银溶液
???????????D.锌
??【反思与拓展】
???①在分析化学反应后所得物质成分时,除考虑生成物外还需
考虑__________________________。
???②要处理烧杯内的溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的_____________。
3.?小明将一定量的氢化钙(CaH2)加入到一定量的Na2CO3溶液中,充分反应后过滤,分离出滤液和滤渣。
【提出问题】滤液中的溶质的成分是什么?
【查阅资料】CaH2遇水迅速反应生成Ca(OH)2和H2。反应的化学方程式为___________________________。
【结论推理】滤液中溶质一定有NaOH,可能有Na2CO3或____________。
实验方法
实验现象
实验结论
取滤液少许,向其中滴加Na2CO3溶液
无明显现象
(1)__________
(2)______________________________
有气体放出
滤液中有Na2CO3
【反思拓展】
(1)如果要从上述滤液中以最小的成本获得大量的NaOH,应该向滤液中加入适量的_________溶液。
(2)小明认为CaH2和水反应是复分解反应,谈谈你的看法并说明理由。
?
4.?为研究氢氧化钠、氢氧化钙两种溶液的化学性质,进行了如下实验。
?
(1)A、D中酚酞均变____色,说明两种溶液都呈碱性。
(2)B中溶液的pH____7(填“>”、“<”或“=”)。
(3)F中沉淀的化学式是___________。
(4)四支试管内的物质在G中混合后得到无色溶液,除酚酞以外,其中还一定含有的溶质是_______________,可能含有的溶质是_______________。
5.?小明将稀盐酸滴入NaOH溶液中,意外看到有气泡产生,查验后确认药品没错,但在瓶口发现有白色粉末状物质,猜想NaOH溶液已变质。
(1)利用与上述实验不同的原理,小明又设计了一个实验再次确认该NaOH溶液已变质。
实验步骤
现象
结论
取少量样品于试管中,滴加________溶液
____________
该NaOH溶液已变质
(2)为了进一步探究该NaOH溶液变质的程度,请你帮小明设计一种实验方案,写出实验步骤、现象及结论。
?
6.?化学兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【作出猜想】猜想①:NaOH;
猜想②:Na2CO3;猜想③:__________________。
【实验探究一】甲同学用酚酞溶液来检验NaOH是否变质,
你认为他能否成功?_______(填“能”或“不能”),理由是________________________________________________。
【实验探究二】乙同学按如图所示实验方案进行探究:
?
(1)若现象a为有气泡产生,则加入的X溶液是________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式为___________________________________。
(2)若X是CaCl2溶液,实验现象a为________________,现象b为_________________时,猜想②成立。猜想③成立的实验现象是_____________________________。
(3)若X是Ca(OH)2溶液,现象a为有白色沉淀产生,现象b为无色酚酞溶液变红色,则白色沉淀为____________(填化学式),该实验_______(填“能”或“不能”)说明样品中有NaOH。
7.?某化学兴趣小组的同学们在实验室发现一盛石灰水的试剂瓶,瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
【作出猜想】
猜想①CaCO3:原因是石灰水与空气中的CO2反应。
猜想②______:原因是溶剂蒸发,石灰水中的溶质结晶析出。
猜想③_______________。
【实验探究】
甲同学取白色粉末于试管中,加少量的水、振荡,发现试管底部有白色固体,于是他得出白色粉末是CaCO3的结论。乙同学认为甲同学的结论不严密,理由是__________________。
为了得出较严密的结论,进行了下表所示实验,请完成表格:
实验步骤
实验现象
实验结论
①取上述试管中的上层清液,滴加1~2滴无色酚酞溶液
溶液呈红色
白色粉末中含有_________
②往上述试管残留的白色固体中滴加______________
___________
白色粉末中含有CaCO3
由上述实验可知,猜想____是正确的。
酸碱盐相关实验(习题)
1.?为探究“酸碱中和反应”,某班同学进行了如下实验,将一定量的稀H2SO4加入盛有NaOH溶液的小烧杯中,该反应的化学方程式为_______________________________。
【提出问题】
反应后溶液中的溶质是什么?
【作出猜想】①Na2SO4?②Na2SO4和H2SO4
③Na2SO4和NaOH
??④Na2SO4、H2SO4和NaOH
不需要证明,就可以排除的猜想是________(填序号)。
【实验探究】
取烧杯中的溶液于试管中,滴加CuSO4溶液后无明显变化,则该溶液中一定没有______________。为了验证其余猜想,同学们进行了如下三个实验探究:
实验方案
测溶液pH
滴加Na2CO3溶液
滴加BaCl2溶液
实验操作
?
实验现象
试纸变色,对比标准比色卡,pH<7
有气泡产生
产生白色沉淀
实验结论
溶液中有H2SO4
溶液中有H2SO4
溶液中有H2SO4
【结论反思】
(1)通过以上探究,可确定正确的猜想是____(填序号)。
(2)请指出以上实验探究中存在的两处错误。
?
(3)请你再设计一个实验,验证正确猜想,你选用的药品是_________,实验现象是__________________________。
2.?下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应实验。请你与甲、乙同学一起完成下列实验:
?
?
探究环节
甲同学的探究
乙同学的探究
提出问题
A3溶液为什么不变红?
B3溶液中溶质的成分是什么?(酚酞不计)
作出猜想
实验过程中,酚酞变质了
①NaCl②NaCl、HCl
实验验证
(1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想_______(填“成立”或“不成立”)(2)你认为,在常温下A2溶液测出的pH应____7(填“>”、“=”或“<”)。
取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为____________。据此,你认为乙同学的猜想______成立(填序号)。
交流反思
(1)A3溶液未变红,你认为原因是A2溶液中的?????__________较多,加入的NaOH溶液未将其完全中和。(2)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意控制药品的用量。
?
3.?某化学活动小组在一次实验中进行了如图所示实验:
此时观察到的实验现象是____________________________;
实验后,同学们充分振荡U形管,将U形管内的物质过滤后,对滤液成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】滤液中除Na+外,还含有什么离子?
【猜想假设】A同学:含有OH-、Cl-、CO32-;
B同学:含有OH-、Cl-、Ba2+;
C同学:含有____________(填离子符号)。
【实验探究】B同学为了验证自己的猜想,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此B同学得出结论:自己的猜想不成立,A同学的猜想成立。
【评论与交流】请你评价B同学的结论:_________________
___________________________________________________。
同学们经过讨论后一致认为:B同学在验证自己的猜想时,若将所加试剂换成足量的另一种试剂_________(填化学式),既能验证自己的猜想,也能确定滤液中的离子成分。
4.?盛有NaOH溶液的试剂瓶瓶口和橡胶塞上出现了白色粉末。甲、乙两同学对白色粉末的成分进行如下猜想和验证。
猜想:①NaOH
??②Na2CO3???③NaOH与Na2CO3的混合物
(1)甲同学向所取少量粉末中滴加一种溶液后,排除①的可能性。请推测他所加的试剂和观察到的现象。
?
(2)乙同学提议用酚酞溶液来继续鉴定猜想②和③哪个正确,你认为可行吗?请简要说明理由。
?
(3)请你设计一种实验方案进一步验证猜想②和③哪个正确,写出实验步骤、现象及结论。
?
?
5.?某实验小组取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂。小军认为生石灰已变质,试剂瓶中可能含有CaO、Ca(OH)2、CaCO3三种物质,并开展如下探究:?
?
实验操作
实验现象
结论
甲
取试样加入水中,充分搅拌
产生白色浑浊
一定含有CaCO3
乙
取试样加入稀盐酸中
产生无色气泡
一定含有CaCO3
(1)比较甲、乙两种方案,你认为_____方案不够合理,理由是_____________________________________________。
(2)小红认为放置时间过长,可能全部变成了CaCO3,请你?利用实验验证小红的猜想是否正确,写出实验步骤、现象及结论。
?
?
?(3)小林认为不可能全部变成CaCO3,一定还有CaO,请你?利用实验验证小林的猜想否正确,写出实验步骤、现象及结论。
【参考答案】
??知识点睛?
2.?(1)CO2
???Na2CO3
??????CaCO3
(2)Na2CO3和NaOH????????Na2CO3
CaCO3和Ca(OH)2??????CaCO3
??精讲精练
1.?溶液由红色变为无色????小?????小于
2.?CaCl2和HCl
???溶液不变红
??有气泡冒出
??AD
反应物是否过量??碳酸钙(CaCO3)
3.?【查阅资料】CaH2+2H2OCa(OH)2+2H2↑??
【结论推理】Ca(OH)2
?????????????????(1)滤液中无Ca(OH)2
??????????????????????(2)取滤液少许,向其中滴加过量稀盐酸
【反思拓展】(1)Ca(OH)2
????????????????(2)CaH2和水反应不是复分解反应,因为生成物中有单质。
4.?(1)红
(2)<
(3)CaCO3
(4)NaCl、KCl、CaCl2????????HCl
5.?(1)CaCl2或BaCl2等(答案合理即可)???产生白色沉淀
(2)取少量样品于试管中,向其中加入足量的BaCl2溶液,有白色沉淀产生,过滤,向滤液中滴加酚酞溶液。若观察到溶液不变红,则该样品全部变质;若观察到溶液变红,则该样品部分变质。
6.?NaOH和Na2CO3????不能???
NaOH和Na2CO3溶液都显碱性,都能使酚酞溶液变红。
(1)稀盐酸(或稀硫酸)
?
Na2CO3+2HCl2NaCl+CO2↑+H2O?
??(2)有白色沉淀产生
???溶液不变色
???
a为有白色沉淀产生,b为溶液变红色
(3)CaCO3?????不能
?
7.?Ca(OH)2?????Ca(OH)2和CaCO3???????Ca(OH)2微溶于水???
①Ca(OH)2????②稀盐酸
??有气泡产生
??③
?
?
?
?
【参考答案】
1.?2NaOH
+
H2SO4?Na2SO4?+
2H2O
?④
??NaOH
(1)②
(2)两处错误:一是实验操作中,不能将pH试纸直接伸入到待测溶液中;二是实验方案中,滴加BaCl2不能证明溶液中有H2SO4,因为BaCl2与Na2SO4反应也会生成白色沉淀。
(3)铁片
??有气泡产生
2.?实验验证:甲同学???(1)不成立
???(2)<
??????????乙同学????浅绿色?????②
交流反思:(1)盐酸
3.?U形管左、右两端均产生白色沉淀
????OH-、Cl-
B同学的猜想确实不成立,但也无法证明A同学的猜想成立。(答案合理均可)
H2SO4
4.?(1)所加试剂为稀盐酸,观察到有气泡产生。
???
(2)不可行。因为NaOH和Na2CO3溶液均显碱性,都能使
无色酚酞溶液变红。
????(3)取少量粉末于试管中,向其中滴加过量的氯化钙溶液,观察到有白色沉淀,静置,向上层清液中滴加酚酞溶液,若溶液变红,证明猜想③正确,若溶液不变红,证明猜想②正确。
5.?(1)甲
?氢氧化钙溶解度较小,溶于水也可能出现白色沉淀
(2)取试样加入水中,充分搅拌,取上层清液,滴加无色酚
酞溶液,如果呈现红色,说明还有CaO或Ca(OH)2,如不变色,说明全部变成了CaCO3
(3)取试样加入水中,充分搅拌,用手触摸容器外壁,如果
感觉有明显放热,说明其中还含有CaO
同课章节目录
