中考二轮专题 物质的分离和提纯 复习学案
图片预览

文档简介
物质的分离和提纯(讲义)
一、知识点睛
1.?分离和提纯
分离:把混合物中的各组分物质彼此分开,并恢复到各物质的
原来状态,分别得到纯净物。
提纯:把混入某物质里的少量杂质除去,以便获得相对纯净的
物质,又称除杂。
2.?除杂思路及原则
思路:将杂质直接除去或将杂质转化为所需物质。
原则:①除杂不除物(只能除去杂质);
??????②不引杂(不能引入新的杂质);
??????③除杂后易分离(一般将杂质转化成气体或沉淀)。
3.?气体的除杂
通过吸收剂除去杂质气体的过程称为气体的净化;一般又把除去水蒸气称为气体的干燥。
①净化
吸收剂
可吸收的气体杂质
水
易溶性气体,如____________
碱溶液(如NaOH)
酸性气体,如______________
碱石灰(NaOH+CaO)
水蒸气、酸性气体
灼热的CuO
还原性气体,如____________
灼热的Cu网
_____________
②干燥
干燥剂
可干燥的气体
酸性
浓硫酸
酸性和中性气体,如__________
碱性
生石灰、碱石灰、固体氢氧化钠
碱性和中性气体,如__________
中性
无水氯化钙
除NH3外所有气体
③净化与干燥装置
常用的有洗气瓶、球形干燥管、U形管、玻璃管等。
使用时连接的原则:保证气体和试剂充分接触。
洗气瓶的连接:__进__出;球形干燥管的连接:__进__出;U形管和玻璃管则无特殊要求,一般按照仪器接口的字母顺序连接。
4.?固体或溶液的除杂
(1)物理方法
(2)化学方法
例:①NaCl(NaHCO3):加入适量稀盐酸;
②NaOH(Na2CO3):加入适量Ca(OH)2;
③FeCl2(CuCl2):加入足量Fe粉;
④炭粉(CuO):加入足量稀盐酸。
二、精讲精练
1.?下列物质中都含有水蒸气,既能用浓硫酸干燥,又能用氢氧化钠固体干燥的是(????)
A.NH3???????B.CO2????????C.HCl
????D.N2
2.?为了除去O2中混有的少量CO2和水蒸气,将混合气体分别通过下面两个装置,能达到目的的是哪一个?说明理由。
?
?
3.?要除去N2中混有的少量H2、CO、CO2,从而得到纯净、干燥的N2,通过下列试剂的先后顺序正确的是( )
①浓硫酸
????②苛性钠溶液
????③灼热的氧化铜
A.①②③
????B.②③①
???C.③②①
???D.②①③
4.?下图是将潮湿空气中的氧气、二氧化碳、水蒸气分别除去的流程图:
请根据你确定的除杂方案,将使用的试剂名称填写在下面的横线上:A为__________;B为__________;C为_________。
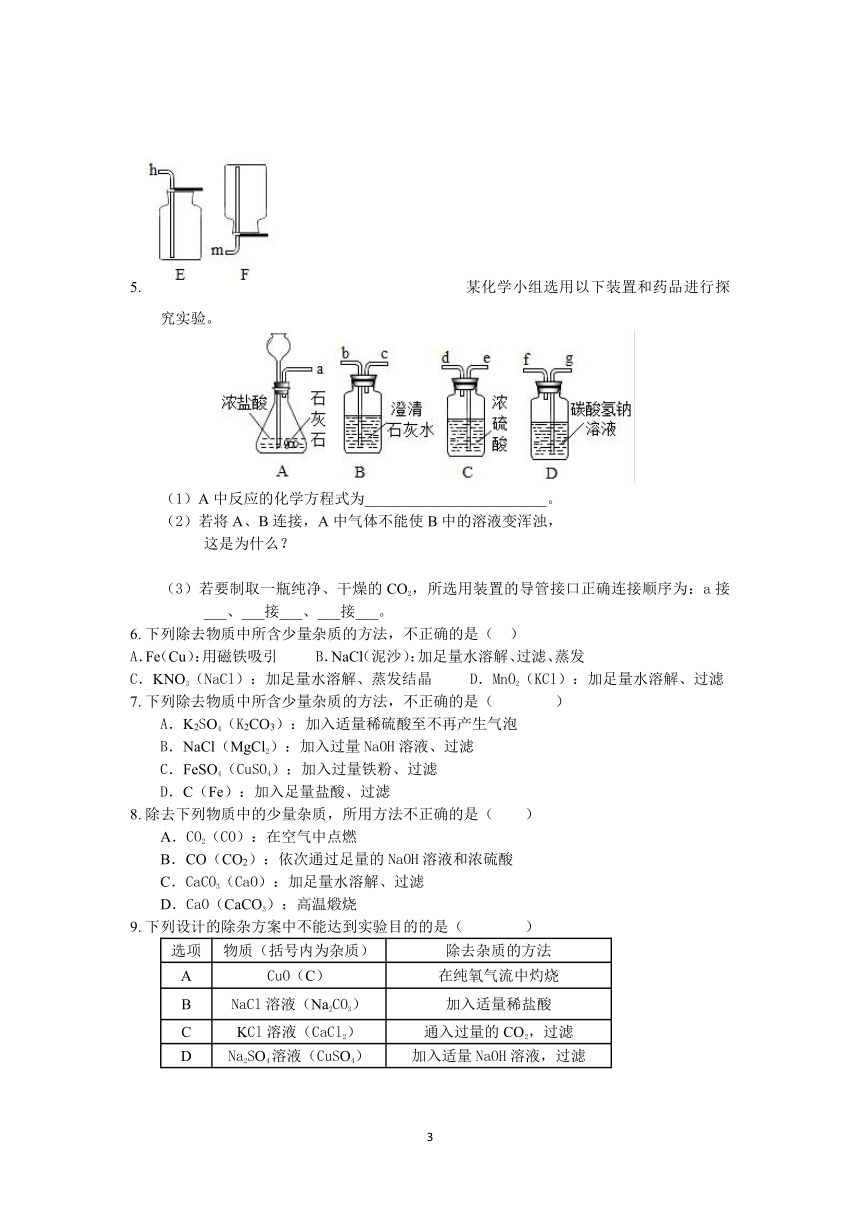
5.?某化学小组选用以下装置和药品进行探究实验。
?
(1)A中反应的化学方程式为________________________。
(2)若将A、B连接,A中气体不能使B中的溶液变浑浊,
这是为什么?
?
(3)若要制取一瓶纯净、干燥的CO2,所选用装置的导管接口正确连接顺序为:a接___、___接___、___接___。
6.?下列除去物质中所含少量杂质的方法,不正确的是(????)
A.Fe(Cu):用磁铁吸引
B.NaCl(泥沙):加足量水溶解、过滤、蒸发??????????????
C.KNO3(NaCl):加足量水溶解、蒸发结晶
D.MnO2(KCl):加足量水溶解、过滤
7.?下列除去物质中所含少量杂质的方法,不正确的是(????)
A.K2SO4(K2CO3):加入适量稀硫酸至不再产生气泡
B.NaCl(MgCl2):加入过量NaOH溶液、过滤
????????????
C.FeSO4(CuSO4):加入过量铁粉、过滤?????????
D.C(Fe):加入足量盐酸、过滤
8.?除去下列物质中的少量杂质,所用方法不正确的是( )
A.CO2(CO):在空气中点燃?
B.CO(CO2):依次通过足量的NaOH溶液和浓硫酸
?
C.CaCO3(CaO):加足量水溶解、过滤
D.CaO(CaCO3):高温煅烧
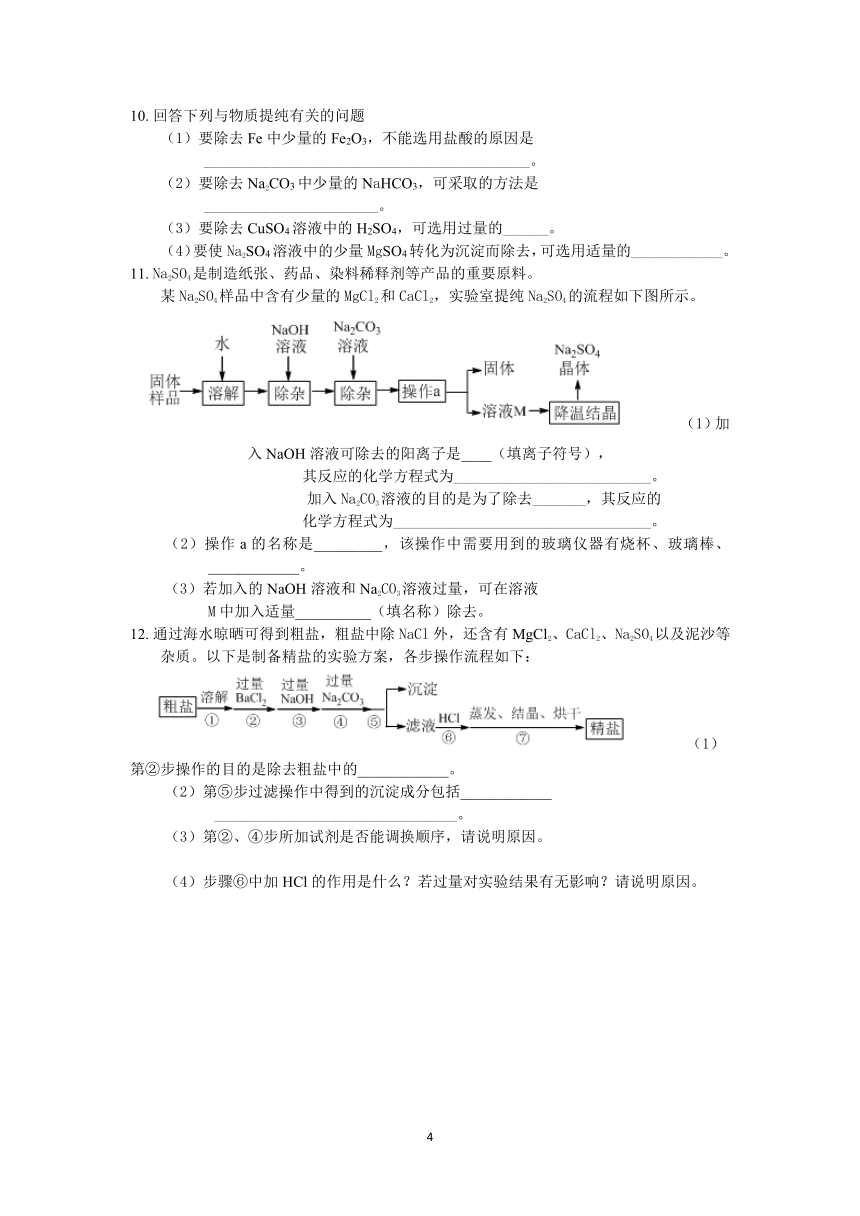
9.?下列设计的除杂方案中不能达到实验目的的是(????)
选项
物质(括号内为杂质)
除去杂质的方法
A
CuO(C)
在纯氧气流中灼烧
B
NaCl溶液(Na2CO3)
加入适量稀盐酸
C
KCl溶液(CaCl2)
通入过量的CO2,过滤
D
Na2SO4溶液(CuSO4)
加入适量NaOH溶液,过滤
?
10.?回答下列与物质提纯有关的问题
(1)要除去Fe中少量的Fe2O3,不能选用盐酸的原因是
___________________________________________。
(2)要除去Na2CO3中少量的NaHCO3,可采取的方法是
_______________________。
(3)要除去CuSO4溶液中的H2SO4,可选用过量的______。
(4)要使Na2SO4溶液中的少量MgSO4转化为沉淀而除去,可选用适量的____________。
11.?Na2SO4是制造纸张、药品、染料稀释剂等产品的重要原料。
某Na2SO4样品中含有少量的MgCl2和CaCl2,实验室提纯Na2SO4的流程如下图所示。
????(1)加入NaOH溶液可除去的阳离子是____(填离子符号),
??????其反应的化学方程式为__________________________。
??????加入Na2CO3溶液的目的是为了除去_______,其反应的
??????化学方程式为__________________________________。
(2)操作a的名称是_________,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、____________。
(3)若加入的NaOH溶液和Na2CO3溶液过量,可在溶液
M中加入适量__________(填名称)除去。
12.?通过海水晾晒可得到粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
????(1)第②步操作的目的是除去粗盐中的____________。
(2)第⑤步过滤操作中得到的沉淀成分包括____________
________________________________。
(3)第②、④步所加试剂是否能调换顺序,请说明原因。
?
(4)步骤⑥中加HCl的作用是什么?若过量对实验结果有无影响?请说明原因。
物质的分离和提纯(习题)
1.?下列气体能用浓硫酸干燥而不能用苛性钠干燥的是(????)
A.H2???????B.NH3???????C.O2????????D.CO2
2.?用锌与盐酸反应制得的氢气中,常常混有水蒸气和氯化氢。为除去杂质,可通过如图两个装置,得到纯净干燥的氢气。气体通过两瓶的导管连接顺序正确的是( )
?
A.abcd
?????B.cdab
?????C.dcba
?????D.bacd
3.?有下列三种试剂:①浓硫酸;②饱和NaHCO3溶液;③红热的铜丝。为除去CO2中混有的少量O2、水蒸气和HCl,此混合气体通过上述三种试剂的顺序是( )
A.②①③
???B.③①②
???C.①③②
??D.①②③
4.?为了除去CO中混有的少量O2,某同学设计了如下图所示的实验装置(装置气密性良好)。
?
(1)请写出用这套装置除去O2的化学方程式。
?
(2)老师认为他的实验设计不科学,请你指出存在的错误。
?
5.?除去下列物质中的少量杂质,所用试剂及操作方法不正确的是( )
选项
物质
杂质
试剂及操作方法
A
氨气
水蒸气
通过足量氢氧化钠固体
B
NaCl
Na2CO3
加足量稀盐酸,蒸发
C
稀盐酸
稀硝酸
加足量硝酸银溶液,过滤
D
KNO3溶液
Ba(NO3)2
加适量K2SO4溶液,过滤
6.?物质除杂是化学实验中经常遇到的问题。
【方法探究】
为了除去CO2中混有的少量CO,小明设计了三种方案。
方案A
方案B
方案C
上述三个方案中不合理的是方案____,该方案不合理的原因是_____________________________;试写出合理方案中任意一个反应的化学方程式:____________________________。
【方法提炼】上述两个合理方案体现了物质除杂的不同思路:
思路一:将杂质直接转化为所需物质;
思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
【方法运用】
运用思路一:除去MgCl2粉末中混有的少量BaCl2,先加足量水溶解,再向溶液中加入适量的_______溶液,过滤、蒸发,即可得到MgCl2固体。
运用思路二:除去MgCl2粉末中混有的少量BaCl2、NaCl和K2SO4。
步骤①中反应的化学方程式是_________________________,
滤液B中一定含有的溶质是__________________________;
步骤②中反应的化学方程式是_________________________,
滤液C中一定含有的阴离子是________________________。
步骤③中乙溶液是________。
7.?某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。小青同学设计了以下方案来除去可溶性杂质。
???(1)步骤①中加入过量NaOH溶液的目的是____________,
?相关的化学方程式为__________________________。
(2)步骤②中得到的白色沉淀是__________(填化学式)。
(3)步骤③中若加入的稀盐酸过量,对所得到的氯化钠纯度_______(填“有”或“没有”)影响。
(4)经过上述提纯操作后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果__________(填“增大”、“不变”或“减小”)。
【参考答案】
一、知识点睛?
3.?①HCl、NH3????????CO2、SO2、HCl
??????H2、CO
?????O2
②HCl、CO2、H2?????NH3、H2??????
③长
?短
??????粗
?细
4.?(1)蒸发结晶
???降温结晶
二、精讲精练
1.?D
2.?②,①中最终出来的气体中仍含有水蒸气。
3.?C
4.?NaOH溶液
??浓硫酸
??灼热的铜网
5.?(1)CaCO3+2HClCaCl2+CO2↑+H2O
(2)浓盐酸易挥发,使CO2中混有HCl,不能生成CaCO3沉淀
(3)g
?f
?e
?d
?h
6.?C
7.?B
8.?A
9.?C
10.?(1)盐酸不仅能和Fe2O3反应,还能和Fe反应
(2)加热
(3)CuO或Cu(OH)2
(4)NaOH
11.?(1)Mg2+????MgCl2+2NaOHMg(OH)2↓+2NaCl
?????CaCl2????CaCl2+Na2CO3CaCO3↓+2NaCl
(2)过滤
???漏斗
(3)稀硫酸
12.?(1)Na2SO4
(2)泥沙、BaSO4、Mg(OH)2、CaCO3、BaCO3
(3)不能,为了除去过量的BaCl2,Na2CO3溶液必须加在BaCl2溶液后面,即先②后④。
(4)除去溶液中过量的NaOH和Na2CO3。
?????无影响,因为蒸发结晶过程中HCl会挥发掉。
【参考答案】?????????????????????
1.?D
2.?B
3.?A
4.?(1)2Cu+O22CuO
(2)除去氧气的同时,可能生成二氧化碳
5.?C
6.?B
??大量CO2存在时,少量CO不会燃烧
CO+CuOCu+CO2(或2NaOH+CO2Na2CO3+H2O、
Na2CO3+2HCl2NaCl+CO2↑+H2O)
MgSO4
BaCl2+K2SO42KCl+BaSO4↓
KCl、NaCl、MgCl2
MgCl2+2NaOH2NaCl+Mg(OH)2↓
OH-、Cl-?稀盐酸
7.?(1)除去溶液中的MgCl2
?????MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)CaCO3??????
(3)没有
(4)增大
?
一、知识点睛
1.?分离和提纯
分离:把混合物中的各组分物质彼此分开,并恢复到各物质的
原来状态,分别得到纯净物。
提纯:把混入某物质里的少量杂质除去,以便获得相对纯净的
物质,又称除杂。
2.?除杂思路及原则
思路:将杂质直接除去或将杂质转化为所需物质。
原则:①除杂不除物(只能除去杂质);
??????②不引杂(不能引入新的杂质);
??????③除杂后易分离(一般将杂质转化成气体或沉淀)。
3.?气体的除杂
通过吸收剂除去杂质气体的过程称为气体的净化;一般又把除去水蒸气称为气体的干燥。
①净化
吸收剂
可吸收的气体杂质
水
易溶性气体,如____________
碱溶液(如NaOH)
酸性气体,如______________
碱石灰(NaOH+CaO)
水蒸气、酸性气体
灼热的CuO
还原性气体,如____________
灼热的Cu网
_____________
②干燥
干燥剂
可干燥的气体
酸性
浓硫酸
酸性和中性气体,如__________
碱性
生石灰、碱石灰、固体氢氧化钠
碱性和中性气体,如__________
中性
无水氯化钙
除NH3外所有气体
③净化与干燥装置
常用的有洗气瓶、球形干燥管、U形管、玻璃管等。
使用时连接的原则:保证气体和试剂充分接触。
洗气瓶的连接:__进__出;球形干燥管的连接:__进__出;U形管和玻璃管则无特殊要求,一般按照仪器接口的字母顺序连接。
4.?固体或溶液的除杂
(1)物理方法
(2)化学方法
例:①NaCl(NaHCO3):加入适量稀盐酸;
②NaOH(Na2CO3):加入适量Ca(OH)2;
③FeCl2(CuCl2):加入足量Fe粉;
④炭粉(CuO):加入足量稀盐酸。
二、精讲精练
1.?下列物质中都含有水蒸气,既能用浓硫酸干燥,又能用氢氧化钠固体干燥的是(????)
A.NH3???????B.CO2????????C.HCl
????D.N2
2.?为了除去O2中混有的少量CO2和水蒸气,将混合气体分别通过下面两个装置,能达到目的的是哪一个?说明理由。
?
?
3.?要除去N2中混有的少量H2、CO、CO2,从而得到纯净、干燥的N2,通过下列试剂的先后顺序正确的是( )
①浓硫酸
????②苛性钠溶液
????③灼热的氧化铜
A.①②③
????B.②③①
???C.③②①
???D.②①③
4.?下图是将潮湿空气中的氧气、二氧化碳、水蒸气分别除去的流程图:
请根据你确定的除杂方案,将使用的试剂名称填写在下面的横线上:A为__________;B为__________;C为_________。
5.?某化学小组选用以下装置和药品进行探究实验。
?
(1)A中反应的化学方程式为________________________。
(2)若将A、B连接,A中气体不能使B中的溶液变浑浊,
这是为什么?
?
(3)若要制取一瓶纯净、干燥的CO2,所选用装置的导管接口正确连接顺序为:a接___、___接___、___接___。
6.?下列除去物质中所含少量杂质的方法,不正确的是(????)
A.Fe(Cu):用磁铁吸引
B.NaCl(泥沙):加足量水溶解、过滤、蒸发??????????????
C.KNO3(NaCl):加足量水溶解、蒸发结晶
D.MnO2(KCl):加足量水溶解、过滤
7.?下列除去物质中所含少量杂质的方法,不正确的是(????)
A.K2SO4(K2CO3):加入适量稀硫酸至不再产生气泡
B.NaCl(MgCl2):加入过量NaOH溶液、过滤
????????????
C.FeSO4(CuSO4):加入过量铁粉、过滤?????????
D.C(Fe):加入足量盐酸、过滤
8.?除去下列物质中的少量杂质,所用方法不正确的是( )
A.CO2(CO):在空气中点燃?
B.CO(CO2):依次通过足量的NaOH溶液和浓硫酸
?
C.CaCO3(CaO):加足量水溶解、过滤
D.CaO(CaCO3):高温煅烧
9.?下列设计的除杂方案中不能达到实验目的的是(????)
选项
物质(括号内为杂质)
除去杂质的方法
A
CuO(C)
在纯氧气流中灼烧
B
NaCl溶液(Na2CO3)
加入适量稀盐酸
C
KCl溶液(CaCl2)
通入过量的CO2,过滤
D
Na2SO4溶液(CuSO4)
加入适量NaOH溶液,过滤
?
10.?回答下列与物质提纯有关的问题
(1)要除去Fe中少量的Fe2O3,不能选用盐酸的原因是
___________________________________________。
(2)要除去Na2CO3中少量的NaHCO3,可采取的方法是
_______________________。
(3)要除去CuSO4溶液中的H2SO4,可选用过量的______。
(4)要使Na2SO4溶液中的少量MgSO4转化为沉淀而除去,可选用适量的____________。
11.?Na2SO4是制造纸张、药品、染料稀释剂等产品的重要原料。
某Na2SO4样品中含有少量的MgCl2和CaCl2,实验室提纯Na2SO4的流程如下图所示。
????(1)加入NaOH溶液可除去的阳离子是____(填离子符号),
??????其反应的化学方程式为__________________________。
??????加入Na2CO3溶液的目的是为了除去_______,其反应的
??????化学方程式为__________________________________。
(2)操作a的名称是_________,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、____________。
(3)若加入的NaOH溶液和Na2CO3溶液过量,可在溶液
M中加入适量__________(填名称)除去。
12.?通过海水晾晒可得到粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
????(1)第②步操作的目的是除去粗盐中的____________。
(2)第⑤步过滤操作中得到的沉淀成分包括____________
________________________________。
(3)第②、④步所加试剂是否能调换顺序,请说明原因。
?
(4)步骤⑥中加HCl的作用是什么?若过量对实验结果有无影响?请说明原因。
物质的分离和提纯(习题)
1.?下列气体能用浓硫酸干燥而不能用苛性钠干燥的是(????)
A.H2???????B.NH3???????C.O2????????D.CO2
2.?用锌与盐酸反应制得的氢气中,常常混有水蒸气和氯化氢。为除去杂质,可通过如图两个装置,得到纯净干燥的氢气。气体通过两瓶的导管连接顺序正确的是( )
?
A.abcd
?????B.cdab
?????C.dcba
?????D.bacd
3.?有下列三种试剂:①浓硫酸;②饱和NaHCO3溶液;③红热的铜丝。为除去CO2中混有的少量O2、水蒸气和HCl,此混合气体通过上述三种试剂的顺序是( )
A.②①③
???B.③①②
???C.①③②
??D.①②③
4.?为了除去CO中混有的少量O2,某同学设计了如下图所示的实验装置(装置气密性良好)。
?
(1)请写出用这套装置除去O2的化学方程式。
?
(2)老师认为他的实验设计不科学,请你指出存在的错误。
?
5.?除去下列物质中的少量杂质,所用试剂及操作方法不正确的是( )
选项
物质
杂质
试剂及操作方法
A
氨气
水蒸气
通过足量氢氧化钠固体
B
NaCl
Na2CO3
加足量稀盐酸,蒸发
C
稀盐酸
稀硝酸
加足量硝酸银溶液,过滤
D
KNO3溶液
Ba(NO3)2
加适量K2SO4溶液,过滤
6.?物质除杂是化学实验中经常遇到的问题。
【方法探究】
为了除去CO2中混有的少量CO,小明设计了三种方案。
方案A
方案B
方案C
上述三个方案中不合理的是方案____,该方案不合理的原因是_____________________________;试写出合理方案中任意一个反应的化学方程式:____________________________。
【方法提炼】上述两个合理方案体现了物质除杂的不同思路:
思路一:将杂质直接转化为所需物质;
思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
【方法运用】
运用思路一:除去MgCl2粉末中混有的少量BaCl2,先加足量水溶解,再向溶液中加入适量的_______溶液,过滤、蒸发,即可得到MgCl2固体。
运用思路二:除去MgCl2粉末中混有的少量BaCl2、NaCl和K2SO4。
步骤①中反应的化学方程式是_________________________,
滤液B中一定含有的溶质是__________________________;
步骤②中反应的化学方程式是_________________________,
滤液C中一定含有的阴离子是________________________。
步骤③中乙溶液是________。
7.?某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。小青同学设计了以下方案来除去可溶性杂质。
???(1)步骤①中加入过量NaOH溶液的目的是____________,
?相关的化学方程式为__________________________。
(2)步骤②中得到的白色沉淀是__________(填化学式)。
(3)步骤③中若加入的稀盐酸过量,对所得到的氯化钠纯度_______(填“有”或“没有”)影响。
(4)经过上述提纯操作后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果__________(填“增大”、“不变”或“减小”)。
【参考答案】
一、知识点睛?
3.?①HCl、NH3????????CO2、SO2、HCl
??????H2、CO
?????O2
②HCl、CO2、H2?????NH3、H2??????
③长
?短
??????粗
?细
4.?(1)蒸发结晶
???降温结晶
二、精讲精练
1.?D
2.?②,①中最终出来的气体中仍含有水蒸气。
3.?C
4.?NaOH溶液
??浓硫酸
??灼热的铜网
5.?(1)CaCO3+2HClCaCl2+CO2↑+H2O
(2)浓盐酸易挥发,使CO2中混有HCl,不能生成CaCO3沉淀
(3)g
?f
?e
?d
?h
6.?C
7.?B
8.?A
9.?C
10.?(1)盐酸不仅能和Fe2O3反应,还能和Fe反应
(2)加热
(3)CuO或Cu(OH)2
(4)NaOH
11.?(1)Mg2+????MgCl2+2NaOHMg(OH)2↓+2NaCl
?????CaCl2????CaCl2+Na2CO3CaCO3↓+2NaCl
(2)过滤
???漏斗
(3)稀硫酸
12.?(1)Na2SO4
(2)泥沙、BaSO4、Mg(OH)2、CaCO3、BaCO3
(3)不能,为了除去过量的BaCl2,Na2CO3溶液必须加在BaCl2溶液后面,即先②后④。
(4)除去溶液中过量的NaOH和Na2CO3。
?????无影响,因为蒸发结晶过程中HCl会挥发掉。
【参考答案】?????????????????????
1.?D
2.?B
3.?A
4.?(1)2Cu+O22CuO
(2)除去氧气的同时,可能生成二氧化碳
5.?C
6.?B
??大量CO2存在时,少量CO不会燃烧
CO+CuOCu+CO2(或2NaOH+CO2Na2CO3+H2O、
Na2CO3+2HCl2NaCl+CO2↑+H2O)
MgSO4
BaCl2+K2SO42KCl+BaSO4↓
KCl、NaCl、MgCl2
MgCl2+2NaOH2NaCl+Mg(OH)2↓
OH-、Cl-?稀盐酸
7.?(1)除去溶液中的MgCl2
?????MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(2)CaCO3??????
(3)没有
(4)增大
?
同课章节目录
