2020年人教版九年级化学下学期第9单元课题2 溶解度:晶体和结晶的概念与现象精选练习题28道
文档属性
| 名称 | 2020年人教版九年级化学下学期第9单元课题2 溶解度:晶体和结晶的概念与现象精选练习题28道 |
|
|
| 格式 | zip | ||
| 文件大小 | 217.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-16 15:23:57 | ||
图片预览



文档简介
2020年人教版九年级化学下学期第9单元:晶体和结晶的概念与现象精选练习题28道带答案
一.选择题(共18小题)
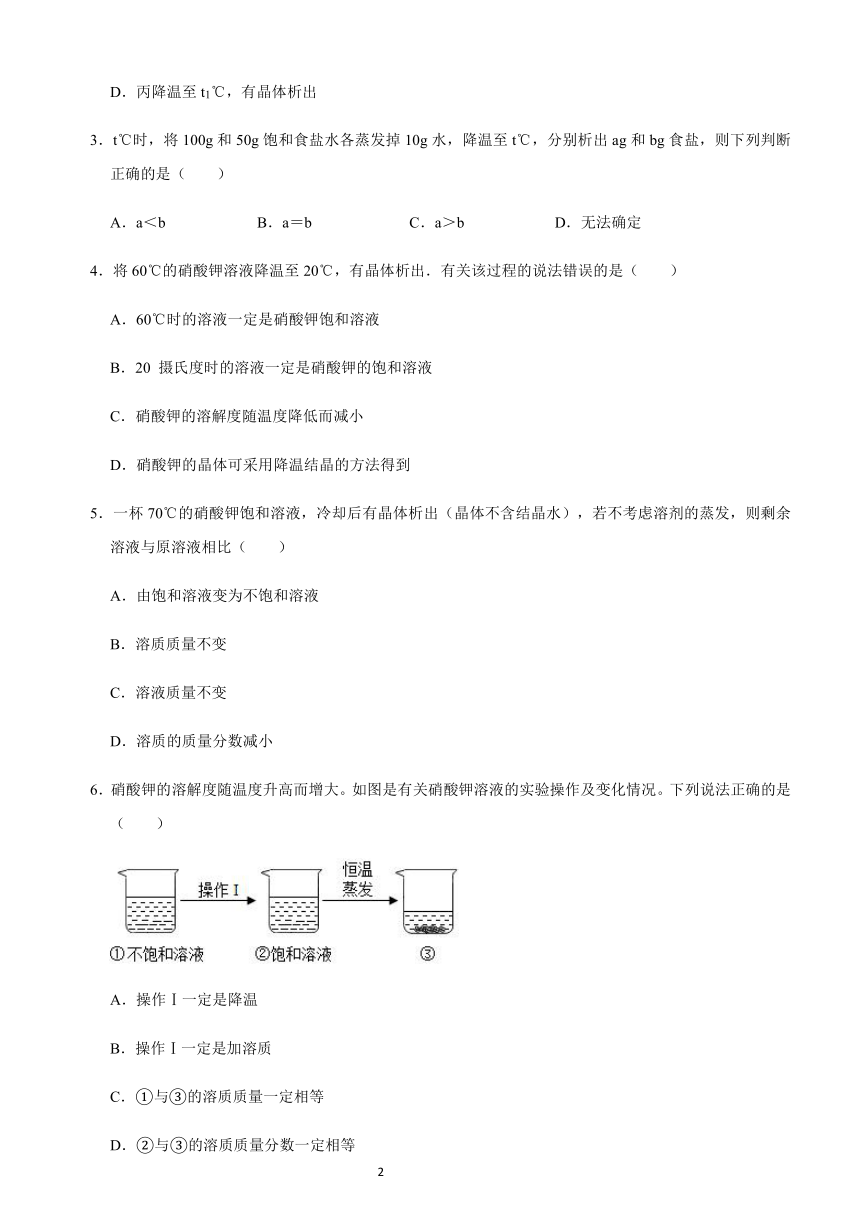
1.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有量随时间变化趋势的图象不正确的是( )
A.
B.
C.
D.
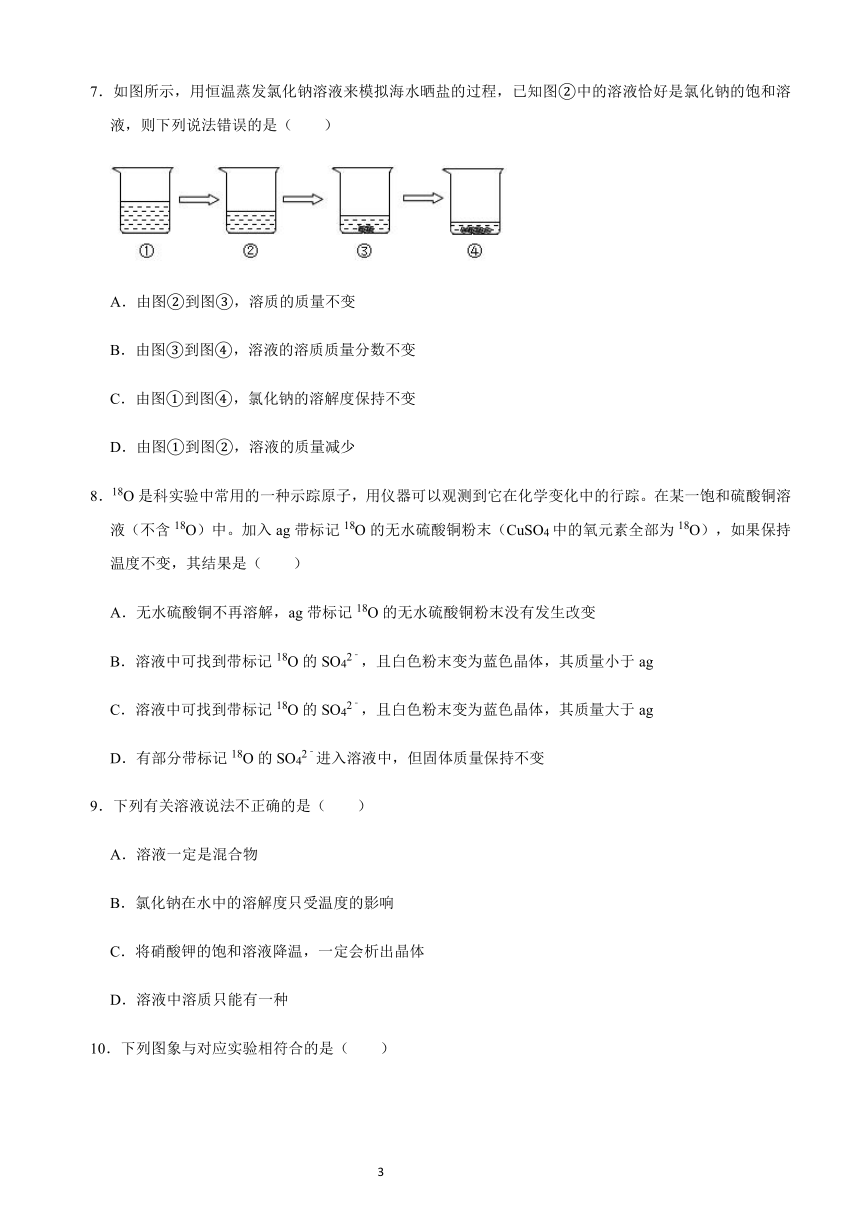
2.如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃)
t1
t2
KNO3的溶解度(g/100g水)
60
90
A.甲、乙混合后为t1℃的不饱和溶液
B.乙升温至t2℃,溶液质量增加
C.乙、丙溶液中溶质质量相等
D.丙降温至t1℃,有晶体析出
3.t℃时,将100g和50g饱和食盐水各蒸发掉10g水,降温至t℃,分别析出ag和bg食盐,则下列判断正确的是( )
A.a<b
B.a=b
C.a>b
D.无法确定
4.将60℃的硝酸钾溶液降温至20℃,有晶体析出.有关该过程的说法错误的是( )
A.60℃时的溶液一定是硝酸钾饱和溶液
B.20
摄氏度时的溶液一定是硝酸钾的饱和溶液
C.硝酸钾的溶解度随温度降低而减小
D.硝酸钾的晶体可采用降温结晶的方法得到
5.一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )
A.由饱和溶液变为不饱和溶液
B.溶质质量不变
C.溶液质量不变
D.溶质的质量分数减小
6.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
A.操作Ⅰ一定是降温
B.操作Ⅰ一定是加溶质
C.①与③的溶质质量一定相等
D.②与③的溶质质量分数一定相等
7.如图所示,用恒温蒸发氯化钠溶液来模拟海水晒盐的过程,已知图②中的溶液恰好是氯化钠的饱和溶液,则下列说法错误的是( )
A.由图②到图③,溶质的质量不变
B.由图③到图④,溶液的溶质质量分数不变
C.由图①到图④,氯化钠的溶解度保持不变
D.由图①到图②,溶液的质量减少
8.18O是科实验中常用的一种示踪原子,用仪器可以观测到它在化学变化中的行踪。在某一饱和硫酸铜溶液(不含18O)中。加入ag带标记18O的无水硫酸铜粉末(CuSO4中的氧元素全部为18O),如果保持温度不变,其结果是( )
A.无水硫酸铜不再溶解,ag带标记18O的无水硫酸铜粉末没有发生改变
B.溶液中可找到带标记18O的SO42﹣,且白色粉末变为蓝色晶体,其质量小于ag
C.溶液中可找到带标记18O的SO42﹣,且白色粉末变为蓝色晶体,其质量大于ag
D.有部分带标记18O的SO42﹣进入溶液中,但固体质量保持不变
9.下列有关溶液说法不正确的是( )
A.溶液一定是混合物
B.氯化钠在水中的溶解度只受温度的影响
C.将硝酸钾的饱和溶液降温,一定会析出晶体
D.溶液中溶质只能有一种
10.下列图象与对应实验相符合的是( )
A.图①表示向pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸
B.图②表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌
C.图③表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
D.图④表示向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸
11.下表列出了硝酸钾在不同温度时的溶解度
温度/℃
0
10
20
30
40
50
60
溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
110
某兴趣小组做了以下实验:
下列说法不正确的是( )
A.上述实验中得到的溶液一定属于不饱和溶液的是①③④
B.⑤种对应的实验现象是有晶体析出
C.从操作④到操作⑤,溶质质量分数变大
D.将⑤继续冷却至0℃,过滤,共回收得到KNO3固体48.4g
12.如图是小烧杯中盛有的是硝酸钾饱和溶液,若将少量的下列物质分别加到大烧杯的水中,不断搅拌,一定能使小烧杯中有固体析出的是( )
A.氢氧化钠
B.生石灰
C.浓硫酸
D.硝酸铵
13.某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列说法正确的是( )
A.原溶液在t℃时一定是不饱和溶液
B.原溶液一定是稀溶液
C.最后剩余的溶液一定比原溶液稀
D.最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小
14.一定温度下,向如图所示烧杯中加入一定量水,仅有部分晶体溶解。所得溶液与原溶液相比,说法正确的是( )
A.溶剂的质量增加,溶液颜色变浅
B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色不变
D.溶质溶解度不变,溶液颜色变浅
15.在t℃时,分别取甲、乙两固体物质的等质量溶液,恒温蒸发水分,得到蒸发水的质量(x)与析出晶体质量(y)的关系如图所示(析出晶体不含结晶水)。下列说法正确的是( )
A.t℃时,甲的溶解度大于乙
B.点a为t℃时甲的不饱和溶液
C.t℃时,甲的溶解度为×100g
D.t℃时,乙的溶解度为×100g
16.现有t℃时A物质(不含结晶水)的溶液,恒温蒸发20克水,析出了2克晶体;再恒温蒸发20克水,析出6克晶体,则下列说法正确的是( )
A.在t℃时,原溶液一定是稀溶液
B.在t℃时,未蒸发水之前原溶液为不饱和溶液
C.在t℃时,A物质的溶解度为40克
D.第二次蒸发后的溶液的溶质质量分数比第一次蒸发后的溶液的溶质质量分数大
17.下列“一定”的说法正确的是( )
A.离子是带电粒子,所以带电的粒子一定是离子
B.置换反应会生成一种单质和一种化合物,则生成一种单质和一种化合物的反应一定是置换反应
C.分子由原子构成,则分子一定比原子大
D.饱和的硝酸钾溶液降温结晶后,一定仍为硝酸钾的饱和溶液
二.填空题(共1小题)
18.向装有一定量饱和石灰水的烧杯中加入少量生石灰,请在如图绘制溶液质量与溶液中溶质质量分数随时间变化的曲线:
、
,
三.实验探究题(共2小题)
19.20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如表:
溶液的温度/℃
20
35
50
65
75
析出固体X的质量/g
10.4
8.0
5.0
0
0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)35℃时,该溶液的质量是
g;
(2)65℃时,该溶液是
(选填编号);
Ⅰ.饱和溶液Ⅱ.不饱和溶液Ⅲ.无法判断
(3)根据下表溶解度与溶解性的关系,可知X属于
物质;
溶解性
易溶
可溶
微溶
难溶(或不溶)
溶解度(20℃)
>10
1﹣10
0.01﹣1
<0.01
(4)50℃时,使烧杯中析出的5g固体X全部溶解,至少加入
g水。
20.以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况。
图A是给试管中水和硝酸钾固体加热;
图B是在加热过程中进行搅拌;
图C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图D是在溶液中插入温度计;
图E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度。
请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到15.5g时,小组同学分别测出的温度为74.9℃、75.0℃、75.3℃,他们将在实验报告中记录的温度是
。他们进行反复实验的目的是
。
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格。请根据表格中已有数据,分析实验时,试管中盛有水的体积为
,并将表中空格内的相应溶解度填写完整。
试管中硝酸钾的总量/g
5
6.5
8
10
12.5
开始析出晶体时的温度t/℃
32.8
39.6
45.8
54.7
64.9
溶解度/g
50
四.解答题(共8小题)
21.如表为硝酸钾和氯化钠的部分溶解度数据,某同学进行了如图所示的两个溶解实验。
物质/溶解度/g/温度
10℃
20℃
30℃
40℃
50℃
60℃
70℃
80℃
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
(1)由表格数据可知,溶解度随温度升高变化显著的物质是
(选填“NaCl”或“KNO3”)。
(2)上述溶液中属于饱和溶液的是
(填
A﹣F序号)。
(3)B、C、E、F溶液中溶质质量分数由大到小的关系是
(用“<”、“>”、“=”表示)。
(4)关于图中有关说法不正确的是
。
A.B烧杯的溶液还可以溶解硝酸钾固体
B.将20℃时硝酸钾的不饱和溶液转化为饱和溶液的方法:蒸发溶剂或升高温度
C.氯化钠中混有少量的硝酸钾可以用蒸发结晶的方法除去
22.结合下表给出的NaCl、KNO3两种固体物质的溶解度,回答有关问题。
温度(℃)
0
20
40
60
80
100
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)60℃时,NaCl的溶解度是
g;
(2)20℃时,将10gKNO3溶解在50g水中,若将其变成该温度下的饱和溶液,至少需要再加入KNO3
g:
(3)将180gKNO3和20
g
NaCl的混合物放入100g
60℃的水中,充分搅拌,再降温到20℃,有大量晶体析出,下列说法中,正确的是
(填序号)。
A.析出的晶体一定有KNO3,可能有NaCl
B.60℃时有部分KNO3与溶液共存
C.降温到20℃时溶液中的溶质只有NaCl
D.20℃时的溶液是NaCl的不饱和溶液
23.分析下列有关溶解度的相关数据,回答有关问题。
温度/℃
0
20
40
60
80
100
溶解度/g
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)在40℃时,NaCl的溶解度为
g:
(2)60℃时,将40g硝酸钾和40g氯化钠组成的混合物加到100g水中,充分溶解后,能得到饱和溶液的物质是
;
(3)某混合物由170gKNO3和30gNaCl组成,将其放入100g80℃的水中,充分搅拌,再降温至20℃,下列有关说法中正确的是
。
A.NaCl的质量分数保持不变
B.溶液的质量减小
C.降温到20℃时,溶液中的溶质只有NaCl
24.根据表中给出的KNO3和NaCl两种物质的溶解度,回答有关问题:
温度
0
20
40
60
80
100
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)在20℃时,KNO3的溶解度为
g;
(2)将40gKNO3和40gNaCl组成的混合物全部放入盛有100g80℃水的烧杯中成分溶解,蒸发掉50g水,并在80℃下过滤,得到的晶体是
;
(3)某混合物由180gKNO3根20gNaCl组成,将其放入100g60℃的水中,充分搅拌,在降温到20℃,有大量晶体析出,下列说法中,正确的是
。
A.60℃时有部分KNO3与溶液共存
B.析出的晶体只有KNO3
C.降温到20℃时溶液中的溶质只有NaCl
D.20℃时的溶液是NaCl的饱和溶液
25.如图所示,打开分液漏斗的活塞K后,水同时被注入人字形左右两个管中,观察到两个烧杯中出现的共同现象是?产生此现象的变化属于什么变化?
26.根据如表回答问题:
温度(℃)
20
40
50
60
80
溶解度/g
NaCl
36.0
36.6
37.0
37.3
38.4
NH4Cl
37.2
45.8
50.4
55.2
65.6
KNO3
31.6
63.9
85.5
110
169
(1)20℃时,溶解度最大的物质是
。
(2)KNO3中混有少量的NaCl,提纯的方法是
(填“降温结晶”或“蒸发结晶”)。
(3)甲是80℃含有110g水的KNO3溶液,经过如下操作,得到20g
KNO3固体。
①丁溶液为
(选填“饱和”或“不饱和”)溶液。
②对以上过程的分析,正确的是
(填字母)。
A.甲到乙的过程中,溶质质量没有改变
B.乙种溶质与溶剂的质量比为169:100
C.开始析出KNO3固体的温度在40℃至50℃之间
D.甲溶液的质量等于161.6g
27.根据表中的数据,回答下列问题。
温度(℃)
0
20
40
60
80
100
KNO3
13.3
31.6
63.6
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)20℃时,NaCl的溶解度是
;
(2)20℃时,称取20gKNO3固体加入盛有100g水中,若保持温度不变,再加入KNO3
g即可将其变成恰好饱和的溶液;
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法是
;
(4)将100gKNO3和20gNaCl组成的混合物放入100g60℃的水中充分搅拌,当温度降低到20℃时,发现有较多固体析出,下列有关说法正确的是(填序号)
。
A.60℃时固体全部溶解
B.析出31.6gKNO3固体
C.剩余溶液中含有两种溶质
28.某同学设计了如图所示的探究Ca(OH)2溶解度随温度变化的实验。
(1)向U形管中注入新配制的饱和澄清石灰水,用酒精灯对U形管的右侧加热,左管无明显变化,而右管中明显出现
,这种现象称之为
(填“结晶”或“蒸馏”),此时右管中溶液的溶质质量分数
(填“增加”、“减小”或“不变”);停止加热冷却至常温,能观察到右管中的
消失,通过对比有效地证实了Ca(OH)2的溶解度随温度的
的事实。
(2)上述U形管若敞口长期放置,澄清的石灰水表面会出现一层白膜,试写出有关反应的化学方程式:
。
参考答案
一.选择题(共18小题)
1-17DCBADDACDACDACDBD
二.填空题(共1小题)
18.;。
三.实验探究题(共2小题)
19.(1)57;(2)Ⅲ;(3)可溶;(4)25。
20.(1)75.1℃;减少实验的误差;(2)10ml;65;80;100;125;
四.解答题(共8小题)
21.(1)KNO3。(2)BCE。(3)C>B>E>F。(4)BC。
22.37.3;(2)5.8;(3)BD。
23.(1)36.6;(2)NaCl;(3)B
24.(1)31.6;(2)NaCl;(3)AB。
25.观察到两个烧杯中出现的共同现象是两个烧杯中都变浑浊;
产生此现象的变化属于物理变化。
26.(1)氯化铵;(2)降温结晶;(3)①饱和;②AD
27.(1)36.0g;(2)11.6;(3)降温结晶;(4)AC。
28.(1)溶液变浑浊,结晶,减小;白色固体,升高而减小(2)Ca(OH)2+CO2=CaCO3↓+H2O
1
一.选择题(共18小题)
1.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有量随时间变化趋势的图象不正确的是( )
A.
B.
C.
D.
2.如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
温度(℃)
t1
t2
KNO3的溶解度(g/100g水)
60
90
A.甲、乙混合后为t1℃的不饱和溶液
B.乙升温至t2℃,溶液质量增加
C.乙、丙溶液中溶质质量相等
D.丙降温至t1℃,有晶体析出
3.t℃时,将100g和50g饱和食盐水各蒸发掉10g水,降温至t℃,分别析出ag和bg食盐,则下列判断正确的是( )
A.a<b
B.a=b
C.a>b
D.无法确定
4.将60℃的硝酸钾溶液降温至20℃,有晶体析出.有关该过程的说法错误的是( )
A.60℃时的溶液一定是硝酸钾饱和溶液
B.20
摄氏度时的溶液一定是硝酸钾的饱和溶液
C.硝酸钾的溶解度随温度降低而减小
D.硝酸钾的晶体可采用降温结晶的方法得到
5.一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )
A.由饱和溶液变为不饱和溶液
B.溶质质量不变
C.溶液质量不变
D.溶质的质量分数减小
6.硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )
A.操作Ⅰ一定是降温
B.操作Ⅰ一定是加溶质
C.①与③的溶质质量一定相等
D.②与③的溶质质量分数一定相等
7.如图所示,用恒温蒸发氯化钠溶液来模拟海水晒盐的过程,已知图②中的溶液恰好是氯化钠的饱和溶液,则下列说法错误的是( )
A.由图②到图③,溶质的质量不变
B.由图③到图④,溶液的溶质质量分数不变
C.由图①到图④,氯化钠的溶解度保持不变
D.由图①到图②,溶液的质量减少
8.18O是科实验中常用的一种示踪原子,用仪器可以观测到它在化学变化中的行踪。在某一饱和硫酸铜溶液(不含18O)中。加入ag带标记18O的无水硫酸铜粉末(CuSO4中的氧元素全部为18O),如果保持温度不变,其结果是( )
A.无水硫酸铜不再溶解,ag带标记18O的无水硫酸铜粉末没有发生改变
B.溶液中可找到带标记18O的SO42﹣,且白色粉末变为蓝色晶体,其质量小于ag
C.溶液中可找到带标记18O的SO42﹣,且白色粉末变为蓝色晶体,其质量大于ag
D.有部分带标记18O的SO42﹣进入溶液中,但固体质量保持不变
9.下列有关溶液说法不正确的是( )
A.溶液一定是混合物
B.氯化钠在水中的溶解度只受温度的影响
C.将硝酸钾的饱和溶液降温,一定会析出晶体
D.溶液中溶质只能有一种
10.下列图象与对应实验相符合的是( )
A.图①表示向pH=13的氢氧化钠溶液中逐滴加入pH=1的盐酸
B.图②表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌
C.图③表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出
D.图④表示向氢氧化钠与氯化钡的混合溶液中逐滴加入稀硫酸
11.下表列出了硝酸钾在不同温度时的溶解度
温度/℃
0
10
20
30
40
50
60
溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
110
某兴趣小组做了以下实验:
下列说法不正确的是( )
A.上述实验中得到的溶液一定属于不饱和溶液的是①③④
B.⑤种对应的实验现象是有晶体析出
C.从操作④到操作⑤,溶质质量分数变大
D.将⑤继续冷却至0℃,过滤,共回收得到KNO3固体48.4g
12.如图是小烧杯中盛有的是硝酸钾饱和溶液,若将少量的下列物质分别加到大烧杯的水中,不断搅拌,一定能使小烧杯中有固体析出的是( )
A.氢氧化钠
B.生石灰
C.浓硫酸
D.硝酸铵
13.某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列说法正确的是( )
A.原溶液在t℃时一定是不饱和溶液
B.原溶液一定是稀溶液
C.最后剩余的溶液一定比原溶液稀
D.最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小
14.一定温度下,向如图所示烧杯中加入一定量水,仅有部分晶体溶解。所得溶液与原溶液相比,说法正确的是( )
A.溶剂的质量增加,溶液颜色变浅
B.溶质溶解度不变,溶液颜色变深
C.溶质的质量增加,溶液颜色不变
D.溶质溶解度不变,溶液颜色变浅
15.在t℃时,分别取甲、乙两固体物质的等质量溶液,恒温蒸发水分,得到蒸发水的质量(x)与析出晶体质量(y)的关系如图所示(析出晶体不含结晶水)。下列说法正确的是( )
A.t℃时,甲的溶解度大于乙
B.点a为t℃时甲的不饱和溶液
C.t℃时,甲的溶解度为×100g
D.t℃时,乙的溶解度为×100g
16.现有t℃时A物质(不含结晶水)的溶液,恒温蒸发20克水,析出了2克晶体;再恒温蒸发20克水,析出6克晶体,则下列说法正确的是( )
A.在t℃时,原溶液一定是稀溶液
B.在t℃时,未蒸发水之前原溶液为不饱和溶液
C.在t℃时,A物质的溶解度为40克
D.第二次蒸发后的溶液的溶质质量分数比第一次蒸发后的溶液的溶质质量分数大
17.下列“一定”的说法正确的是( )
A.离子是带电粒子,所以带电的粒子一定是离子
B.置换反应会生成一种单质和一种化合物,则生成一种单质和一种化合物的反应一定是置换反应
C.分子由原子构成,则分子一定比原子大
D.饱和的硝酸钾溶液降温结晶后,一定仍为硝酸钾的饱和溶液
二.填空题(共1小题)
18.向装有一定量饱和石灰水的烧杯中加入少量生石灰,请在如图绘制溶液质量与溶液中溶质质量分数随时间变化的曲线:
、
,
三.实验探究题(共2小题)
19.20℃时,在盛有50g水的烧杯中加入15g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时析出固体X的质量。测定结果记录如表:
溶液的温度/℃
20
35
50
65
75
析出固体X的质量/g
10.4
8.0
5.0
0
0
若不考虑水蒸发对实验的影响,请回答下列问题。
(1)35℃时,该溶液的质量是
g;
(2)65℃时,该溶液是
(选填编号);
Ⅰ.饱和溶液Ⅱ.不饱和溶液Ⅲ.无法判断
(3)根据下表溶解度与溶解性的关系,可知X属于
物质;
溶解性
易溶
可溶
微溶
难溶(或不溶)
溶解度(20℃)
>10
1﹣10
0.01﹣1
<0.01
(4)50℃时,使烧杯中析出的5g固体X全部溶解,至少加入
g水。
20.以下各图所示是某校兴趣小组测定硝酸钾溶解度的部分操作实况。
图A是给试管中水和硝酸钾固体加热;
图B是在加热过程中进行搅拌;
图C是待硝酸钾全部溶解后,将试管从烧杯中取出,停止加热;
图D是在溶液中插入温度计;
图E是用玻璃棒轻轻摩擦试管内壁,当溶液中刚出现硝酸钾晶体时,记下温度计上所示温度。
请根据上述实验内容,回答下列问题:
(1)当试管中硝酸钾的总量达到15.5g时,小组同学分别测出的温度为74.9℃、75.0℃、75.3℃,他们将在实验报告中记录的温度是
。他们进行反复实验的目的是
。
(2)如表所示为兴趣小组在实验报告中,设计的记录实验数据的表格。请根据表格中已有数据,分析实验时,试管中盛有水的体积为
,并将表中空格内的相应溶解度填写完整。
试管中硝酸钾的总量/g
5
6.5
8
10
12.5
开始析出晶体时的温度t/℃
32.8
39.6
45.8
54.7
64.9
溶解度/g
50
四.解答题(共8小题)
21.如表为硝酸钾和氯化钠的部分溶解度数据,某同学进行了如图所示的两个溶解实验。
物质/溶解度/g/温度
10℃
20℃
30℃
40℃
50℃
60℃
70℃
80℃
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
(1)由表格数据可知,溶解度随温度升高变化显著的物质是
(选填“NaCl”或“KNO3”)。
(2)上述溶液中属于饱和溶液的是
(填
A﹣F序号)。
(3)B、C、E、F溶液中溶质质量分数由大到小的关系是
(用“<”、“>”、“=”表示)。
(4)关于图中有关说法不正确的是
。
A.B烧杯的溶液还可以溶解硝酸钾固体
B.将20℃时硝酸钾的不饱和溶液转化为饱和溶液的方法:蒸发溶剂或升高温度
C.氯化钠中混有少量的硝酸钾可以用蒸发结晶的方法除去
22.结合下表给出的NaCl、KNO3两种固体物质的溶解度,回答有关问题。
温度(℃)
0
20
40
60
80
100
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)60℃时,NaCl的溶解度是
g;
(2)20℃时,将10gKNO3溶解在50g水中,若将其变成该温度下的饱和溶液,至少需要再加入KNO3
g:
(3)将180gKNO3和20
g
NaCl的混合物放入100g
60℃的水中,充分搅拌,再降温到20℃,有大量晶体析出,下列说法中,正确的是
(填序号)。
A.析出的晶体一定有KNO3,可能有NaCl
B.60℃时有部分KNO3与溶液共存
C.降温到20℃时溶液中的溶质只有NaCl
D.20℃时的溶液是NaCl的不饱和溶液
23.分析下列有关溶解度的相关数据,回答有关问题。
温度/℃
0
20
40
60
80
100
溶解度/g
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)在40℃时,NaCl的溶解度为
g:
(2)60℃时,将40g硝酸钾和40g氯化钠组成的混合物加到100g水中,充分溶解后,能得到饱和溶液的物质是
;
(3)某混合物由170gKNO3和30gNaCl组成,将其放入100g80℃的水中,充分搅拌,再降温至20℃,下列有关说法中正确的是
。
A.NaCl的质量分数保持不变
B.溶液的质量减小
C.降温到20℃时,溶液中的溶质只有NaCl
24.根据表中给出的KNO3和NaCl两种物质的溶解度,回答有关问题:
温度
0
20
40
60
80
100
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)在20℃时,KNO3的溶解度为
g;
(2)将40gKNO3和40gNaCl组成的混合物全部放入盛有100g80℃水的烧杯中成分溶解,蒸发掉50g水,并在80℃下过滤,得到的晶体是
;
(3)某混合物由180gKNO3根20gNaCl组成,将其放入100g60℃的水中,充分搅拌,在降温到20℃,有大量晶体析出,下列说法中,正确的是
。
A.60℃时有部分KNO3与溶液共存
B.析出的晶体只有KNO3
C.降温到20℃时溶液中的溶质只有NaCl
D.20℃时的溶液是NaCl的饱和溶液
25.如图所示,打开分液漏斗的活塞K后,水同时被注入人字形左右两个管中,观察到两个烧杯中出现的共同现象是?产生此现象的变化属于什么变化?
26.根据如表回答问题:
温度(℃)
20
40
50
60
80
溶解度/g
NaCl
36.0
36.6
37.0
37.3
38.4
NH4Cl
37.2
45.8
50.4
55.2
65.6
KNO3
31.6
63.9
85.5
110
169
(1)20℃时,溶解度最大的物质是
。
(2)KNO3中混有少量的NaCl,提纯的方法是
(填“降温结晶”或“蒸发结晶”)。
(3)甲是80℃含有110g水的KNO3溶液,经过如下操作,得到20g
KNO3固体。
①丁溶液为
(选填“饱和”或“不饱和”)溶液。
②对以上过程的分析,正确的是
(填字母)。
A.甲到乙的过程中,溶质质量没有改变
B.乙种溶质与溶剂的质量比为169:100
C.开始析出KNO3固体的温度在40℃至50℃之间
D.甲溶液的质量等于161.6g
27.根据表中的数据,回答下列问题。
温度(℃)
0
20
40
60
80
100
KNO3
13.3
31.6
63.6
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
(1)20℃时,NaCl的溶解度是
;
(2)20℃时,称取20gKNO3固体加入盛有100g水中,若保持温度不变,再加入KNO3
g即可将其变成恰好饱和的溶液;
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法是
;
(4)将100gKNO3和20gNaCl组成的混合物放入100g60℃的水中充分搅拌,当温度降低到20℃时,发现有较多固体析出,下列有关说法正确的是(填序号)
。
A.60℃时固体全部溶解
B.析出31.6gKNO3固体
C.剩余溶液中含有两种溶质
28.某同学设计了如图所示的探究Ca(OH)2溶解度随温度变化的实验。
(1)向U形管中注入新配制的饱和澄清石灰水,用酒精灯对U形管的右侧加热,左管无明显变化,而右管中明显出现
,这种现象称之为
(填“结晶”或“蒸馏”),此时右管中溶液的溶质质量分数
(填“增加”、“减小”或“不变”);停止加热冷却至常温,能观察到右管中的
消失,通过对比有效地证实了Ca(OH)2的溶解度随温度的
的事实。
(2)上述U形管若敞口长期放置,澄清的石灰水表面会出现一层白膜,试写出有关反应的化学方程式:
。
参考答案
一.选择题(共18小题)
1-17DCBADDACDACDACDBD
二.填空题(共1小题)
18.;。
三.实验探究题(共2小题)
19.(1)57;(2)Ⅲ;(3)可溶;(4)25。
20.(1)75.1℃;减少实验的误差;(2)10ml;65;80;100;125;
四.解答题(共8小题)
21.(1)KNO3。(2)BCE。(3)C>B>E>F。(4)BC。
22.37.3;(2)5.8;(3)BD。
23.(1)36.6;(2)NaCl;(3)B
24.(1)31.6;(2)NaCl;(3)AB。
25.观察到两个烧杯中出现的共同现象是两个烧杯中都变浑浊;
产生此现象的变化属于物理变化。
26.(1)氯化铵;(2)降温结晶;(3)①饱和;②AD
27.(1)36.0g;(2)11.6;(3)降温结晶;(4)AC。
28.(1)溶液变浑浊,结晶,减小;白色固体,升高而减小(2)Ca(OH)2+CO2=CaCO3↓+H2O
1
同课章节目录
