10-11高中化学课时讲练通课件:222 离子反应(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:222 离子反应(人教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 00:00:00 | ||
图片预览











文档简介
(共57张PPT)
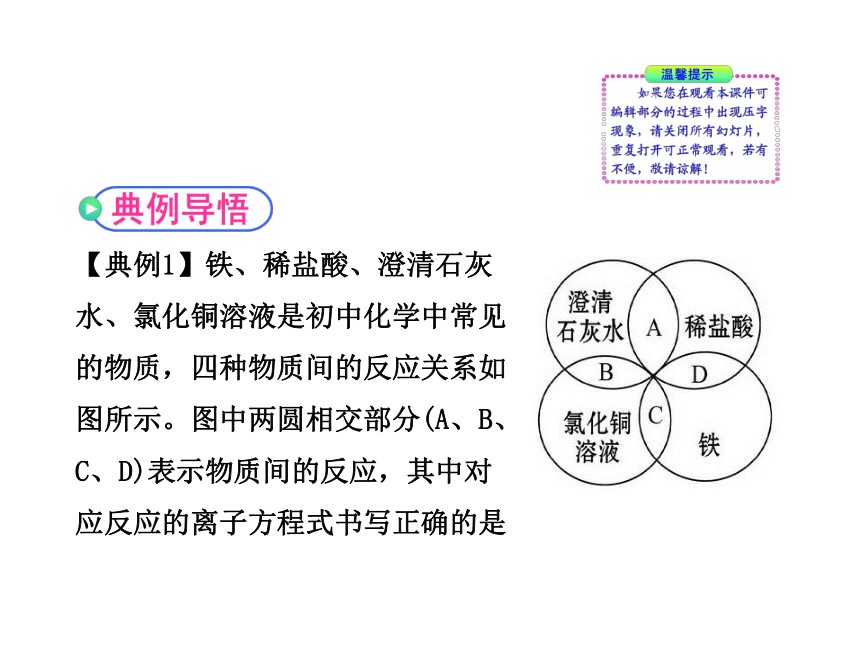
【典例1】铁、稀盐酸、澄清石灰
水、氯化铜溶液是初中化学中常见
的物质,四种物质间的反应关系如
图所示。图中两圆相交部分(A、B、
C、D)表示物质间的反应,其中对
应反应的离子方程式书写正确的是
A.OH-+HCl====H2O+Cl-
B.Ca(OH)2+Cu2+====Ca2++Cu(OH)2↓
C.Fe+Cu2+====Cu+Fe2+
D.2Fe+6H+====2Fe3++3H2↑
【思路点拨】初学离子方程式的书写,一定要严格按照书写规则,逐步进行。
【自主解答】选C。A项是澄清石灰水与稀盐酸的反应,离子方程式应为OH-+H+====H2O,故A错;B项澄清石灰水应拆为离子形式,离子方程式应为2OH-+Cu2+====Cu(OH)2↓,故B错;C项是铁与氯化铜溶液的反应,离子方程式为Fe+Cu2+====Cu+Fe2+,故C对;D项是铁与稀盐酸的反应,离子方程式应为Fe+2H+====Fe2++H2↑,故D错。
【典例2】下列各组离子在溶液中能大量共存,且加入过量NaOH溶液后可得到澄清溶液的是
A.Na+、Cu2+、Cl-、SO42-
B.Ba2+、Na+、Cl-、NO3-
C.Ag+、K+、NO3-、Cl-
D.K+、Ba2+、CO32-、Cl-
【思路点拨】明确离子反应发生的条件,即可判断离子能否大量共存。
【自主解答】选B。A项,加入过量NaOH溶液后生成Cu(OH)2沉淀;B项,各离子能共存且加入NaOH溶液后仍为澄清溶液;C项,Ag+和Cl-不能大量共存,生成AgCl沉淀;D项,Ba2+和CO32-不能大量共存,生成BaCO3沉淀。
知识点一:离子反应
1.(双选)关于离子方程式Cu2++2OH-====Cu(OH)2↓的说法正确的是( )
A.可表示CuSO4溶液和NaOH溶液的反应
B.可表示某一个具体的反应,也可以表示一类反应
C.离子方程式中的OH-可代表弱碱或强碱
D.该反应可看到Cu(OH)2白色沉淀
【解析】选A、B。OH-只能代表强碱,C错;Cu(OH)2为蓝色沉淀,D错。
2.(2010·三明高一检测)下列离子方程式正确的
是( )
A.CuO+2H++2Cl-====H2O+CuCl2
B.CaCO3+2H+====Ca2++CO2↑+H2O
C.2Fe+6H+====2Fe3++H2↑
D.CuSO4+2OH-====Cu(OH)2↓+SO42-
解题提示:离子反应必须符合客观事实,不能主观创造产物。
【解析】选B。A项中CuCl2应拆为Cu2+和Cl-,正确的离子方程式为:CuO+2H+====H2O+Cu2+;C项中Fe3+应为Fe2+,正确的离子方程式为:Fe+2H+====Fe2++H2↑;D项中CuSO4应拆为Cu2+和SO42-,正确的离子方程式为:Cu2++2OH-====Cu(OH)2↓。
知识点二:离子反应发生的条件
3.根据离子反应发生的条件,判断下列各组物质中不能发生离子反应的是( )
A.Na2SO4溶液与BaCl2溶液
B.Na2CO3溶液与H2SO4溶液
C.H2SO4溶液与NaOH溶液
D.CuSO4溶液与NaCl溶液
【解析】选D。A项中有沉淀BaSO4生成,符合离子反应发生的条件;B项中有CO2气体生成,符合离子反应发生的条件;C项中有H2O生成,符合离子反应发生的条件;D项中无沉淀、气体和水生成,不能发生离子反应。
4.下列各组离子在溶液中可大量共存的是( )
A.H+,SO42-,K+,OH-
B.H+,Ba2+,NO3-,SO42-
C.K+,Cl-,CO32-,Na+
D.Ca2+,NO3-,Na+,CO32-
解题提示:只要能反应生成沉淀、气体或水,就不能大量共存。
【解析】选C。A项中H+和OH-不能大量共存,生成H2O;B项中Ba2+和SO42-不能大量共存,生成BaSO4沉淀;D项中Ca2+和CO32-不能大量共存,生成CaCO3沉淀。
5.完成下列离子反应,并改写成化学方程式。
(1)____+____Ag+====____+____Ag
___________________________________;
(2) ____Fe2O3+____====____Fe3++____
___________________________________ ;
(3) ____CaCO3+____====____CO2↑+____+____
___________________________________ 。
【解析】(1)排在Ag前面的金属可以把Ag从它的盐溶液中置换出来,如Cu,Cu+2AgNO3====Cu(NO3)2+2Ag;
(2)Fe2O3与酸反应生成Fe3+,如盐酸,Fe2O3+6HCl====2FeCl3+3H2O;
(3)CaCO3与强酸反应生成CO2气体,如盐酸,CaCO3+2HCl====CaCl2+H2O+CO2↑。
答案:(1)Cu 2 Cu2+ 2
Cu+2AgNO3====Cu(NO3)2+2Ag
(2)1 6H+ 2 3H2O
Fe2O3+6HCl====2FeCl3+3H2O
(3)1 2H+ 1 H2O Ca2+
CaCO3+2HCl====CaCl2+H2O+CO2↑(答案合理即可)
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列反应属于离子反应的是( )
A.H2和O2反应生成水
B.锌片放入稀硫酸中
C.加热分解KMnO4固体制O2
D.加热时CO还原Fe2O3
【解析】选B。A、C、D为气体与气体、固体、气体与固体之间的反应,不是在水溶液中的反应,故三者均不属于离子反应,B为水溶液中的反应,故B正确。
2.与离子方程式H++OH-====H2O相对应的化学方程式正确的是( )
A.Mg(OH)2+2HCl====MgCl2+2H2O
B.2NaOH+H2SO4====Na2SO4+2H2O
C.Ba(OH)2+H2SO4====BaSO4↓+2H2O
D.Cu(OH)2+2HCl====CuCl2+2H2O
【解析】选B。A中Mg(OH)2是难溶物,不能写成OH-;C中除生成H2O之外还生成BaSO4沉淀;D中Cu(OH)2是难溶性碱,不可用OH-表示。
3.(2010·天津五校联考)下列离子方程式正确的
是( )
A.铁跟稀硫酸反应:2Fe+6H+====2Fe3++3H2↑
B.饱和石灰水跟盐酸反应:H++OH-====H2O
C.在硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-====BaSO4↓
D.碳酸钙中加入盐酸:CO32-+2H+====CO2↑+H2O
【解析】选B。铁跟稀硫酸反应生成Fe2+而不是Fe3+,不符合客观事实,正确的离子方程式为:Fe+2H+====Fe2++H2↑,A错误;硫酸铜溶液和氢氧化钡溶液反应生成BaSO4沉淀和Cu(OH)2沉淀,漏掉了Cu2+和OH-的反应,正确的离子方程式为:Ba2++SO42-+Cu2++2OH-====Cu(OH)2↓+BaSO4↓,C错误;碳酸钙为难溶盐,不能拆开,正确的离子方程式为:CaCO3+2H+====Ca2++CO2↑+H2O,D错误。
4.某无色溶液中,可大量共存的离子组是( )
A.Na+、CO32-、SO42-、Cl-
B.Cu2+、NO3-、Cl-、SO42-
C.Ba2+、Cl-、K+、CO32-
D.K+、Mg2+、SO42-、OH-
【解析】选A。A、B实际都是盐的混合溶液,根据它们的溶解性可认定均能在溶液中大量共存,阴、阳离子间不会发生反应,但Cu2+在水溶液中有颜色,因此,A项符合题意,B项不符合题意;C、D中因Ba2+与CO32-可结合生成BaCO3沉淀,Mg2+与OH-可结合生成Mg(OH)2沉淀,均不能大量共存,C、D均不符合题意。
5.(2010·保定高一检测)下列除杂质的方法,正确的是( )
A.氢氧化钠溶液中混有碳酸钠,可加盐酸除去
B.生石灰中混有石灰石,可加盐酸除去
C.碳酸钙中混有少量碳酸钠,可加氢氧化钠除去
D.硝酸钾溶液中混有少量硫酸钾,可加硝酸钡溶液除去
【解析】选D。除杂要求杂质要除尽,被提纯的物质不能减少,不能引入新的杂质。A项中氢氧化钠和碳酸钠均能与盐酸反应,A错误;B项中生石灰(CaO)和石灰石(CaCO3)均能与盐酸反应,B错误;C项中碳酸钙不溶于水,碳酸钠易溶于水,溶解后过滤即可除去杂质,不必加入氢氧化钠,C错误;D项中硫酸钾与硝酸钡反应,生成硝酸钾和硫酸钡沉淀,过滤出沉淀即可。
二、非选择题(本题包括1个小题,共10分)
6.(2010·天津五校联考)现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编上A、B、C、D后,产生的现象如表所示。根据实验现象按要求回答:
(1)写出A、B、C、D溶液中溶质的化学式
A____;B ____ ;C ____ ;D ____ ;
(2)写出上述实验中③④反应的离子方程式
③ _________________;④ ___________________。
【解析】B+D有气体放出,说明B、D为HCl和Na2CO3,另外A+B没有现象发生,B+C有沉淀生成,若B为Na2CO3,则A+B和B+C均会有沉淀(CaCO3和Ag2CO3)产生,不符合题目所给的信息,故B为HCl,D为Na2CO3;HCl与AgNO3反应产生沉淀,故C为AgNO3,A为CaCl2。
答案:(1)CaCl2 HCl AgNO3 Na2CO3
(2)③Ag++Cl-====AgCl↓
④Ca2++CO32-====CaCO3↓
1.(5分)(2010·广东高考)能在溶液中大量共存的一组离子是( )
A.NH4+、Ag+、PO43-、Cl-
B.Fe3+、H+、I-、CO32-
C.K+、Na+、NO3-、MnO4-
D.Al3+、Mg2+、SO42-、CO32-
【解析】选C。A项中Ag+与Cl-、PO43-不能大量共存;B项中Fe3+与I-、H+与CO32-不能大量共存;D项中Al3+、Mg2+与CO32-均不能大量共存;故A、B、D均错,只有C正确。
2.(15分)如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系。
首先在水槽中加入200 mL 2 mol·L-1的H2SO4溶液,同时将一个表面光滑的小球放入溶液中,小球悬浮在溶液中央,闭合开关K,电流计发生偏转。然后再进行以下操作;请回答问题。
(1)向溶液中逐滴加入与H2SO4密度相同的Ba(OH)2溶液至反应完全,观察到的现象是____,反应的离子方程式是_______________________。
(2)将Ba(OH)2溶液换成浓度相同(假设密度也相同)的以下三种溶液(设反应后溶液的体积为两溶液的体积和)
A.Ba(NO3)2溶液 B.Na2SO4溶液 C.Na2CO3溶液
①滴加A的过程中,观察到的现象是________。
反应的离子方程式是___________________。
②滴加B的过程中,小球的位置________。
③滴加C的过程中,观察到的现象是________ 。
反应的离子方程式是___________________ 。
【解析】溶液的导电程度与溶液中离子浓度有关。两种电解质溶液混合,若能发生离子反应,就有可能改变溶液中的离子浓度,影响导电性。也会改变溶液密度,使小球的位置发生变化。
(1)滴加Ba(OH)2溶液的过程中,发生反应:H2SO4+Ba(OH)2 ==== BaSO4↓+2H2O,溶液中离子浓度逐渐减小,由于产生沉淀使溶液中电解质减少,溶液密度减小,浮力减小,小球下沉。
(2)①滴加Ba(NO3)2溶液的过程中,发生反应H2SO4+Ba(NO3)2====BaSO4↓+2HNO3,生成的HNO3是强电解质,但由于溶液体积增大了一倍,使溶液中离子浓度减小,导电能力减弱。溶液密度减小,小球下沉。
②Na2SO4与H2SO4不发生反应,溶液中的离子浓度和溶液密度均不变。
③滴加Na2CO3溶液的过程中,发生反应H2SO4+Na2CO3====Na2SO4+CO2↑+H2O,生成的Na2SO4是强电解质,情况同①相似。
答案:(1)产生白色沉淀,电流计偏转度逐渐减小到零,小球下沉2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
(2)①产生白色沉淀,电流计偏转程度减小,但不到零,小球下沉 Ba2++SO42-====BaSO4↓
②不变
③有气泡产生,电流计偏转度减小,但不到零,小球下沉CO32-+2H+====CO2↑+H2O
【典例1】铁、稀盐酸、澄清石灰
水、氯化铜溶液是初中化学中常见
的物质,四种物质间的反应关系如
图所示。图中两圆相交部分(A、B、
C、D)表示物质间的反应,其中对
应反应的离子方程式书写正确的是
A.OH-+HCl====H2O+Cl-
B.Ca(OH)2+Cu2+====Ca2++Cu(OH)2↓
C.Fe+Cu2+====Cu+Fe2+
D.2Fe+6H+====2Fe3++3H2↑
【思路点拨】初学离子方程式的书写,一定要严格按照书写规则,逐步进行。
【自主解答】选C。A项是澄清石灰水与稀盐酸的反应,离子方程式应为OH-+H+====H2O,故A错;B项澄清石灰水应拆为离子形式,离子方程式应为2OH-+Cu2+====Cu(OH)2↓,故B错;C项是铁与氯化铜溶液的反应,离子方程式为Fe+Cu2+====Cu+Fe2+,故C对;D项是铁与稀盐酸的反应,离子方程式应为Fe+2H+====Fe2++H2↑,故D错。
【典例2】下列各组离子在溶液中能大量共存,且加入过量NaOH溶液后可得到澄清溶液的是
A.Na+、Cu2+、Cl-、SO42-
B.Ba2+、Na+、Cl-、NO3-
C.Ag+、K+、NO3-、Cl-
D.K+、Ba2+、CO32-、Cl-
【思路点拨】明确离子反应发生的条件,即可判断离子能否大量共存。
【自主解答】选B。A项,加入过量NaOH溶液后生成Cu(OH)2沉淀;B项,各离子能共存且加入NaOH溶液后仍为澄清溶液;C项,Ag+和Cl-不能大量共存,生成AgCl沉淀;D项,Ba2+和CO32-不能大量共存,生成BaCO3沉淀。
知识点一:离子反应
1.(双选)关于离子方程式Cu2++2OH-====Cu(OH)2↓的说法正确的是( )
A.可表示CuSO4溶液和NaOH溶液的反应
B.可表示某一个具体的反应,也可以表示一类反应
C.离子方程式中的OH-可代表弱碱或强碱
D.该反应可看到Cu(OH)2白色沉淀
【解析】选A、B。OH-只能代表强碱,C错;Cu(OH)2为蓝色沉淀,D错。
2.(2010·三明高一检测)下列离子方程式正确的
是( )
A.CuO+2H++2Cl-====H2O+CuCl2
B.CaCO3+2H+====Ca2++CO2↑+H2O
C.2Fe+6H+====2Fe3++H2↑
D.CuSO4+2OH-====Cu(OH)2↓+SO42-
解题提示:离子反应必须符合客观事实,不能主观创造产物。
【解析】选B。A项中CuCl2应拆为Cu2+和Cl-,正确的离子方程式为:CuO+2H+====H2O+Cu2+;C项中Fe3+应为Fe2+,正确的离子方程式为:Fe+2H+====Fe2++H2↑;D项中CuSO4应拆为Cu2+和SO42-,正确的离子方程式为:Cu2++2OH-====Cu(OH)2↓。
知识点二:离子反应发生的条件
3.根据离子反应发生的条件,判断下列各组物质中不能发生离子反应的是( )
A.Na2SO4溶液与BaCl2溶液
B.Na2CO3溶液与H2SO4溶液
C.H2SO4溶液与NaOH溶液
D.CuSO4溶液与NaCl溶液
【解析】选D。A项中有沉淀BaSO4生成,符合离子反应发生的条件;B项中有CO2气体生成,符合离子反应发生的条件;C项中有H2O生成,符合离子反应发生的条件;D项中无沉淀、气体和水生成,不能发生离子反应。
4.下列各组离子在溶液中可大量共存的是( )
A.H+,SO42-,K+,OH-
B.H+,Ba2+,NO3-,SO42-
C.K+,Cl-,CO32-,Na+
D.Ca2+,NO3-,Na+,CO32-
解题提示:只要能反应生成沉淀、气体或水,就不能大量共存。
【解析】选C。A项中H+和OH-不能大量共存,生成H2O;B项中Ba2+和SO42-不能大量共存,生成BaSO4沉淀;D项中Ca2+和CO32-不能大量共存,生成CaCO3沉淀。
5.完成下列离子反应,并改写成化学方程式。
(1)____+____Ag+====____+____Ag
___________________________________;
(2) ____Fe2O3+____====____Fe3++____
___________________________________ ;
(3) ____CaCO3+____====____CO2↑+____+____
___________________________________ 。
【解析】(1)排在Ag前面的金属可以把Ag从它的盐溶液中置换出来,如Cu,Cu+2AgNO3====Cu(NO3)2+2Ag;
(2)Fe2O3与酸反应生成Fe3+,如盐酸,Fe2O3+6HCl====2FeCl3+3H2O;
(3)CaCO3与强酸反应生成CO2气体,如盐酸,CaCO3+2HCl====CaCl2+H2O+CO2↑。
答案:(1)Cu 2 Cu2+ 2
Cu+2AgNO3====Cu(NO3)2+2Ag
(2)1 6H+ 2 3H2O
Fe2O3+6HCl====2FeCl3+3H2O
(3)1 2H+ 1 H2O Ca2+
CaCO3+2HCl====CaCl2+H2O+CO2↑(答案合理即可)
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列反应属于离子反应的是( )
A.H2和O2反应生成水
B.锌片放入稀硫酸中
C.加热分解KMnO4固体制O2
D.加热时CO还原Fe2O3
【解析】选B。A、C、D为气体与气体、固体、气体与固体之间的反应,不是在水溶液中的反应,故三者均不属于离子反应,B为水溶液中的反应,故B正确。
2.与离子方程式H++OH-====H2O相对应的化学方程式正确的是( )
A.Mg(OH)2+2HCl====MgCl2+2H2O
B.2NaOH+H2SO4====Na2SO4+2H2O
C.Ba(OH)2+H2SO4====BaSO4↓+2H2O
D.Cu(OH)2+2HCl====CuCl2+2H2O
【解析】选B。A中Mg(OH)2是难溶物,不能写成OH-;C中除生成H2O之外还生成BaSO4沉淀;D中Cu(OH)2是难溶性碱,不可用OH-表示。
3.(2010·天津五校联考)下列离子方程式正确的
是( )
A.铁跟稀硫酸反应:2Fe+6H+====2Fe3++3H2↑
B.饱和石灰水跟盐酸反应:H++OH-====H2O
C.在硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-====BaSO4↓
D.碳酸钙中加入盐酸:CO32-+2H+====CO2↑+H2O
【解析】选B。铁跟稀硫酸反应生成Fe2+而不是Fe3+,不符合客观事实,正确的离子方程式为:Fe+2H+====Fe2++H2↑,A错误;硫酸铜溶液和氢氧化钡溶液反应生成BaSO4沉淀和Cu(OH)2沉淀,漏掉了Cu2+和OH-的反应,正确的离子方程式为:Ba2++SO42-+Cu2++2OH-====Cu(OH)2↓+BaSO4↓,C错误;碳酸钙为难溶盐,不能拆开,正确的离子方程式为:CaCO3+2H+====Ca2++CO2↑+H2O,D错误。
4.某无色溶液中,可大量共存的离子组是( )
A.Na+、CO32-、SO42-、Cl-
B.Cu2+、NO3-、Cl-、SO42-
C.Ba2+、Cl-、K+、CO32-
D.K+、Mg2+、SO42-、OH-
【解析】选A。A、B实际都是盐的混合溶液,根据它们的溶解性可认定均能在溶液中大量共存,阴、阳离子间不会发生反应,但Cu2+在水溶液中有颜色,因此,A项符合题意,B项不符合题意;C、D中因Ba2+与CO32-可结合生成BaCO3沉淀,Mg2+与OH-可结合生成Mg(OH)2沉淀,均不能大量共存,C、D均不符合题意。
5.(2010·保定高一检测)下列除杂质的方法,正确的是( )
A.氢氧化钠溶液中混有碳酸钠,可加盐酸除去
B.生石灰中混有石灰石,可加盐酸除去
C.碳酸钙中混有少量碳酸钠,可加氢氧化钠除去
D.硝酸钾溶液中混有少量硫酸钾,可加硝酸钡溶液除去
【解析】选D。除杂要求杂质要除尽,被提纯的物质不能减少,不能引入新的杂质。A项中氢氧化钠和碳酸钠均能与盐酸反应,A错误;B项中生石灰(CaO)和石灰石(CaCO3)均能与盐酸反应,B错误;C项中碳酸钙不溶于水,碳酸钠易溶于水,溶解后过滤即可除去杂质,不必加入氢氧化钠,C错误;D项中硫酸钾与硝酸钡反应,生成硝酸钾和硫酸钡沉淀,过滤出沉淀即可。
二、非选择题(本题包括1个小题,共10分)
6.(2010·天津五校联考)现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编上A、B、C、D后,产生的现象如表所示。根据实验现象按要求回答:
(1)写出A、B、C、D溶液中溶质的化学式
A____;B ____ ;C ____ ;D ____ ;
(2)写出上述实验中③④反应的离子方程式
③ _________________;④ ___________________。
【解析】B+D有气体放出,说明B、D为HCl和Na2CO3,另外A+B没有现象发生,B+C有沉淀生成,若B为Na2CO3,则A+B和B+C均会有沉淀(CaCO3和Ag2CO3)产生,不符合题目所给的信息,故B为HCl,D为Na2CO3;HCl与AgNO3反应产生沉淀,故C为AgNO3,A为CaCl2。
答案:(1)CaCl2 HCl AgNO3 Na2CO3
(2)③Ag++Cl-====AgCl↓
④Ca2++CO32-====CaCO3↓
1.(5分)(2010·广东高考)能在溶液中大量共存的一组离子是( )
A.NH4+、Ag+、PO43-、Cl-
B.Fe3+、H+、I-、CO32-
C.K+、Na+、NO3-、MnO4-
D.Al3+、Mg2+、SO42-、CO32-
【解析】选C。A项中Ag+与Cl-、PO43-不能大量共存;B项中Fe3+与I-、H+与CO32-不能大量共存;D项中Al3+、Mg2+与CO32-均不能大量共存;故A、B、D均错,只有C正确。
2.(15分)如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系。
首先在水槽中加入200 mL 2 mol·L-1的H2SO4溶液,同时将一个表面光滑的小球放入溶液中,小球悬浮在溶液中央,闭合开关K,电流计发生偏转。然后再进行以下操作;请回答问题。
(1)向溶液中逐滴加入与H2SO4密度相同的Ba(OH)2溶液至反应完全,观察到的现象是____,反应的离子方程式是_______________________。
(2)将Ba(OH)2溶液换成浓度相同(假设密度也相同)的以下三种溶液(设反应后溶液的体积为两溶液的体积和)
A.Ba(NO3)2溶液 B.Na2SO4溶液 C.Na2CO3溶液
①滴加A的过程中,观察到的现象是________。
反应的离子方程式是___________________。
②滴加B的过程中,小球的位置________。
③滴加C的过程中,观察到的现象是________ 。
反应的离子方程式是___________________ 。
【解析】溶液的导电程度与溶液中离子浓度有关。两种电解质溶液混合,若能发生离子反应,就有可能改变溶液中的离子浓度,影响导电性。也会改变溶液密度,使小球的位置发生变化。
(1)滴加Ba(OH)2溶液的过程中,发生反应:H2SO4+Ba(OH)2 ==== BaSO4↓+2H2O,溶液中离子浓度逐渐减小,由于产生沉淀使溶液中电解质减少,溶液密度减小,浮力减小,小球下沉。
(2)①滴加Ba(NO3)2溶液的过程中,发生反应H2SO4+Ba(NO3)2====BaSO4↓+2HNO3,生成的HNO3是强电解质,但由于溶液体积增大了一倍,使溶液中离子浓度减小,导电能力减弱。溶液密度减小,小球下沉。
②Na2SO4与H2SO4不发生反应,溶液中的离子浓度和溶液密度均不变。
③滴加Na2CO3溶液的过程中,发生反应H2SO4+Na2CO3====Na2SO4+CO2↑+H2O,生成的Na2SO4是强电解质,情况同①相似。
答案:(1)产生白色沉淀,电流计偏转度逐渐减小到零,小球下沉2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
(2)①产生白色沉淀,电流计偏转程度减小,但不到零,小球下沉 Ba2++SO42-====BaSO4↓
②不变
③有气泡产生,电流计偏转度减小,但不到零,小球下沉CO32-+2H+====CO2↑+H2O
