10-11高中化学课时讲练通课件:232 氧化还原反应(人教版必修1)(共59张PPT)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:232 氧化还原反应(人教版必修1)(共59张PPT) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 00:00:00 | ||
图片预览









文档简介
(共59张PPT)
【典例】(双选,2010·天津五校联考)ClO2是一种
消毒杀菌效率高、二次污染小的水处理剂。实验室
可以通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
△
====
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.此反应中每生成1 mol ClO2转移的电子数为1 mol
【思路点拨】解答本题要注意以下两点:
(1)根据化合价的变化,判断出氧化剂和还原剂及对应产物;
(2)根据化合价的升降变化,得出转移的电子数。
【自主解答】选A、D。由方程式可知:KClO3中Cl元素从+5价变为+4价,化合价降低,得到电子被还原,所以KClO3为氧化剂,反应后生成ClO2,故ClO2为还原产物。H2C2O4中C元素从+3价变为+4价,化合价升高,失去电子被氧化,所以H2C2O4为还原剂,反应后生成CO2,故CO2为氧化产物,故A正确,B、C均错误;其电子转移的情况表示如下:
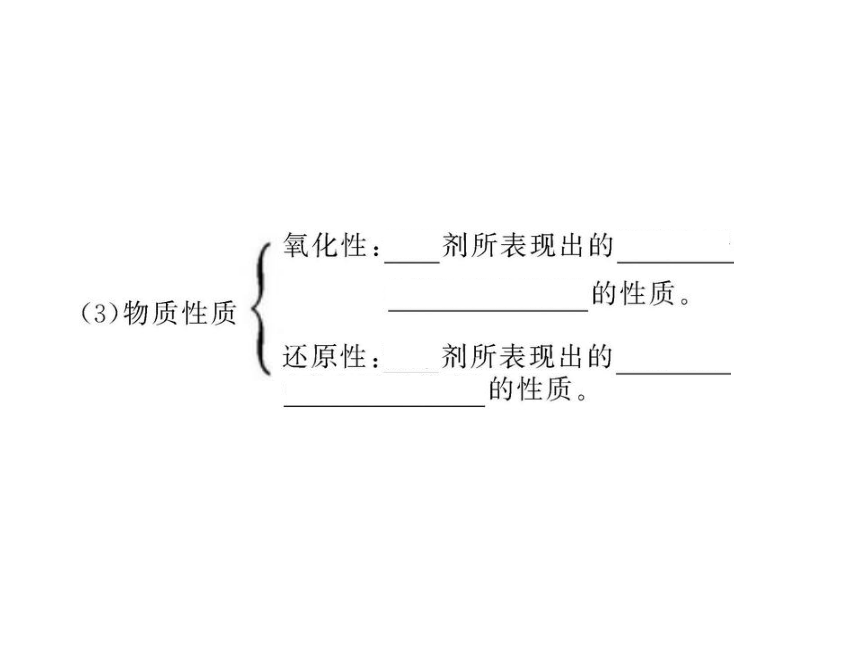
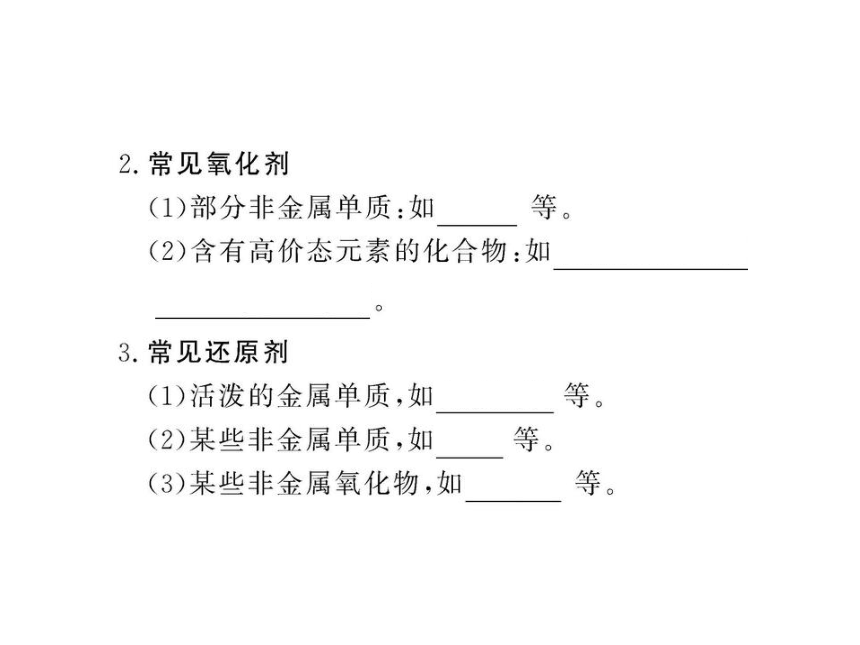
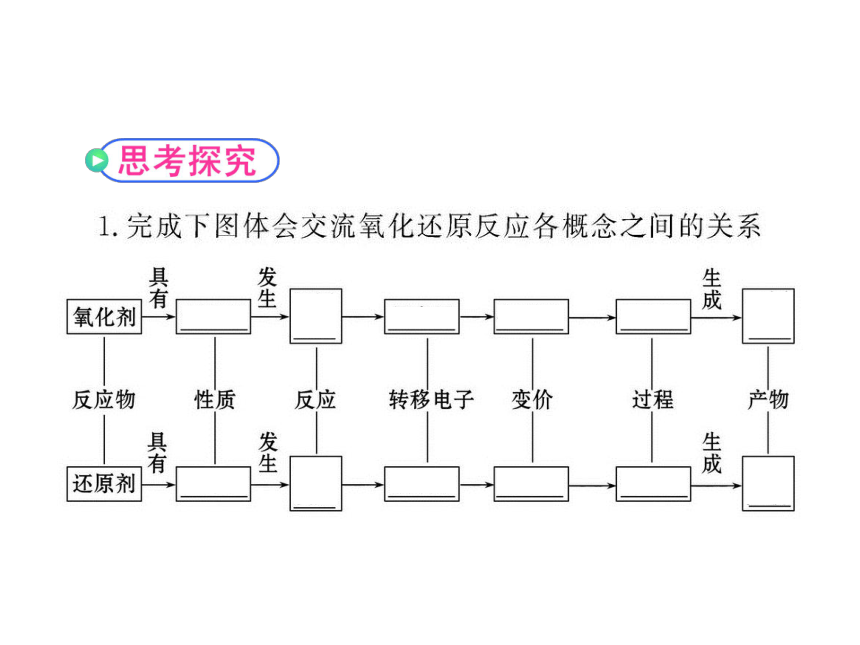
知识点一:氧化剂和还原剂
1.下列有关氧化还原反应的说法正确的是( )
A.化合价升高的物质发生氧化反应,被还原,作还原剂
B.化合价降低的物质发生还原反应,被还原,作氧化剂
C.失电子的物质发生还原反应,被氧化,作还原剂
D.得电子的物质发生还原反应,被氧化,作氧化剂
【解析】选B。失电子,化合价升高,发生氧化反应,被氧化作还原剂;得电子,化合价降低,发生还原反应,被还原作氧化剂,A、C、D均不正确,只有B正确。
2.在2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化产物是( )
A.KCl B.MnCl2 C.H2O D.Cl2
解题提示:首先找出还原剂,还原剂反应后即转化为氧化产物。
【解析】选D。氧化产物指的是还原剂被氧化后所得到的产物,该反应中Cl元素化合价从-1价变为0价,化合价升高,失去电子,被氧化,所以HCl是还原剂,反应后生成Cl2,故Cl2是氧化产物。
3.(2010·焦作高一检测)在下列反应中:
A.2F2+2H2O====4HF+O2
B.2Na+2H2O2====NaOH+H2↑
C.CaO+H2O====Ca(OH)2
D.2H2O2 H2↑+O2↑
水只作氧化剂的是____,水只作还原剂的是____ ,水既作氧化剂又作还原剂的是____ ,水既不作氧化剂又不作还原剂的是____ 。
电解
====
【解析】A项H2O中O元素由-2价变为0价,化合价升高,被氧化,H2O是还原剂;B项H2O中H元素由+1价变为0价,化合价降低,被还原,H2O是氧化剂;C项H2O中H、O两元素化合价没有变化,H2O既不是氧化剂也不是还原剂;D项H2O中H元素由+1价变为0价,化合价降低,被还原,H2O是氧化剂,O元素由-2价变为0价,化合价升高,被氧化,H2O是还原剂;所以H2O既是氧化剂也是还原剂。
答案:B A D C
知识点二:氧化性和还原性的判断
4.下列微粒中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg
A.①⑦ B.②④
C.③⑤⑥ D.②④⑤⑥
【解析】选C。元素处于最高价态时只有氧化性。S2-为最低价态,Fe2+是中间价态,Fe3+是最高价态,S处于中间价态,H+为最高价态,Na+是最高价态,Mg为最低价态,所以选C。
5.有反应①2H2O+Cl2+SO2====H2SO4+2HCl,
②2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)氧化剂的氧化性强弱顺序为______,还原剂的还原性强弱顺序为______ 。
(2)反应①中氧化产物和还原产物质量比为______。
(3)反应②中氯化氢表现出的性质是______ 。
a.还原性 b.酸性 c.氧化性
【解析】(1)由反应①知氧化性Cl2>H2SO4,还原性SO2>Cl-,由反应②知氧化性KMnO4>Cl2
还原性Cl->Mn2+
(2)在反应①中氧化产物为H2SO4
还原产物为HCl,其质量比为98∶73
(3)在反应②中HCl被氧化为Cl2,表现了还原性,同时还生成了盐和水,表现了酸性。
答案:(1)KMnO4>Cl2 SO2>Cl-
(2)98∶73 (3)a、b
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列关于氧化还原反应的说法中错误的是( )
A.在反应中失去电子的物质是还原剂,得到电子的物质是氧化剂
B.在反应中氧化剂发生还原反应,还原剂发生氧化反应
C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应
D.只有氧化没有还原的反应是不存在的
【解析】选C。氧化还原反应中物质被氧化和被还原是同时发生的,而且还可能是一种物质既被氧化又被还原,如Cl2+2NaOH====NaCl+NaClO+H2O。
2.(2010·焦作高一检测)已知 2Fe3++2I-====
2Fe2++I2 2Fe2++Cl2====2Fe3++2Cl-则有关离子的还原性由强到弱的顺序为( )
A.Cl->Fe2+>I-
B.Fe2+>I->Cl-
C.I->Fe2+>Cl-
D.Fe2+>Cl->I-
【解析】选C。在氧化还原反应中,还原性:还原剂>还原产物,由2Fe3++2I-====2Fe2++I2可知还原性:I->Fe2+,由2Fe2++Cl2====2Fe3++2Cl-可知还原性:Fe2+>Cl-,即:I->Fe2+>Cl-。
3.在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
【解析】选D。A项,HCl→H2氢元素化合价降低,需要加入还原剂,如活泼金属单质等;B项,CO2→CO,碳元素化合价降低,需要加入还原剂,如碳单质等;C项,Fe2O3→Fe,铁元素化合价降低,需要加入还原剂,如碳单质等;D项,Br-→Br2,溴元素化合价升高,需要加入氧化剂,如Cl2等。
4.(2010·宜春高一检测)被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应, NaBH4+2H2O====NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1∶1
【解析】选D。NaBH4和NaBO2中B元素的化合价均为+3价,没有发生变化;NaBH4中H元素由-1价升高为0价,失去电子被氧化,NaBH4为还原剂;H2O中H元素由+1价降为0价,得到电子被还原,H2O为氧化剂;被氧化的-1价H原子是4个,被还原的+1价H原子也是4个,二者相等,故被氧化的元素与被还原的元素质量比为1∶1。
5.工业上制取ClO2的化学反应为:2NaClO3+SO2+H2SO4
====2ClO2+2NaHSO4,下列说法正确的是( )
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4 在反应中作氧化剂
D.ClO2是氧化产物
【解析】选A。SO2中S元素从+4变为+6,化合价升高,被氧化,A正确;NaClO3中Cl元素从+5变为+4,化合价降低,被还原,得到电子,故NaClO3是氧化剂,反应后转化为ClO2,故ClO2为还原产物;B、D错误;H2SO4中H、O两元素化合价均没有变化,故H2SO4既不是氧化剂也不是还原剂,C错误。
二、非选择题(本题包括1个小题,共10分)
6.火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S====
K2S+N2↑+3CO2↑。氧化剂是____,还原剂是____ ,
氧化产物是____ ,还原产物是____ ,转移电子____个。
【解析】由反应方程式可知:KNO3中N元素从+5价变为0价,得到电子,被还原,KNO3是氧化剂,反应后转化为N2,故N2为还原产物;S元素从0价变为-2价,得到电子,被还原,S也是氧化剂,反应后转化为K2S,故K2S也为还原产物;C元素从0价变为+4价,失去电子,被氧化,C是还原剂,反应后转化为CO2,故CO2为氧化产物;还原剂C共失去12个电子,氧化剂KNO3 和S共得到12个电子,故转移电子12个。
答案:KNO3和S C CO2 K2S和N2 12
1.(5分)(2010·秦皇岛高一检测)在NaClO+2HCl
====NaCl+H2O+Cl2↑反应中,被氧化的氯原子与被还原的氯原子个数比是( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
【解析】选A。由
可知被氧化的氯原子与被还原的氯原子个数比为1∶1。
2.(5分)在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
【解析】选C。本题主要考查氧化还原反应顺序。根据金属活动性顺序表,可以判断,还原性强弱:Mg>H2>
Cu>Ag;则离子氧化性强弱为:Ag+>Cu2+>H+>Mg2+,所以首先析出Ag。
3.(10分)(2010·成都高一检测)根据反应8NH3+3Cl2====6NH4Cl+N2回答下列问题。
(1)氧化剂____,还原剂____ 。
(2)氧化剂与氧化产物的质量比____ 。
(3)当生成28 g N2时,被氧化的物质____克。
(4)该反应中发生还原反应的过程表示为Cl2+2e-====2Cl-,则发生氧化反应的过程可表示为________ 。
【解析】在此反应中,NH3中N元素化合价升高,被氧化,作还原剂,对应氧化产物为N2;Cl2中Cl元素化合价降低,被还原,作氧化剂,对应还原产物为NH4Cl;而8 mol NH3中只有2 mol NH3被氧化,所以生成1 mol N2时,有2 mol NH3被氧化。在反应中,8 mol NH3失去6 mol电子生成6 mol NH4+和2 mol N2。
答案:(1)Cl2 NH3 (2)213∶28 (3)34
(4)8NH3-6e-====6NH4++N2
【典例】(双选,2010·天津五校联考)ClO2是一种
消毒杀菌效率高、二次污染小的水处理剂。实验室
可以通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
△
====
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.此反应中每生成1 mol ClO2转移的电子数为1 mol
【思路点拨】解答本题要注意以下两点:
(1)根据化合价的变化,判断出氧化剂和还原剂及对应产物;
(2)根据化合价的升降变化,得出转移的电子数。
【自主解答】选A、D。由方程式可知:KClO3中Cl元素从+5价变为+4价,化合价降低,得到电子被还原,所以KClO3为氧化剂,反应后生成ClO2,故ClO2为还原产物。H2C2O4中C元素从+3价变为+4价,化合价升高,失去电子被氧化,所以H2C2O4为还原剂,反应后生成CO2,故CO2为氧化产物,故A正确,B、C均错误;其电子转移的情况表示如下:
知识点一:氧化剂和还原剂
1.下列有关氧化还原反应的说法正确的是( )
A.化合价升高的物质发生氧化反应,被还原,作还原剂
B.化合价降低的物质发生还原反应,被还原,作氧化剂
C.失电子的物质发生还原反应,被氧化,作还原剂
D.得电子的物质发生还原反应,被氧化,作氧化剂
【解析】选B。失电子,化合价升高,发生氧化反应,被氧化作还原剂;得电子,化合价降低,发生还原反应,被还原作氧化剂,A、C、D均不正确,只有B正确。
2.在2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化产物是( )
A.KCl B.MnCl2 C.H2O D.Cl2
解题提示:首先找出还原剂,还原剂反应后即转化为氧化产物。
【解析】选D。氧化产物指的是还原剂被氧化后所得到的产物,该反应中Cl元素化合价从-1价变为0价,化合价升高,失去电子,被氧化,所以HCl是还原剂,反应后生成Cl2,故Cl2是氧化产物。
3.(2010·焦作高一检测)在下列反应中:
A.2F2+2H2O====4HF+O2
B.2Na+2H2O2====NaOH+H2↑
C.CaO+H2O====Ca(OH)2
D.2H2O2 H2↑+O2↑
水只作氧化剂的是____,水只作还原剂的是____ ,水既作氧化剂又作还原剂的是____ ,水既不作氧化剂又不作还原剂的是____ 。
电解
====
【解析】A项H2O中O元素由-2价变为0价,化合价升高,被氧化,H2O是还原剂;B项H2O中H元素由+1价变为0价,化合价降低,被还原,H2O是氧化剂;C项H2O中H、O两元素化合价没有变化,H2O既不是氧化剂也不是还原剂;D项H2O中H元素由+1价变为0价,化合价降低,被还原,H2O是氧化剂,O元素由-2价变为0价,化合价升高,被氧化,H2O是还原剂;所以H2O既是氧化剂也是还原剂。
答案:B A D C
知识点二:氧化性和还原性的判断
4.下列微粒中,只有氧化性的是( )
①S2- ②Fe2+ ③Fe3+ ④S ⑤H+ ⑥Na+ ⑦Mg
A.①⑦ B.②④
C.③⑤⑥ D.②④⑤⑥
【解析】选C。元素处于最高价态时只有氧化性。S2-为最低价态,Fe2+是中间价态,Fe3+是最高价态,S处于中间价态,H+为最高价态,Na+是最高价态,Mg为最低价态,所以选C。
5.有反应①2H2O+Cl2+SO2====H2SO4+2HCl,
②2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)氧化剂的氧化性强弱顺序为______,还原剂的还原性强弱顺序为______ 。
(2)反应①中氧化产物和还原产物质量比为______。
(3)反应②中氯化氢表现出的性质是______ 。
a.还原性 b.酸性 c.氧化性
【解析】(1)由反应①知氧化性Cl2>H2SO4,还原性SO2>Cl-,由反应②知氧化性KMnO4>Cl2
还原性Cl->Mn2+
(2)在反应①中氧化产物为H2SO4
还原产物为HCl,其质量比为98∶73
(3)在反应②中HCl被氧化为Cl2,表现了还原性,同时还生成了盐和水,表现了酸性。
答案:(1)KMnO4>Cl2 SO2>Cl-
(2)98∶73 (3)a、b
一、选择题(本题包括5个小题,每小题4分,共20分)
1.下列关于氧化还原反应的说法中错误的是( )
A.在反应中失去电子的物质是还原剂,得到电子的物质是氧化剂
B.在反应中氧化剂发生还原反应,还原剂发生氧化反应
C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应
D.只有氧化没有还原的反应是不存在的
【解析】选C。氧化还原反应中物质被氧化和被还原是同时发生的,而且还可能是一种物质既被氧化又被还原,如Cl2+2NaOH====NaCl+NaClO+H2O。
2.(2010·焦作高一检测)已知 2Fe3++2I-====
2Fe2++I2 2Fe2++Cl2====2Fe3++2Cl-则有关离子的还原性由强到弱的顺序为( )
A.Cl->Fe2+>I-
B.Fe2+>I->Cl-
C.I->Fe2+>Cl-
D.Fe2+>Cl->I-
【解析】选C。在氧化还原反应中,还原性:还原剂>还原产物,由2Fe3++2I-====2Fe2++I2可知还原性:I->Fe2+,由2Fe2++Cl2====2Fe3++2Cl-可知还原性:Fe2+>Cl-,即:I->Fe2+>Cl-。
3.在下列变化中,需要加入合适的氧化剂才能实现的是( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
【解析】选D。A项,HCl→H2氢元素化合价降低,需要加入还原剂,如活泼金属单质等;B项,CO2→CO,碳元素化合价降低,需要加入还原剂,如碳单质等;C项,Fe2O3→Fe,铁元素化合价降低,需要加入还原剂,如碳单质等;D项,Br-→Br2,溴元素化合价升高,需要加入氧化剂,如Cl2等。
4.(2010·宜春高一检测)被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应, NaBH4+2H2O====NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1∶1
【解析】选D。NaBH4和NaBO2中B元素的化合价均为+3价,没有发生变化;NaBH4中H元素由-1价升高为0价,失去电子被氧化,NaBH4为还原剂;H2O中H元素由+1价降为0价,得到电子被还原,H2O为氧化剂;被氧化的-1价H原子是4个,被还原的+1价H原子也是4个,二者相等,故被氧化的元素与被还原的元素质量比为1∶1。
5.工业上制取ClO2的化学反应为:2NaClO3+SO2+H2SO4
====2ClO2+2NaHSO4,下列说法正确的是( )
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4 在反应中作氧化剂
D.ClO2是氧化产物
【解析】选A。SO2中S元素从+4变为+6,化合价升高,被氧化,A正确;NaClO3中Cl元素从+5变为+4,化合价降低,被还原,得到电子,故NaClO3是氧化剂,反应后转化为ClO2,故ClO2为还原产物;B、D错误;H2SO4中H、O两元素化合价均没有变化,故H2SO4既不是氧化剂也不是还原剂,C错误。
二、非选择题(本题包括1个小题,共10分)
6.火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S====
K2S+N2↑+3CO2↑。氧化剂是____,还原剂是____ ,
氧化产物是____ ,还原产物是____ ,转移电子____个。
【解析】由反应方程式可知:KNO3中N元素从+5价变为0价,得到电子,被还原,KNO3是氧化剂,反应后转化为N2,故N2为还原产物;S元素从0价变为-2价,得到电子,被还原,S也是氧化剂,反应后转化为K2S,故K2S也为还原产物;C元素从0价变为+4价,失去电子,被氧化,C是还原剂,反应后转化为CO2,故CO2为氧化产物;还原剂C共失去12个电子,氧化剂KNO3 和S共得到12个电子,故转移电子12个。
答案:KNO3和S C CO2 K2S和N2 12
1.(5分)(2010·秦皇岛高一检测)在NaClO+2HCl
====NaCl+H2O+Cl2↑反应中,被氧化的氯原子与被还原的氯原子个数比是( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
【解析】选A。由
可知被氧化的氯原子与被还原的氯原子个数比为1∶1。
2.(5分)在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
【解析】选C。本题主要考查氧化还原反应顺序。根据金属活动性顺序表,可以判断,还原性强弱:Mg>H2>
Cu>Ag;则离子氧化性强弱为:Ag+>Cu2+>H+>Mg2+,所以首先析出Ag。
3.(10分)(2010·成都高一检测)根据反应8NH3+3Cl2====6NH4Cl+N2回答下列问题。
(1)氧化剂____,还原剂____ 。
(2)氧化剂与氧化产物的质量比____ 。
(3)当生成28 g N2时,被氧化的物质____克。
(4)该反应中发生还原反应的过程表示为Cl2+2e-====2Cl-,则发生氧化反应的过程可表示为________ 。
【解析】在此反应中,NH3中N元素化合价升高,被氧化,作还原剂,对应氧化产物为N2;Cl2中Cl元素化合价降低,被还原,作氧化剂,对应还原产物为NH4Cl;而8 mol NH3中只有2 mol NH3被氧化,所以生成1 mol N2时,有2 mol NH3被氧化。在反应中,8 mol NH3失去6 mol电子生成6 mol NH4+和2 mol N2。
答案:(1)Cl2 NH3 (2)213∶28 (3)34
(4)8NH3-6e-====6NH4++N2
