10-11高中化学课时讲练通课件:单元质量评估二(人教版必修1)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:单元质量评估二(人教版必修1) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 00:00:00 | ||
图片预览









文档简介
(共61张PPT)
第二章 化学物质及其变化
(90分钟 100分)
一、选择题(本题包括15个小题,
每小题3分,共45分)
1.(2010·天津五校联考)现有①液态氧 ②氢氧化铁
胶体 ③食盐水 ④纯碱 ⑤氢氧化钾 ⑥空气 对上述物质的分类全部正确的是( )
A.盐——③④ B.纯净物——④⑤⑥
C.碱——④⑤ D.混合物——②③⑥
【解析】选D。纯净物有①④⑤;混合物有②③⑥;盐与碱均属于纯净物中的化合物,盐有④;碱有⑤。
2.将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是( )
A.冷水
B.沸水
C.NaOH溶液
D.NaCl溶液
【解析】选B。Fe(OH)3胶体的制备方法是将饱和FeCl3溶
液滴入沸水中,继续加热至液体呈现红褐色为止,即可
得到Fe(OH)3胶体。饱和FeCl3溶液滴入NaOH溶液中,得
到的是Fe(OH)3沉淀。
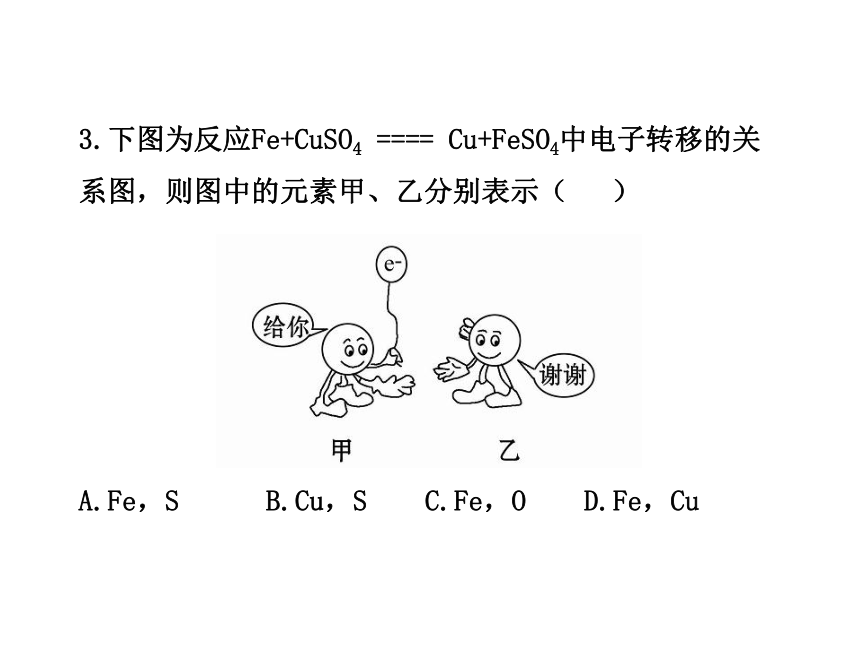
3.下图为反应Fe+CuSO4 ==== Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。在反应Fe+CuSO4====Cu+FeSO4中,Fe为还原剂,失去电子,化合价升高;CuSO4中Cu2+得到电子,为氧化剂,化合价降低,故选D。
4.(2010·雅安高一检测)下列物质属于电解质并能导电的是( )
A.酒精
B.氯化钾晶体
C.液态氯化氢
D.熔融态的氢氧化钠
【解析】选D。酒精为非电解质,A错误;氯化钾晶体、液态氯化氢、熔融态的氢氧化钠均为电解质,但氯化钾晶体、液态氯化氢不导电,B、C错误;只有熔融态的氢氧化钠导电,故选D。
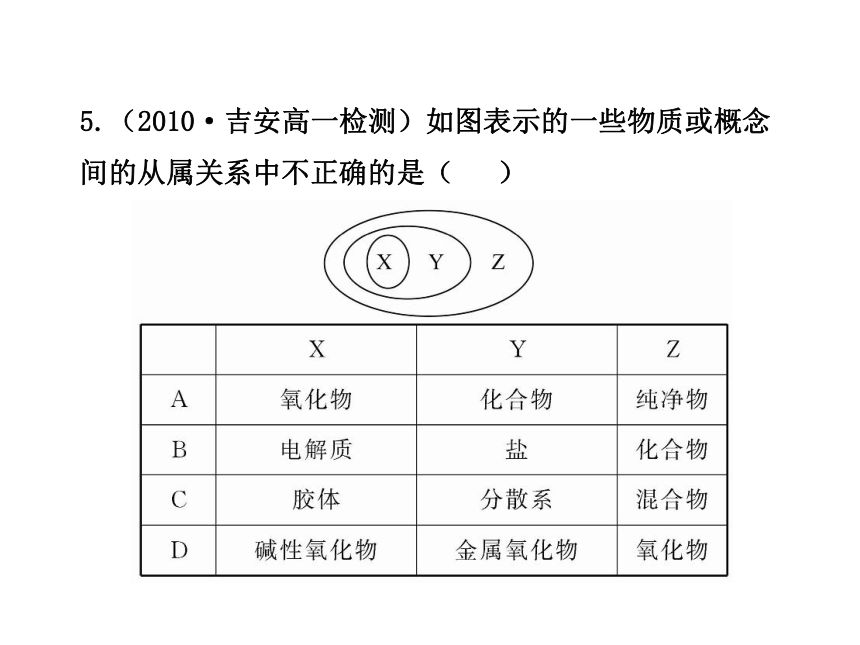
5.(2010·吉安高一检测)如图表示的一些物质或概念间的从属关系中不正确的是( )
【解析】选B。电解质包括酸、碱、盐,电解质均是化合物,故B中X、Y的从属关系不正确,正好相反。
6.下列有关胶体和溶液的比较中正确的是( )
A.溶液澄清透明,胶体浑浊不透明
B.胶体比溶液稳定
C.光束通过溶液没有特殊现象,光束通过胶体有丁达尔
效应
D.溶液中溶质粒子的直径大,胶体粒子的直径小
【解析】选C。溶液澄清透明,均一稳定,胶体澄清透
明,但它的稳定性介于浊液与溶液之间,属于介稳体
系,故A、B错误;丁达尔效应是胶体的特有性质,溶液
不具备,C正确;胶体粒子的直径大,介于
1 nm~100 nm之间,溶液中溶质粒子的直径小于1 nm,
D错误。
7.能用H++OH-====H2O表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中
【解析】选C。能改写成离子形式的为易溶于水、易电
离的物质,故H++OH-====H2O表示的是强酸与强碱生成可
溶性盐的化学反应。A中氢氧化镁为难溶性弱碱,不能改写成离子形式,B中生成难溶性盐BaSO4,D中二氧化碳不能改写成离子形式,另外生成CaCO3沉淀,只有C符合题意。A、B、D的离子方程式分别为:Mg(OH)2+2H+====2H2O+Mg2+,
Ba2++2OH-+2H++SO42-====2H2O+BaSO4↓,
Ca2++2OH-+CO2====CaCO3↓+H2O。
8.(2010·包头高一检测)下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl====CaCl2+CO2↑+H2O
B.CaO+H2O====Ca(OH)2
C.2H2O2 2H2O+O2↑
D.CaCO3 CaO+CO2↑
催化剂
====
高温
====
【解析】选C。有化合价变化的为氧化还原反应,四个选项中只有C项有化合价的变化,H2O2中-1价的O元素变为H2O中-2价的O元素和O2中0价的O元素,故选C。
9.下列离子方程式书写正确的是( )
A.氯化铜溶液与铁粉反应:Cu2++Fe====Fe2++Cu
B.稀H2SO4与铁粉反应:2Fe+6H+====2Fe3++3H2↑
C.NaOH溶液与过量CO2反应:
2OH-+CO2====CO32-+H2O
D.碳酸钙与盐酸反应:CO32-+2H+====H2O+CO2↑
【解析】选A。B项不符合反应事实,正确的离子方程式为Fe+2H+====Fe2++H2↑;C项NaOH与过量CO2反应生成NaHCO3,正确的离子方程式为CO2+OH-====HCO3-;D项碳酸钙为难溶性盐,不能改写成Ca2+与CO32-的形式,正确的离子方程式为CaCO3+2H+====Ca2++CO2↑+H2O。
10.(2010·鹤壁高一检测)关于氧化还原反应的说法中正确的是( )
A.失去电子的物质是氧化剂
B.氧化反应的本质是得电子
C.原子得到电子后,元素的化合价一定升高
D.有单质参加或生成的反应不一定是氧化还原反应
【解析】选D。在氧化还原反应中,失去电子的物质是还原剂,被氧化,发生氧化反应,所以氧化反应的本质是失去电子,A、B错误;原子得到电子后,元素的化合价一定降低,C错误;有单质参加或生成的反应不一定是氧化还原反应,如:3O2====2O3,但有单质参加的化合反应或有单质生成的分解反应一定是氧化还原反应,故D正确。
11.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4-、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Cu2+、Na+、Cl-、SO42-
【解析】选B。MnO4-与Cu2+是有色离子,A、D不符合题意要求;碱性溶液中存在大量OH-,C项中H+与OH-不能大量共存,只有B项符合题意。
12.实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3,实验员选择了一种试剂就把它们区别开来了,这种试剂是( )
A.盐酸
B.氢氧化钠溶液
C.氯化钡溶液
D.硝酸
【解析】选A。盐酸与Na2CO3反应产生气泡(CO2气
体),盐酸与NaCl不反应,盐酸与AgNO3反应产生AgCl
白色沉淀,现象均不相同,可以把它们区别开来。氢氧
化钠溶液只与AgNO3反应产生沉淀,与Na2CO3、NaCl均不
反应;氯化钡溶液与NaCl不反应,与Na2CO3、AgNO3均产
生白色沉淀;硝酸与Na2CO3反应产生气泡(CO2气体),
与NaCl、AgNO3均不反应。
13.在反应2H2S+SO2====3S↓+2H2O中( )
A.H2S是氧化剂
B.SO2是还原剂
C.H2O是还原产物
D.氧化产物与还原产物之比为2∶1
【解析】选D。H2S中S元素由-2价升为0价,失去电子,
被氧化,H2S是还原剂,A错误;SO2中S元素由+4价降为
0价,得到电子,被还原,SO2是氧化剂,B错误;H、O元素没有化合价的变化,故H2O既不是还原产物也不是氧化产物,C错误;被氧化的S与被还原的S个数比为
2∶1,所以氧化产物与还原产物之比即为2∶1,D正
确。
14.(2010·秦皇岛高一检测)分类法是化学学习中常用的一种方法,下列分类标准不正确的是( )
A.根据物质组成的种类,可以将物质分为纯净物和混合物
B.根据分散质粒子的大小,可以将分散系分为溶液、胶体和浊液
C.根据反应物和生成物的类别以及反应前后物质种类的多少,将化学反应分为:置换、化合、分解和复分解反应
D.根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等
【解析】选D。化合物中含氢元素,不一定为酸,如:
NH3、H2O等,故D不正确。酸的概念是:电离出的阳离子
全部为H+的化合物,依据电离出H+的数目的多少,将酸
分为一元酸、二元酸、三元酸等。
15.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系来表示,其中正确的是( )
【解析】选A。复分解反应一定不是氧化还原反应,置
换反应一定是氧化还原反应,离子反应可能是复分解反
应,也可能是氧化还原反应,如:Cu2++Fe====Fe2++Cu;
Ba2++SO42-====BaSO4↓。
二、非选择题(本题包括6个小题,共55分)
16.(4分)(2010·焦作高一检测)下列4组物质均有一
种物质的类别与其他3种不同,且这四种物质相互作用
可生成一种新物质——碱式碳酸铜,化学式为
Cu2(OH)2CO3。
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
以上四组物质中与其他物质不同的物质依次是(填化学式)
A.______;B.______;C.______;D.______。
【解析】A中CO2为非金属氧化物,其余均为金属氧化物;B中Cu为金属,其余均为非金属;C中O2为非金属,其余均为金属;D中 H2O为氧化物,其余均为酸。此四种物质相互作用发生的反应为:2Cu+O2+CO2+H2O====Cu2(OH)2CO3。
答案:CO2 Cu O2 H2O
17.(10分)按要求填空。
(1)Fe与FeCl3反应生成FeCl2(写出离子方程式)
_________________________________________。
(2)氢氧化钡溶液与硫酸铜反应(写出离子方程式)
_________________________________________。
(3)Fe2(SO4)3(写出电离方程式)
__________________________________________。
(4)H++OH-====H2O(写出对应的化学方程式)
__________________________________________。
(5)CO32-+2H+====CO2↑+H2O(写出对应的化学方程式)
__________________________________________。
【解析】书写离子方程式时注意物质的拆分原则,反应前后电荷守恒;氢氧化钡溶液和硫酸铜的反应,注意不要漏掉离子反应Cu2++2OH- ==== Cu(OH)2↓,由离子方程式书写化学方程式时,也要注意拆分原则,不能增加离子反应,写完后要将其再改写成离子方程式进行对比,检验改写的是否正确。
答案:(1)Fe+2Fe3+====3Fe2+
(2)Ba2++2OH-+Cu2++SO42-====BaSO4↓+Cu(OH)2↓
(3)Fe2(SO4)3====2Fe3++3SO42-
(4)HCl+NaOH====NaCl+H2O(合理即可)
(5)Na2CO3+2HCl====2NaCl+H2O+CO2↑(合理即可)
18.(13分)(1)在反应Fe2O3+3CO 2Fe+3CO2
中,_____是氧化剂,_____是还原剂,用双线桥法标出电子转移的方向和数目______,若反应过程中生成1个CO2分子,则转移电子数为______个。
(2)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、
OH-按可能大量共存于同一溶液的情况,把他们分成A、
B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_________________________________。
B组:_________________________________。
高温
====
【解析】(1)在反应Fe2O3 +3CO 2Fe+3CO2
中,Fe元素化合价降低,得到电子,被还原,Fe2O3是氧化剂;C元素化合价升高,失去电子,被氧化,CO是还原剂。用双线桥法表示电子转移的方向和数目为:
高温
====
由双线桥法可知,生成3个CO2分子,转移电子数为
6个,故生成1个CO2分子,转移电子数为2个。
(2)在离子中有H+和OH-,所以可将离子分为酸性组和
碱性组,凡与H+不共存的离子分在碱性组,凡与OH-不
共存的离子分在酸性组。与H+不共存的离子有:CO32-、
OH-,与OH-不共存的离子有:Cu2+、H+,根据每组中均
含两种阳离子和两种阴离子,即可分为两组。
答案:(1)Fe2O3 CO
2
(2)A组:Na+、K+、CO32-、OH-
B组:Cu2+、H+、NO3-、Cl-(可互换)
19.(10分)有一包白色固体,可能是NaCl、K2CO3、Na2SO4和BaCl2中的一种或几种。将此白色固体溶解于水时,有白色沉淀生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)通过上述实验现象分析:该白色固体中一定含有的物质为_______,不可能含有的物质为_________。
(2)试写出有关反应的离子方程式:
①______________________________;
②______________________________;
③______________________________。
【解析】白色固体溶解于水时,有白色沉淀生成,白色沉淀可能为BaCO3或BaSO4;部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成,说明白色沉淀为BaCO3而不是BaSO4,因BaSO4不溶于稀硝酸,而BaCO3与稀硝酸反应生成CO2气体,故原白色固体一定含有K2CO3、BaCl2,一定不含Na2SO4;所以滤液中一定含有KCl,滴入几滴AgNO3溶液,一定有白色沉淀生成,再加入稀硝酸,沉淀不溶解,故有无NaCl不能确定。
答案:(1)K2CO3、BaCl2 Na2SO4
(2)①Ba2++CO32- ==== BaCO3↓
②BaCO3+2H+====Ba2++CO2↑+H2O
③Ag++Cl-====AgCl↓
20.(8分)碘(I)元素在生产和生活中有着十分广泛的用途。对于下列A~D涉及I2的反应,填写空白:
A.I2+2H2O+SO2====H2SO4+2HI
B.I2+6H2O+5Cl2====2HIO3+10HCl
C.2Fe3++2I- ====2Fe2++I2
D.3I2+6KOH====2KIO3+5KI+3H2O
(1)I2仅体现还原性的反应是(填代号)______ 。
(2)I2仅体现氧化性的反应是(填代号)______ 。
(3)I2既体现氧化性又体现还原性的反应是(填代号)________________。
(4)上述反应说明I2、SO2、Cl2氧化性由强到弱的顺序是:________________。
【解析】A中I元素化合价全部从0价降为-1价,得到电
子,被还原,故A中I2仅体现氧化性;B中I元素全部从
0价升高到+5价,失去电子,被氧化,I2仅体现还原
性;C中I2是生成物,不是反应物,故既不体现氧化性
也不体现还原性;D中I元素一部分从0价升高到+5价,
一部分降为-1价,故I2既体现氧化性又体现还原性。由
A可知氧化性I2>SO2,由B可知氧化性Cl2>I2,即氧化
性Cl2>I2>SO2。
答案:(1)B (2)A (3)D (4)Cl2>I2>SO2
21.(10分)(2010·深圳高一检测)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如图(各步反应恰好完全进行)
(1)沉淀的化学式:沉淀1_______,沉淀2_______,
沉淀3_________;
(2)写出混合液+A的离子方程式:______________。
溶液+B的离子方程式:_______________。
【解析】Ba2+、Cu2+、Ag+三种离子中,只有Cu2+的溶液是蓝色的,由蓝色溶液与C反应得到沉淀3可知C为NaOH溶液,盐酸和Na2SO4溶液不与Cu2+反应;Ba2+、Ag+均与Na2SO4溶液反应生成BaSO4、Ag2SO4沉淀,Ba2+、Ag+则不能分离,故A不能为Na2SO4溶液,只能为盐酸,B只能为Na2SO4溶液。
答案:(1)AgCl BaSO4 Cu(OH)2
(2)Ag++Cl-====AgCl↓
Ba2++SO42-====BaSO4↓
第二章 化学物质及其变化
(90分钟 100分)
一、选择题(本题包括15个小题,
每小题3分,共45分)
1.(2010·天津五校联考)现有①液态氧 ②氢氧化铁
胶体 ③食盐水 ④纯碱 ⑤氢氧化钾 ⑥空气 对上述物质的分类全部正确的是( )
A.盐——③④ B.纯净物——④⑤⑥
C.碱——④⑤ D.混合物——②③⑥
【解析】选D。纯净物有①④⑤;混合物有②③⑥;盐与碱均属于纯净物中的化合物,盐有④;碱有⑤。
2.将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是( )
A.冷水
B.沸水
C.NaOH溶液
D.NaCl溶液
【解析】选B。Fe(OH)3胶体的制备方法是将饱和FeCl3溶
液滴入沸水中,继续加热至液体呈现红褐色为止,即可
得到Fe(OH)3胶体。饱和FeCl3溶液滴入NaOH溶液中,得
到的是Fe(OH)3沉淀。
3.下图为反应Fe+CuSO4 ==== Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe,S B.Cu,S C.Fe,O D.Fe,Cu
【解析】选D。在反应Fe+CuSO4====Cu+FeSO4中,Fe为还原剂,失去电子,化合价升高;CuSO4中Cu2+得到电子,为氧化剂,化合价降低,故选D。
4.(2010·雅安高一检测)下列物质属于电解质并能导电的是( )
A.酒精
B.氯化钾晶体
C.液态氯化氢
D.熔融态的氢氧化钠
【解析】选D。酒精为非电解质,A错误;氯化钾晶体、液态氯化氢、熔融态的氢氧化钠均为电解质,但氯化钾晶体、液态氯化氢不导电,B、C错误;只有熔融态的氢氧化钠导电,故选D。
5.(2010·吉安高一检测)如图表示的一些物质或概念间的从属关系中不正确的是( )
【解析】选B。电解质包括酸、碱、盐,电解质均是化合物,故B中X、Y的从属关系不正确,正好相反。
6.下列有关胶体和溶液的比较中正确的是( )
A.溶液澄清透明,胶体浑浊不透明
B.胶体比溶液稳定
C.光束通过溶液没有特殊现象,光束通过胶体有丁达尔
效应
D.溶液中溶质粒子的直径大,胶体粒子的直径小
【解析】选C。溶液澄清透明,均一稳定,胶体澄清透
明,但它的稳定性介于浊液与溶液之间,属于介稳体
系,故A、B错误;丁达尔效应是胶体的特有性质,溶液
不具备,C正确;胶体粒子的直径大,介于
1 nm~100 nm之间,溶液中溶质粒子的直径小于1 nm,
D错误。
7.能用H++OH-====H2O表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中
【解析】选C。能改写成离子形式的为易溶于水、易电
离的物质,故H++OH-====H2O表示的是强酸与强碱生成可
溶性盐的化学反应。A中氢氧化镁为难溶性弱碱,不能改写成离子形式,B中生成难溶性盐BaSO4,D中二氧化碳不能改写成离子形式,另外生成CaCO3沉淀,只有C符合题意。A、B、D的离子方程式分别为:Mg(OH)2+2H+====2H2O+Mg2+,
Ba2++2OH-+2H++SO42-====2H2O+BaSO4↓,
Ca2++2OH-+CO2====CaCO3↓+H2O。
8.(2010·包头高一检测)下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl====CaCl2+CO2↑+H2O
B.CaO+H2O====Ca(OH)2
C.2H2O2 2H2O+O2↑
D.CaCO3 CaO+CO2↑
催化剂
====
高温
====
【解析】选C。有化合价变化的为氧化还原反应,四个选项中只有C项有化合价的变化,H2O2中-1价的O元素变为H2O中-2价的O元素和O2中0价的O元素,故选C。
9.下列离子方程式书写正确的是( )
A.氯化铜溶液与铁粉反应:Cu2++Fe====Fe2++Cu
B.稀H2SO4与铁粉反应:2Fe+6H+====2Fe3++3H2↑
C.NaOH溶液与过量CO2反应:
2OH-+CO2====CO32-+H2O
D.碳酸钙与盐酸反应:CO32-+2H+====H2O+CO2↑
【解析】选A。B项不符合反应事实,正确的离子方程式为Fe+2H+====Fe2++H2↑;C项NaOH与过量CO2反应生成NaHCO3,正确的离子方程式为CO2+OH-====HCO3-;D项碳酸钙为难溶性盐,不能改写成Ca2+与CO32-的形式,正确的离子方程式为CaCO3+2H+====Ca2++CO2↑+H2O。
10.(2010·鹤壁高一检测)关于氧化还原反应的说法中正确的是( )
A.失去电子的物质是氧化剂
B.氧化反应的本质是得电子
C.原子得到电子后,元素的化合价一定升高
D.有单质参加或生成的反应不一定是氧化还原反应
【解析】选D。在氧化还原反应中,失去电子的物质是还原剂,被氧化,发生氧化反应,所以氧化反应的本质是失去电子,A、B错误;原子得到电子后,元素的化合价一定降低,C错误;有单质参加或生成的反应不一定是氧化还原反应,如:3O2====2O3,但有单质参加的化合反应或有单质生成的分解反应一定是氧化还原反应,故D正确。
11.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4-、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Cu2+、Na+、Cl-、SO42-
【解析】选B。MnO4-与Cu2+是有色离子,A、D不符合题意要求;碱性溶液中存在大量OH-,C项中H+与OH-不能大量共存,只有B项符合题意。
12.实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3,实验员选择了一种试剂就把它们区别开来了,这种试剂是( )
A.盐酸
B.氢氧化钠溶液
C.氯化钡溶液
D.硝酸
【解析】选A。盐酸与Na2CO3反应产生气泡(CO2气
体),盐酸与NaCl不反应,盐酸与AgNO3反应产生AgCl
白色沉淀,现象均不相同,可以把它们区别开来。氢氧
化钠溶液只与AgNO3反应产生沉淀,与Na2CO3、NaCl均不
反应;氯化钡溶液与NaCl不反应,与Na2CO3、AgNO3均产
生白色沉淀;硝酸与Na2CO3反应产生气泡(CO2气体),
与NaCl、AgNO3均不反应。
13.在反应2H2S+SO2====3S↓+2H2O中( )
A.H2S是氧化剂
B.SO2是还原剂
C.H2O是还原产物
D.氧化产物与还原产物之比为2∶1
【解析】选D。H2S中S元素由-2价升为0价,失去电子,
被氧化,H2S是还原剂,A错误;SO2中S元素由+4价降为
0价,得到电子,被还原,SO2是氧化剂,B错误;H、O元素没有化合价的变化,故H2O既不是还原产物也不是氧化产物,C错误;被氧化的S与被还原的S个数比为
2∶1,所以氧化产物与还原产物之比即为2∶1,D正
确。
14.(2010·秦皇岛高一检测)分类法是化学学习中常用的一种方法,下列分类标准不正确的是( )
A.根据物质组成的种类,可以将物质分为纯净物和混合物
B.根据分散质粒子的大小,可以将分散系分为溶液、胶体和浊液
C.根据反应物和生成物的类别以及反应前后物质种类的多少,将化学反应分为:置换、化合、分解和复分解反应
D.根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等
【解析】选D。化合物中含氢元素,不一定为酸,如:
NH3、H2O等,故D不正确。酸的概念是:电离出的阳离子
全部为H+的化合物,依据电离出H+的数目的多少,将酸
分为一元酸、二元酸、三元酸等。
15.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系来表示,其中正确的是( )
【解析】选A。复分解反应一定不是氧化还原反应,置
换反应一定是氧化还原反应,离子反应可能是复分解反
应,也可能是氧化还原反应,如:Cu2++Fe====Fe2++Cu;
Ba2++SO42-====BaSO4↓。
二、非选择题(本题包括6个小题,共55分)
16.(4分)(2010·焦作高一检测)下列4组物质均有一
种物质的类别与其他3种不同,且这四种物质相互作用
可生成一种新物质——碱式碳酸铜,化学式为
Cu2(OH)2CO3。
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
以上四组物质中与其他物质不同的物质依次是(填化学式)
A.______;B.______;C.______;D.______。
【解析】A中CO2为非金属氧化物,其余均为金属氧化物;B中Cu为金属,其余均为非金属;C中O2为非金属,其余均为金属;D中 H2O为氧化物,其余均为酸。此四种物质相互作用发生的反应为:2Cu+O2+CO2+H2O====Cu2(OH)2CO3。
答案:CO2 Cu O2 H2O
17.(10分)按要求填空。
(1)Fe与FeCl3反应生成FeCl2(写出离子方程式)
_________________________________________。
(2)氢氧化钡溶液与硫酸铜反应(写出离子方程式)
_________________________________________。
(3)Fe2(SO4)3(写出电离方程式)
__________________________________________。
(4)H++OH-====H2O(写出对应的化学方程式)
__________________________________________。
(5)CO32-+2H+====CO2↑+H2O(写出对应的化学方程式)
__________________________________________。
【解析】书写离子方程式时注意物质的拆分原则,反应前后电荷守恒;氢氧化钡溶液和硫酸铜的反应,注意不要漏掉离子反应Cu2++2OH- ==== Cu(OH)2↓,由离子方程式书写化学方程式时,也要注意拆分原则,不能增加离子反应,写完后要将其再改写成离子方程式进行对比,检验改写的是否正确。
答案:(1)Fe+2Fe3+====3Fe2+
(2)Ba2++2OH-+Cu2++SO42-====BaSO4↓+Cu(OH)2↓
(3)Fe2(SO4)3====2Fe3++3SO42-
(4)HCl+NaOH====NaCl+H2O(合理即可)
(5)Na2CO3+2HCl====2NaCl+H2O+CO2↑(合理即可)
18.(13分)(1)在反应Fe2O3+3CO 2Fe+3CO2
中,_____是氧化剂,_____是还原剂,用双线桥法标出电子转移的方向和数目______,若反应过程中生成1个CO2分子,则转移电子数为______个。
(2)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、
OH-按可能大量共存于同一溶液的情况,把他们分成A、
B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_________________________________。
B组:_________________________________。
高温
====
【解析】(1)在反应Fe2O3 +3CO 2Fe+3CO2
中,Fe元素化合价降低,得到电子,被还原,Fe2O3是氧化剂;C元素化合价升高,失去电子,被氧化,CO是还原剂。用双线桥法表示电子转移的方向和数目为:
高温
====
由双线桥法可知,生成3个CO2分子,转移电子数为
6个,故生成1个CO2分子,转移电子数为2个。
(2)在离子中有H+和OH-,所以可将离子分为酸性组和
碱性组,凡与H+不共存的离子分在碱性组,凡与OH-不
共存的离子分在酸性组。与H+不共存的离子有:CO32-、
OH-,与OH-不共存的离子有:Cu2+、H+,根据每组中均
含两种阳离子和两种阴离子,即可分为两组。
答案:(1)Fe2O3 CO
2
(2)A组:Na+、K+、CO32-、OH-
B组:Cu2+、H+、NO3-、Cl-(可互换)
19.(10分)有一包白色固体,可能是NaCl、K2CO3、Na2SO4和BaCl2中的一种或几种。将此白色固体溶解于水时,有白色沉淀生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)通过上述实验现象分析:该白色固体中一定含有的物质为_______,不可能含有的物质为_________。
(2)试写出有关反应的离子方程式:
①______________________________;
②______________________________;
③______________________________。
【解析】白色固体溶解于水时,有白色沉淀生成,白色沉淀可能为BaCO3或BaSO4;部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成,说明白色沉淀为BaCO3而不是BaSO4,因BaSO4不溶于稀硝酸,而BaCO3与稀硝酸反应生成CO2气体,故原白色固体一定含有K2CO3、BaCl2,一定不含Na2SO4;所以滤液中一定含有KCl,滴入几滴AgNO3溶液,一定有白色沉淀生成,再加入稀硝酸,沉淀不溶解,故有无NaCl不能确定。
答案:(1)K2CO3、BaCl2 Na2SO4
(2)①Ba2++CO32- ==== BaCO3↓
②BaCO3+2H+====Ba2++CO2↑+H2O
③Ag++Cl-====AgCl↓
20.(8分)碘(I)元素在生产和生活中有着十分广泛的用途。对于下列A~D涉及I2的反应,填写空白:
A.I2+2H2O+SO2====H2SO4+2HI
B.I2+6H2O+5Cl2====2HIO3+10HCl
C.2Fe3++2I- ====2Fe2++I2
D.3I2+6KOH====2KIO3+5KI+3H2O
(1)I2仅体现还原性的反应是(填代号)______ 。
(2)I2仅体现氧化性的反应是(填代号)______ 。
(3)I2既体现氧化性又体现还原性的反应是(填代号)________________。
(4)上述反应说明I2、SO2、Cl2氧化性由强到弱的顺序是:________________。
【解析】A中I元素化合价全部从0价降为-1价,得到电
子,被还原,故A中I2仅体现氧化性;B中I元素全部从
0价升高到+5价,失去电子,被氧化,I2仅体现还原
性;C中I2是生成物,不是反应物,故既不体现氧化性
也不体现还原性;D中I元素一部分从0价升高到+5价,
一部分降为-1价,故I2既体现氧化性又体现还原性。由
A可知氧化性I2>SO2,由B可知氧化性Cl2>I2,即氧化
性Cl2>I2>SO2。
答案:(1)B (2)A (3)D (4)Cl2>I2>SO2
21.(10分)(2010·深圳高一检测)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如图(各步反应恰好完全进行)
(1)沉淀的化学式:沉淀1_______,沉淀2_______,
沉淀3_________;
(2)写出混合液+A的离子方程式:______________。
溶液+B的离子方程式:_______________。
【解析】Ba2+、Cu2+、Ag+三种离子中,只有Cu2+的溶液是蓝色的,由蓝色溶液与C反应得到沉淀3可知C为NaOH溶液,盐酸和Na2SO4溶液不与Cu2+反应;Ba2+、Ag+均与Na2SO4溶液反应生成BaSO4、Ag2SO4沉淀,Ba2+、Ag+则不能分离,故A不能为Na2SO4溶液,只能为盐酸,B只能为Na2SO4溶液。
答案:(1)AgCl BaSO4 Cu(OH)2
(2)Ag++Cl-====AgCl↓
Ba2++SO42-====BaSO4↓
