10-11高中化学课时讲练通课件:阶段质量评估二(人教版必修1)90分钟 100分(共47张PPT)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:阶段质量评估二(人教版必修1)90分钟 100分(共47张PPT) |

|
|
| 格式 | rar | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 00:00:00 | ||
图片预览











文档简介
(共47张PPT)
(第三、四章)
(90分钟 100分)
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15个小题,每小题3分,共45分)
1.下列物质中,不属于合金的是( )
A.硬铝 B.黄铜
C.钢铁 D.水银
【解析】选D。只有水银是金属单质汞,其余均为含有多种金属或非金属成分的合金。
2.在下列化学反应方程式中,硝酸只表现氧化性的是
( )
A.3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
B.CuO+2HNO3(稀) Cu(NO3)2+H2O
C.C+4HNO3(浓) CO2↑+4NO2↑+2H2O
D.3Ag+4HNO3(稀) 3AgNO3+NO↑+2H2O
====
△
====
====
△
====
△
【解析】选C。有关硝酸参与的反应中,只起酸性作用的HNO3,也就是只提供H+的硝酸,这部分HNO3中的NO3-不变,在产物中生成盐。起氧化作用的HNO3,就是HNO3分子在反应过程中氮元素化合价降低生成较低价态含氮产物的那部分HNO3,硝酸只表现了氧化性,说明硝酸全部被还原,即没有硝酸盐生成。
3.实验室制取FeSO4溶液应采用的方法是( )
A.在稀硫酸中投入过量的铁粉
B.FeO溶解在过量的稀硫酸中
C.在浓硫酸中投入过量的铁屑
D.铁粉溶解在过量的稀H2SO4中
【解析】选A。FeSO4溶液中的Fe2+有强还原性,易被氧化成Fe3+,加入过量Fe,发生Fe+2Fe3+====3Fe2+,防止Fe2+被氧化。
4.把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入X物质的量的关系如图所示,符合图中曲线的是( )
A.X为CO2,Y为Ca(OH)2
B.X为NH3·H2O,Y为AlCl3
C.X为NaOH,Y为AlCl3
D.X为HCl,Y为NaAlO2
【解析】选D。CO2通入Ca(OH)2溶液中可产生碳酸钙沉淀,继续通CO2沉淀溶解而生成Ca(HCO3)2溶液。氨水加入AlCl3溶液产生沉淀,但过量沉淀不溶解,离子方程式为Al3++3NH3·H2O====Al(OH)3↓+3NH4+。NaOH溶液滴加到AlCl3溶液中生成Al(OH)3沉淀,继续加入,沉淀溶解生成偏铝酸钠:AlCl3+3NaOH====Al(OH)3↓
+3NaCl,Al(OH)3+NaOH====NaAlO2+2H2O。盐酸加入
到NaAlO2溶液中,先生成Al(OH)3沉淀,继续加入,沉淀溶解生成三氯化铝:HCl+NaAlO2+H2O====Al(OH)3↓
+NaCl,Al(OH)3+3HCl====AlCl3+3H2O。观察化学方程式的化学计量数,从定量角度分析,只有D答案符合题意。
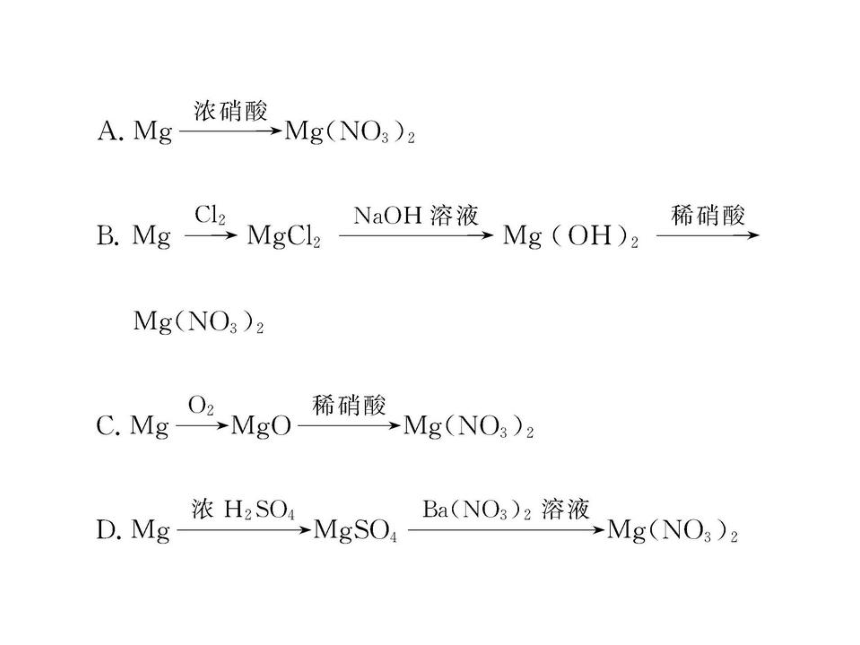
5.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列四个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
【解析】选C。镁和浓硝酸反应生成NO2,和浓硫酸反应生成SO2,它们都是大气污染物,不符合“绿色化学”要求;B和C方案从原理上都是可行的,但是B方案操作步骤多,流程复杂,原料消耗多,成本大。
6.北京市从2008年起,开始实施欧洲Ⅲ号标准,对污染物的排放实行更加严格的控制,下列有关控制污染物排放的措施不正确的是( )
A.调整能源结构,发展清洁能源
B.对原煤进行脱硫处理
C.在汽车尾气排放管中安装催化转换器,减少CO和NO的排放
D.高空排放工业生产硝酸的废气
【解析】选D。本题以北京市从2008年实施欧洲Ⅲ标准,控制环境污染为背景,考查对污染物的控制和处理办法。A项调整能源结构,发展清洁能源是正确的;B项中的原煤进行脱硫处理是为了防止煤燃烧过程中产生SO2污染环境,B也是正确的;C项中在汽车尾气排放装置中安装催化转换器,使有毒的NO和CO反应生成N2和CO2,C也正确;D项中高空排放工业生产硝酸中的废气,虽然暂时减弱了当地的污染,但废气的危害并没有消除,所以是错误的。
7.稀硫酸中插一块铜片,加入下列物质后,可使铜片迅速发生反应的是( )
A.稀盐酸 B.硫酸钠晶体
C.硝酸钾晶体 D.氯化钠晶体
【解析】选C。酸性条件下,加入KNO3,NO3-在H+存在条件下可将Cu氧化,3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O。
8.在一定条件下,下列物质能和二氧化硅反应的是
( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸
⑤高氯酸 ⑥氢氧化钾 ⑦水 ⑧氮气
A.①②③④⑥ B.⑤⑦⑧
C.⑤⑧ D.⑤⑦⑧
【解析】选A。因为碳酸的酸性比硅酸强,但SiO2与
碳酸钙在高温下反应,反应方程式为:SiO2+CaCO3====
CaSiO3+CO2↑,因为H2CO3的酸性强于H2SiO3,在硅酸
钠溶液里通入CO2能发生反应:Na2SiO3+CO2+H2O====
H2SiO3↓+Na2CO3,但在高温下Na2CO3+SiO2====Na2SiO3
+CO2↑也能发生。因为生成的 CO2是挥发性的气体,逸出反应体系,使反应不断正向进行。SiO2为难溶的酸性氧化物,常温下不与一般的酸反应,但能与强碱溶液反应。能与氢氟酸反应,在高温下能与碱性氧化物、碳酸盐、碳等反应。
高温
高温
涉及到的方程式:
2C+SiO2 Si+2CO↑
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
SiO2+4HF SiF4+2H2O
SiO2+2KOH K2SiO3+H2O
高温
====
高温
====
高温
====
====
====
9.(双选)将Na2O2投入FeCl3溶液中,可观察到的现象是( )
A.生成白色沉淀 B.生成红褐色沉淀
C.有气泡产生 D.无明显现象
【解析】选B、C。Na2O2投入FeCl3溶液中,Na2O2与水反应生成NaOH和O2,NaOH与FeCl3反应生成Fe(OH)3红褐色沉淀。
10.现在有100 mL 3mol·L-1的NaOH溶液和100 mL
1 mol·L-1的AlCl3溶液,①将NaOH溶液分多次滴加到AlCl3溶液中;②将AlCl3溶液分多次滴加到NaOH溶液中。比较两种操作的现象是( )
A.现象相同,沉淀质量不等
B.现象相同,沉淀质量也相等
C.现象不同,沉淀质量相等
D.现象不同,沉淀质量不等
【解析】选C。由于Al(OH)3可溶于过量的NaOH溶液中,因此将NaOH溶液分多次加到AlCl3溶液中,开始时Al3+过量,产生白色沉淀将AlCl3溶液分多次加到NaOH溶液中,开始时NaOH过量,没有沉淀生成。因为OH-与Al3+的物质的量关系是3∶1,故最终都有沉淀且沉淀质量是相同的。
11.(2010·山东高考)下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、 Na2O2组成元素相同,与CO2反应产物也相同
C.CO、 NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
【解析】选A。B项中Na2O与CO2反应只生成Na2CO3,而Na2O2与CO2反应除生成Na2CO3外还有O2生成,B项错;C项中NO不能在大气中稳定存在,C项错;新制的氯水中次氯酸有漂白性,因此石蕊试液最终褪色,D项错。
12.(双选)某金属A,其氧化物的相对分子质量为M1,对应氯化物的相对分子质量为M2,则该金属的化合价可能为( )
【解析】选B、D。设该金属化合价为+n,则n为奇数时,氧化物、氯化物的化学式分别为:A2On、ACln,此时M1
=2MA+16n,M2=MA+35.5n,解得 若n为偶数,则二者的化学式分别为:
解得
13.向倒扣在水槽中盛有NO的试管中,缓慢通入35 mL O2,反应完全后,若试管内液面仍保持在原来的位置,则试管中原NO的体积是( )
A.20 mL B.15 mL
C.10 mL D.5 mL
【解析】选A。设NO原有x mL,开始发生反应为4NO+3O2+2H2O====4HNO3,当NO消耗完后,再通入O2不
再有反应发生,由反应方程式知,与NO反应的O2为
x,后来通入O2为x,即
14.将SO2和X气体分别通入BaCl2溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
( )
A.CO2 B.NH3
C.Cl2 D.H2S
【解析】选A。四种气体通入BaCl2溶液中,均没有沉淀生成。NH3和SO2同时通入,可能有BaSO3沉淀生成;Cl2和SO2同时通入,有BaSO4沉淀生成;H2S和SO2同时通入,有单质S生成。
15.下列各组中的两种离子,分别加入过量的氨水,现象明显不同的是( )
①Al3+、Fe3+ ②Al3+、Cu2+ ③K+、Na+
④Mg2+、Al3+ ⑤Fe2+、Fe3+ ⑥Mg2+、Fe2+
A.①②⑤⑥ B.①②④⑤
C.①②④⑥ D.③④⑤⑥
【解析】选A。①②中加入氨水后都能生成沉淀,但沉淀的颜色不同。③中加氨水均无明显变化,④均为白色沉淀,现象相同;⑤⑥中一个是Fe(OH)2白色沉淀,但会迅速变为灰绿色最终变为红褐色,与直接生成Fe(OH)3、Mg(OH)2现象不同。故①②⑤⑥现象均不相同。
第Ⅱ卷(非选择题 共55分)
二、非选择题(本题包括6个小题,共55分)
16.(7分)吸烟对健康有害,科学实验表明:香烟所产生的烟雾中至少有300多种化合物对人体有不同的危害。为了鉴定该烟雾中是否存在CO2和CO,将香烟燃烧产生的烟雾进行适当处理后,依次通过足量以下试剂:①澄清石灰水;②浓硫酸;③灼热的黑色氧化铜粉末;④澄清石灰水。发现①④中澄清石灰水变浑浊,其他无明显现象。试回答:
(1)①中现象说明_______________________________
______________________________________________。
(2)烟雾中______(填“存在”或“不存在”)CO,作出此判断所依据的实验现象为____________________
______________________________________________。
(3)③中无明显变化的原因可能是_________________
______________________________________________。
【解析】二氧化碳可以使澄清的石灰水变浑浊,CO还原氧化铜,现象为黑色固体变红,同时产生二氧化碳。
答案:(1)该烟雾中含有CO2
(2)存在 ④中澄清石灰水变浑浊
(3)CO还原CuO得到的Cu又被氧化,故看不到CuO变色
17.(6分)在实验室中常常会用一套装置
进行不同的实验,现有如图所示装置,如
果用浓硫酸来干燥氯气,气体应从______
口进入(填“A”或“B”,下同);收集
一氧化氮时,气体应从_________口进入;收集氨气时,气体应从__________口进入。
【解析】要使用该装置干燥洗气,进气口,必须插入液体中(即“长进短出”),收集NO必须用排水法收集,收集NH3必须用向下排空气法收集。
答案:A B B
18.(8分)已知有以下物质间的相互转化关系:
试回答:
(1)写出B的化学式________,D的化学式_______。
(2)写出由E转变成F的化学方程式_______________
______________________________________________。
(3)写出向G溶液中加入A时反应的离子方程式为
______________________________________________。
(4)F和盐酸反应的离子方程式为________________
______________________________________________。
【解析】从F入手,F为氢氧化铁,所以E为氢氧化亚铁,B中有亚铁离子,所以A为铁单质,气体为氢气,C中有氢氧根离子;由溶液的焰色和白色沉淀H,可确定D为氯化钾。
答案:(1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O 4Fe(OH)3
(3)2Fe3++Fe ==== 3Fe2+
(4)Fe(OH)3+3H+ ==== Fe3++3H2O
19.(8分)某学生兴趣小组想利用高岭土[其主要成分是Al2O3·2SiO2·2H2O]试验新型的净水剂。试验程序如下:
其中滤液C就是欲求的净水剂。已知Al2O3与纯碱反应和SiO2与纯碱反应相似,生成NaAlO2。
试回答下列问题:
(1)写出混合物A,滤液C、沉淀D的主要成分:
A:________;C:________;D:_________。
(2)写出高岭土与纯碱熔融的两个化学方程式:
①___________________________________________;
②___________________________________________。
(3)该实验中,熔融高岭土可以选用的坩埚有____。
A.玻璃坩埚 B.瓷坩埚
C.氧化铝坩埚 D.铁坩埚
【解析】可以认为高岭土中含有SiO2和Al2O3,在高温下和Na2CO3发生如下反应:SiO2+Na2CO3====Na2SiO3+CO2↑和Al2O3+Na2CO3====2NaAlO2+CO2↑,所以A为NaAlO2和Na2SiO3的混合物;NaAlO2和Na2SiO3都溶于水,滤液中
含这两种物质。因为铝盐是常用的净水剂,所以C为AlCl3,即所加入的盐酸是过量的,反应的离子方程式为:AlO2-+4H+(过量)====Al3++2H2O和SiO32-+2H+====
H2SiO3↓,沉淀D为H2SiO3。因为瓷坩埚、玻璃坩埚中都含有SiO2,SiO2、Al2O3在高温下都能够和纯碱反应,故只能用铁坩埚进行加热。
高温
高温
答案:(1)NaAlO2和Na2SiO3 AlCl3 H2SiO3
(2)Al2O3+Na2CO3 2NaAlO2+CO2↑
SiO2+Na2CO3 Na2SiO3+CO2↑
(3)D
高温
====
高温
====
20.(12分)某研究性学习小组对Cl2使有色物质褪色的机理进行了探究。甲同学设计了如下图所示的实验装置并进行实验:
(1)甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因______________________
______________________________________________。
(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是______________________,
由此得出Cl2使有色物质褪色的机理是_____________
______________________________________________。
(3)乙同学认为甲设计的实验装置即使改进后还缺少一部分。请你将乙认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。
(4)请你写出Cl2和“(3)”中“最合适的化学试剂”反应的离子方程式__________________________。
【解析】本题考查Cl2使有机色质褪色的机理。Cl2本身不具有漂白作用,起漂白作用的是Cl2与水反应生成的HClO,因此,褪色的关键是同时有Cl2和水参与。
答案:(1)使用的干燥剂碱石灰将Cl2吸收
(2)干燥的有色布条不褪色,
湿润的有色布条褪色Cl2和水
反应生成HClO,HClO具有漂白
作用
(3)如图
(4)Cl2+2OH- ====Cl-+ClO-+H2O
21.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为
8CuFeS2+2lO2 8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_______(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是_______(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
高温
====
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I- ====2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程_______、
________。(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是_______________________
______________________________________________。
b.选用提供的试剂,设计实验证明炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水,所选试剂为___________。
证明炉渣中含有FeO的实验现象为_________________
______________________________________________。
【解析】(1)分析反应中的化合价升降可得:Cu、O的化合价降低,作氧化剂,被还原;Fe、S的化合价升高,作还原剂,被氧化。
(2)高空排放并不能减少SO2排放的总量,同样会污染空气,造成酸雨,a项错误;b、c两项均正确;SO2在浓硫酸中的溶解量很小,d项错误。
(3)Fe3+有氧化性,可以把I-氧化为I2,离子方程式为:2Fe3++2I- ====2Fe2++I2;同时Fe2+有还原性,可以把S2O82-还原为SO42-,离子方程式为:S2O82-+2Fe2+ ====2SO42-+2Fe3+。在上述反应中,Fe3+起催化剂的作用。
(4)a.Al2O3用稀盐酸处理后转变为Al3+,再加过量NaOH后发生反应,其离子方程式为:Al3++4OH- ====AlO2-+2H2O,此时,除Fe(OH)3为沉淀外,其余离子均存在于滤液中。b.若要验证炉渣中FeO的存在,可先加稀硫酸,把FeO转化为Fe2+,再利用Fe2+的还原性来验证。
答案:(1)Cu、O
(2)b、c
(3)2Fe3++2I- ====2Fe2++I2
S2O82-+2Fe2+====2SO42-+2Fe3+(可不配平)
(4)a.Al3++4OH-====AlO2-+2H2O
b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
(第三、四章)
(90分钟 100分)
第Ⅰ卷(选择题 共45分)
一、选择题(本题包括15个小题,每小题3分,共45分)
1.下列物质中,不属于合金的是( )
A.硬铝 B.黄铜
C.钢铁 D.水银
【解析】选D。只有水银是金属单质汞,其余均为含有多种金属或非金属成分的合金。
2.在下列化学反应方程式中,硝酸只表现氧化性的是
( )
A.3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
B.CuO+2HNO3(稀) Cu(NO3)2+H2O
C.C+4HNO3(浓) CO2↑+4NO2↑+2H2O
D.3Ag+4HNO3(稀) 3AgNO3+NO↑+2H2O
====
△
====
====
△
====
△
【解析】选C。有关硝酸参与的反应中,只起酸性作用的HNO3,也就是只提供H+的硝酸,这部分HNO3中的NO3-不变,在产物中生成盐。起氧化作用的HNO3,就是HNO3分子在反应过程中氮元素化合价降低生成较低价态含氮产物的那部分HNO3,硝酸只表现了氧化性,说明硝酸全部被还原,即没有硝酸盐生成。
3.实验室制取FeSO4溶液应采用的方法是( )
A.在稀硫酸中投入过量的铁粉
B.FeO溶解在过量的稀硫酸中
C.在浓硫酸中投入过量的铁屑
D.铁粉溶解在过量的稀H2SO4中
【解析】选A。FeSO4溶液中的Fe2+有强还原性,易被氧化成Fe3+,加入过量Fe,发生Fe+2Fe3+====3Fe2+,防止Fe2+被氧化。
4.把X溶液(或气体)慢慢加入(或通入)到一定量的Y溶液中,产生的沉淀量与加入X物质的量的关系如图所示,符合图中曲线的是( )
A.X为CO2,Y为Ca(OH)2
B.X为NH3·H2O,Y为AlCl3
C.X为NaOH,Y为AlCl3
D.X为HCl,Y为NaAlO2
【解析】选D。CO2通入Ca(OH)2溶液中可产生碳酸钙沉淀,继续通CO2沉淀溶解而生成Ca(HCO3)2溶液。氨水加入AlCl3溶液产生沉淀,但过量沉淀不溶解,离子方程式为Al3++3NH3·H2O====Al(OH)3↓+3NH4+。NaOH溶液滴加到AlCl3溶液中生成Al(OH)3沉淀,继续加入,沉淀溶解生成偏铝酸钠:AlCl3+3NaOH====Al(OH)3↓
+3NaCl,Al(OH)3+NaOH====NaAlO2+2H2O。盐酸加入
到NaAlO2溶液中,先生成Al(OH)3沉淀,继续加入,沉淀溶解生成三氯化铝:HCl+NaAlO2+H2O====Al(OH)3↓
+NaCl,Al(OH)3+3HCl====AlCl3+3H2O。观察化学方程式的化学计量数,从定量角度分析,只有D答案符合题意。
5.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列四个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
【解析】选C。镁和浓硝酸反应生成NO2,和浓硫酸反应生成SO2,它们都是大气污染物,不符合“绿色化学”要求;B和C方案从原理上都是可行的,但是B方案操作步骤多,流程复杂,原料消耗多,成本大。
6.北京市从2008年起,开始实施欧洲Ⅲ号标准,对污染物的排放实行更加严格的控制,下列有关控制污染物排放的措施不正确的是( )
A.调整能源结构,发展清洁能源
B.对原煤进行脱硫处理
C.在汽车尾气排放管中安装催化转换器,减少CO和NO的排放
D.高空排放工业生产硝酸的废气
【解析】选D。本题以北京市从2008年实施欧洲Ⅲ标准,控制环境污染为背景,考查对污染物的控制和处理办法。A项调整能源结构,发展清洁能源是正确的;B项中的原煤进行脱硫处理是为了防止煤燃烧过程中产生SO2污染环境,B也是正确的;C项中在汽车尾气排放装置中安装催化转换器,使有毒的NO和CO反应生成N2和CO2,C也正确;D项中高空排放工业生产硝酸中的废气,虽然暂时减弱了当地的污染,但废气的危害并没有消除,所以是错误的。
7.稀硫酸中插一块铜片,加入下列物质后,可使铜片迅速发生反应的是( )
A.稀盐酸 B.硫酸钠晶体
C.硝酸钾晶体 D.氯化钠晶体
【解析】选C。酸性条件下,加入KNO3,NO3-在H+存在条件下可将Cu氧化,3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O。
8.在一定条件下,下列物质能和二氧化硅反应的是
( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸
⑤高氯酸 ⑥氢氧化钾 ⑦水 ⑧氮气
A.①②③④⑥ B.⑤⑦⑧
C.⑤⑧ D.⑤⑦⑧
【解析】选A。因为碳酸的酸性比硅酸强,但SiO2与
碳酸钙在高温下反应,反应方程式为:SiO2+CaCO3====
CaSiO3+CO2↑,因为H2CO3的酸性强于H2SiO3,在硅酸
钠溶液里通入CO2能发生反应:Na2SiO3+CO2+H2O====
H2SiO3↓+Na2CO3,但在高温下Na2CO3+SiO2====Na2SiO3
+CO2↑也能发生。因为生成的 CO2是挥发性的气体,逸出反应体系,使反应不断正向进行。SiO2为难溶的酸性氧化物,常温下不与一般的酸反应,但能与强碱溶液反应。能与氢氟酸反应,在高温下能与碱性氧化物、碳酸盐、碳等反应。
高温
高温
涉及到的方程式:
2C+SiO2 Si+2CO↑
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
SiO2+4HF SiF4+2H2O
SiO2+2KOH K2SiO3+H2O
高温
====
高温
====
高温
====
====
====
9.(双选)将Na2O2投入FeCl3溶液中,可观察到的现象是( )
A.生成白色沉淀 B.生成红褐色沉淀
C.有气泡产生 D.无明显现象
【解析】选B、C。Na2O2投入FeCl3溶液中,Na2O2与水反应生成NaOH和O2,NaOH与FeCl3反应生成Fe(OH)3红褐色沉淀。
10.现在有100 mL 3mol·L-1的NaOH溶液和100 mL
1 mol·L-1的AlCl3溶液,①将NaOH溶液分多次滴加到AlCl3溶液中;②将AlCl3溶液分多次滴加到NaOH溶液中。比较两种操作的现象是( )
A.现象相同,沉淀质量不等
B.现象相同,沉淀质量也相等
C.现象不同,沉淀质量相等
D.现象不同,沉淀质量不等
【解析】选C。由于Al(OH)3可溶于过量的NaOH溶液中,因此将NaOH溶液分多次加到AlCl3溶液中,开始时Al3+过量,产生白色沉淀将AlCl3溶液分多次加到NaOH溶液中,开始时NaOH过量,没有沉淀生成。因为OH-与Al3+的物质的量关系是3∶1,故最终都有沉淀且沉淀质量是相同的。
11.(2010·山东高考)下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、 Na2O2组成元素相同,与CO2反应产物也相同
C.CO、 NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
【解析】选A。B项中Na2O与CO2反应只生成Na2CO3,而Na2O2与CO2反应除生成Na2CO3外还有O2生成,B项错;C项中NO不能在大气中稳定存在,C项错;新制的氯水中次氯酸有漂白性,因此石蕊试液最终褪色,D项错。
12.(双选)某金属A,其氧化物的相对分子质量为M1,对应氯化物的相对分子质量为M2,则该金属的化合价可能为( )
【解析】选B、D。设该金属化合价为+n,则n为奇数时,氧化物、氯化物的化学式分别为:A2On、ACln,此时M1
=2MA+16n,M2=MA+35.5n,解得 若n为偶数,则二者的化学式分别为:
解得
13.向倒扣在水槽中盛有NO的试管中,缓慢通入35 mL O2,反应完全后,若试管内液面仍保持在原来的位置,则试管中原NO的体积是( )
A.20 mL B.15 mL
C.10 mL D.5 mL
【解析】选A。设NO原有x mL,开始发生反应为4NO+3O2+2H2O====4HNO3,当NO消耗完后,再通入O2不
再有反应发生,由反应方程式知,与NO反应的O2为
x,后来通入O2为x,即
14.将SO2和X气体分别通入BaCl2溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
( )
A.CO2 B.NH3
C.Cl2 D.H2S
【解析】选A。四种气体通入BaCl2溶液中,均没有沉淀生成。NH3和SO2同时通入,可能有BaSO3沉淀生成;Cl2和SO2同时通入,有BaSO4沉淀生成;H2S和SO2同时通入,有单质S生成。
15.下列各组中的两种离子,分别加入过量的氨水,现象明显不同的是( )
①Al3+、Fe3+ ②Al3+、Cu2+ ③K+、Na+
④Mg2+、Al3+ ⑤Fe2+、Fe3+ ⑥Mg2+、Fe2+
A.①②⑤⑥ B.①②④⑤
C.①②④⑥ D.③④⑤⑥
【解析】选A。①②中加入氨水后都能生成沉淀,但沉淀的颜色不同。③中加氨水均无明显变化,④均为白色沉淀,现象相同;⑤⑥中一个是Fe(OH)2白色沉淀,但会迅速变为灰绿色最终变为红褐色,与直接生成Fe(OH)3、Mg(OH)2现象不同。故①②⑤⑥现象均不相同。
第Ⅱ卷(非选择题 共55分)
二、非选择题(本题包括6个小题,共55分)
16.(7分)吸烟对健康有害,科学实验表明:香烟所产生的烟雾中至少有300多种化合物对人体有不同的危害。为了鉴定该烟雾中是否存在CO2和CO,将香烟燃烧产生的烟雾进行适当处理后,依次通过足量以下试剂:①澄清石灰水;②浓硫酸;③灼热的黑色氧化铜粉末;④澄清石灰水。发现①④中澄清石灰水变浑浊,其他无明显现象。试回答:
(1)①中现象说明_______________________________
______________________________________________。
(2)烟雾中______(填“存在”或“不存在”)CO,作出此判断所依据的实验现象为____________________
______________________________________________。
(3)③中无明显变化的原因可能是_________________
______________________________________________。
【解析】二氧化碳可以使澄清的石灰水变浑浊,CO还原氧化铜,现象为黑色固体变红,同时产生二氧化碳。
答案:(1)该烟雾中含有CO2
(2)存在 ④中澄清石灰水变浑浊
(3)CO还原CuO得到的Cu又被氧化,故看不到CuO变色
17.(6分)在实验室中常常会用一套装置
进行不同的实验,现有如图所示装置,如
果用浓硫酸来干燥氯气,气体应从______
口进入(填“A”或“B”,下同);收集
一氧化氮时,气体应从_________口进入;收集氨气时,气体应从__________口进入。
【解析】要使用该装置干燥洗气,进气口,必须插入液体中(即“长进短出”),收集NO必须用排水法收集,收集NH3必须用向下排空气法收集。
答案:A B B
18.(8分)已知有以下物质间的相互转化关系:
试回答:
(1)写出B的化学式________,D的化学式_______。
(2)写出由E转变成F的化学方程式_______________
______________________________________________。
(3)写出向G溶液中加入A时反应的离子方程式为
______________________________________________。
(4)F和盐酸反应的离子方程式为________________
______________________________________________。
【解析】从F入手,F为氢氧化铁,所以E为氢氧化亚铁,B中有亚铁离子,所以A为铁单质,气体为氢气,C中有氢氧根离子;由溶液的焰色和白色沉淀H,可确定D为氯化钾。
答案:(1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O 4Fe(OH)3
(3)2Fe3++Fe ==== 3Fe2+
(4)Fe(OH)3+3H+ ==== Fe3++3H2O
19.(8分)某学生兴趣小组想利用高岭土[其主要成分是Al2O3·2SiO2·2H2O]试验新型的净水剂。试验程序如下:
其中滤液C就是欲求的净水剂。已知Al2O3与纯碱反应和SiO2与纯碱反应相似,生成NaAlO2。
试回答下列问题:
(1)写出混合物A,滤液C、沉淀D的主要成分:
A:________;C:________;D:_________。
(2)写出高岭土与纯碱熔融的两个化学方程式:
①___________________________________________;
②___________________________________________。
(3)该实验中,熔融高岭土可以选用的坩埚有____。
A.玻璃坩埚 B.瓷坩埚
C.氧化铝坩埚 D.铁坩埚
【解析】可以认为高岭土中含有SiO2和Al2O3,在高温下和Na2CO3发生如下反应:SiO2+Na2CO3====Na2SiO3+CO2↑和Al2O3+Na2CO3====2NaAlO2+CO2↑,所以A为NaAlO2和Na2SiO3的混合物;NaAlO2和Na2SiO3都溶于水,滤液中
含这两种物质。因为铝盐是常用的净水剂,所以C为AlCl3,即所加入的盐酸是过量的,反应的离子方程式为:AlO2-+4H+(过量)====Al3++2H2O和SiO32-+2H+====
H2SiO3↓,沉淀D为H2SiO3。因为瓷坩埚、玻璃坩埚中都含有SiO2,SiO2、Al2O3在高温下都能够和纯碱反应,故只能用铁坩埚进行加热。
高温
高温
答案:(1)NaAlO2和Na2SiO3 AlCl3 H2SiO3
(2)Al2O3+Na2CO3 2NaAlO2+CO2↑
SiO2+Na2CO3 Na2SiO3+CO2↑
(3)D
高温
====
高温
====
20.(12分)某研究性学习小组对Cl2使有色物质褪色的机理进行了探究。甲同学设计了如下图所示的实验装置并进行实验:
(1)甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因______________________
______________________________________________。
(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象。你认为他预期的实验现象是______________________,
由此得出Cl2使有色物质褪色的机理是_____________
______________________________________________。
(3)乙同学认为甲设计的实验装置即使改进后还缺少一部分。请你将乙认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。
(4)请你写出Cl2和“(3)”中“最合适的化学试剂”反应的离子方程式__________________________。
【解析】本题考查Cl2使有机色质褪色的机理。Cl2本身不具有漂白作用,起漂白作用的是Cl2与水反应生成的HClO,因此,褪色的关键是同时有Cl2和水参与。
答案:(1)使用的干燥剂碱石灰将Cl2吸收
(2)干燥的有色布条不褪色,
湿润的有色布条褪色Cl2和水
反应生成HClO,HClO具有漂白
作用
(3)如图
(4)Cl2+2OH- ====Cl-+ClO-+H2O
21.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为
8CuFeS2+2lO2 8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_______(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是_______(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
高温
====
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I- ====2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程_______、
________。(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是_______________________
______________________________________________。
b.选用提供的试剂,设计实验证明炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水,所选试剂为___________。
证明炉渣中含有FeO的实验现象为_________________
______________________________________________。
【解析】(1)分析反应中的化合价升降可得:Cu、O的化合价降低,作氧化剂,被还原;Fe、S的化合价升高,作还原剂,被氧化。
(2)高空排放并不能减少SO2排放的总量,同样会污染空气,造成酸雨,a项错误;b、c两项均正确;SO2在浓硫酸中的溶解量很小,d项错误。
(3)Fe3+有氧化性,可以把I-氧化为I2,离子方程式为:2Fe3++2I- ====2Fe2++I2;同时Fe2+有还原性,可以把S2O82-还原为SO42-,离子方程式为:S2O82-+2Fe2+ ====2SO42-+2Fe3+。在上述反应中,Fe3+起催化剂的作用。
(4)a.Al2O3用稀盐酸处理后转变为Al3+,再加过量NaOH后发生反应,其离子方程式为:Al3++4OH- ====AlO2-+2H2O,此时,除Fe(OH)3为沉淀外,其余离子均存在于滤液中。b.若要验证炉渣中FeO的存在,可先加稀硫酸,把FeO转化为Fe2+,再利用Fe2+的还原性来验证。
答案:(1)Cu、O
(2)b、c
(3)2Fe3++2I- ====2Fe2++I2
S2O82-+2Fe2+====2SO42-+2Fe3+(可不配平)
(4)a.Al3++4OH-====AlO2-+2H2O
b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
