10-11高中化学课时讲练通课件:311 金属的化学性质(人教版必修1)(共48张PPT)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:311 金属的化学性质(人教版必修1)(共48张PPT) |  | |
| 格式 | rar | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 19:00:58 | ||
图片预览









文档简介
(共48张PPT)
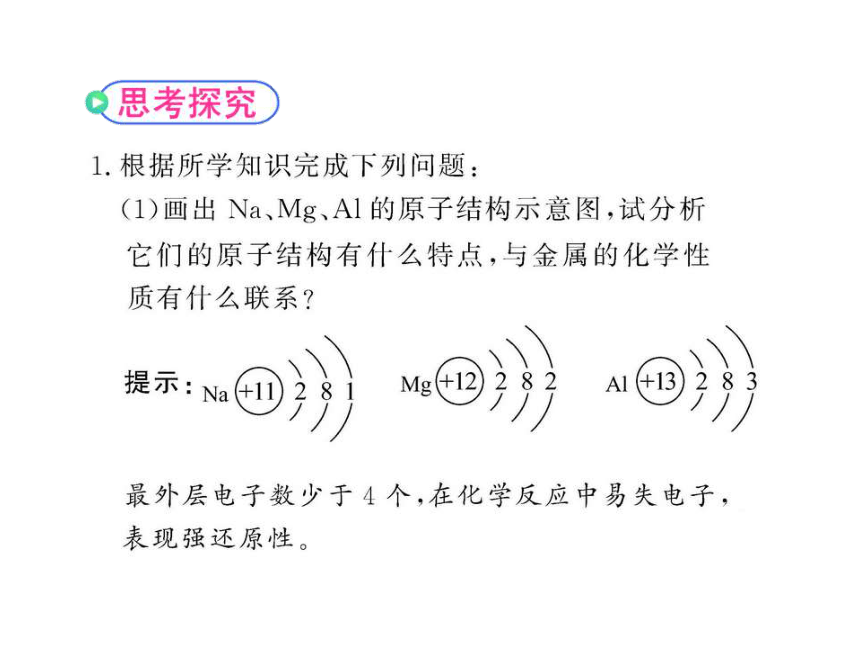
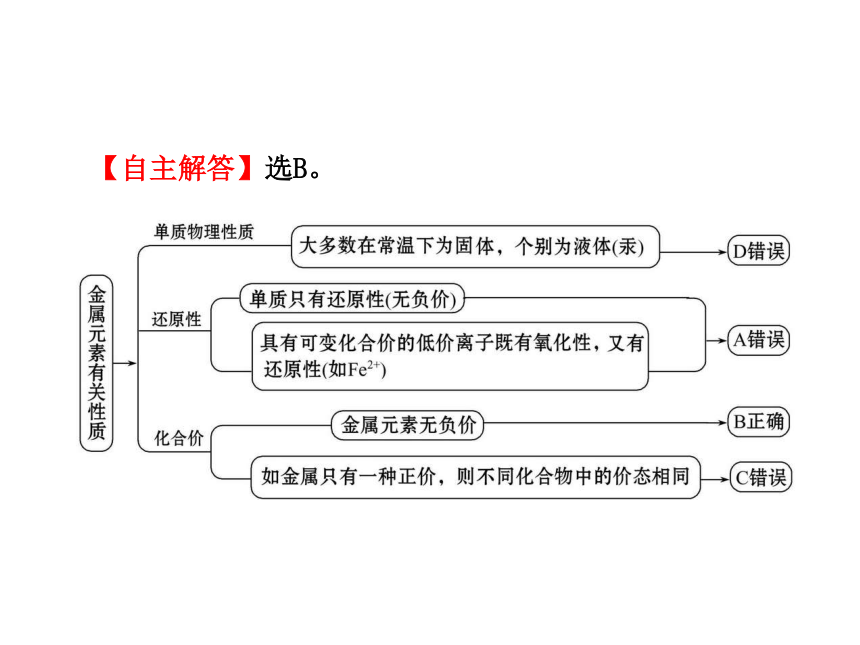
【典例1】下列有关金属元素特征的叙述正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属元素的单质在常温下均为固体
【思路点拨】解答本题要考虑金属元素性质中的共性与特例。
【自主解答】选B。
【典例2】等质量的两块钠,第一块在足量氧气中加热,第二块与足量氧气(常温)充分反应,则下列说法正确的是
A.第一块钠失去电子数多
B.两块钠失去电子数一样多
C.第二块钠的反应产物质量较大
D.两块钠的反应产物质量一样大
【思路点拨】解答本题要明确钠与氧气在不同条件下反应的产物不一样。
【自主解答】选B。根据电荷守恒,不论燃烧还是缓
慢氧化,最终都是Na→Na,故二者失去的电子数一样
多;但燃烧时生成Na2O2,而常温时生成Na2O,故第一
块钠反应的产物质量大。
+1
0
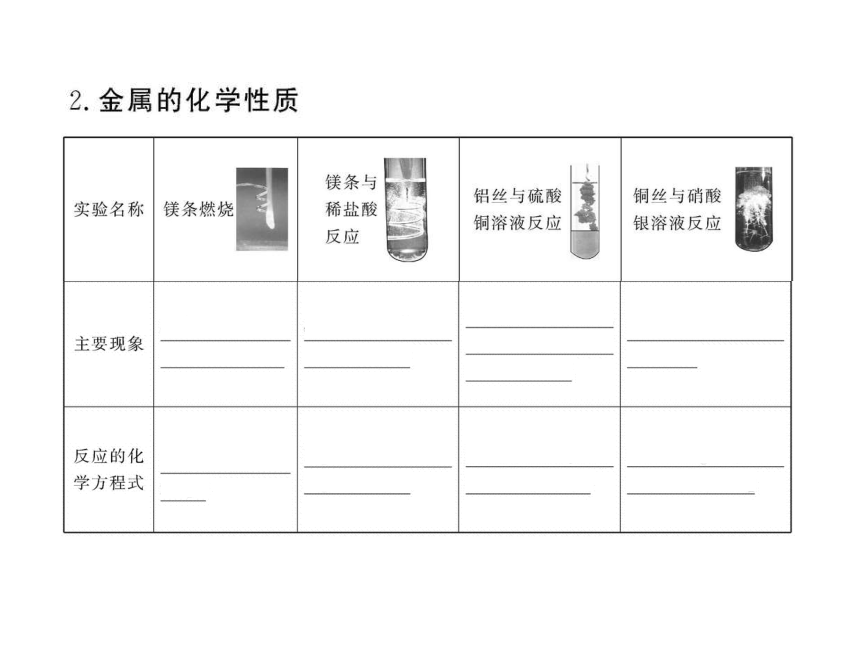
知识点一:金属的通性
1.能正确描述金属通性的是( )
A.具有金属光泽 B.常温下都是固体
C.具有高熔点 D.具有强还原性
【解析】选A。金属汞在常温下为液态,是熔点最低的金属;在金属的活动性顺序表中,前面的金属活动性强,而排在后面的金属活动性差,如金、银、铂等金属的活动性较差,还原性差。
知识点二:金属与氧气的反应
2.(双选)下列关于金属Na的叙述中,说法正确的
是( )
A.Na在空气中燃烧,发出黄色火焰
B.Na在空气中燃烧,产物是Na2O
C.Na是银白色金属,硬度大,熔点高
D.Na、K合金可作原子反应堆的导热剂
【解析】选A、D。钠的焰色反应呈黄色,钠燃烧时发出黄色火焰;钠在空气中燃烧的产物是过氧化钠而不是氧化钠;钠的硬度较小,熔点较低;钠钾合金呈液态,是原子反应堆的导热剂。
3.钠露置在空气中,其变质过程中不可能产生的物质是( )
A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
【解析】选D。Na露置在空气中的变化过程为Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3,不可能会有NaHCO3生成。
4.铝制器皿不易腐蚀的原因是( )
A.铝不易发生化学反应
B.铝不易被氧化
C.铝的氧化物容易发生还原反应
D.铝易被氧化,但氧化生成的氧化铝具有保护内部铝的作用
【解析】选D。铝是一种较活泼的金属,在常温下,铝能与空气里的氧气反应,生成一层致密而坚固的氧化物薄膜,从而保护内部的金属Al不被继续氧化。
5.用金属钠制取Na2O通常采用以下方法:2NaNO2+6Na===4Na2O+N2↑,不用钠在氧气中燃烧的方法制取Na2O的原因是_______________________。
【解析】钠的性质活泼,与O2在燃烧条件下反应生成Na2O2无法制得Na2O;用上述方法制取时除了得到Na2O外,得到的N2还可以保护Na2O不被氧化。
答案:钠在氧气中燃烧会生成过氧化钠,因此不用钠在氧气中燃烧的方法制取氧化钠,而用Na与NaNO2反应的方法制取,生成的氮气同时可起保护的作用
一、选择题(本题包括5个小题,每小题4分,共20分)
1.从利用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是( )
①地壳中的金属元素的含量 ②金属活动性顺序
③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A.①③ B.②⑤ C.③⑤ D.②④
【解析】选D。从活泼性看Al>Fe>Cu,铝的活泼性最强,其离子最难被还原,冶炼相对困难。
2.(双选)下列关于金属铝的叙述中,说法不正确的是( )
A.Al是地壳中含量最多的元素
B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.铝箔在空气中受热可以熔化,且发生剧烈燃烧
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落
【解析】选A、C。铝是地壳中含量最多的金属元素,不是地壳中含量最多的元素;铝箔在空气中加热不能燃烧。所以A、C不正确。
3.下列描述的一定是金属元素的是( )
A.易失去电子的物质
B.能与酸反应的物质
C.原子的最外层电子层只有1个电子的元素
D.原子核内有11个质子的元素
【解析】选D。易失电子的物质和能与酸反应的物质可能是化合物也可能是离子(或原子团),故A、B错。H原子最外层只有1个电子但氢元素是非金属元素,故C错。原子核内有11个质子的元素只能是钠元素,属于金属元素,故D对。
4.下列有关钠离子与钠原子的叙述中,不正确的
是( )
A.原子核内所含质子数目相同
B.含钠离子的溶液无色,而钠原子聚集呈银白色
C.钠离子和钠原子相差一个电子层
D.钠离子与钠原子均具有较强的还原性
【解析】选D。钠原子失去一个电子后成为钠离子,所以两者的质子数相同,而电子层则相差一层。失去电子后,钠离子达到最外层8电子的稳定结构,所以钠原子有强还原性但钠离子很稳定,没有还原性。
5.下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气还是纯氧中都不会燃烧
【解析】选C。Na与O2的反应产物是由反应条件决定的,常温下生成Na2O,点燃时生成Na2O2,与O2的用量无关,A错误;铝箔在空气中受热可熔化,但由于表面形成熔点很高的Al2O3,故不会燃烧,B错;铁丝可在纯氧中燃烧生成Fe3O4,D项错误;金属与非金属单质反应时,只能失电子被氧化,C正确。
二、非选择题(本题包括1个小题,共10分)
6.根据你对金属钠性质的了解,回答下列问题。
(1)关于钠的叙述中,正确的是______。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的_____、_____等物质反应,通常将它保存在____里,以使它与_____、_______等隔绝。
【解析】本题考查钠的有关性质。通过外观的观察和钠与水反应的实验现象可知,钠的物理性质有:银白色、密度小,熔、沸点低、质地柔软、能导电、导热等,作为活泼的金属,钠易与非金属单质O2、水发生化学反应。
(1)A选项中有关钠硬度的描述不正确;C选项中有关钠在空气中燃烧的产物说法有误;D选项中有关金属钠熔点的描述不符合事实。只有B项正确。
(2)由于金属钠很活泼,很容易跟空气中的氧气、水蒸气等物质反应,因此保存时应隔绝空气,通常保存在煤油里,这是因为钠的密度大于煤油的密度且钠与煤油不反应,钠在煤油中沉在底部而避免了与空气的接触。
答案:(1)B (2)氧气 水蒸气 煤油 氧气 水蒸气
1.(6分)镁、铝、铁三种金属单质中的两种组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气2.8 L,由此可判断混合物中必定含有( )
A.Fe B.Mg C.Al D.无法判断
【解析】
2.(14分)金属活动性顺序是学习化学的重要工具,在工农业生产和科学研究中有重要应用。常见的金属活动性顺序如下:
(1)解释不能用铁制容器配制硫酸铜溶液的原因(用化学方程式表示):____________________;
(2)验证镁比锌的金属活动性强,应选用的溶液是____________;
(3)从金属活动性顺序中你还能获得哪些信息?(写出一条即可):_____________________________
___________________________________________。
【解析】本题考查对金属活动性顺序的意义及应用的理解。
(1)因在金属活动性顺序中,Fe排在Cu的前面因而Fe能与CuSO4溶液反应,从而造成容器损坏和CuSO4的变质。
(2)可借助镁、锌分别与酸反应,镁比锌更剧烈或镁能与锌盐溶液反应置换出锌等方法,验证镁比锌活泼。
(3)可从金属活动性顺序的含义或应用等方面说明。
答案:(1)Fe+CuSO4====Cu+FeSO4
(2)稀盐酸(或稀硫酸、氯化锌等可溶性锌盐溶液)
(3)位于氢前面的金属能置换出酸中的氢(或金属的位置越靠前,它的活动性越强,位于前面的金属可以把位于后面的金属从它们的盐溶液中置换出来等)
【典例1】下列有关金属元素特征的叙述正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属元素的单质在常温下均为固体
【思路点拨】解答本题要考虑金属元素性质中的共性与特例。
【自主解答】选B。
【典例2】等质量的两块钠,第一块在足量氧气中加热,第二块与足量氧气(常温)充分反应,则下列说法正确的是
A.第一块钠失去电子数多
B.两块钠失去电子数一样多
C.第二块钠的反应产物质量较大
D.两块钠的反应产物质量一样大
【思路点拨】解答本题要明确钠与氧气在不同条件下反应的产物不一样。
【自主解答】选B。根据电荷守恒,不论燃烧还是缓
慢氧化,最终都是Na→Na,故二者失去的电子数一样
多;但燃烧时生成Na2O2,而常温时生成Na2O,故第一
块钠反应的产物质量大。
+1
0
知识点一:金属的通性
1.能正确描述金属通性的是( )
A.具有金属光泽 B.常温下都是固体
C.具有高熔点 D.具有强还原性
【解析】选A。金属汞在常温下为液态,是熔点最低的金属;在金属的活动性顺序表中,前面的金属活动性强,而排在后面的金属活动性差,如金、银、铂等金属的活动性较差,还原性差。
知识点二:金属与氧气的反应
2.(双选)下列关于金属Na的叙述中,说法正确的
是( )
A.Na在空气中燃烧,发出黄色火焰
B.Na在空气中燃烧,产物是Na2O
C.Na是银白色金属,硬度大,熔点高
D.Na、K合金可作原子反应堆的导热剂
【解析】选A、D。钠的焰色反应呈黄色,钠燃烧时发出黄色火焰;钠在空气中燃烧的产物是过氧化钠而不是氧化钠;钠的硬度较小,熔点较低;钠钾合金呈液态,是原子反应堆的导热剂。
3.钠露置在空气中,其变质过程中不可能产生的物质是( )
A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
【解析】选D。Na露置在空气中的变化过程为Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3,不可能会有NaHCO3生成。
4.铝制器皿不易腐蚀的原因是( )
A.铝不易发生化学反应
B.铝不易被氧化
C.铝的氧化物容易发生还原反应
D.铝易被氧化,但氧化生成的氧化铝具有保护内部铝的作用
【解析】选D。铝是一种较活泼的金属,在常温下,铝能与空气里的氧气反应,生成一层致密而坚固的氧化物薄膜,从而保护内部的金属Al不被继续氧化。
5.用金属钠制取Na2O通常采用以下方法:2NaNO2+6Na===4Na2O+N2↑,不用钠在氧气中燃烧的方法制取Na2O的原因是_______________________。
【解析】钠的性质活泼,与O2在燃烧条件下反应生成Na2O2无法制得Na2O;用上述方法制取时除了得到Na2O外,得到的N2还可以保护Na2O不被氧化。
答案:钠在氧气中燃烧会生成过氧化钠,因此不用钠在氧气中燃烧的方法制取氧化钠,而用Na与NaNO2反应的方法制取,生成的氮气同时可起保护的作用
一、选择题(本题包括5个小题,每小题4分,共20分)
1.从利用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是( )
①地壳中的金属元素的含量 ②金属活动性顺序
③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A.①③ B.②⑤ C.③⑤ D.②④
【解析】选D。从活泼性看Al>Fe>Cu,铝的活泼性最强,其离子最难被还原,冶炼相对困难。
2.(双选)下列关于金属铝的叙述中,说法不正确的是( )
A.Al是地壳中含量最多的元素
B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.铝箔在空气中受热可以熔化,且发生剧烈燃烧
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落
【解析】选A、C。铝是地壳中含量最多的金属元素,不是地壳中含量最多的元素;铝箔在空气中加热不能燃烧。所以A、C不正确。
3.下列描述的一定是金属元素的是( )
A.易失去电子的物质
B.能与酸反应的物质
C.原子的最外层电子层只有1个电子的元素
D.原子核内有11个质子的元素
【解析】选D。易失电子的物质和能与酸反应的物质可能是化合物也可能是离子(或原子团),故A、B错。H原子最外层只有1个电子但氢元素是非金属元素,故C错。原子核内有11个质子的元素只能是钠元素,属于金属元素,故D对。
4.下列有关钠离子与钠原子的叙述中,不正确的
是( )
A.原子核内所含质子数目相同
B.含钠离子的溶液无色,而钠原子聚集呈银白色
C.钠离子和钠原子相差一个电子层
D.钠离子与钠原子均具有较强的还原性
【解析】选D。钠原子失去一个电子后成为钠离子,所以两者的质子数相同,而电子层则相差一层。失去电子后,钠离子达到最外层8电子的稳定结构,所以钠原子有强还原性但钠离子很稳定,没有还原性。
5.下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气还是纯氧中都不会燃烧
【解析】选C。Na与O2的反应产物是由反应条件决定的,常温下生成Na2O,点燃时生成Na2O2,与O2的用量无关,A错误;铝箔在空气中受热可熔化,但由于表面形成熔点很高的Al2O3,故不会燃烧,B错;铁丝可在纯氧中燃烧生成Fe3O4,D项错误;金属与非金属单质反应时,只能失电子被氧化,C正确。
二、非选择题(本题包括1个小题,共10分)
6.根据你对金属钠性质的了解,回答下列问题。
(1)关于钠的叙述中,正确的是______。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的_____、_____等物质反应,通常将它保存在____里,以使它与_____、_______等隔绝。
【解析】本题考查钠的有关性质。通过外观的观察和钠与水反应的实验现象可知,钠的物理性质有:银白色、密度小,熔、沸点低、质地柔软、能导电、导热等,作为活泼的金属,钠易与非金属单质O2、水发生化学反应。
(1)A选项中有关钠硬度的描述不正确;C选项中有关钠在空气中燃烧的产物说法有误;D选项中有关金属钠熔点的描述不符合事实。只有B项正确。
(2)由于金属钠很活泼,很容易跟空气中的氧气、水蒸气等物质反应,因此保存时应隔绝空气,通常保存在煤油里,这是因为钠的密度大于煤油的密度且钠与煤油不反应,钠在煤油中沉在底部而避免了与空气的接触。
答案:(1)B (2)氧气 水蒸气 煤油 氧气 水蒸气
1.(6分)镁、铝、铁三种金属单质中的两种组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气2.8 L,由此可判断混合物中必定含有( )
A.Fe B.Mg C.Al D.无法判断
【解析】
2.(14分)金属活动性顺序是学习化学的重要工具,在工农业生产和科学研究中有重要应用。常见的金属活动性顺序如下:
(1)解释不能用铁制容器配制硫酸铜溶液的原因(用化学方程式表示):____________________;
(2)验证镁比锌的金属活动性强,应选用的溶液是____________;
(3)从金属活动性顺序中你还能获得哪些信息?(写出一条即可):_____________________________
___________________________________________。
【解析】本题考查对金属活动性顺序的意义及应用的理解。
(1)因在金属活动性顺序中,Fe排在Cu的前面因而Fe能与CuSO4溶液反应,从而造成容器损坏和CuSO4的变质。
(2)可借助镁、锌分别与酸反应,镁比锌更剧烈或镁能与锌盐溶液反应置换出锌等方法,验证镁比锌活泼。
(3)可从金属活动性顺序的含义或应用等方面说明。
答案:(1)Fe+CuSO4====Cu+FeSO4
(2)稀盐酸(或稀硫酸、氯化锌等可溶性锌盐溶液)
(3)位于氢前面的金属能置换出酸中的氢(或金属的位置越靠前,它的活动性越强,位于前面的金属可以把位于后面的金属从它们的盐溶液中置换出来等)
