共价键 示例2
图片预览








文档简介
(共34张PPT)
第一节 共价键
第二章 分子结构与性质
【温故】
1.用电子式表示H2、HCl、Cl2分子的形成过程。
2.写出H、Cl 、N的外围电子排布式
教学目标
一、认识共价键的本质及特征
二、能区分σ键和π键的成键方式及
各自特征
三、掌握判断σ键和π键的一般规律
(二)不可能形成H3、H2Cl和Cl3分子,为什么?
这说明共价键有_____性,这是共价键的一个特
征。
(一)从上题总结共价键的本质为:
在原子之间形成共用电子对
【知新】
饱和
探究练习
1、s电子的原子轨道呈____形,p电子的原子轨道呈____形。
2、H的未成对电子位于____能级,Cl的未成对电子位于____能级,故形成H—H键时为两个____电子的____形电子云重叠, Cl—Cl键为两个____电子的____形电子云重叠,而H—Cl键则为一个___形电子云和一个___形电子云重叠。
球
纺锤
1S
3P
1S
球
3P
纺锤
球
纺锤
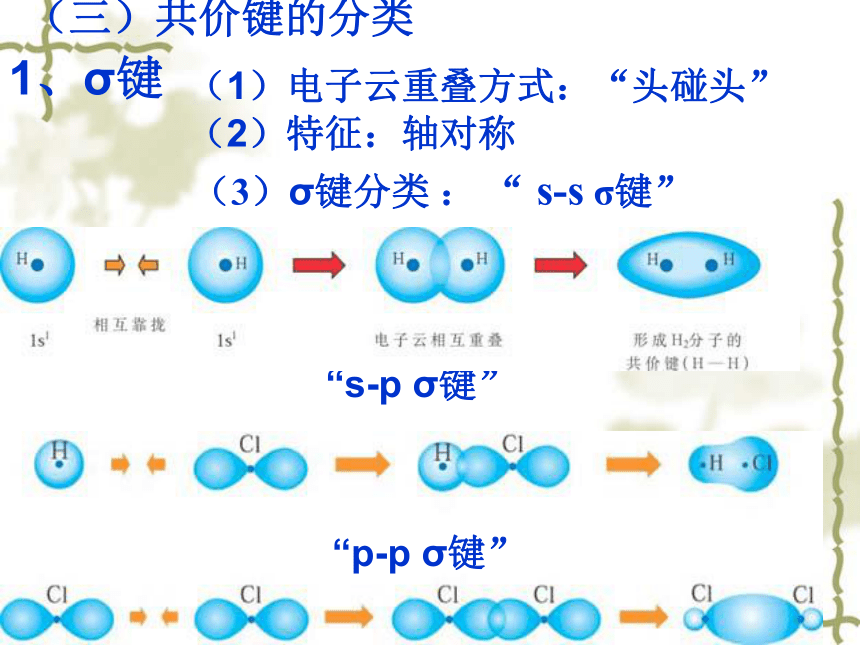
(三)共价键的分类
(3)σ键分类 : “ s-s σ键”
“s-p σ键”
“p-p σ键”
1、σ键
(1)电子云重叠方式:“头碰头”
(2)特征:轴对称
σ键的类型:
(1) “ s-s σ键”:如H2分子 动画
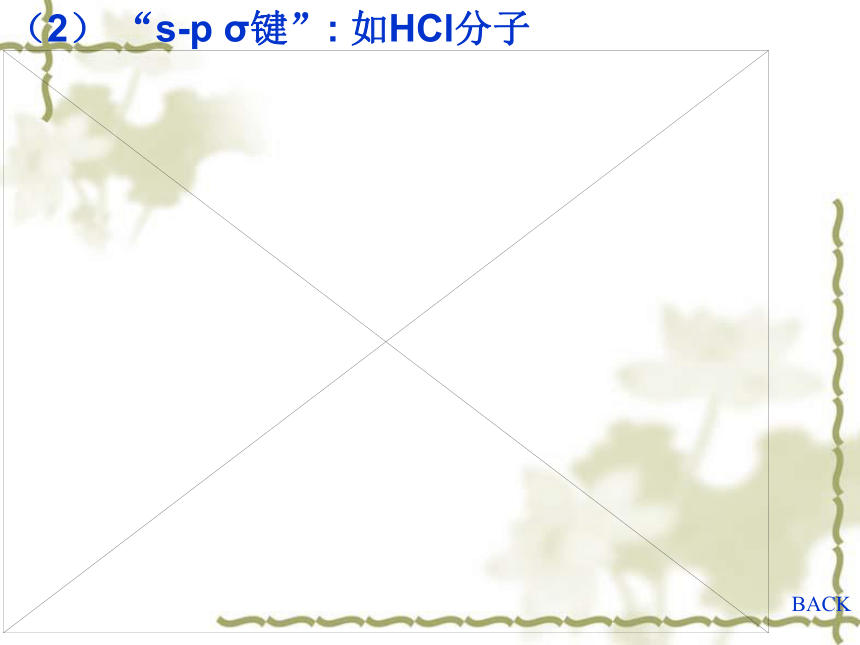
(2) “s-p σ键”: 如HCl分子 动画
(3) “p-p σ键”:如Cl2分子 动画
(1) “ s-s σ键”:如H2分子
BACK
(2) “s-p σ键”: 如HCl分子
BACK
(3) “p-p σ键”:如Cl2分子
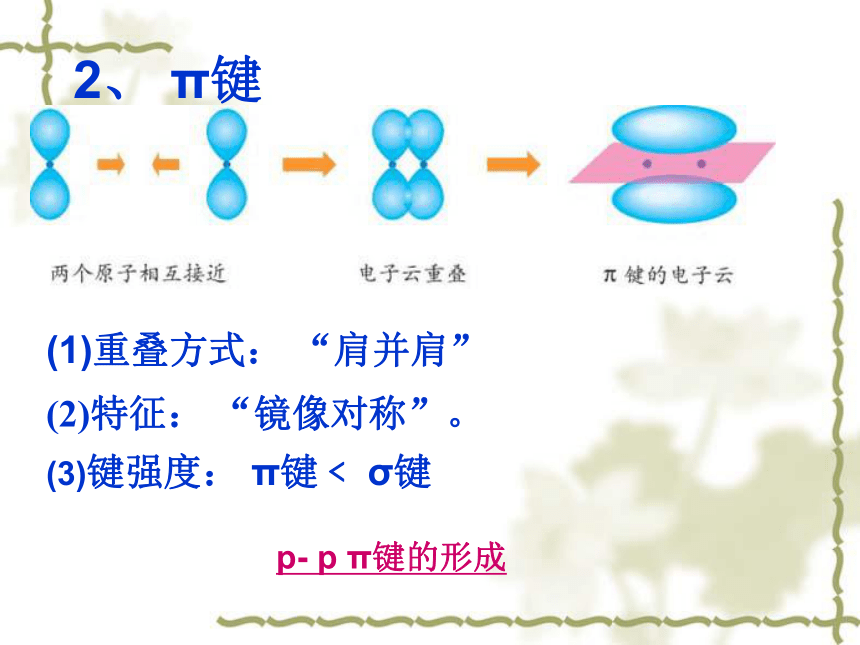
p- p π键的形成
(2)特征: “镜像对称”。
2、 π键
(1)重叠方式: “肩并肩”
(3)键强度: π键﹤ σ键
p- p π键的形成, 如氮分子中均含有p- p π键。
【σ键和π键判断规律】
共价单键是σ键 ;而共价双键中有一个是σ键,另一个是π键;共价三键由一个σ键 和两个π键组成。
键型项目
σ键
π键
成键方向
“头碰头”
“肩并肩”
电子云形状 轴对称 镜像对称
牢固程度 键强度大,不易断裂 x键强度较小,容易断裂
成键判断规律 共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键
小结
探究练习
1.乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
乙烷:7个σ键 乙烯 :5个σ键一个π键 乙炔:3个σ键两个π键
2、钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗 讨论后请填表。
3、已知氮分子的共价键是三键(N三N),你能画出电子云图像及空间几何图形来描述吗
(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键)
[交流汇报
目标检测:
1.乙烯与乙炔分子与溴发生加成反应时,断裂哪种类型的键?
2.下列物质分子中无π键的是( )
A.N2 B.O2 C.Cl2 D.C2H4
p- p π键的形成 动画
(2)π键:形成共价π键的电子云有两块组成,分别位于由两个原子构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征成为镜像对称。
特点:“肩并肩” ;π键的重叠程度小于σ键,所以π键不如σ键牢固,比较容易断裂。π键类型较多,在此不作介绍。
科学探究:课本P32
氮气的化学性质很不活拨,通常难与其他
物质发生发生化学反应。请写出氮分子的
电子式和结构式。
讨论:分析氮分子中氮原子的原子轨道是如何
重叠形成共价键的?
自己完成科学探究2和3提出的问题。
总结
1.价键理论
原子轨道相互重叠形成的σ键 π键总称价键轨道,是分子结构的价键理论中最基本的组成部分。
2.共价键类型的判断
共价单键是σ键 (H2、Cl2、CH4);而共价双键中有一个是σ键,另一个是π键(如C=C);共价三键由一个σ键 和两个π键组成C≡C。
练习
1.乙烯与乙炔分子与溴发生加成反应时,断裂哪种类型的键?为什么?
2.下列物质分子中无π键的是( )
A.N2 B.O2 C.Cl2 D.C2H4
[知识回顾]
1、化学反应伴随着能量变化;
2、当物质发生化学反应时,断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量;化学键的断裂和形成正是化学反应中能量变化的主要原因;
吸收能量
放出能量
3、电离能 原子失去电子要吸收能量;
二、键参数
1、键能:气态基态原子形成1mol化学键释放的最低能量。
键 键能/kj·mol-1 键 键能/kj·mol-1
H—H 436.0 N≡N 946
F—F 157 N—O 176
Cl—Cl 242.7 N=O 607
键能越大,即形成化学键时放出的能量越多,说明这个化学键越稳定,越不容易被打断。是衡量共价键稳定的参数之一。
[例题]
根据表2-1数据,计算1molH2分别跟1molCl2、1molBr2(蒸气)反应,分别生成2molHCl和2molHBr分子,哪个反应放出的能量多?
H2 + Cl2 = 2HCl
ΔH=436.0Kj·mol-1 + 242.7Kj·mol-1 —2×431.8Kj·mol-1 = —184.9Kj
H2 + Br2 = 2HBr
ΔH=436.0Kj·mol-1 + 193.7Kj·mol-1 —2×366Kj·mol-1 = —102.7Kj
ΔH为负值说明该反应为放热反应。即负值越大,放出能量越多。通过刚才计算,可知,生成2molHCl比生成2molHBr放出能量多。相反,H—Br的键能比H—Cl的键能小,所以HBr分子比HCl更容易发生热分解生成相应的单质。说明稳定性比HCl差。
[练习]、
以下化学键的键能(KJ·mol-1):
P—P 198 P—O 360 O=O 498 P=O 585
根据这些数据,计算以下反应的反应热ΔH?
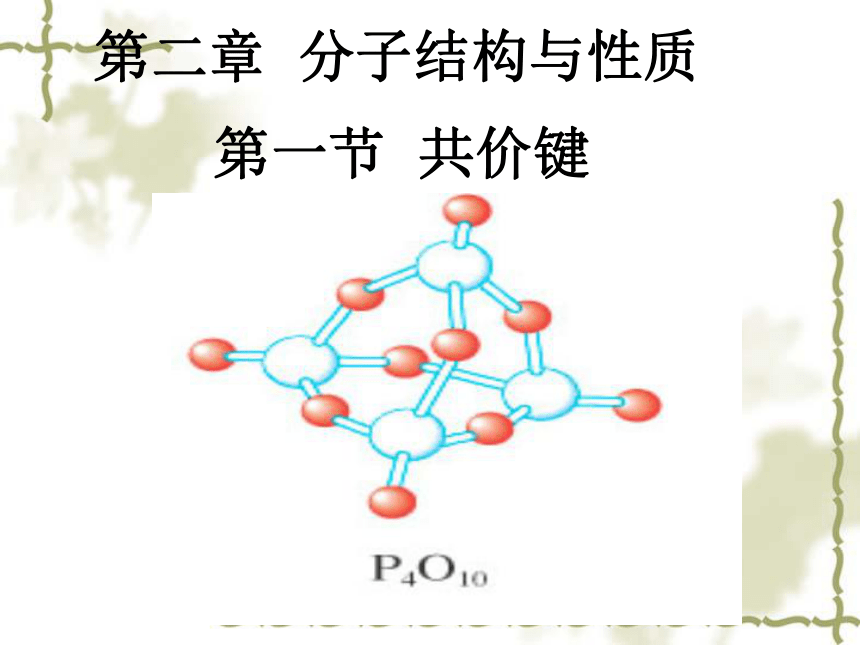
P4 (白磷)+ 5O2 = P4O10 + ΔH
[提示]白磷是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子。
ΔH= 6×198 KJ·mol-1 +5×498 KJ·mol-1—12×360 KJ·mol-1—4×585 KJ·mol-1 =—2982 KJ
2、键长:形成共价键的两个原子之间的核间距。
键 键长/Pm 键 键长/Pm
H—H 74 C=C 120
F—F 141 C—H 109
Cl—Cl 198 O—H 96
键长越短,键能越大,表明共价键越稳定。是衡量共价键稳定性的另一个参数。
3、键角:两个共价键之间的夹角称为键角。
例:三原子分子CO2 (O=C=O)键角为180°,是一种直线型分子。
三原子分子H2O (H—O—H)键角为105°,是一种角形分子。(V形)
键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质与键角有关。
[问]键长、键能对分子的化学性质有什么影响?
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
[观察]P35页中表2-3的数据
从表中可以看出,CO分子与N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子数,导致它们具有相似的化学结构。
三、等电子原理
1.等电子原理 原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相似的。
2.互为等电子体应该满足的条件
①在微粒的组成上,微粒所含原子数目相同②在微粒的构成上,微粒所含电子数目相同③在微粒的结构上,微粒中原子的空间排列方式相同。
[练习]
原子数相同,最外层电子总数相同的分子,互称为等电子体。等电子体的结构相似,物理性质相似。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:
和 和 。
(2)等电子原理又有发展,例如:由短周期元素组成的物质中,与NO2-互为等电子体的分子有 、 。
N2O
CO2
N2
CO
SO2
O3
第一节 共价键
第二章 分子结构与性质
【温故】
1.用电子式表示H2、HCl、Cl2分子的形成过程。
2.写出H、Cl 、N的外围电子排布式
教学目标
一、认识共价键的本质及特征
二、能区分σ键和π键的成键方式及
各自特征
三、掌握判断σ键和π键的一般规律
(二)不可能形成H3、H2Cl和Cl3分子,为什么?
这说明共价键有_____性,这是共价键的一个特
征。
(一)从上题总结共价键的本质为:
在原子之间形成共用电子对
【知新】
饱和
探究练习
1、s电子的原子轨道呈____形,p电子的原子轨道呈____形。
2、H的未成对电子位于____能级,Cl的未成对电子位于____能级,故形成H—H键时为两个____电子的____形电子云重叠, Cl—Cl键为两个____电子的____形电子云重叠,而H—Cl键则为一个___形电子云和一个___形电子云重叠。
球
纺锤
1S
3P
1S
球
3P
纺锤
球
纺锤
(三)共价键的分类
(3)σ键分类 : “ s-s σ键”
“s-p σ键”
“p-p σ键”
1、σ键
(1)电子云重叠方式:“头碰头”
(2)特征:轴对称
σ键的类型:
(1) “ s-s σ键”:如H2分子 动画
(2) “s-p σ键”: 如HCl分子 动画
(3) “p-p σ键”:如Cl2分子 动画
(1) “ s-s σ键”:如H2分子
BACK
(2) “s-p σ键”: 如HCl分子
BACK
(3) “p-p σ键”:如Cl2分子
p- p π键的形成
(2)特征: “镜像对称”。
2、 π键
(1)重叠方式: “肩并肩”
(3)键强度: π键﹤ σ键
p- p π键的形成, 如氮分子中均含有p- p π键。
【σ键和π键判断规律】
共价单键是σ键 ;而共价双键中有一个是σ键,另一个是π键;共价三键由一个σ键 和两个π键组成。
键型项目
σ键
π键
成键方向
“头碰头”
“肩并肩”
电子云形状 轴对称 镜像对称
牢固程度 键强度大,不易断裂 x键强度较小,容易断裂
成键判断规律 共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键
小结
探究练习
1.乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
乙烷:7个σ键 乙烯 :5个σ键一个π键 乙炔:3个σ键两个π键
2、钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗 讨论后请填表。
3、已知氮分子的共价键是三键(N三N),你能画出电子云图像及空间几何图形来描述吗
(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键)
[交流汇报
目标检测:
1.乙烯与乙炔分子与溴发生加成反应时,断裂哪种类型的键?
2.下列物质分子中无π键的是( )
A.N2 B.O2 C.Cl2 D.C2H4
p- p π键的形成 动画
(2)π键:形成共价π键的电子云有两块组成,分别位于由两个原子构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征成为镜像对称。
特点:“肩并肩” ;π键的重叠程度小于σ键,所以π键不如σ键牢固,比较容易断裂。π键类型较多,在此不作介绍。
科学探究:课本P32
氮气的化学性质很不活拨,通常难与其他
物质发生发生化学反应。请写出氮分子的
电子式和结构式。
讨论:分析氮分子中氮原子的原子轨道是如何
重叠形成共价键的?
自己完成科学探究2和3提出的问题。
总结
1.价键理论
原子轨道相互重叠形成的σ键 π键总称价键轨道,是分子结构的价键理论中最基本的组成部分。
2.共价键类型的判断
共价单键是σ键 (H2、Cl2、CH4);而共价双键中有一个是σ键,另一个是π键(如C=C);共价三键由一个σ键 和两个π键组成C≡C。
练习
1.乙烯与乙炔分子与溴发生加成反应时,断裂哪种类型的键?为什么?
2.下列物质分子中无π键的是( )
A.N2 B.O2 C.Cl2 D.C2H4
[知识回顾]
1、化学反应伴随着能量变化;
2、当物质发生化学反应时,断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量;化学键的断裂和形成正是化学反应中能量变化的主要原因;
吸收能量
放出能量
3、电离能 原子失去电子要吸收能量;
二、键参数
1、键能:气态基态原子形成1mol化学键释放的最低能量。
键 键能/kj·mol-1 键 键能/kj·mol-1
H—H 436.0 N≡N 946
F—F 157 N—O 176
Cl—Cl 242.7 N=O 607
键能越大,即形成化学键时放出的能量越多,说明这个化学键越稳定,越不容易被打断。是衡量共价键稳定的参数之一。
[例题]
根据表2-1数据,计算1molH2分别跟1molCl2、1molBr2(蒸气)反应,分别生成2molHCl和2molHBr分子,哪个反应放出的能量多?
H2 + Cl2 = 2HCl
ΔH=436.0Kj·mol-1 + 242.7Kj·mol-1 —2×431.8Kj·mol-1 = —184.9Kj
H2 + Br2 = 2HBr
ΔH=436.0Kj·mol-1 + 193.7Kj·mol-1 —2×366Kj·mol-1 = —102.7Kj
ΔH为负值说明该反应为放热反应。即负值越大,放出能量越多。通过刚才计算,可知,生成2molHCl比生成2molHBr放出能量多。相反,H—Br的键能比H—Cl的键能小,所以HBr分子比HCl更容易发生热分解生成相应的单质。说明稳定性比HCl差。
[练习]、
以下化学键的键能(KJ·mol-1):
P—P 198 P—O 360 O=O 498 P=O 585
根据这些数据,计算以下反应的反应热ΔH?
P4 (白磷)+ 5O2 = P4O10 + ΔH
[提示]白磷是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子。
ΔH= 6×198 KJ·mol-1 +5×498 KJ·mol-1—12×360 KJ·mol-1—4×585 KJ·mol-1 =—2982 KJ
2、键长:形成共价键的两个原子之间的核间距。
键 键长/Pm 键 键长/Pm
H—H 74 C=C 120
F—F 141 C—H 109
Cl—Cl 198 O—H 96
键长越短,键能越大,表明共价键越稳定。是衡量共价键稳定性的另一个参数。
3、键角:两个共价键之间的夹角称为键角。
例:三原子分子CO2 (O=C=O)键角为180°,是一种直线型分子。
三原子分子H2O (H—O—H)键角为105°,是一种角形分子。(V形)
键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质与键角有关。
[问]键长、键能对分子的化学性质有什么影响?
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
[观察]P35页中表2-3的数据
从表中可以看出,CO分子与N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子数,导致它们具有相似的化学结构。
三、等电子原理
1.等电子原理 原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相似的。
2.互为等电子体应该满足的条件
①在微粒的组成上,微粒所含原子数目相同②在微粒的构成上,微粒所含电子数目相同③在微粒的结构上,微粒中原子的空间排列方式相同。
[练习]
原子数相同,最外层电子总数相同的分子,互称为等电子体。等电子体的结构相似,物理性质相似。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是:
和 和 。
(2)等电子原理又有发展,例如:由短周期元素组成的物质中,与NO2-互为等电子体的分子有 、 。
N2O
CO2
N2
CO
SO2
O3
