《物质结构与性质》内容分析与教学建议
图片预览











文档简介
(共49张PPT)
《物质结构与性质》
内容分析与教学建议
高中化学(选修ⅠB)
遂昌中学 周开雄
本模块学习的意义与价值
1、从微观本质的角度理解物质的性质,促进学生对其它模块中很多遗留的问题的深入理解,促进学生对化学学科特色更深层次的理解。
例如:更好地理解自然界物质性质的多样性
(1)熔、沸点的高低;(2)硬度的大小
(3)导电性差异; (4)溶解性
2、让学生在理解世界是物质的基础上,感受到世界也是能量的。
例如:相比于《化学2》中必修内容,本模块专题三的学习十分突出从能量的视角认识世界。
(1)金属键与原子化热;
(2)离子键与晶格能
(3)共价键与键能
本模块学习的意义与价值
3、让学生的思维得到更充分的锻炼。对学生更多的感受化学是在原子、分子、离子水平上研究物质结构的奥秘
例如:抽象是本模块一大特点
(1)各类化学键或晶体模型的微观想象
(2)从图表数据提取信息,抽象分析
本模块学习的意义与价值
4、从外省实施情况看,该模块相比于化学与技术等模块容易得分,因此学生选修的人数和比例很高。而且也为将来选择化学类的学生更好的适应大学学习。
本模块学习的意义与价值
5、对教师本身的专业水平的提升提供机会。
例如:
(1)对疑难化学问题的理解
(2)从基于“化学实验”的实验科学的教学模式到基于“模型”的理论化学的教学模式的转变
(3)如何借助更多的教学方式让学生能更好的理解(如晶体模型,图片、动画、比喻等)
(4)如何运用已有知识,设计问题让学生用结构的知识去解释
本模块学习的意义与价值
※ 教 材 分 析
※ 教学方法建议
※ 课 程 标 准
※ 高考试题赏析
新课程标准中关于本模块内容要求的4
个一级主题:
主题1 原子结构与元素性质
主题2 化学键与物质的性质
主题3 分子间作用力与物质的性质
主题4 研究物质结构的价值
一、课程标准:
物质结构理论是现代化学的重要组成部分,也是医学、生命科学,材料科学、环境科学、能源科学、信息科学的重要基础。它揭示了物质构成的奥秘。物质结构与性质的关系,有助于人们理解物质变化的本质,预测物质的性质,为分子设计提供科学依据。 在本课程模块中,我们将从原子、分子水平上认识物质构成的规律,以微粒之间不同的作用力为线索,侧重研究不同类型物质的有关性质,帮助高中学生进一步丰富物质结构的知识,提高分析问题和解决问题的能力。 通过本课程模块的学习,学生应主要在以下几个方面得到发展: 1.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣; 2.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系; 3.能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质; 4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
一、课程标准:
本模块的作用
本模块的内容和教学要求
本模块的
课程目标
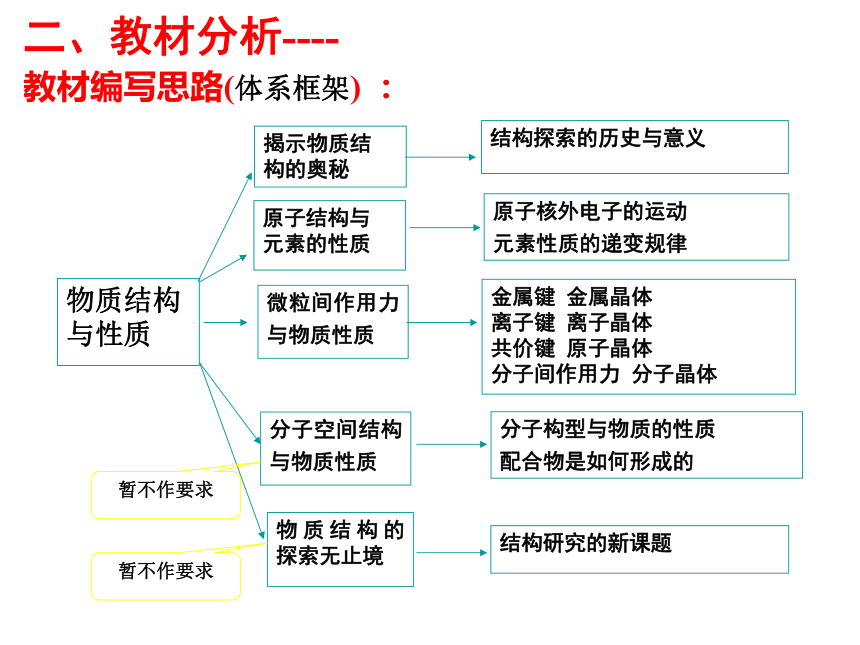
二、教材分析----
教材编写思路(体系框架) :
物质结构
与性质
揭示物质结
构的奥秘
微粒间作用力与物质性质
物质结构的探索无止境
结构探索的历史与意义
金属键 金属晶体
离子键 离子晶体
共价键 原子晶体
分子间作用力 分子晶体
结构研究的新课题
原子结构与
元素的性质
原子核外电子的运动
元素性质的递变规律
分子空间结构与物质性质
分子构型与物质的性质
配合物是如何形成的
暂不作要求
暂不作要求
本模块主要线索是原子核外电子的排布→微粒间的相互作用→晶体结构,整个教材主次分明;每一专题又突出结构与性质的关系,使教材有血有肉,丰富多彩。
1.本教材设置多样化的栏目,转变学生的
学习方式
通过阅读这些内容生动的栏目,学生遵循栏目的提示,明确自我学习的方向,获得自主学习化学的思想和方法,进一步激发了学生学习这门课程的兴趣。同时,在教师和学生之间,更突出了以学生为课堂的主体,让学生体验到不同的学习方式,增强师生之间以及教材与学生之间的互动,同时提高了学习的效果。
编者在编写教材时根据高中生的特点穿插了丰富的图片,增加了理论知识的趣味性,唤起学生的求知欲.
假说:依据实验事实提出原子结构模型
分析归纳:电子对互斥理论的提出
模型化:研究金属晶体中原子的密堆积
统计方法:核外电子运动特征的描述
2.本教材设置丰富的插图,激发学生的学习动机
3. 本教材编排多样化的习题,注重实践性探究.
培养学生解决问题的能力习题的编排在教材编写中占有很重要的地位。通过多样化的习题可以培养学生多方面的能力,同时学生解决问题的程度也能反映出学生掌握知识,运用知识的程度。新教材中习题的编排数量不多,但是形式多样,综合性强,不仅有适量的巩固性习题用以评价学生掌握基础知识的情况,还出现了如调查报告、小论文、查阅资料等实践性题型。这些新题型的出现既突出了新课程的理念以提高学生科学素养为主旨,又使学生能够在知识与技能、过程与方法、情感态度与价值观各方面取得相应的发展。
4.必修与选修模块内容衔接的较好
选修模块:比较深刻从三个层次认识物质结构、结构与性质的关系。
1。为什么说“物质的元素组成、分子结构晶体结构都是决定物质性质的重要因素?
2。不同元素的原子结构的相似性与差异为什么会影响物质的性质?
3。物质中微粒间作用力类型与物质性质有什么关系?
4。分子结构怎样影响物质的性质?
必修模块:提供结构与性质关系的感性知识与初浅的解释:如,卤素(碱金属)单质性质的相似与差异;碳、氧单质的同素异形现象;乙醇、二甲醚等同分异构现象;干冰、石英等不同类型晶体性质差异 等等。
1、物质结构的探索历程与研究价值(专题1)
专题1 揭示物质结构的奥秘(绪言)
从人类探索性质结构的历程中了解人类研究物质结构的常用方法(理论研究、实验研究、假说、模型等)、取得进展的缘由。
了解人类研究物质结构的意义,所取得的成果在科学发展和社会进步中的积极作用,激发对“物质结构与性质”学习的自主性和积极性。
二、教材分析----
教材编写思路(具体分析) :
编写思路
创设问题情景
你是否想过:物质是由什么构成的?为什么物质会发生变化?为什么不同的物质具有不同的性能?如何才能获得优异性能的新物质?
从探索历程了解研究方法
原子分子论 元素周期律
碳的价键 量子力学
假说法 经验归纳法 实验验证法
了解研究成果的作用激发学习兴趣
合成化学 生命科学
2、从三个层次认识物质结构与性质的关系(专题2-3)
内容 结构知识 性质知识 结构性质关系
原子结构与元素性质 原子结构模型的演变,主族元素核外电子排布规律、结构示意图 元素性质(金属性、非金属性、主要化合价、成键类型)的周期性变化—具体表现与规律 性质周期性变化的本质;主族元素原子结构、(非)金属性、 主要化合价、成键类型的判断
微粒间作用力与物质性质 三种化学键的本质、形成条件与类型、键的强弱,离子半径与电荷数,分子间作用力的特征 共价分子的热稳定性 价键类型、强弱对物质热稳定性、分子间作用力大小对分子晶体性质的影响
晶体结构与物质性质 四种晶体结构的构成微粒、作用力类型 四种晶体结构的性质特点 晶体结构对物质导电性、熔沸点、硬度等物理性质的影响
了解并能描述元素原子核外电子的运动状态(电子云、原子轨道) 、排布规律了解原子核外电子的运动。了解s、p原子轨道的形状。
认识并能说明描述不同元素(1-36号元素,周期表中各分区元素)原子结构的变化规律(核外电子排布的周期性、第一电离能的周期性)
认识并能描述元素电负性的周期性
认识并能运用上述知识说明、解释元素的金属性、非金属性差异、形成化学键的类型、对成键电子的吸引力
知道原子核外电子在一定情况下会跃迁,了解其简单应用。
(1)从原子结构知识认识为什么元素组成是决定物质性质的重要因素
编写思路
原子结构
从学生已有经验出发让学生通过学习活动建构知识帮助学生了解知识的应用
原子模型:行星模型 玻尔模型 量子力学模型(统计方法、测不准原理、互补原理)
电子运动状态与排布:原子轨道
电子在核外的填充与排布
原子核外电子排布 原子半径化合价 金属性和非金属性
第一电离能 电负性
元素性质 (周期性变化)
决定
知道并能描述三种化学键的形成与三类晶体的特点,能说明晶体中化学键类型对晶体性质的决定作用;
认识说明金属晶体的密堆积,了解晶胞与晶体的关系 ;
了解什么是离子晶体晶格能,了解它与离子晶体性质的关系,能应用晶格能说明物质的某些性质,了解怎样运用晶胞结构模型说明晶体的组成;
认识共价键的类型( 、 键、极性键、非极性键)能从成键原子核外电子排布特点分析共价键的方向性、饱和性、共价分子的组成与键型,能运用共价键的参数说明共价键的稳定性;了解原子晶体熔点、硬度与其结构的关系;系统认识三种化学键本质、影响键强弱的因素、是否有方向性、饱和性;
了解两种常见分子间作用力及其对物质性质的影响;
比较四类晶体结构与性质特点 。
(2)微粒间作用力类型与物质性质的关系
编写思路
金属 金属键、金属键的强弱 金属晶体
金属原子在晶体中的堆积方式 晶体物理性质特点(金属原子化热)
离子化合物 离子键的形成、特点 离子晶体 离子晶体的晶格能、晶胞 晶体物理性质特点(晶格能)
共价化合物、共价分子 共价健的形成共价键的类型共价键的键能键长 原子晶体
分子晶体 晶体物理性质特点 (共价化合物的稳 定性与反应热)
分子 分子间作用力(范德华力、氢键的形成)
分子晶体 晶体物理性质特点(氢键对物质性质的影响)
学习情景
作用力
物质性质
晶体结构
例如:重视“物质结构决定性质”的思想观念的形成,帮助学生深刻理解元素周期律的本质,掌握借助化学符号系统、模型描述、说明原子、分子、晶体结构的方法:
深刻理解元素性质周期性变化发根本原因
能运用第一电离能、元素电负性说明元素的主要性质
认识核外电子的分层排布 知道核外电子排布式、 原子轨道(s 、p轨道,d 轨道不作过多要求)、 晶格与晶胞
1.依据课程标准,从学生已有知识和经验出发,落实最核心的知识、技能、方法、观点的学习要求,注意教学内容的基础性、时代性、实践性。重视生长和整合建构,初步形成化学学科知识体系。
三、教学方法建议
突出基础知识,强调物质微观结构的核心概念
抓住基础知识与核心概念的学习
运用多媒体技术可以更形
象地进行核心概念教学
关注知识在生产、生活、科学研究中的应用与作用
合金制品
金属键与金属导电性延展性
焰色与发射光谱
原子吸收光谱仪
体现学习内容的时代性、应用性
反映物质结构研究 的发展趋势与成就,体现时代性;关注知识的应用;
X
射线衍射仪
一种固氮酶结构示意图
磁悬浮材料
2.充分利用图表、 录像等材料,重视学习情景创设,关注学习兴趣的激发、倡导多样的学习方式、注重科学方法的启迪和探究能力的培养
运用化学史料
联系生产实际
从学生已有知识、经验出发
学习情景创设
获取、处理信息的能力,
发现问题,主动进行探究的能力,
设计并进行化学实验的能力,
应用化学知识解决实际问题的能力,
对自己学习的反思、调控能力。
着力学习活动的设计、组织,关注自然科学方法的熏陶、学习学习方法、学习能力、实践能力和创新意识的培养
重视能力培养
化学课程中的探究学习不仅限于发现问题、用实验等手段对问题或未知事物进行探究,还包括对已有观念、认识、理论的质疑、思考和验证。
例: p8 :原子结构模型演变缘由
p31:动手探究圆球在的密堆积方式,理解
金属晶体中金属原子的堆积方式
p41:共价理论的发展
p51:氢键对物质性质的影响
组织好探究活动与交流活动、问题解决,引导学生主动建构。
问题解决:
p13 分析 F 原子核外电子应排布在哪些原子轨道上。 模仿C、Na 原子的电子排布式、轨道表示式,写出N、Mg原子的电子排布式、轨道表示式。
P22 元素电负性的应用
交流讨论:
p20 说明第一电离能Mg比Al大、 P比S大的原因
p36 分析离子化合物的晶格能与其熔点、硬度等物理性质的关系
活动与探究:
P31 利用小球探究金属原子的密堆积方式
3.依据课程标准,把握教学的深广度,正确处理基础知识和拓展知识的关系
〈拓展视野〉是围绕核心知识编写拓展性的学习内容,以开阔学生知识视野,帮助学生更好理解核心知识,形成基本观念、了解研究方法。
合金的性质与结构 离子晶体中的离子配位数
苯分子中的共价键 几种类型的范德华力
4.教学安排方式建议
a、集中一段时间,安排上课
b、分散与集中结合的方式进行
依据本校学生的实际情况可将部分内容分散到其它模块的学习之中
如:①在《化学2》学共价键时可增加键的分类
②在《化学2》学化学反应中的热量变化可增加键参数(原来资料卡也有键能说明)
③在《有机化学基础》中穿插分子间作用力和氢键,理解有机物熔沸点的判断,扩展氢键的认识范围
c、运用学案导学或自学,加强学生自主学习,减少集中上课时间
举例
谢谢 !
(09年山东卷)32.写出Si的基态原子核外电子排布式 。
1s22s22p63s23p2
(09广东化学27) (1) Cu位于元素周期表第I B族。Cu2+的核外电子排布式为___[Ar]3d9或1s22s22p63s23p63d9 _______。
(10年江苏卷)21.(2)将乙炔通入 溶液生成 红棕色沉淀。 基态核外电子排布式为 。
1s22s22p63s23p63d10
(2010安徽卷)25.Cu的基态原子核外电子排布式是[Ar]3d104s1。
(11福建卷)30.(1)基态氮原子的价电子排布式是___。
(1)2s22p3 ,学生可能审题时没注意到是价电子排布式。
(2011新课标全国)基态B原子的电子排布式为_1s22s22p1
热点之1:核外电子排布的表示方法
(2010福建卷)30.(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
①除S外,上列元素的电负性从大到小依次为 。
①钾为活泼金属,电负性比较小;在同周期
,非金属性逐渐增强,电负性也逐渐增大
(2011福建卷)30.(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(2)C、N、O三种元素第一电离能从大到小的顺序是N>O>C
热点之2:电离能、电负性
(09年山东卷32)(1)从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2010山东卷)32. (2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(1)C、Si和O的电负性大小顺序为:O>C>Si。
(2011新课标全国)(2)元素B和N相比,电负性较大的是___
B和N都属于第二周期,同周期自左向右电负性逐渐增大,所以B和N相比,电负性较大的是N
(10福建卷)30.③已知 CN-与N2 结构相似,推算HCN分子中σ键与π键数目之比为 。
③HCN中 CN-与N2结构相同,含有三个键,一个σ键和两个π键;另外C和H之间形成一个σ键,所以分子中σ键和π键数目之比为2:2,即为1:1.
(2011福建卷)30.②肼可作火箭燃料,燃烧发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有_____mol。
②反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在___d _____(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
热点之3:共价键类型
(09江苏卷 ) 21 . ② 1mol甲醛分子中σ键的数目为 3NA 。
(10江苏卷 ) 21. (1)1mol 中含有的键数目为 2NA 。
(11江苏卷) 21.(1)1mol Y2X2(C2H2)含有σ键的数目为 3mol或3×6.2×10 个。
(11新课标全国)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为____,层间作用力为__;
共价键(或极性共价键);分子间作用力
(10安徽卷)25. (2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(2)2 H-Z H-Y
(08年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
答案:A
解析:化合物的化学式确定的方法为均摊法。X处在正方体的八个顶点上,其个数为: ;
Y处在正方体的12条楞上,其个数为: ;
Z处在正方体的体心上,其个数为1。
热点之4:晶体结构
(2010山东卷)32. (4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与
个O2-配位。
(2011江苏卷) 21.(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是________
(09广东化学) 27.右下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
1、原子结构示意图和分层排布-----复习,易整合
2、同一电子层中不同类型的原子轨道-
---易建构,最好有问题引入创设情景。
3、形状相同的原子轨道,伸展方向不同
---易在电子云角度上理解伸展方向。
5、原子轨道与电子填充顺序的表示方法----原知识结构易同化
4、原子轨道的表示方法----自然生长,语言表达上的表示
6、填充在同一原子轨道中的两种电子运动状
----较难理解自旋状态的意义,但每个轨道只能填2个电子还是容易理解的。
案例一、 原子核外电子的运动特征(注意教学内容的衔接。)
1、 “能量最低原理”、“泡利不相容原理”、“洪特规则”)和原子核外电子排布的轨道能量顺序(能级交错)
2、分析1~18号元素基态原子的电子排布式,学习电子排布式和轨道表示式外围电子排布式的书写。
3、分析K\Ca号元素基态原子的电子排布式,完整了解能级交错与轨道能量顺序。
4、分析第四周期过渡元素及元素Cr基态原子的电子排布式,得出洪特规则及洪特规则特例。
5、了解能量高低顺序及洪特规则只是一般经验规律,形成完整电子排布的知识体系。
案例三、 原子核外电子的排布
1、前两者易生长,后二者原因与现象、导致的结果难整合。
3、4与1整合,改变次序。改演绎为归纳。
2、技能训练。
5、科学性问题,易整合。
(2)各层最多容纳2n2 个电子
(3)最外层不超过8个(K层2个)
(4)次外层不超过18个,倒数第
三层不超过32个。
排布规律(一低四不超)
(1)能量最低原理
案例四、 元素第一电离能的周期性变化
1、元素第一电离能的概念
2、 同主族元素第一电离能的变化规律
同周期元素第一电离能的变化规律
镁铝、磷硫第一电离能的大小的原因
影响元素第一电离能的结构因素
电离能数据的应用(交流与讨论) .
3、第一个稀有气体化合物的发现
(化学史话)。
交流的讨论的方式非常适合,注意学生归纳描述的科学性,注意稀有气体的第一电离能,注意不要把第一电离能与金属性建立等同关系。
关于影响第一电离能的结构因素作为课堂核心,需要学生学会表述,而不仅是理解。
能量
E0
核间距
E0为两个远离的氢原子的能量之和
+
+
两个核外电子自旋方向相同的氢原子靠近的模拟动画
案例二:共价键的形成和类型
+
+
能量
E0
核间距
E0为两个远离的氢原子的能量之和
E1=-436kJ/mol
r=74pm
两个核外电子自旋方向相反的氢原子靠近的模拟动画
思考1:从两个模拟动画中可以得出什么结论?
能量
E0
核间距
E0为两个远离的氢原子的能量之和
E1=-436kJ/mol
r=74pm
思考2:由此可知共价键形成的本质是什么?
思考3:你认为可把图中的r=74pm和E1=436kJ/mol 定义为什么比较恰当?
思考4:当两个自旋相反的氢原子的1s轨道最大重叠成键后,能否再与另一个氢原子成键,为什么?
讨论:如下原子轨道式,表述HF中共价键是如何形成的?
1s
H
2px
2py
2pz
2s
F
2s2
2px2
2py2
2pz1
F原子
1s1
H原子
思考1:当F原子与H原子成键后,F原子能否再与其它氢原子形成共价键
思考2:比较离子键成键特点,总结共价键的成键特点
HF中共价键的形成
共价键有方向性和饱和性
2s2
2px1
2py1
2pz1
N原子
2s2
2px1
2py1
2pz1
N原子
σ键
π键
π键
σ键:“头碰头”
π键:“肩并肩”
N
N
π键
π键
σ键
《物质结构与性质》
内容分析与教学建议
高中化学(选修ⅠB)
遂昌中学 周开雄
本模块学习的意义与价值
1、从微观本质的角度理解物质的性质,促进学生对其它模块中很多遗留的问题的深入理解,促进学生对化学学科特色更深层次的理解。
例如:更好地理解自然界物质性质的多样性
(1)熔、沸点的高低;(2)硬度的大小
(3)导电性差异; (4)溶解性
2、让学生在理解世界是物质的基础上,感受到世界也是能量的。
例如:相比于《化学2》中必修内容,本模块专题三的学习十分突出从能量的视角认识世界。
(1)金属键与原子化热;
(2)离子键与晶格能
(3)共价键与键能
本模块学习的意义与价值
3、让学生的思维得到更充分的锻炼。对学生更多的感受化学是在原子、分子、离子水平上研究物质结构的奥秘
例如:抽象是本模块一大特点
(1)各类化学键或晶体模型的微观想象
(2)从图表数据提取信息,抽象分析
本模块学习的意义与价值
4、从外省实施情况看,该模块相比于化学与技术等模块容易得分,因此学生选修的人数和比例很高。而且也为将来选择化学类的学生更好的适应大学学习。
本模块学习的意义与价值
5、对教师本身的专业水平的提升提供机会。
例如:
(1)对疑难化学问题的理解
(2)从基于“化学实验”的实验科学的教学模式到基于“模型”的理论化学的教学模式的转变
(3)如何借助更多的教学方式让学生能更好的理解(如晶体模型,图片、动画、比喻等)
(4)如何运用已有知识,设计问题让学生用结构的知识去解释
本模块学习的意义与价值
※ 教 材 分 析
※ 教学方法建议
※ 课 程 标 准
※ 高考试题赏析
新课程标准中关于本模块内容要求的4
个一级主题:
主题1 原子结构与元素性质
主题2 化学键与物质的性质
主题3 分子间作用力与物质的性质
主题4 研究物质结构的价值
一、课程标准:
物质结构理论是现代化学的重要组成部分,也是医学、生命科学,材料科学、环境科学、能源科学、信息科学的重要基础。它揭示了物质构成的奥秘。物质结构与性质的关系,有助于人们理解物质变化的本质,预测物质的性质,为分子设计提供科学依据。 在本课程模块中,我们将从原子、分子水平上认识物质构成的规律,以微粒之间不同的作用力为线索,侧重研究不同类型物质的有关性质,帮助高中学生进一步丰富物质结构的知识,提高分析问题和解决问题的能力。 通过本课程模块的学习,学生应主要在以下几个方面得到发展: 1.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣; 2.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系; 3.能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质; 4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
一、课程标准:
本模块的作用
本模块的内容和教学要求
本模块的
课程目标
二、教材分析----
教材编写思路(体系框架) :
物质结构
与性质
揭示物质结
构的奥秘
微粒间作用力与物质性质
物质结构的探索无止境
结构探索的历史与意义
金属键 金属晶体
离子键 离子晶体
共价键 原子晶体
分子间作用力 分子晶体
结构研究的新课题
原子结构与
元素的性质
原子核外电子的运动
元素性质的递变规律
分子空间结构与物质性质
分子构型与物质的性质
配合物是如何形成的
暂不作要求
暂不作要求
本模块主要线索是原子核外电子的排布→微粒间的相互作用→晶体结构,整个教材主次分明;每一专题又突出结构与性质的关系,使教材有血有肉,丰富多彩。
1.本教材设置多样化的栏目,转变学生的
学习方式
通过阅读这些内容生动的栏目,学生遵循栏目的提示,明确自我学习的方向,获得自主学习化学的思想和方法,进一步激发了学生学习这门课程的兴趣。同时,在教师和学生之间,更突出了以学生为课堂的主体,让学生体验到不同的学习方式,增强师生之间以及教材与学生之间的互动,同时提高了学习的效果。
编者在编写教材时根据高中生的特点穿插了丰富的图片,增加了理论知识的趣味性,唤起学生的求知欲.
假说:依据实验事实提出原子结构模型
分析归纳:电子对互斥理论的提出
模型化:研究金属晶体中原子的密堆积
统计方法:核外电子运动特征的描述
2.本教材设置丰富的插图,激发学生的学习动机
3. 本教材编排多样化的习题,注重实践性探究.
培养学生解决问题的能力习题的编排在教材编写中占有很重要的地位。通过多样化的习题可以培养学生多方面的能力,同时学生解决问题的程度也能反映出学生掌握知识,运用知识的程度。新教材中习题的编排数量不多,但是形式多样,综合性强,不仅有适量的巩固性习题用以评价学生掌握基础知识的情况,还出现了如调查报告、小论文、查阅资料等实践性题型。这些新题型的出现既突出了新课程的理念以提高学生科学素养为主旨,又使学生能够在知识与技能、过程与方法、情感态度与价值观各方面取得相应的发展。
4.必修与选修模块内容衔接的较好
选修模块:比较深刻从三个层次认识物质结构、结构与性质的关系。
1。为什么说“物质的元素组成、分子结构晶体结构都是决定物质性质的重要因素?
2。不同元素的原子结构的相似性与差异为什么会影响物质的性质?
3。物质中微粒间作用力类型与物质性质有什么关系?
4。分子结构怎样影响物质的性质?
必修模块:提供结构与性质关系的感性知识与初浅的解释:如,卤素(碱金属)单质性质的相似与差异;碳、氧单质的同素异形现象;乙醇、二甲醚等同分异构现象;干冰、石英等不同类型晶体性质差异 等等。
1、物质结构的探索历程与研究价值(专题1)
专题1 揭示物质结构的奥秘(绪言)
从人类探索性质结构的历程中了解人类研究物质结构的常用方法(理论研究、实验研究、假说、模型等)、取得进展的缘由。
了解人类研究物质结构的意义,所取得的成果在科学发展和社会进步中的积极作用,激发对“物质结构与性质”学习的自主性和积极性。
二、教材分析----
教材编写思路(具体分析) :
编写思路
创设问题情景
你是否想过:物质是由什么构成的?为什么物质会发生变化?为什么不同的物质具有不同的性能?如何才能获得优异性能的新物质?
从探索历程了解研究方法
原子分子论 元素周期律
碳的价键 量子力学
假说法 经验归纳法 实验验证法
了解研究成果的作用激发学习兴趣
合成化学 生命科学
2、从三个层次认识物质结构与性质的关系(专题2-3)
内容 结构知识 性质知识 结构性质关系
原子结构与元素性质 原子结构模型的演变,主族元素核外电子排布规律、结构示意图 元素性质(金属性、非金属性、主要化合价、成键类型)的周期性变化—具体表现与规律 性质周期性变化的本质;主族元素原子结构、(非)金属性、 主要化合价、成键类型的判断
微粒间作用力与物质性质 三种化学键的本质、形成条件与类型、键的强弱,离子半径与电荷数,分子间作用力的特征 共价分子的热稳定性 价键类型、强弱对物质热稳定性、分子间作用力大小对分子晶体性质的影响
晶体结构与物质性质 四种晶体结构的构成微粒、作用力类型 四种晶体结构的性质特点 晶体结构对物质导电性、熔沸点、硬度等物理性质的影响
了解并能描述元素原子核外电子的运动状态(电子云、原子轨道) 、排布规律了解原子核外电子的运动。了解s、p原子轨道的形状。
认识并能说明描述不同元素(1-36号元素,周期表中各分区元素)原子结构的变化规律(核外电子排布的周期性、第一电离能的周期性)
认识并能描述元素电负性的周期性
认识并能运用上述知识说明、解释元素的金属性、非金属性差异、形成化学键的类型、对成键电子的吸引力
知道原子核外电子在一定情况下会跃迁,了解其简单应用。
(1)从原子结构知识认识为什么元素组成是决定物质性质的重要因素
编写思路
原子结构
从学生已有经验出发让学生通过学习活动建构知识帮助学生了解知识的应用
原子模型:行星模型 玻尔模型 量子力学模型(统计方法、测不准原理、互补原理)
电子运动状态与排布:原子轨道
电子在核外的填充与排布
原子核外电子排布 原子半径化合价 金属性和非金属性
第一电离能 电负性
元素性质 (周期性变化)
决定
知道并能描述三种化学键的形成与三类晶体的特点,能说明晶体中化学键类型对晶体性质的决定作用;
认识说明金属晶体的密堆积,了解晶胞与晶体的关系 ;
了解什么是离子晶体晶格能,了解它与离子晶体性质的关系,能应用晶格能说明物质的某些性质,了解怎样运用晶胞结构模型说明晶体的组成;
认识共价键的类型( 、 键、极性键、非极性键)能从成键原子核外电子排布特点分析共价键的方向性、饱和性、共价分子的组成与键型,能运用共价键的参数说明共价键的稳定性;了解原子晶体熔点、硬度与其结构的关系;系统认识三种化学键本质、影响键强弱的因素、是否有方向性、饱和性;
了解两种常见分子间作用力及其对物质性质的影响;
比较四类晶体结构与性质特点 。
(2)微粒间作用力类型与物质性质的关系
编写思路
金属 金属键、金属键的强弱 金属晶体
金属原子在晶体中的堆积方式 晶体物理性质特点(金属原子化热)
离子化合物 离子键的形成、特点 离子晶体 离子晶体的晶格能、晶胞 晶体物理性质特点(晶格能)
共价化合物、共价分子 共价健的形成共价键的类型共价键的键能键长 原子晶体
分子晶体 晶体物理性质特点 (共价化合物的稳 定性与反应热)
分子 分子间作用力(范德华力、氢键的形成)
分子晶体 晶体物理性质特点(氢键对物质性质的影响)
学习情景
作用力
物质性质
晶体结构
例如:重视“物质结构决定性质”的思想观念的形成,帮助学生深刻理解元素周期律的本质,掌握借助化学符号系统、模型描述、说明原子、分子、晶体结构的方法:
深刻理解元素性质周期性变化发根本原因
能运用第一电离能、元素电负性说明元素的主要性质
认识核外电子的分层排布 知道核外电子排布式、 原子轨道(s 、p轨道,d 轨道不作过多要求)、 晶格与晶胞
1.依据课程标准,从学生已有知识和经验出发,落实最核心的知识、技能、方法、观点的学习要求,注意教学内容的基础性、时代性、实践性。重视生长和整合建构,初步形成化学学科知识体系。
三、教学方法建议
突出基础知识,强调物质微观结构的核心概念
抓住基础知识与核心概念的学习
运用多媒体技术可以更形
象地进行核心概念教学
关注知识在生产、生活、科学研究中的应用与作用
合金制品
金属键与金属导电性延展性
焰色与发射光谱
原子吸收光谱仪
体现学习内容的时代性、应用性
反映物质结构研究 的发展趋势与成就,体现时代性;关注知识的应用;
X
射线衍射仪
一种固氮酶结构示意图
磁悬浮材料
2.充分利用图表、 录像等材料,重视学习情景创设,关注学习兴趣的激发、倡导多样的学习方式、注重科学方法的启迪和探究能力的培养
运用化学史料
联系生产实际
从学生已有知识、经验出发
学习情景创设
获取、处理信息的能力,
发现问题,主动进行探究的能力,
设计并进行化学实验的能力,
应用化学知识解决实际问题的能力,
对自己学习的反思、调控能力。
着力学习活动的设计、组织,关注自然科学方法的熏陶、学习学习方法、学习能力、实践能力和创新意识的培养
重视能力培养
化学课程中的探究学习不仅限于发现问题、用实验等手段对问题或未知事物进行探究,还包括对已有观念、认识、理论的质疑、思考和验证。
例: p8 :原子结构模型演变缘由
p31:动手探究圆球在的密堆积方式,理解
金属晶体中金属原子的堆积方式
p41:共价理论的发展
p51:氢键对物质性质的影响
组织好探究活动与交流活动、问题解决,引导学生主动建构。
问题解决:
p13 分析 F 原子核外电子应排布在哪些原子轨道上。 模仿C、Na 原子的电子排布式、轨道表示式,写出N、Mg原子的电子排布式、轨道表示式。
P22 元素电负性的应用
交流讨论:
p20 说明第一电离能Mg比Al大、 P比S大的原因
p36 分析离子化合物的晶格能与其熔点、硬度等物理性质的关系
活动与探究:
P31 利用小球探究金属原子的密堆积方式
3.依据课程标准,把握教学的深广度,正确处理基础知识和拓展知识的关系
〈拓展视野〉是围绕核心知识编写拓展性的学习内容,以开阔学生知识视野,帮助学生更好理解核心知识,形成基本观念、了解研究方法。
合金的性质与结构 离子晶体中的离子配位数
苯分子中的共价键 几种类型的范德华力
4.教学安排方式建议
a、集中一段时间,安排上课
b、分散与集中结合的方式进行
依据本校学生的实际情况可将部分内容分散到其它模块的学习之中
如:①在《化学2》学共价键时可增加键的分类
②在《化学2》学化学反应中的热量变化可增加键参数(原来资料卡也有键能说明)
③在《有机化学基础》中穿插分子间作用力和氢键,理解有机物熔沸点的判断,扩展氢键的认识范围
c、运用学案导学或自学,加强学生自主学习,减少集中上课时间
举例
谢谢 !
(09年山东卷)32.写出Si的基态原子核外电子排布式 。
1s22s22p63s23p2
(09广东化学27) (1) Cu位于元素周期表第I B族。Cu2+的核外电子排布式为___[Ar]3d9或1s22s22p63s23p63d9 _______。
(10年江苏卷)21.(2)将乙炔通入 溶液生成 红棕色沉淀。 基态核外电子排布式为 。
1s22s22p63s23p63d10
(2010安徽卷)25.Cu的基态原子核外电子排布式是[Ar]3d104s1。
(11福建卷)30.(1)基态氮原子的价电子排布式是___。
(1)2s22p3 ,学生可能审题时没注意到是价电子排布式。
(2011新课标全国)基态B原子的电子排布式为_1s22s22p1
热点之1:核外电子排布的表示方法
(2010福建卷)30.(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
①除S外,上列元素的电负性从大到小依次为 。
①钾为活泼金属,电负性比较小;在同周期
,非金属性逐渐增强,电负性也逐渐增大
(2011福建卷)30.(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(2)C、N、O三种元素第一电离能从大到小的顺序是N>O>C
热点之2:电离能、电负性
(09年山东卷32)(1)从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2010山东卷)32. (2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(1)C、Si和O的电负性大小顺序为:O>C>Si。
(2011新课标全国)(2)元素B和N相比,电负性较大的是___
B和N都属于第二周期,同周期自左向右电负性逐渐增大,所以B和N相比,电负性较大的是N
(10福建卷)30.③已知 CN-与N2 结构相似,推算HCN分子中σ键与π键数目之比为 。
③HCN中 CN-与N2结构相同,含有三个键,一个σ键和两个π键;另外C和H之间形成一个σ键,所以分子中σ键和π键数目之比为2:2,即为1:1.
(2011福建卷)30.②肼可作火箭燃料,燃烧发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有_____mol。
②反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在___d _____(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
热点之3:共价键类型
(09江苏卷 ) 21 . ② 1mol甲醛分子中σ键的数目为 3NA 。
(10江苏卷 ) 21. (1)1mol 中含有的键数目为 2NA 。
(11江苏卷) 21.(1)1mol Y2X2(C2H2)含有σ键的数目为 3mol或3×6.2×10 个。
(11新课标全国)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为____,层间作用力为__;
共价键(或极性共价键);分子间作用力
(10安徽卷)25. (2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(2)2 H-Z H-Y
(08年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的
A.ZXY3 B.ZX2Y6 C.ZX4Y8 D.ZX8Y12
答案:A
解析:化合物的化学式确定的方法为均摊法。X处在正方体的八个顶点上,其个数为: ;
Y处在正方体的12条楞上,其个数为: ;
Z处在正方体的体心上,其个数为1。
热点之4:晶体结构
(2010山东卷)32. (4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与
个O2-配位。
(2011江苏卷) 21.(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是________
(09广东化学) 27.右下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_________。
1、原子结构示意图和分层排布-----复习,易整合
2、同一电子层中不同类型的原子轨道-
---易建构,最好有问题引入创设情景。
3、形状相同的原子轨道,伸展方向不同
---易在电子云角度上理解伸展方向。
5、原子轨道与电子填充顺序的表示方法----原知识结构易同化
4、原子轨道的表示方法----自然生长,语言表达上的表示
6、填充在同一原子轨道中的两种电子运动状
----较难理解自旋状态的意义,但每个轨道只能填2个电子还是容易理解的。
案例一、 原子核外电子的运动特征(注意教学内容的衔接。)
1、 “能量最低原理”、“泡利不相容原理”、“洪特规则”)和原子核外电子排布的轨道能量顺序(能级交错)
2、分析1~18号元素基态原子的电子排布式,学习电子排布式和轨道表示式外围电子排布式的书写。
3、分析K\Ca号元素基态原子的电子排布式,完整了解能级交错与轨道能量顺序。
4、分析第四周期过渡元素及元素Cr基态原子的电子排布式,得出洪特规则及洪特规则特例。
5、了解能量高低顺序及洪特规则只是一般经验规律,形成完整电子排布的知识体系。
案例三、 原子核外电子的排布
1、前两者易生长,后二者原因与现象、导致的结果难整合。
3、4与1整合,改变次序。改演绎为归纳。
2、技能训练。
5、科学性问题,易整合。
(2)各层最多容纳2n2 个电子
(3)最外层不超过8个(K层2个)
(4)次外层不超过18个,倒数第
三层不超过32个。
排布规律(一低四不超)
(1)能量最低原理
案例四、 元素第一电离能的周期性变化
1、元素第一电离能的概念
2、 同主族元素第一电离能的变化规律
同周期元素第一电离能的变化规律
镁铝、磷硫第一电离能的大小的原因
影响元素第一电离能的结构因素
电离能数据的应用(交流与讨论) .
3、第一个稀有气体化合物的发现
(化学史话)。
交流的讨论的方式非常适合,注意学生归纳描述的科学性,注意稀有气体的第一电离能,注意不要把第一电离能与金属性建立等同关系。
关于影响第一电离能的结构因素作为课堂核心,需要学生学会表述,而不仅是理解。
能量
E0
核间距
E0为两个远离的氢原子的能量之和
+
+
两个核外电子自旋方向相同的氢原子靠近的模拟动画
案例二:共价键的形成和类型
+
+
能量
E0
核间距
E0为两个远离的氢原子的能量之和
E1=-436kJ/mol
r=74pm
两个核外电子自旋方向相反的氢原子靠近的模拟动画
思考1:从两个模拟动画中可以得出什么结论?
能量
E0
核间距
E0为两个远离的氢原子的能量之和
E1=-436kJ/mol
r=74pm
思考2:由此可知共价键形成的本质是什么?
思考3:你认为可把图中的r=74pm和E1=436kJ/mol 定义为什么比较恰当?
思考4:当两个自旋相反的氢原子的1s轨道最大重叠成键后,能否再与另一个氢原子成键,为什么?
讨论:如下原子轨道式,表述HF中共价键是如何形成的?
1s
H
2px
2py
2pz
2s
F
2s2
2px2
2py2
2pz1
F原子
1s1
H原子
思考1:当F原子与H原子成键后,F原子能否再与其它氢原子形成共价键
思考2:比较离子键成键特点,总结共价键的成键特点
HF中共价键的形成
共价键有方向性和饱和性
2s2
2px1
2py1
2pz1
N原子
2s2
2px1
2py1
2pz1
N原子
σ键
π键
π键
σ键:“头碰头”
π键:“肩并肩”
N
N
π键
π键
σ键
