10-11高中化学课时讲练通课件:432硫和氮的氧化物(人教版必修1)(共57张PPT)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:432硫和氮的氧化物(人教版必修1)(共57张PPT) |  | |
| 格式 | rar | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 19:10:00 | ||
图片预览











文档简介
(共57张PPT)
【典例1】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升。
【思路点拨】解答本题需注意以下两点:
(1)NO2完全反应,剩余的2mL气体为O2。
(2)O2完全反应,剩余的2mL无色气体是剩余的NO2与H2O反应转化成的NO气体。
【自主解答】剩余2 mL气体可能是NO或O2,分两种情况讨论:
(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O====4HNO3。剩余的NO2又与水作用,最终
有2 mL NO产生。由反应3NO2+H2O====2HNO3+NO得剩余
的NO2体积为2 mL×3=6 mL。则原有O2体积为(10 mL-
6 mL)× =0.8 mL,NO2体积为10 mL-0.8 mL=
9.2 mL。
(2)剩余的是O2,则有10 mL-2 mL=8 mL是NO2和O2的混
合气体按反应:4NO2+O2+2H2O====4HNO3进行。所以NO2
的体积为8 mL× =6.4 mL,O2体积为10 mL-6.4 mL
=3.6 mL。
答案:(1)若剩余的是NO,则NO2和O2的体积分别为
9.2 mL和0.8 mL。
(2)若剩余的是O2,则NO2和O2的体积分别为6.4 mL
和3.6 mL。
【典例2】下列有关环境污染的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7之间的降水通常称为酸雨
D.含磷洗涤剂易于被细菌分解,故不会导致水体污染
【思路点拨】解答本题要注意以下两点:
(1)酸雨的形成原因。
(2)了解常见环境污染。
【自主解答】选A。燃煤时加入石灰石发生的反应有CaCO3 CaO+CO2↑、CaO+SO2====CaSO3、2CaSO3+O2====2CaSO4(炉渣),因此能减少SO2的排放;B项空气中臭氧超过10-5%时可加速血液循环,令人产生振奋的感觉,故B错误;pH<5.6的雨水被称为酸雨,C项错误;含磷的洗涤剂会造成水体污染使水体富营养化而引起赤潮、水华等现象。
高温
====
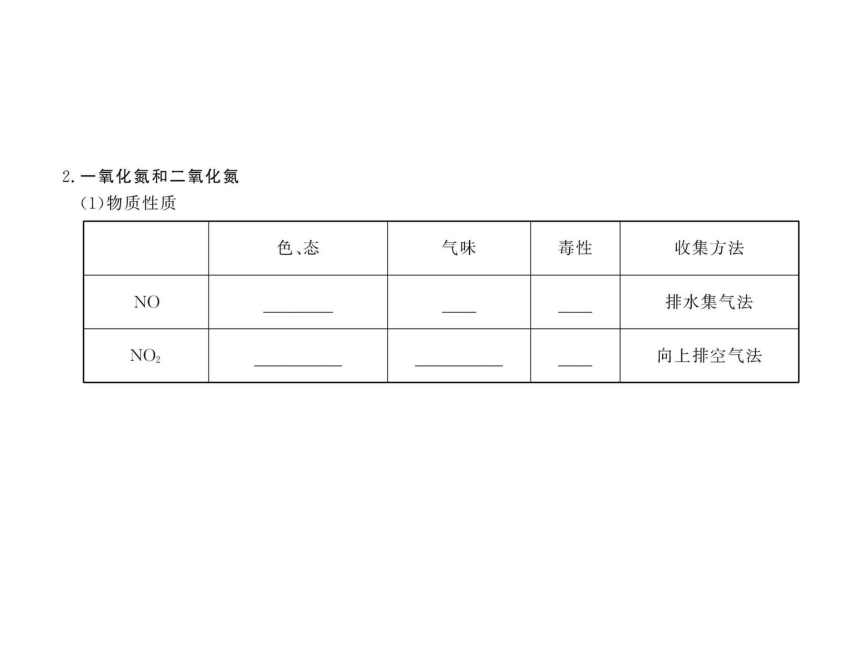
知识点一:二氧化氮和一氧化氮
1.下列气体都有毒,使人中毒的原理与CO相似的是
( )
A.Cl2 B.SO2 C.NO D.NO2
【解析】选C。NO与CO使人中毒的原理都是结合人体内血红蛋白,使血红蛋白无法再结合氧。
2.在一定体积的密闭容器中通入a mol NO和b mol O2,反应后容器内氮原子个数与氧原子个数之比为( )
A. B.
C. D.
【解析】选C。本题抓住质量守恒定律这一关键,可以不用考虑NO与O2之间的反应关系问题。
根据反应前后原子个数和种类不变,故反应后与反应前原子个数与种类相同。n(N)=n(NO)=a mol,
n(O)=n(NO)+2n(O2)=a+2b,
故n(N)∶n(O)=a∶(a+2b)。
3.实验室收集NO、NO2两种气体( )
A.均可用排水法
B.均可用向上排空气法
C.NO用向上排空气法,NO2用排水法
D.NO用排水法,NO2用向上排空气法
【解析】选D。NO易与O2反应,不能用排空气法收集,NO2易与H2O反应,不能用排水法收集,故只有D项正确。
知识点二:二氧化硫和二氧化氮对大气的污染
4.酸雨的形成主要是由于( )
A.大气中CO2含量的增多
B.以“氟利昂”为制冷剂的空调、冰箱的大量使用
C.工业上大量燃烧含硫燃料
D.森林遭乱砍滥伐,破坏了生态平衡
【解析】选C。酸雨的形成主要是由SO2、NO2等气体引起的,而SO2主要来自于含硫的化石燃料的燃烧,C项正确;A中CO2增多会引起温室效应,而“氟利昂”主要破坏臭氧层。
5.可持续发展是全球经济发展的共同课题,珍惜地球,保护环境已成为我国的基本国策。汽车尾气(含有烃类、CO、SO2和NO等物质)是城市空气的污染源,治理方法之一是在汽车排气管上装一个“催化转化器”(用铂-钯合金作催化剂),它的特点是使CO与NO反应,生成两种可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的催化氧化。
(1)写出CO与NO在催化剂作用下的化学反应方程式
_________________________。
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是__________________。
(3)控制城市空气污染源方法可行的有_______。
A.开发氢能源
B.使用电动车
C.植树造林
D.戴上呼吸面具
【解析】(1)2CO+2NO ====== 2CO2+N2
(2)生成的CO2易与水蒸气结合成碳酸,SO2催化氧化成SO3与水蒸气结合成硫酸,增加了酸度。
(3)选A。B、C、D都不能从根本上解决污染源问题。
答案:(1)2CO+2NO ====== 2CO2+N2
(2)生成的CO2易与水蒸气结合成碳酸,而SO2催化氧化成的SO3与水蒸气结合成硫酸
(3)A、B
催化剂
催化剂
一、选择题(本题包括5个小题,每小题4分,共20分)
1.保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是( )
A.①②④⑤ B.②③④⑥
C.①②④⑥ D.③④⑤⑥
【解析】选C。使用一次性筷子会加快森林的砍伐,对环境不利;过量使用化肥、农药会造成水体污染;含磷洗涤剂会导致水质富营养化而产生水华、赤潮等现象。
2.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
【解析】选C。少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量比为1∶1,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2恰好与NO反应生成NO2,逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
3.标准状况下,将NO2和O2按4∶1的体积比混合,充满干燥烧瓶,然后倒立于水中,烧瓶内液面逐渐上升,直到充满整个烧瓶,假设瓶中溶液不扩散,则烧瓶内溶液的物质的量浓度为( )
A. mol/L B. mol/L
C. mol/L D. mol/L
【解析】选C。假设烧瓶体积为V L,则V(NO2)= V L,V(O2)= V L,由N元素守恒,n(HNO3)=n(NO2)=
由于充满烧瓶,最后溶液体积为V L,
。
4.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
【解析】选B。由题意可知,所放出的气体中只有NO与空气中的O2能发生反应,生成红棕色的NO2而出现题中的现象。
5.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片振荡,得橙色溶液,气体颜色消失。再拿走玻璃片后,瓶中气体又变为红棕色,则该气体可能是下列混合气体中的( )
A.N2、NO2、Br2 B.NO2、NO、N2
C.NO2、NO、O2 D.N2、O2、Br2
【解析】选A。气体呈红棕色说明含有NO2或Br2中的至少一种,溶于水得橙色溶液说明气体中必定含有溴蒸气,所得无色气体遇空气重新变为红棕色说明无色气体含NO,即原气体中有NO2,原气体既有NO2也有Br2,只有A选项符合。
二、非选择题(本题包括1个小题,共10分)
6.将V mL NO和NO2的混合气体通过水吸收后,得到
a mL无色气体A。将此无色气体A与等体积的O2混合,通过水充分吸收后,得到5 mL无色气体B,试回答:
(1)A气体是_______,B气体是_______。
(2)A气体的体积是_______mL。
(3)V的取值范围是_____________。
【解析】(1)NO、NO2混合气体与水反应后只能得到无色气体NO,即A为NO。NO与O2等体积混合后与水反应,据4NO+3O2+2H2O====4HNO3知,剩余气体为O2。
(2)设A气体的体积为x,则x- x=5 mL,x=20 mL。
(3)按极限取值法,若V mL全为NO,则V =20;
若V mL全为NO2,则V=60,故其取值范围为:20答案:(1)NO O2 (2)20 (3)201.(6分)将充有m mL NO和n mL NO2气体的试管倒立
于水槽中,然后通入相同状况下的m mL O2,若已知
n>m,则充分反应后试管中的气体在相同状况下的体积
为( )
A. mL B. mL
mL D.3(n-m) mL
【解析】选B。NO、NO2、O2混合气体与水作用,可按
1∶1∶1恰好完全溶于水计算。也可用方程式:4NO+
3O2+2H2O====4HNO3和4NO2+O2+2H2O====4HNO3解答。
4NO+3O2+2H2O====4HNO3
4 3
m m
余O2(m- m)= m mL
4NO2+O2+2H2O====4HNO3
4 1
m m
故余NO2 (n-m) mL
最后的气体为NO,V(NO)= (n-m) mL。
2.(14分)2008年奥运会在北京成功举行。奥运前夕,为了改善北京的空气质量,北京市对汽车实行了单双号限行,全国多数的火力发电厂纷纷减少发电量,这些措施最大程度地减少了酸雨的产生。
科学兴趣小组为了研究酸雨的成分及成因,对取得的酸雨样品进行了pH的测定,随时间推移,得到了如下的实验数据。
(1)雨水样品放置时,pH变化的主要原因为:_______
_______________(用化学方程式表示),由此可以得出酸雨形成的过程可能是___________________。
(2)下列各选项是酸雨给人类造成的危害,其中不正确的是__________。
A.腐蚀建筑物、雕塑等 B.污染水源
C.改良碱性土壤 D.损害庄稼
(3)现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤作燃料,③燃煤时鼓入足量空气,④开发清洁能源。其中能减少酸雨产生的措施是______。
A.①②③ B.②③④ C.①②④ D.①③④
(4)实验室中进行SO2的制备及性质实验时,在装置最后必须有______装置,所选试剂为_______,发生反应的离子方程式为___________________。
(5)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用氢氧化钙的悬浊液吸收煤燃烧时产生的二氧化硫气体,并用来制取石膏(CaSO4·2H2O),有关反应的化学方程式为:__________________,
__________________________________________,
__________________________________________。
②硫酸工业中常用浓氨水来吸收二氧化硫,有关的化学方程式为:_______________________________,
___________________________________________。
【解析】(1)酸雨主要是SO2及NO2等溶于水生成的,故酸雨的成分中既含有HNO3,也含有H2SO3、H2SO4等,H2SO3不稳定,具有强的还原性,可被空气中的O2氧化为H2SO4,故氧化后溶液的酸性变强,pH减小。
(2)酸雨危害极大,会危害农作物、森林、草原、鱼类、建筑物、工业设备、电信电缆等。
(3)要减少酸雨的产生,首先要了解大气中二氧化硫的来源。大气中二氧化硫的来源主要是化石燃料的燃烧,以及含硫矿石的冶炼和硫酸、磷肥、造纸等生产过程中产生的尾气。因此少用煤作燃料以及对燃料进行脱硫处理,是减少酸雨的有效措施。开发新能源如氢能、核能等可以从根本上杜绝二氧化硫的产生,燃煤时鼓入足量空气不会减少SO2的排放。
(4)SO2有毒,会污染环境,因此必须有尾气吸收装置,可在洗气瓶中装入NaOH溶液,发生反应的离子方程式为SO2+2OH-====SO32-+H2O。
答案:(1)2H2SO3+O2====2H2SO4 雨水溶解SO2生成H2SO3,H2SO3被空气中的氧气氧化为H2SO4,降落下来而形成酸雨 (2)C (3)C (4)尾气吸收 NaOH溶液
SO2+2OH-====SO32-+H2O
(5)①Ca(OH)2+SO2====CaSO3↓+H2O
2CaSO3+O2====2CaSO4
CaSO4+2H2O====CaSO4·2H2O
②2NH3·H2O+SO2====(NH4)2SO3+H2O
2(NH4)2SO3+O2====2(NH4)2SO4
【典例1】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升。
【思路点拨】解答本题需注意以下两点:
(1)NO2完全反应,剩余的2mL气体为O2。
(2)O2完全反应,剩余的2mL无色气体是剩余的NO2与H2O反应转化成的NO气体。
【自主解答】剩余2 mL气体可能是NO或O2,分两种情况讨论:
(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O====4HNO3。剩余的NO2又与水作用,最终
有2 mL NO产生。由反应3NO2+H2O====2HNO3+NO得剩余
的NO2体积为2 mL×3=6 mL。则原有O2体积为(10 mL-
6 mL)× =0.8 mL,NO2体积为10 mL-0.8 mL=
9.2 mL。
(2)剩余的是O2,则有10 mL-2 mL=8 mL是NO2和O2的混
合气体按反应:4NO2+O2+2H2O====4HNO3进行。所以NO2
的体积为8 mL× =6.4 mL,O2体积为10 mL-6.4 mL
=3.6 mL。
答案:(1)若剩余的是NO,则NO2和O2的体积分别为
9.2 mL和0.8 mL。
(2)若剩余的是O2,则NO2和O2的体积分别为6.4 mL
和3.6 mL。
【典例2】下列有关环境污染的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7之间的降水通常称为酸雨
D.含磷洗涤剂易于被细菌分解,故不会导致水体污染
【思路点拨】解答本题要注意以下两点:
(1)酸雨的形成原因。
(2)了解常见环境污染。
【自主解答】选A。燃煤时加入石灰石发生的反应有CaCO3 CaO+CO2↑、CaO+SO2====CaSO3、2CaSO3+O2====2CaSO4(炉渣),因此能减少SO2的排放;B项空气中臭氧超过10-5%时可加速血液循环,令人产生振奋的感觉,故B错误;pH<5.6的雨水被称为酸雨,C项错误;含磷的洗涤剂会造成水体污染使水体富营养化而引起赤潮、水华等现象。
高温
====
知识点一:二氧化氮和一氧化氮
1.下列气体都有毒,使人中毒的原理与CO相似的是
( )
A.Cl2 B.SO2 C.NO D.NO2
【解析】选C。NO与CO使人中毒的原理都是结合人体内血红蛋白,使血红蛋白无法再结合氧。
2.在一定体积的密闭容器中通入a mol NO和b mol O2,反应后容器内氮原子个数与氧原子个数之比为( )
A. B.
C. D.
【解析】选C。本题抓住质量守恒定律这一关键,可以不用考虑NO与O2之间的反应关系问题。
根据反应前后原子个数和种类不变,故反应后与反应前原子个数与种类相同。n(N)=n(NO)=a mol,
n(O)=n(NO)+2n(O2)=a+2b,
故n(N)∶n(O)=a∶(a+2b)。
3.实验室收集NO、NO2两种气体( )
A.均可用排水法
B.均可用向上排空气法
C.NO用向上排空气法,NO2用排水法
D.NO用排水法,NO2用向上排空气法
【解析】选D。NO易与O2反应,不能用排空气法收集,NO2易与H2O反应,不能用排水法收集,故只有D项正确。
知识点二:二氧化硫和二氧化氮对大气的污染
4.酸雨的形成主要是由于( )
A.大气中CO2含量的增多
B.以“氟利昂”为制冷剂的空调、冰箱的大量使用
C.工业上大量燃烧含硫燃料
D.森林遭乱砍滥伐,破坏了生态平衡
【解析】选C。酸雨的形成主要是由SO2、NO2等气体引起的,而SO2主要来自于含硫的化石燃料的燃烧,C项正确;A中CO2增多会引起温室效应,而“氟利昂”主要破坏臭氧层。
5.可持续发展是全球经济发展的共同课题,珍惜地球,保护环境已成为我国的基本国策。汽车尾气(含有烃类、CO、SO2和NO等物质)是城市空气的污染源,治理方法之一是在汽车排气管上装一个“催化转化器”(用铂-钯合金作催化剂),它的特点是使CO与NO反应,生成两种可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的催化氧化。
(1)写出CO与NO在催化剂作用下的化学反应方程式
_________________________。
(2)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是__________________。
(3)控制城市空气污染源方法可行的有_______。
A.开发氢能源
B.使用电动车
C.植树造林
D.戴上呼吸面具
【解析】(1)2CO+2NO ====== 2CO2+N2
(2)生成的CO2易与水蒸气结合成碳酸,SO2催化氧化成SO3与水蒸气结合成硫酸,增加了酸度。
(3)选A。B、C、D都不能从根本上解决污染源问题。
答案:(1)2CO+2NO ====== 2CO2+N2
(2)生成的CO2易与水蒸气结合成碳酸,而SO2催化氧化成的SO3与水蒸气结合成硫酸
(3)A、B
催化剂
催化剂
一、选择题(本题包括5个小题,每小题4分,共20分)
1.保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是( )
A.①②④⑤ B.②③④⑥
C.①②④⑥ D.③④⑤⑥
【解析】选C。使用一次性筷子会加快森林的砍伐,对环境不利;过量使用化肥、农药会造成水体污染;含磷洗涤剂会导致水质富营养化而产生水华、赤潮等现象。
2.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
【解析】选C。少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量比为1∶1,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2恰好与NO反应生成NO2,逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
3.标准状况下,将NO2和O2按4∶1的体积比混合,充满干燥烧瓶,然后倒立于水中,烧瓶内液面逐渐上升,直到充满整个烧瓶,假设瓶中溶液不扩散,则烧瓶内溶液的物质的量浓度为( )
A. mol/L B. mol/L
C. mol/L D. mol/L
【解析】选C。假设烧瓶体积为V L,则V(NO2)= V L,V(O2)= V L,由N元素守恒,n(HNO3)=n(NO2)=
由于充满烧瓶,最后溶液体积为V L,
。
4.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
【解析】选B。由题意可知,所放出的气体中只有NO与空气中的O2能发生反应,生成红棕色的NO2而出现题中的现象。
5.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片振荡,得橙色溶液,气体颜色消失。再拿走玻璃片后,瓶中气体又变为红棕色,则该气体可能是下列混合气体中的( )
A.N2、NO2、Br2 B.NO2、NO、N2
C.NO2、NO、O2 D.N2、O2、Br2
【解析】选A。气体呈红棕色说明含有NO2或Br2中的至少一种,溶于水得橙色溶液说明气体中必定含有溴蒸气,所得无色气体遇空气重新变为红棕色说明无色气体含NO,即原气体中有NO2,原气体既有NO2也有Br2,只有A选项符合。
二、非选择题(本题包括1个小题,共10分)
6.将V mL NO和NO2的混合气体通过水吸收后,得到
a mL无色气体A。将此无色气体A与等体积的O2混合,通过水充分吸收后,得到5 mL无色气体B,试回答:
(1)A气体是_______,B气体是_______。
(2)A气体的体积是_______mL。
(3)V的取值范围是_____________。
【解析】(1)NO、NO2混合气体与水反应后只能得到无色气体NO,即A为NO。NO与O2等体积混合后与水反应,据4NO+3O2+2H2O====4HNO3知,剩余气体为O2。
(2)设A气体的体积为x,则x- x=5 mL,x=20 mL。
(3)按极限取值法,若V mL全为NO,则V =20;
若V mL全为NO2,则V=60,故其取值范围为:20
于水槽中,然后通入相同状况下的m mL O2,若已知
n>m,则充分反应后试管中的气体在相同状况下的体积
为( )
A. mL B. mL
mL D.3(n-m) mL
【解析】选B。NO、NO2、O2混合气体与水作用,可按
1∶1∶1恰好完全溶于水计算。也可用方程式:4NO+
3O2+2H2O====4HNO3和4NO2+O2+2H2O====4HNO3解答。
4NO+3O2+2H2O====4HNO3
4 3
m m
余O2(m- m)= m mL
4NO2+O2+2H2O====4HNO3
4 1
m m
故余NO2 (n-m) mL
最后的气体为NO,V(NO)= (n-m) mL。
2.(14分)2008年奥运会在北京成功举行。奥运前夕,为了改善北京的空气质量,北京市对汽车实行了单双号限行,全国多数的火力发电厂纷纷减少发电量,这些措施最大程度地减少了酸雨的产生。
科学兴趣小组为了研究酸雨的成分及成因,对取得的酸雨样品进行了pH的测定,随时间推移,得到了如下的实验数据。
(1)雨水样品放置时,pH变化的主要原因为:_______
_______________(用化学方程式表示),由此可以得出酸雨形成的过程可能是___________________。
(2)下列各选项是酸雨给人类造成的危害,其中不正确的是__________。
A.腐蚀建筑物、雕塑等 B.污染水源
C.改良碱性土壤 D.损害庄稼
(3)现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤作燃料,③燃煤时鼓入足量空气,④开发清洁能源。其中能减少酸雨产生的措施是______。
A.①②③ B.②③④ C.①②④ D.①③④
(4)实验室中进行SO2的制备及性质实验时,在装置最后必须有______装置,所选试剂为_______,发生反应的离子方程式为___________________。
(5)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用氢氧化钙的悬浊液吸收煤燃烧时产生的二氧化硫气体,并用来制取石膏(CaSO4·2H2O),有关反应的化学方程式为:__________________,
__________________________________________,
__________________________________________。
②硫酸工业中常用浓氨水来吸收二氧化硫,有关的化学方程式为:_______________________________,
___________________________________________。
【解析】(1)酸雨主要是SO2及NO2等溶于水生成的,故酸雨的成分中既含有HNO3,也含有H2SO3、H2SO4等,H2SO3不稳定,具有强的还原性,可被空气中的O2氧化为H2SO4,故氧化后溶液的酸性变强,pH减小。
(2)酸雨危害极大,会危害农作物、森林、草原、鱼类、建筑物、工业设备、电信电缆等。
(3)要减少酸雨的产生,首先要了解大气中二氧化硫的来源。大气中二氧化硫的来源主要是化石燃料的燃烧,以及含硫矿石的冶炼和硫酸、磷肥、造纸等生产过程中产生的尾气。因此少用煤作燃料以及对燃料进行脱硫处理,是减少酸雨的有效措施。开发新能源如氢能、核能等可以从根本上杜绝二氧化硫的产生,燃煤时鼓入足量空气不会减少SO2的排放。
(4)SO2有毒,会污染环境,因此必须有尾气吸收装置,可在洗气瓶中装入NaOH溶液,发生反应的离子方程式为SO2+2OH-====SO32-+H2O。
答案:(1)2H2SO3+O2====2H2SO4 雨水溶解SO2生成H2SO3,H2SO3被空气中的氧气氧化为H2SO4,降落下来而形成酸雨 (2)C (3)C (4)尾气吸收 NaOH溶液
SO2+2OH-====SO32-+H2O
(5)①Ca(OH)2+SO2====CaSO3↓+H2O
2CaSO3+O2====2CaSO4
CaSO4+2H2O====CaSO4·2H2O
②2NH3·H2O+SO2====(NH4)2SO3+H2O
2(NH4)2SO3+O2====2(NH4)2SO4
