10-11高中化学课时讲练通课件:442 氨 硝酸 硫酸(人教版必修1)(共56张PPT)
文档属性
| 名称 | 10-11高中化学课时讲练通课件:442 氨 硝酸 硫酸(人教版必修1)(共56张PPT) |  | |
| 格式 | rar | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-11-13 20:06:45 | ||
图片预览











文档简介
(共56张PPT)
【典例1】下列现象反映了硫酸的哪些主要性质?(填空)
(1)浓硫酸滴在木条上,过一会儿,木条变黑:_____。
(2)敞口放置浓硫酸时,质量增加:_______。
(3)锌粒投入稀硫酸中,有气泡产生:________。
(4)把铜片放入浓硫酸里加热,有气体产生:_____。
(5)浓硫酸不能用来干燥硫化氢气体:______。
【思路点拨】解答本题要注意浓硫酸的性质和浓、稀硫酸性质的差异。
【自主解答】木条变黑,原因是木条中H和O被浓硫酸按2∶1脱去。敞口放置的浓硫酸会吸收空气中的水蒸气,质量增加。稀硫酸可与氢之前的活泼金属反应产生氢气,是利用稀硫酸的酸性,铜与浓硫酸反应生成CuSO4体现浓硫酸的酸性,生成SO2体现浓硫酸的强氧化性;H2S气体具有较强还原性,遇具有强氧化性的浓硫酸,会被浓硫酸氧化,故不能用浓硫酸干燥H2S气体。
答案:(1)脱水性 (2)吸水性 (3)酸性
(4)强氧化性、酸性 (5)强氧化性
【典例2】(2009·全国卷Ⅱ)物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1∶4 B.1∶5
C.2∶3 D.2∶5
【思路点拨】本题考查了氧化还原反应原理及电子得失守恒的应用。忽略中间过程,找出最终得失电子的物质及得失电子的个数是解决问题的关键。
【自主解答】选A。设2 mol Zn参与反应,因Zn无剩余,则最终生成了2 mol Zn(NO3)2,显然含有4 mol NO3-,这部分是由没有参与氧化还原反应的HNO3转化而来;HNO3→N2O过程中N元素的化合价+5价→+1价,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=
1 mol,即有1 mol HNO3被还原。
知识点一:硫酸
1.向50 mL 18 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol
解题提示:浓H2SO4与Cu加热发生反应,而H2SO4浓度减小到一定程度,反应不再进行。
【解析】选A。本题旨在考查浓硫酸的特性之一——强氧化性以及根据反应方程式进行定量计算。
根据要求,不仅要知道浓、稀溶液,还要知道什么浓度范围内是浓溶液及稀溶液。现在有18 mol/L的H2SO4溶液,是浓H2SO4,在与足量的铜片反应过程中,逐渐变稀,稀H2SO4不与Cu反应。从Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O可知,浓H2SO4每有2 mol参加反应,则有1 mol被还原,变成稀H2SO4后,反应逐渐停止,由H2SO4的量可知,被还原的量应小于0.45 mol。
====
2.在热的稀H2SO4中投入铜片,然后通入空气,实验现象为( )
①无明显现象,因为不发生反应
②铜片溶解,溶液变蓝
③铜片上有气体
④铜片溶解,有SO2生成
⑤铜片变黑有H2放出
A.④⑤ B.②④ C.② D.③④
【解析】选C。发生的反应有:2Cu+O2 △ 2CuO,CuO+H2SO4====CuSO4+H2O。
====
3.在加热条件下,木炭和浓H2SO4可发生反应:C+2H2SO4(浓) △ CO2↑+2SO2↑+2H2O,关于该反应下列叙述不正确的是( )
A.该反应中碳作还原剂
B.该反应中浓硫酸发生还原反应
C.该反应中浓硫酸表现强氧化性
D.每有0.1 mol CO2生成,就转移0.2 mol电子
【解析】选D。在木炭与浓H2SO4的反应中,碳被浓H2SO4氧化,碳作还原剂,浓H2SO4被还原发生还原反应,每有0.1 mol CO2生成转移的电子的物质的量为0.4 mol,故D错。
====
知识点二:硝酸
4.(双选)下列块状金属在常温时,能全部溶于足量的浓硝酸的是( )
A.Ag B.Cu C.Al D.Fe
【解析】选A、B。常温下Ag、Cu能与浓硝酸反应,而Al、Fe却被钝化。
5.(双选)打开盛有下列试剂的试剂瓶,有白雾出现的是( )
A.浓硫酸 B.浓硝酸 C.稀硝酸 D.浓盐酸
【解析】选B、D。浓硝酸、浓盐酸具有挥发性,浓硝酸瓶口的白雾是硝酸小液滴,浓盐酸瓶口的白雾是盐酸小液滴。
6.探究SO42-的检验方法。
(1)分析以下两个方案能否判断溶液中是否存在SO42-
①能否判断:_______________________________。
②原因:___________________________________。
①能否判断:_________________________。
②原因:____________________________。
(2)根据以上两个实验,探究检验SO42-的正确方法。
【解析】本题是探究SO42-的检验方法,同时也在考查HNO3的强氧化性,从而干扰SO42-的检验,因此在SO42-的检验过程中应避免HNO3的加入。
答案:(1)①不能 ②若试样中有Ag+,而无SO42-,同样会发生上述现象
①不能 ②若试样A中有SO32-,而无SO42-,同样会发生上述现象
(2)
一、选择题(本题包括4个小题,每小题5分,共20分)
1.下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.SO2、O2、HBr B.NH3、O2、N2
C.NH3、CO2、HCl D.H2、CH4、O2
【解析】选D。SO2、HBr属于酸性气体,能与碱石灰反应,且HBr又属于还原性气体,能被浓H2SO4氧化,故不选A;因为NH3是碱性气体,与浓硫酸反应,故不选B;因为NH3与HCl易化合生成NH4Cl,两气体不能大量共存,且NH3与浓硫酸反应,HCl与碱石灰反应,故不选C;因为H2、CH4、O2在常温常压下互不反应,且各气体既不与浓H2SO4反应,又不与碱石灰反应,符合题意,所以选D。
2.在铜跟稀硝酸的反应中,如果有1 mol硝酸被还原,则被氧化的铜的物质的量为( )
A.3/8 mol B.8/3 mol
C.3 mol D.3/2 mol
【解析】选D。铜与稀硝酸的反应原理为:3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O,硝酸起酸性和氧化性作用,每有8 mol HNO3参加反应其中只有
2 mol被还原,有3 mol Cu被氧化,故1 mol硝酸被还
原,就有 mol铜被氧化。
3.(双选)下列反应中,浓硝酸既能表现强氧化性,又能表现酸性的是( )
A.浓硝酸中滴入紫色石蕊试液
B.氧化亚铁与浓硝酸反应
C.氢氧化铜与浓硝酸反应
D.碳与浓硝酸反应
【解析】选A、B。浓硝酸中滴入石蕊试液先变红后褪色,变红是由于浓硝酸具有酸性,红色褪去是由于浓硝酸的强氧化性所致;FeO与浓硝酸反应生成硝酸盐表现出硝酸的酸性,Fe2+被氧化为Fe3+表现浓硝酸的强氧化性,氢氧化铜与硝酸只发生中和反应,而碳与浓硝酸的反应只体现了强氧化性。
4.(2010·北京高考)用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
【解析】选D。为确认CuSO4生成,因为①中有浓硫酸,所以应把①中的溶液倒入盛有水的小烧杯中。
二、非选择题(本题包括1个小题,共10分)
5.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为
11.2 L。请回答:
(1)NO的体积为_____L,NO2的体积为_____L。
(2)待产生的气体全部释放后,向溶液中加入V mL
a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水______g。
【解析】(1)设生成NO的物质的量为x,NO2 的物质的量为y
则有
解x=0.26 mol y=0.24 mol
V(NO)=0.26 mol×22.4 L/mol=5.824 L
V(NO2)=0.24 mol×22.4 L/mol=5.376 L
(2)由原子守恒得:
n(HNO3)=n(气体)+n(NaOH)
所以c(HNO3)= mol·L-1。
(3)由得失电子守恒得:
0.24 mol×1+0.26 mol×3=2n(H2O2)
解得n(H2O2)=0.51 mol,
m(H2O2)= =57.8 g。
答案:(1)5.824 5.376
(2) (3)57.8
1.(6分)38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4 mL(标准状况)气体,则反应消耗的硝酸的物质的量可能是( )
A.1.0×10-3 mol B.1.6×10-3 mol
C.2.2×10-3 mol D.2.4×10-3 mol
【解析】选C。本题主要考查硝酸与铜反应的有关计算。解题时依据氮元素守恒及得失电子守恒来解题。
2.(14分)(2009·全国卷Ⅰ)浓硫酸和木炭在加热时发生反应的化学方程式是:
2H2SO4(浓)+C △ CO2↑+2H2O+2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓硫酸、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
====
将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
【解析】这是一道学生非常熟悉的常规题目,考查CO2、SO2、水蒸气的检验。成套装置包括反应装置、检验装置和尾气处理装置。C中加入浓硫酸和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其他试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红溶液检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,然后再用装置A,放入品红,检验品红是否除尽,因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,故先要除去SO2。
答案:C 浓硫酸和木炭 生成产物
B 无水硫酸铜 检验是否有水
A 品红溶液 检验SO2
A 酸性KMnO4 除去SO2
A 品红溶液 检验SO2是否除尽
A 澄清石灰水 检验CO2的存在
【典例1】下列现象反映了硫酸的哪些主要性质?(填空)
(1)浓硫酸滴在木条上,过一会儿,木条变黑:_____。
(2)敞口放置浓硫酸时,质量增加:_______。
(3)锌粒投入稀硫酸中,有气泡产生:________。
(4)把铜片放入浓硫酸里加热,有气体产生:_____。
(5)浓硫酸不能用来干燥硫化氢气体:______。
【思路点拨】解答本题要注意浓硫酸的性质和浓、稀硫酸性质的差异。
【自主解答】木条变黑,原因是木条中H和O被浓硫酸按2∶1脱去。敞口放置的浓硫酸会吸收空气中的水蒸气,质量增加。稀硫酸可与氢之前的活泼金属反应产生氢气,是利用稀硫酸的酸性,铜与浓硫酸反应生成CuSO4体现浓硫酸的酸性,生成SO2体现浓硫酸的强氧化性;H2S气体具有较强还原性,遇具有强氧化性的浓硫酸,会被浓硫酸氧化,故不能用浓硫酸干燥H2S气体。
答案:(1)脱水性 (2)吸水性 (3)酸性
(4)强氧化性、酸性 (5)强氧化性
【典例2】(2009·全国卷Ⅱ)物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1∶4 B.1∶5
C.2∶3 D.2∶5
【思路点拨】本题考查了氧化还原反应原理及电子得失守恒的应用。忽略中间过程,找出最终得失电子的物质及得失电子的个数是解决问题的关键。
【自主解答】选A。设2 mol Zn参与反应,因Zn无剩余,则最终生成了2 mol Zn(NO3)2,显然含有4 mol NO3-,这部分是由没有参与氧化还原反应的HNO3转化而来;HNO3→N2O过程中N元素的化合价+5价→+1价,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=
1 mol,即有1 mol HNO3被还原。
知识点一:硫酸
1.向50 mL 18 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol
解题提示:浓H2SO4与Cu加热发生反应,而H2SO4浓度减小到一定程度,反应不再进行。
【解析】选A。本题旨在考查浓硫酸的特性之一——强氧化性以及根据反应方程式进行定量计算。
根据要求,不仅要知道浓、稀溶液,还要知道什么浓度范围内是浓溶液及稀溶液。现在有18 mol/L的H2SO4溶液,是浓H2SO4,在与足量的铜片反应过程中,逐渐变稀,稀H2SO4不与Cu反应。从Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O可知,浓H2SO4每有2 mol参加反应,则有1 mol被还原,变成稀H2SO4后,反应逐渐停止,由H2SO4的量可知,被还原的量应小于0.45 mol。
====
2.在热的稀H2SO4中投入铜片,然后通入空气,实验现象为( )
①无明显现象,因为不发生反应
②铜片溶解,溶液变蓝
③铜片上有气体
④铜片溶解,有SO2生成
⑤铜片变黑有H2放出
A.④⑤ B.②④ C.② D.③④
【解析】选C。发生的反应有:2Cu+O2 △ 2CuO,CuO+H2SO4====CuSO4+H2O。
====
3.在加热条件下,木炭和浓H2SO4可发生反应:C+2H2SO4(浓) △ CO2↑+2SO2↑+2H2O,关于该反应下列叙述不正确的是( )
A.该反应中碳作还原剂
B.该反应中浓硫酸发生还原反应
C.该反应中浓硫酸表现强氧化性
D.每有0.1 mol CO2生成,就转移0.2 mol电子
【解析】选D。在木炭与浓H2SO4的反应中,碳被浓H2SO4氧化,碳作还原剂,浓H2SO4被还原发生还原反应,每有0.1 mol CO2生成转移的电子的物质的量为0.4 mol,故D错。
====
知识点二:硝酸
4.(双选)下列块状金属在常温时,能全部溶于足量的浓硝酸的是( )
A.Ag B.Cu C.Al D.Fe
【解析】选A、B。常温下Ag、Cu能与浓硝酸反应,而Al、Fe却被钝化。
5.(双选)打开盛有下列试剂的试剂瓶,有白雾出现的是( )
A.浓硫酸 B.浓硝酸 C.稀硝酸 D.浓盐酸
【解析】选B、D。浓硝酸、浓盐酸具有挥发性,浓硝酸瓶口的白雾是硝酸小液滴,浓盐酸瓶口的白雾是盐酸小液滴。
6.探究SO42-的检验方法。
(1)分析以下两个方案能否判断溶液中是否存在SO42-
①能否判断:_______________________________。
②原因:___________________________________。
①能否判断:_________________________。
②原因:____________________________。
(2)根据以上两个实验,探究检验SO42-的正确方法。
【解析】本题是探究SO42-的检验方法,同时也在考查HNO3的强氧化性,从而干扰SO42-的检验,因此在SO42-的检验过程中应避免HNO3的加入。
答案:(1)①不能 ②若试样中有Ag+,而无SO42-,同样会发生上述现象
①不能 ②若试样A中有SO32-,而无SO42-,同样会发生上述现象
(2)
一、选择题(本题包括4个小题,每小题5分,共20分)
1.下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.SO2、O2、HBr B.NH3、O2、N2
C.NH3、CO2、HCl D.H2、CH4、O2
【解析】选D。SO2、HBr属于酸性气体,能与碱石灰反应,且HBr又属于还原性气体,能被浓H2SO4氧化,故不选A;因为NH3是碱性气体,与浓硫酸反应,故不选B;因为NH3与HCl易化合生成NH4Cl,两气体不能大量共存,且NH3与浓硫酸反应,HCl与碱石灰反应,故不选C;因为H2、CH4、O2在常温常压下互不反应,且各气体既不与浓H2SO4反应,又不与碱石灰反应,符合题意,所以选D。
2.在铜跟稀硝酸的反应中,如果有1 mol硝酸被还原,则被氧化的铜的物质的量为( )
A.3/8 mol B.8/3 mol
C.3 mol D.3/2 mol
【解析】选D。铜与稀硝酸的反应原理为:3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O,硝酸起酸性和氧化性作用,每有8 mol HNO3参加反应其中只有
2 mol被还原,有3 mol Cu被氧化,故1 mol硝酸被还
原,就有 mol铜被氧化。
3.(双选)下列反应中,浓硝酸既能表现强氧化性,又能表现酸性的是( )
A.浓硝酸中滴入紫色石蕊试液
B.氧化亚铁与浓硝酸反应
C.氢氧化铜与浓硝酸反应
D.碳与浓硝酸反应
【解析】选A、B。浓硝酸中滴入石蕊试液先变红后褪色,变红是由于浓硝酸具有酸性,红色褪去是由于浓硝酸的强氧化性所致;FeO与浓硝酸反应生成硝酸盐表现出硝酸的酸性,Fe2+被氧化为Fe3+表现浓硝酸的强氧化性,氢氧化铜与硝酸只发生中和反应,而碳与浓硝酸的反应只体现了强氧化性。
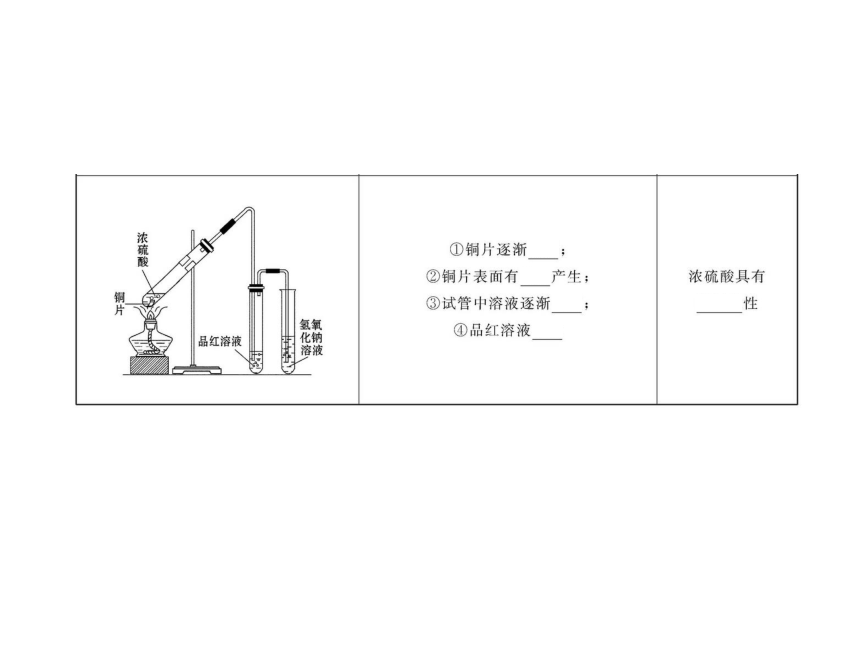
4.(2010·北京高考)用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
【解析】选D。为确认CuSO4生成,因为①中有浓硫酸,所以应把①中的溶液倒入盛有水的小烧杯中。
二、非选择题(本题包括1个小题,共10分)
5.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为
11.2 L。请回答:
(1)NO的体积为_____L,NO2的体积为_____L。
(2)待产生的气体全部释放后,向溶液中加入V mL
a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水______g。
【解析】(1)设生成NO的物质的量为x,NO2 的物质的量为y
则有
解x=0.26 mol y=0.24 mol
V(NO)=0.26 mol×22.4 L/mol=5.824 L
V(NO2)=0.24 mol×22.4 L/mol=5.376 L
(2)由原子守恒得:
n(HNO3)=n(气体)+n(NaOH)
所以c(HNO3)= mol·L-1。
(3)由得失电子守恒得:
0.24 mol×1+0.26 mol×3=2n(H2O2)
解得n(H2O2)=0.51 mol,
m(H2O2)= =57.8 g。
答案:(1)5.824 5.376
(2) (3)57.8
1.(6分)38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4 mL(标准状况)气体,则反应消耗的硝酸的物质的量可能是( )
A.1.0×10-3 mol B.1.6×10-3 mol
C.2.2×10-3 mol D.2.4×10-3 mol
【解析】选C。本题主要考查硝酸与铜反应的有关计算。解题时依据氮元素守恒及得失电子守恒来解题。
2.(14分)(2009·全国卷Ⅰ)浓硫酸和木炭在加热时发生反应的化学方程式是:
2H2SO4(浓)+C △ CO2↑+2H2O+2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并要检出反应产物的装置。现提供浓硫酸、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器所用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
====
将所选的仪器连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
【解析】这是一道学生非常熟悉的常规题目,考查CO2、SO2、水蒸气的检验。成套装置包括反应装置、检验装置和尾气处理装置。C中加入浓硫酸和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其他试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红溶液检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,然后再用装置A,放入品红,检验品红是否除尽,因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,故先要除去SO2。
答案:C 浓硫酸和木炭 生成产物
B 无水硫酸铜 检验是否有水
A 品红溶液 检验SO2
A 酸性KMnO4 除去SO2
A 品红溶液 检验SO2是否除尽
A 澄清石灰水 检验CO2的存在
