2020-2021学年江苏省南通市海安市高三(上)期中化学试卷(含解析)
文档属性
| 名称 | 2020-2021学年江苏省南通市海安市高三(上)期中化学试卷(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 426.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-20 21:52:14 | ||
图片预览



文档简介
2020-2021学年江苏省南通市海安市高三(上)期中化学试卷
一、选择题(共9小题,每小题2分,满分20分)
1.化学与科技、社会、生产密切相关。下列说法正确的是( )
A.生产SMS医用口罩所用的一种原料丙烯,主要来源于石油的裂化
B.纤维漂白剂NO2在低温时变成无色液体,该过程属于物理变化
C.核酸检测是诊断新冠肺炎的重要依据,核酸组成为C、H、O三种元素
D.过氧化氢空气消毒机广泛应用于抗疫中,这是利用了过氧化氢的氧化性
2.下列化学用语不正确的是( )
A.S2﹣的结构示意图:
B.中子数为7的氮原子:N
C.葡萄糖分子的实验式:CH2O
D.乙炔的结构式:H﹣C≡C﹣H
3.下列有关物质的性质与用途具有对应关系的是( )
A.二氧化硫具有强还原性,可用作漂白剂
B.硅胶具有弱酸性,可用作袋装食品的干燥剂
C.硝酸能发生酯化反应,可用于制造硝化甘油
D.氧化铝熔点高,可用于制坩埚熔化烧碱固体
4.室温时,下列各环境下的离子组合一定能够大量共存的是( )
A.0.1mol/L
Na2CO3的溶液中:Ca2+、Fe3+、SO42﹣、Cl﹣
B.0.1mol/L
HCl的溶液中:Fe3+、K+、I﹣、NO3﹣
C.0.1mol/L
NaOH的溶液中:K+、Ba2+、Cl﹣、ClO﹣
D.0.1mol/L
NaHCO3的溶液中:Na+、K+、Al3+、Cl﹣
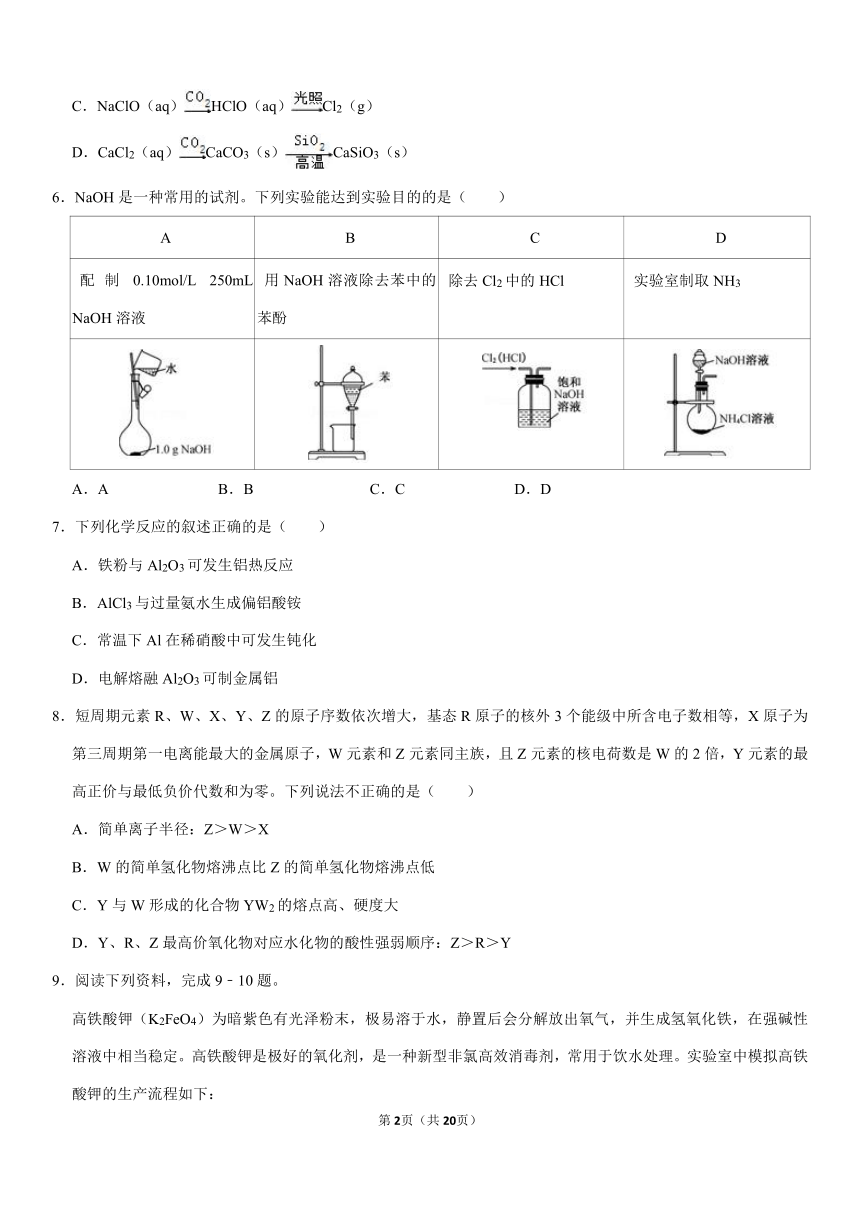
5.在一定条件下,下列转化关系正确的是( )
A.CuO(s)Cu(OH)2(s)Cu2O(s)
B.Na(s)Na2O2(s)NaOH(aq)
C.NaClO(aq)HClO(aq)Cl2(g)
D.CaCl2(aq)CaCO3(s)CaSiO3(s)
6.NaOH是一种常用的试剂。下列实验能达到实验目的的是( )
A
B
C
D
配制0.10mol/L
250mL
NaOH溶液
用NaOH溶液除去苯中的苯酚
除去Cl2中的HCl
实验室制取NH3
A.A
B.B
C.C
D.D
7.下列化学反应的叙述正确的是( )
A.铁粉与Al2O3可发生铝热反应
B.AlCl3与过量氨水生成偏铝酸铵
C.常温下Al在稀硝酸中可发生钝化
D.电解熔融Al2O3可制金属铝
8.短周期元素R、W、X、Y、Z的原子序数依次增大,基态R原子的核外3个能级中所含电子数相等,X原子为第三周期第一电离能最大的金属原子,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y元素的最高正价与最低负价代数和为零。下列说法不正确的是( )
A.简单离子半径:Z>W>X
B.W的简单氢化物熔沸点比Z的简单氢化物熔沸点低
C.Y与W形成的化合物YW2的熔点高、硬度大
D.Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y
9.阅读下列资料,完成9﹣10题。
高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如下:
上述流程中涉及的离子反应方程式书写不正确的是( )
A.反应①:2Cl﹣+2H2OCl2↑+H2↑+2OH﹣
B.反应②:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
C.反应③:3Fe3O4+28H++NO3﹣═9Fe3++NO↑+14H2O
D.反应④:2Fe3++3ClO﹣+5H2O═2FeO42﹣+3Cl﹣+10H+
10.阅读下列资料,完成9﹣10题。
高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如下:
下列说法正确的是( )
A.K2FeO4具有强氧化性,所以能够吸附水中的悬浮物质,起到絮凝沉淀作用
B.上述流程反应④中,每生成1mol
K2FeO4转移电子为4mol
C.当1mol
K2FeO4与水反应时,生成O2的体积在标准状况下为16.8L
D.K2FeO4能够将亚硝酸盐氧化为硝酸盐,氧化剂与还原剂的物质的量之比为3:2
二、不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色
该溶液中一定不含K+
B
将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生
非金属性:Cl>Si
C
向盛有Na2SO3溶液的试管中加入盐酸酸化,无白色沉淀,再加氯化钡溶液,生成白色沉淀
原Na2SO3已被氧化
D
向20%麦芽糖溶液中加入少量稀硫酸、加热水解,冷却后加入银氨溶液,水浴加热,未出现银镜
麦芽糖水解产物不具有还原性
A.A
B.B
C.C
D.D
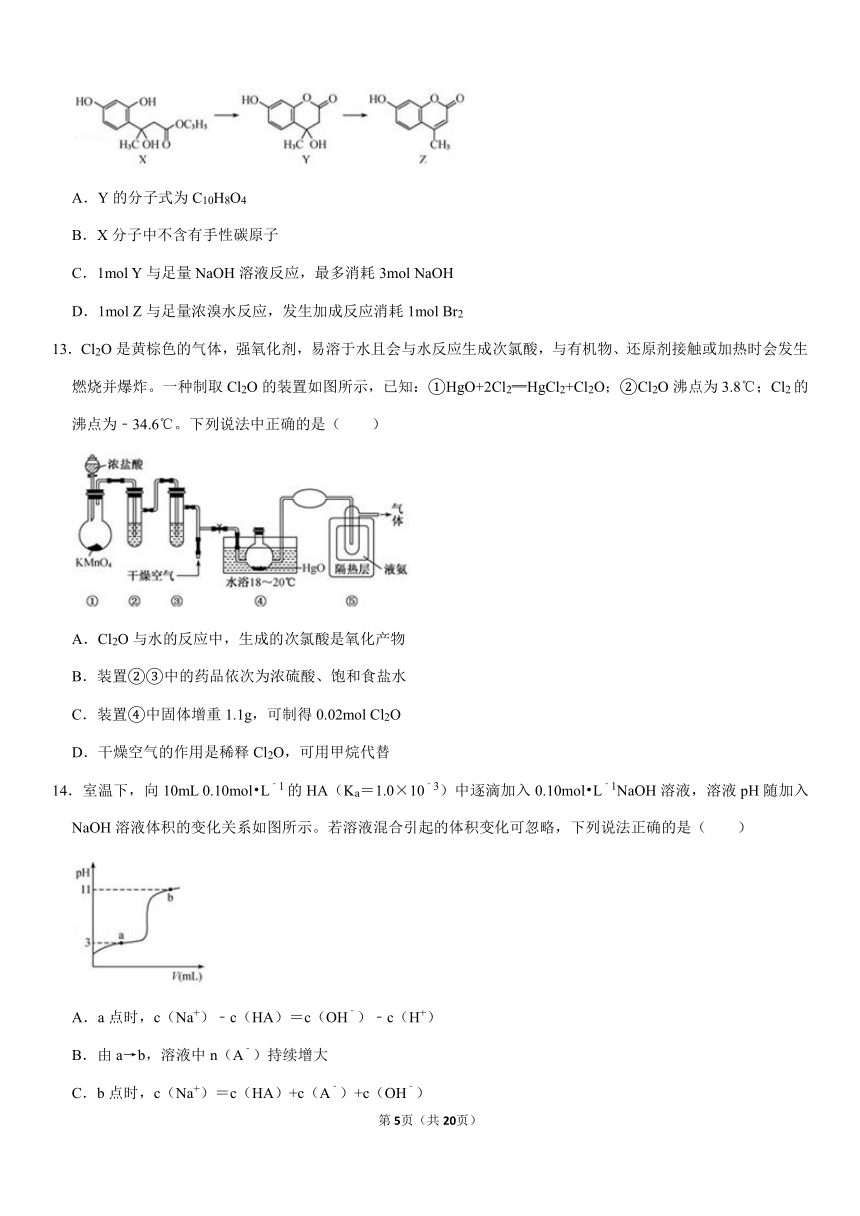
12.羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化,下列有关说法正确的是( )
A.Y的分子式为C10H8O4
B.X分子中不含有手性碳原子
C.1mol
Y与足量NaOH溶液反应,最多消耗3mol
NaOH
D.1mol
Z与足量浓溴水反应,发生加成反应消耗1mol
Br2
13.Cl2O是黄棕色的气体,强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示,已知:①HgO+2Cl2═HgCl2+Cl2O;②Cl2O沸点为3.8℃;Cl2的沸点为﹣34.6℃。下列说法中正确的是( )
A.Cl2O与水的反应中,生成的次氯酸是氧化产物
B.装置②③中的药品依次为浓硫酸、饱和食盐水
C.装置④中固体增重1.1g,可制得0.02mol
Cl2O
D.干燥空气的作用是稀释Cl2O,可用甲烷代替
14.室温下,向10mL
0.10mol?L﹣1的HA(Ka=1.0×10﹣3)中逐滴加入0.10mol?L﹣1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。若溶液混合引起的体积变化可忽略,下列说法正确的是( )
A.a点时,c(Na+)﹣c(HA)=c(OH﹣)﹣c(H+)
B.由a→b,溶液中n(A﹣)持续增大
C.b点时,c(Na+)=c(HA)+c(A﹣)+c(OH﹣)
D.V=10mL时,c(HA)+c(A﹣)+c(Na+)=0.20mol?L﹣1
15.2019年9月我国科研人员研制出Ti﹣H﹣Fe双温区催化剂,其中Ti﹣H区域和Fe区域的温度差可超过100℃。Ti﹣H﹣Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用标注。下列说法正确的是( )
A.能量变化最大的过程中发生了N≡N断裂
B.过程②③处于高温区域;过程⑤处于低温区域
C.过程④表示N原子由Fe区域向Ti﹣H区域传递
D.使用双温区催化合成氨,使合成氨反应转化为吸热反应
二、解答题(共5小题,满分60分)
16.砷(As)元素广泛的存在于自然界。金属冶炼过程产生的含砷有毒工业废水经处理转化为粗As2O3流程如图1所示。
已知:砷酸盐比亚砷酸盐更难溶。H3AsO3受热易分解为As2O3。
(1)H3AsO3溶液中各组分的物质的量分数随pH变化如图2所示:用NaOH溶液调节pH至11时亚砷酸主要反应的离子方程式为
。
(2)通入空气氧化的目的为
。
(3)滤渣的主要成分为
。
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
①Ca(OH)2(s)?Ca2+(aq)+2OH﹣(aq)△H<0
②5Ca2+(aq)+OH﹣(aq)+3AsO43﹣(aq)?Ca5(AsO4)3OH(s)△H>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是
。
(5)还原过程中发生反应的化学方程式为
。
(6)上述流程中可循环使用的物质为
。(填写化学式)
17.元素周期表中第四周期的某些过渡元素(如V、Zn、Co等)在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①基态钒原子的外围电子排布式为
。
②V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为
。
(2)Co(NH3)5Cl3是钴的一种配合物,中心离子的配位数为6,向100mL0.2mol?L﹣1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀。
①NO3﹣的空间构型为
。
②则该配合物中配离子的化学式为
。
(3)ZnF2是生成良好的光学基质材料KZnF3的原料,ZnF2、KZnF3两种晶体的晶胞结构如图所示。
①已知:ZnF2的熔点为872℃,ZnCl2的熔点为275℃,ZnBr2的熔点为394℃,ZnBr2的熔点高于ZnCl2的原因为
。
②KZnF3晶体(晶胞顶点为K+)中,与Zn2+最近且等距离的F﹣数为
。
③若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为
g/cm3。(用含a、c、NA的代数式表示)
18.以化合物A为原料合成化合物M的线路如图所示。
(1)写出化合物B中含氧官能团的名称为
。
(2)④的反应类型为
。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:
。
①能与FeCl3发生显色反应;
②分子中有3种不同化学环境的氢。
(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式:
。
(5)以苯酚、化合物A为原料合成,写出制备该物质的合成路线流程图
。(无机试剂任用,合成路线流程图示例见本题题干)
19.实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、SiO2等)制备K2CrO4的工艺流程如图1。
已知:
①Cr(OH)3不溶于水,与Al(OH)3类似,具有两性;
②酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;
③+6价的Cr在溶液pH<5时,主要以Cr2O72﹣的形式存在;在pH>7时,主要以CrO42﹣的形式存在;
④部分物质溶解度曲线如图2所示。
(1)用KOH调节pH至11~12的目的是
。
(2)写出加入30%
H2O2过程中发生的离子反应方程式:
。
(3)流程中K2CrO4溶液含有少量过氧化氢,经过多步处理制得K2Cr2O7晶体。请补充完整由K2CrO4溶液为原料制备K2Cr2O7晶体的实验方案:取一定量流程中的K2CrO4溶液于烧杯中,
,过滤、冰水洗涤及干燥。(实验中必须使用的试剂:稀盐酸)
(4)铁明矾[Al2Fe(SO4)4?24H2O]在空气中能被氧气氧化,久置后生成盐A,盐A的化学式为Al2Fe(OH)x(SO4)4?24H2O。为确定盐A的化学式,学习小组进行如下实验:
①取一定质量的盐A样品溶于足量的稀硫酸中,将溶液分为两等份;
②其中一份与酸性K2Cr2O7溶液充分反应(反应后Cr2O72﹣被还原成Cr3+),消耗浓度为0.3000mol?L﹣1的K2Cr2O7溶液25.00mL;
③往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.10g干燥固体粉末。通过计算确定x的值。(写出计算过程)
20.CO2的综合利用是解决温室问题的有效途径。
(1)Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式:
;该反应为
(填“吸热”或“放热”)反应。
(2)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图1所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应,单次循环可生成
mol C(碳)。
(3)利用CO2与H2合成甲醇涉及的主要反应如下:
a.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=﹣58kJ?mol﹣1
b.CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41kJ?mol
则CO(g)与H2(g)合成CH3OH(g)的热化学方程式为:
。
(4)中国科学家首次用CO2高效合成乙酸,其反应路径如图2所示。
①根据图2所示,写出总反应的化学方程式:
。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
。
③催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。300℃到400℃之间,乙酸生成速率加快的原因是
。
2020-2021学年江苏省南通市海安市高三(上)期中化学试卷
试题解析
一、选择题(共9小题,每小题2分,满分20分)
1.解:A.裂化的目的是为了提高汽油的产量,丙烯为石油裂解产物,故A错误;
B.低温时NO2转化为无色液体N2O4,发生了化学变化,故B错误;
C.核素中含有蛋白质,蛋白质由C、H、O、N等组成,则核酸组成为C、H、O、N等元素,故C错误;
D.过氧化氢具有强氧化性,能使蛋白质变性,可用于杀菌消毒,所以过氧化氢空气消毒机广泛应用于抗疫中,这是利用了过氧化氢的氧化性,故D正确;
故选:D。
2.解:A.S2﹣的核电荷数为16,其离子结构示意图为,故A错误;
B.中子数为7的氮原子的质量数为7+7=14,该原子可以表示为:N,故B正确;
C.葡萄糖的分子式为C6H12O6,其实验式CH2O,故C正确;
D.乙炔的结构式为H﹣C≡C﹣H,故D正确;
故选:A。
3.解:A.二氧化硫能够与有色物质化合生成无色物质,所以具有漂白性,能做漂白剂,与其还原性无关,故A错误;
B.硅胶疏松多孔,具有吸水性,可用作袋装食品的干燥剂,与其有弱酸性无关,故B错误;
C.硝酸能与醇发生酯化反应,能与甘油发生酯化反应生成硝化甘油,故C正确;
D.氧化铝是两性氧化物,能与强碱反应,所以氧化铝坩埚不能熔融烧碱,故D错误;
故选:C。
4.解:A.Ca2+、Fe3+都与CO32﹣反应,不能大量共存,故A错误;
B.Fe3+、I﹣之间发生氧化还原反应,I﹣、NO3﹣在酸性条件下发生氧化还原反应,不能大量共存,故B错误;
C.K+、Ba2+、Cl﹣、ClO﹣之间不反应,都不与Na+、OH﹣反应,能够大量共存,故C正确;
D.Al3+、HCO3﹣之间发生反应生成氢氧化铝沉淀和二氧化碳气体,不能大量共存,故D错误;
故选:C。
5.解:A.氧化铜与水不反应,也难溶于水,故A错误;
B.金属钠与氧气在点燃条件下生成过氧化钠,过氧化钠与水生成氢氧化钠和氧气,故B正确;
C.次氯酸见光分解生成盐酸和氧气,故C错误;
D.二氧化碳与氯化钙若反应,生成碳酸钙和盐酸,不符合“强酸制弱酸”原理,故D错误;
故选:B。
6.解:A.不能在容量瓶中溶解固体,应在烧杯中溶解、冷却后转移到容量瓶中定容,故A错误;
B.NaOH与苯酚反应后,与苯分层,然后分液可分离,且苯在上层,故B正确;
C.二者均与NaOH溶液反应,不能除杂,故C错误;
D.NaOH溶液与氯化铵溶液生成一水合氨,应选浓氨水与碱混合制备,故D错误;
故选:B。
7.解:A.还原性:Fe<Al,铁粉与Al2O3无法发生铝热反应,故A错误;
B.AlCl3与过量氨水生成氢氧化铝沉淀和氯化铵,不会生成偏铝酸钠,故B错误;
C.常温下Al与稀硝酸反应生成硝酸铝、NO和水,不会发生钝化,故C错误;
D.Al的活泼性较强,工业上通过电解熔融Al2O3冶炼金属铝,故D正确;
故选:D。
8.解:结合分析可知,R为C,W为O,X为Na,Y为Si,Z为S元素,
A.电子层越多离子半径越大,电子层结构相同时,核电荷数越大离子半径越小,则简单离子半径:Z>W>X,故A正确;
B.水分子之间存在氢键,导致水的沸点较高,即W的简单氢化物熔沸点比Z的简单氢化物熔沸点高,故B错误;
C.YW2为SiO2,属于原子晶体,SiO2的熔点高、硬度大,故C正确;
D.非金属性S>C>Si,则最高价氧化物对应水化物的酸性强弱顺序为:Z>R>Y,故D正确;
故选:B。
9.解:A.①电解氯化钠溶液生成氯气和氢气和氢氧化钠,离子方程式:2Cl﹣+2H2OCl2↑+H2↑+2OH﹣,故A正确;
B.②氯气与氢氧化钾反应生成氯化钾和次氯酸钾和水,离子方程式:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O,故B正确;
C.③硝酸与四氧化三铁反应生成硝酸铁和一氧化氮和水,离子方程式:3Fe3O4+28H++NO3﹣═9Fe3++NO↑+14H2O,故C正确;
D.④碱性次氯酸钾与硝酸铁反应离子方程式:2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O,故D错误。
故选:D。
10.解:A.能够吸附水中的悬浮物质,起到絮凝沉淀作用的是氢氧化铁,与K2FeO4具有强氧化性无关,故A错误;
B.上述流程反应④中,铁离子转化成K2FeO4,Fe元素化合价从+3变为+6,则每生成1molK2FeO4转移电子为3mol,故B错误;
C.当1molK2FeO4与水反应时,Fe元素化合价从+6变为+3,得到3mol电子,生成氧气的物质的量为:=0.75mol,生成O2的体积在标准状况下为:22.4L/mol×0.75mol=16.8L,故C正确;
D.K2FeO4能够将亚硝酸盐氧化为硝酸盐,铁元素化合价从+6变为+3,化合价降低3价,N元素化合价从+3变为+5,化合价升高2价,结合电子守恒可知,氧化剂与还原剂的物质的量之比为2:3,故D错误;
故选:C。
二、不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.解:A.观察K的焰色反应需要透过蓝色的钴玻璃,由操作和现象不能确定是否含K+,故A错误;
B.发生强酸制取弱酸的反应,且盐酸为无氧酸,则不能由盐酸、硅酸的酸性比较非金属性,故B错误;
C.加入盐酸酸化,排除亚硫酸根离子的干扰,无白色沉淀,再加氯化钡溶液,生成白色沉淀,可知白色沉淀为硫酸钡,则原Na2SO3已被氧化,故C正确;
D.水解后在碱性溶液中检验﹣CHO,且麦芽糖、葡萄糖均含﹣CHO,则酸性溶液中加银氨溶液,水浴加热,不会出现银镜,不能说明麦芽糖水解产物不具有还原性,故D错误;
故选:C。
12.解:A.由结构可知Y的分子式为C10H10O4,故A错误;
B.连接4个不同基团的C为手性碳,则连接甲基和﹣OH的C具有手性,故B错误;
C.Y中酚﹣OH、﹣COOC﹣及水解生成的酚﹣OH均与NaOH反应,则1mol
Y与足量NaOH溶液反应,最多消耗3mol
NaOH,故C正确;
D.Z中酚﹣OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则1mol
Z与足量浓溴水反应,发生加成反应消耗3mol
Br2,故D错误;
故选:C。
13.解:A.Cl2O+H2O=2HClO,该反应中无元素化合价变化,不是氧化还原反应,故A错误;
B.装置②中盛装的试剂是饱和食盐水,用来除掉①中的挥发出的氯化氢气体,③中盛放浓硫酸,用来干燥氯气,保证进入④中试剂无水,因Cl2O易溶于水且会与水反应生成次氯酸,故B错误;
C.HgO+2Cl2═HgCl2+Cl2O△m
217
272
87
272﹣17=55
m(Cl2O)
1.1g
m(Cl2O)==1.74g,n(Cl2O)==0.02mol,故C正确;
D.通干燥空气的目的是将生成的Cl2O稀释减少爆炸危险,减少实验危险程度,避免接触还原剂等而爆炸,Cl2O与甲烷接触会发生燃烧并爆炸,所以干燥空气不能用甲烷代替,故D错误;
故选:C。
14.解:A.a点pH为3,c(H+)=1.0×10﹣3mol/L=Ka(HA),则c(A﹣)=c(HA),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(A﹣),则c(Na+)﹣c(HA)=c(OH﹣)﹣c(H+),故A正确;
B.由a→b是向一元弱酸HA中逐滴加入NaOH溶液,发生反应生成NaA,即:HA+NaOH=NaA+H2O,溶液中n(A﹣)持续增大;V=10mL时,HA与NaOH恰好完全反应生成NaA,根据A﹣+H2O?HA+OH﹣,继续加入NaOH溶液,抑制A﹣的水解,所以溶液中n(A﹣)持续增大,故B正确;
C.根据电荷守恒c(Na+)+c(H+)=c(A﹣)+c(OH﹣)可知:c(Na+)=c(A﹣)+c(OH﹣)﹣c(H+),则c(Na+)<c(A﹣)+c(OH﹣)+c(HA),故C错误;
D.V=10mL时,反应恰好生成NaA,根据物料守恒:c(Na+)=c(HA)+c(A﹣),所以c(HA)+c(A﹣)+c(Na+)=2c(Na+)=2××0.1mol/L=0.1mol/L,故D错误;
故选:AB。
15.解:A.历程中能量变化最大的是2.46eV,氮分子中氮氮三键的断裂过程发生在历程②,吸热﹣1.87eV﹣(﹣2.46eV)=0.59eV,所以N≡N断裂时不是能量变化最大的过程,故A错误;
B.②为形成过渡态的过程,③为N2解离为N的过程,以上都是吸热反应,需要在高温时进行,而⑤原子生成分子的过程,为放热过程,为了增大平衡产率,需要在低温下进行,故B正确;
C.由图可知,④过程中Ti﹣H﹣Fe﹣
N转化为Ti﹣H﹣
N﹣Fe,表示N原子由Fe区域向Ti﹣H区域传递,故C正确;
D.催化剂能改变反应历程,降低反应的活化能,但不能改变反应的始态和终态,由图知整个反应过程能量降低,仍为放热反应,故D错误;
故选:BC。
二、解答题(共5小题,满分60分)
16.解:(1)根据图象可知,pH由酸性调至11时,H3AsO3转化为H2AsO3﹣,反应的离子方程式为:H3AsO3+OH﹣=H2AsO3﹣+H2O,
故答案为:H3AsO3+OH﹣=H2AsO3﹣+H2O;
(2)通入空气可以将Na3AsO3氧化成Na3AsO4,因为砷酸盐比亚砷酸盐更难溶,所以沉砷时可以提高砷元素沉淀率,
故答案为:将溶液中的亚砷酸根氧化为砷酸根,沉砷时可以提高砷元素沉淀率;
(3)滤渣的主要成分为硫酸钙沉淀,
故答案为:硫酸钙;
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反反应:
①Ca(OH)2(s)?Ca2+(aq)+2OH﹣(aq)△H<0
②5Ca2+(aq)+OH﹣(aq)+3AsO43﹣(aq)?Ca5(AsO4)3OH(s)△H>0
高于85℃后,温度升高,反应①平衡逆向移动,c(Ca2+)下降,反应②平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,
故答案为:反应①为放热反应,高于85℃时,平衡向逆反应方向移动,c(Ca2+)减小;反应②c(Ca2+)减小是影响平衡移动的主要因素,所以反应②平衡也向逆反应方向移动,沉淀率下降;
(5)“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,反应为:H3AsO4+H2O+SO2=H3AsO3+H2SO4,
故答案为:H3AsO4+H2O+SO2=H3AsO3+H2SO4;
(6)“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,同时生成滤液2﹣﹣H2SO4,可循环使用,
故答案为:H2SO4溶液。
17.解:(1)①钒是23号元素,核外有23个电子,外围电子就是价电子,其价电子排布式为3d34s2,
故答案为:3d34s2;
②根据图知,V2O5分子中含有4个V=O双键和2个V﹣O单键,一个双键含有1个σ键和1个π键,单键均为σ键,所以V2O5分子中含有6个σ键和4个π键,σ键和π键数目之比为3:2,
故答案为:3:2;
(2)①NO3﹣中N原子价层电子对个数=3+=3且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为平面正三角形,
故答案为:平面正三角形;
②n(AgCl)=mol=0.04mol,n(配合物)=0.2mol/L×0.1L=0.02mol,根据氯原子守恒得n(AgCl)=2n(配合物),所以该配合物外界中含有两个氯离子,内界中还含有一个氯原子,所以配离子化学式为[Co(NH3)5Cl]2+,
故答案为:[Co(NH3)5Cl]2+;
(3)①ZnBr2、ZnCl2都是不含氢键的分子晶体且相对分子质量ZnBr2>ZnCl2,所以ZnBr2的熔点高于ZnCl2,
故答案为:ZnBr2、ZnCl2都是不含氢键的分子晶体且相对分子质量ZnBr2>ZnCl2;
②晶胞顶点为K+,K+个数=8×=1、面心上微粒个数=6×=3、中心上一个微粒,根据其化学式知,F﹣为面心上的微粒,所以与Zn2+最近且等距离的F﹣数为6,
故答案为:6;
③该晶胞中白色球个数=1+8×=2、黑色球个数=2+4×=4,白色球、黑色球个数之比=2:4=1:2,所以白色球表示Zn2+、黑色球表示F﹣,该晶胞体积=(a×10﹣7cm)2×(c×10﹣7cm)=a2c×10﹣21cm3,晶胞密度==g/cm3=g/cm3,
故答案为:。
18.解:(1)化合物B中含氧官能团的名称为羟基、醚键,
故答案为:羟基、醚键;
(2)反应④为硝基被还原生成氨基,则该反应的反应类型为还原反应,
故答案为:还原反应;
(3)E的一种同分异构体符合下列条件:
①能与FeCl3发生显色反应,说明含有酚羟基;
②分子中有3种不同化学环境的氢,
符合条件的结构简式为(合理即可),
故答案为:(合理即可);
(4)E与Y反应生成M同时还生成甲醇,Y(C5H8O4)的结构简式:CH3OOCCH2COOCH3,
故答案为:CH3OOCCH2COOCH3;
(5)以苯酚、为原料合成,由和发生取代反应得到,由和溴发生加成反应得到,由发生消去反应得到,由苯酚和氢气发生加成反应得到,其合成路线为,
故答案为:。
19.解:(1)用KOH调节pH至11~12的目的是:除去Fe3+,得到的滤渣为Fe(OH)3,使铬元素溶解形成CrO22﹣溶液,
故答案为:分离铁和铬,使铁形成Fe(OH)3沉淀,铬转变为CrO22﹣溶液;
(2)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2﹣氧化为CrO42﹣,同时生成水,反应离子方程式为:3H2O2+2CrO2﹣+2OH﹣=2CrO42﹣+4H2O,
故答案为:3H2O2+2CrO2﹣+2OH﹣=2CrO42﹣+4H2O;
(3)取一定量流程中的K2CrO4溶液于烧杯中,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤,故答案为:煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶;
(4)n(K2Cr2O7)=0.3000mol/L×25ml×10﹣3L/ml=7.5000×10﹣3mol,
n(Fe2+)=6×7.500×10﹣3mol=0.045mol,依据盐的化学式可知在久置的盐A中n(Al3+)=2×[0.045mol+n(Fe3+)],
加入氨水后得9.10g的干燥固体粉末中,n(Al2O3)=0.045mol+n(Fe3+),
n(Fe2O3)=[0.04500mol+n(Fe3+)]
102g/mol×[0.045mol+n(Fe3+)]+160g/mol××[0.045mol+n(Fe3+)]=9.10g
解得n(Fe3+)=0.005mol
n(Al3+)=2×[0.045mol+n(Fe3+)]=0.1000mol
n(SO42﹣)=2n(Al3+)=0.2000mol
久置的盐A中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=3×0.1mol+2×0.045mol+3×0.005mol=0.405mol
根据电荷守恒,得n(OH﹣)=3n(Al3+)+2n(Fe2+)+3n(Fe3+)﹣2n(SO42﹣)=0.405mol﹣0.4000mol=0.005mol
微粒的下标之比=个数之比=物质的量之比=0.1mol:(0.005mol+0.045mol):0.005mol:0.2000mol=20:10:1:40,
所以x=0.1,
故答案为:n(K2Cr2O7)=0.3000mol/L×25ml×10﹣3L/ml=7.5000×10﹣3mol,
n(Fe2+)=6×7.500×10﹣3mol=0.045mol,依据盐的化学式可知在久置的盐A中n(Al3+)=2×[0.045mol+n(Fe3+)],
加入氨水后得9.10g的干燥固体粉末中,n(Al2O3)=0.045mol+n(Fe3+),
n(Fe2O3)=[0.04500mol+n(Fe3+)]
102g/mol×[0.045mol+n(Fe3+)]+160g/mol××[0.045mol+n(Fe3+)]=9.10g
解得n(Fe3+)=0.005mol
n(Al3+)=2×[0.045mol+n(Fe3+)]=0.1000mol
n(SO42﹣)=2n(Al3+)=0.2000mol
久置的盐A中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=3×0.1mol+2×0.045mol+3×0.005mol=0.405mol
根据电荷守恒,得n(OH﹣)=3n(Al3+)+2n(Fe2+)+3n(Fe3+)﹣2n(SO42﹣)=0.405mol﹣0.4000mol=0.005mol
微粒的下标之比=个数之比=物质的量之比=0.1mol:(0.005mol+0.045mol):0.005mol:0.2000mol=20:10:1:40,
所以x=0.1。
20.解:(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4Li2CO3+Li2SiO3;由于升高温度平衡左移,故正反应为放热反应,
故答案为:CO2+Li4SiO4Li2CO3+Li2SiO3;放热;
(2)据图示得到化学方程式:Fe0.9O+0.1CO2=0.1C+0.3Fe3O4,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应,单次循环可生成0.1molC,
故答案为:0.1;
(3)已知反应:a.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=﹣58kJ?mol﹣1
b.CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41kJ?mol
根据盖斯定律可知,将a﹣b可得反应CO(g)+2H2(g)?CH3OH(g)△H3=△H1﹣△H2=﹣58kJ?mol﹣1=﹣(+41kJ?mol﹣1)=﹣99kJ?mol﹣1
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=﹣99kJ?mol﹣1;
(4)①根据图示,CH3OH、CO2和H2在LiI、Rh+催化作用下生产CH3COOH和H2O,总反应的化学方程式为CH3OH+CO2+H2CH3COOH+H2O,
故答案为:CH3OH+CO2+H2CH3COOH+H2O;
②通过电解法由CO2制取CH3OH,碳元素化合价降低,故是二氧化碳得电子被还原的反应,故二氧化碳在阴极反应,则生成CH3OH的电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,
故答案为:CO2+6e﹣+6H+=CH3OH+H2O;
③温度超过275~300℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;300~400℃时温度升高,化学反应速率加快;
故答案为:温度升高,化学反应速率加快。
第1页(共1页)
一、选择题(共9小题,每小题2分,满分20分)
1.化学与科技、社会、生产密切相关。下列说法正确的是( )
A.生产SMS医用口罩所用的一种原料丙烯,主要来源于石油的裂化
B.纤维漂白剂NO2在低温时变成无色液体,该过程属于物理变化
C.核酸检测是诊断新冠肺炎的重要依据,核酸组成为C、H、O三种元素
D.过氧化氢空气消毒机广泛应用于抗疫中,这是利用了过氧化氢的氧化性
2.下列化学用语不正确的是( )
A.S2﹣的结构示意图:
B.中子数为7的氮原子:N
C.葡萄糖分子的实验式:CH2O
D.乙炔的结构式:H﹣C≡C﹣H
3.下列有关物质的性质与用途具有对应关系的是( )
A.二氧化硫具有强还原性,可用作漂白剂
B.硅胶具有弱酸性,可用作袋装食品的干燥剂
C.硝酸能发生酯化反应,可用于制造硝化甘油
D.氧化铝熔点高,可用于制坩埚熔化烧碱固体
4.室温时,下列各环境下的离子组合一定能够大量共存的是( )
A.0.1mol/L
Na2CO3的溶液中:Ca2+、Fe3+、SO42﹣、Cl﹣
B.0.1mol/L
HCl的溶液中:Fe3+、K+、I﹣、NO3﹣
C.0.1mol/L
NaOH的溶液中:K+、Ba2+、Cl﹣、ClO﹣
D.0.1mol/L
NaHCO3的溶液中:Na+、K+、Al3+、Cl﹣
5.在一定条件下,下列转化关系正确的是( )
A.CuO(s)Cu(OH)2(s)Cu2O(s)
B.Na(s)Na2O2(s)NaOH(aq)
C.NaClO(aq)HClO(aq)Cl2(g)
D.CaCl2(aq)CaCO3(s)CaSiO3(s)
6.NaOH是一种常用的试剂。下列实验能达到实验目的的是( )
A
B
C
D
配制0.10mol/L
250mL
NaOH溶液
用NaOH溶液除去苯中的苯酚
除去Cl2中的HCl
实验室制取NH3
A.A
B.B
C.C
D.D
7.下列化学反应的叙述正确的是( )
A.铁粉与Al2O3可发生铝热反应
B.AlCl3与过量氨水生成偏铝酸铵
C.常温下Al在稀硝酸中可发生钝化
D.电解熔融Al2O3可制金属铝
8.短周期元素R、W、X、Y、Z的原子序数依次增大,基态R原子的核外3个能级中所含电子数相等,X原子为第三周期第一电离能最大的金属原子,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y元素的最高正价与最低负价代数和为零。下列说法不正确的是( )
A.简单离子半径:Z>W>X
B.W的简单氢化物熔沸点比Z的简单氢化物熔沸点低
C.Y与W形成的化合物YW2的熔点高、硬度大
D.Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y
9.阅读下列资料,完成9﹣10题。
高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如下:
上述流程中涉及的离子反应方程式书写不正确的是( )
A.反应①:2Cl﹣+2H2OCl2↑+H2↑+2OH﹣
B.反应②:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
C.反应③:3Fe3O4+28H++NO3﹣═9Fe3++NO↑+14H2O
D.反应④:2Fe3++3ClO﹣+5H2O═2FeO42﹣+3Cl﹣+10H+
10.阅读下列资料,完成9﹣10题。
高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如下:
下列说法正确的是( )
A.K2FeO4具有强氧化性,所以能够吸附水中的悬浮物质,起到絮凝沉淀作用
B.上述流程反应④中,每生成1mol
K2FeO4转移电子为4mol
C.当1mol
K2FeO4与水反应时,生成O2的体积在标准状况下为16.8L
D.K2FeO4能够将亚硝酸盐氧化为硝酸盐,氧化剂与还原剂的物质的量之比为3:2
二、不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色
该溶液中一定不含K+
B
将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生
非金属性:Cl>Si
C
向盛有Na2SO3溶液的试管中加入盐酸酸化,无白色沉淀,再加氯化钡溶液,生成白色沉淀
原Na2SO3已被氧化
D
向20%麦芽糖溶液中加入少量稀硫酸、加热水解,冷却后加入银氨溶液,水浴加热,未出现银镜
麦芽糖水解产物不具有还原性
A.A
B.B
C.C
D.D
12.羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化,下列有关说法正确的是( )
A.Y的分子式为C10H8O4
B.X分子中不含有手性碳原子
C.1mol
Y与足量NaOH溶液反应,最多消耗3mol
NaOH
D.1mol
Z与足量浓溴水反应,发生加成反应消耗1mol
Br2
13.Cl2O是黄棕色的气体,强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示,已知:①HgO+2Cl2═HgCl2+Cl2O;②Cl2O沸点为3.8℃;Cl2的沸点为﹣34.6℃。下列说法中正确的是( )
A.Cl2O与水的反应中,生成的次氯酸是氧化产物
B.装置②③中的药品依次为浓硫酸、饱和食盐水
C.装置④中固体增重1.1g,可制得0.02mol
Cl2O
D.干燥空气的作用是稀释Cl2O,可用甲烷代替
14.室温下,向10mL
0.10mol?L﹣1的HA(Ka=1.0×10﹣3)中逐滴加入0.10mol?L﹣1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。若溶液混合引起的体积变化可忽略,下列说法正确的是( )
A.a点时,c(Na+)﹣c(HA)=c(OH﹣)﹣c(H+)
B.由a→b,溶液中n(A﹣)持续增大
C.b点时,c(Na+)=c(HA)+c(A﹣)+c(OH﹣)
D.V=10mL时,c(HA)+c(A﹣)+c(Na+)=0.20mol?L﹣1
15.2019年9月我国科研人员研制出Ti﹣H﹣Fe双温区催化剂,其中Ti﹣H区域和Fe区域的温度差可超过100℃。Ti﹣H﹣Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用标注。下列说法正确的是( )
A.能量变化最大的过程中发生了N≡N断裂
B.过程②③处于高温区域;过程⑤处于低温区域
C.过程④表示N原子由Fe区域向Ti﹣H区域传递
D.使用双温区催化合成氨,使合成氨反应转化为吸热反应
二、解答题(共5小题,满分60分)
16.砷(As)元素广泛的存在于自然界。金属冶炼过程产生的含砷有毒工业废水经处理转化为粗As2O3流程如图1所示。
已知:砷酸盐比亚砷酸盐更难溶。H3AsO3受热易分解为As2O3。
(1)H3AsO3溶液中各组分的物质的量分数随pH变化如图2所示:用NaOH溶液调节pH至11时亚砷酸主要反应的离子方程式为
。
(2)通入空气氧化的目的为
。
(3)滤渣的主要成分为
。
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
①Ca(OH)2(s)?Ca2+(aq)+2OH﹣(aq)△H<0
②5Ca2+(aq)+OH﹣(aq)+3AsO43﹣(aq)?Ca5(AsO4)3OH(s)△H>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是
。
(5)还原过程中发生反应的化学方程式为
。
(6)上述流程中可循环使用的物质为
。(填写化学式)
17.元素周期表中第四周期的某些过渡元素(如V、Zn、Co等)在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①基态钒原子的外围电子排布式为
。
②V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为
。
(2)Co(NH3)5Cl3是钴的一种配合物,中心离子的配位数为6,向100mL0.2mol?L﹣1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀。
①NO3﹣的空间构型为
。
②则该配合物中配离子的化学式为
。
(3)ZnF2是生成良好的光学基质材料KZnF3的原料,ZnF2、KZnF3两种晶体的晶胞结构如图所示。
①已知:ZnF2的熔点为872℃,ZnCl2的熔点为275℃,ZnBr2的熔点为394℃,ZnBr2的熔点高于ZnCl2的原因为
。
②KZnF3晶体(晶胞顶点为K+)中,与Zn2+最近且等距离的F﹣数为
。
③若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为
g/cm3。(用含a、c、NA的代数式表示)
18.以化合物A为原料合成化合物M的线路如图所示。
(1)写出化合物B中含氧官能团的名称为
。
(2)④的反应类型为
。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:
。
①能与FeCl3发生显色反应;
②分子中有3种不同化学环境的氢。
(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式:
。
(5)以苯酚、化合物A为原料合成,写出制备该物质的合成路线流程图
。(无机试剂任用,合成路线流程图示例见本题题干)
19.实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、SiO2等)制备K2CrO4的工艺流程如图1。
已知:
①Cr(OH)3不溶于水,与Al(OH)3类似,具有两性;
②酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;
③+6价的Cr在溶液pH<5时,主要以Cr2O72﹣的形式存在;在pH>7时,主要以CrO42﹣的形式存在;
④部分物质溶解度曲线如图2所示。
(1)用KOH调节pH至11~12的目的是
。
(2)写出加入30%
H2O2过程中发生的离子反应方程式:
。
(3)流程中K2CrO4溶液含有少量过氧化氢,经过多步处理制得K2Cr2O7晶体。请补充完整由K2CrO4溶液为原料制备K2Cr2O7晶体的实验方案:取一定量流程中的K2CrO4溶液于烧杯中,
,过滤、冰水洗涤及干燥。(实验中必须使用的试剂:稀盐酸)
(4)铁明矾[Al2Fe(SO4)4?24H2O]在空气中能被氧气氧化,久置后生成盐A,盐A的化学式为Al2Fe(OH)x(SO4)4?24H2O。为确定盐A的化学式,学习小组进行如下实验:
①取一定质量的盐A样品溶于足量的稀硫酸中,将溶液分为两等份;
②其中一份与酸性K2Cr2O7溶液充分反应(反应后Cr2O72﹣被还原成Cr3+),消耗浓度为0.3000mol?L﹣1的K2Cr2O7溶液25.00mL;
③往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.10g干燥固体粉末。通过计算确定x的值。(写出计算过程)
20.CO2的综合利用是解决温室问题的有效途径。
(1)Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式:
;该反应为
(填“吸热”或“放热”)反应。
(2)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图1所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应,单次循环可生成
mol C(碳)。
(3)利用CO2与H2合成甲醇涉及的主要反应如下:
a.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=﹣58kJ?mol﹣1
b.CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41kJ?mol
则CO(g)与H2(g)合成CH3OH(g)的热化学方程式为:
。
(4)中国科学家首次用CO2高效合成乙酸,其反应路径如图2所示。
①根据图2所示,写出总反应的化学方程式:
。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
。
③催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。300℃到400℃之间,乙酸生成速率加快的原因是
。
2020-2021学年江苏省南通市海安市高三(上)期中化学试卷
试题解析
一、选择题(共9小题,每小题2分,满分20分)
1.解:A.裂化的目的是为了提高汽油的产量,丙烯为石油裂解产物,故A错误;
B.低温时NO2转化为无色液体N2O4,发生了化学变化,故B错误;
C.核素中含有蛋白质,蛋白质由C、H、O、N等组成,则核酸组成为C、H、O、N等元素,故C错误;
D.过氧化氢具有强氧化性,能使蛋白质变性,可用于杀菌消毒,所以过氧化氢空气消毒机广泛应用于抗疫中,这是利用了过氧化氢的氧化性,故D正确;
故选:D。
2.解:A.S2﹣的核电荷数为16,其离子结构示意图为,故A错误;
B.中子数为7的氮原子的质量数为7+7=14,该原子可以表示为:N,故B正确;
C.葡萄糖的分子式为C6H12O6,其实验式CH2O,故C正确;
D.乙炔的结构式为H﹣C≡C﹣H,故D正确;
故选:A。
3.解:A.二氧化硫能够与有色物质化合生成无色物质,所以具有漂白性,能做漂白剂,与其还原性无关,故A错误;
B.硅胶疏松多孔,具有吸水性,可用作袋装食品的干燥剂,与其有弱酸性无关,故B错误;
C.硝酸能与醇发生酯化反应,能与甘油发生酯化反应生成硝化甘油,故C正确;
D.氧化铝是两性氧化物,能与强碱反应,所以氧化铝坩埚不能熔融烧碱,故D错误;
故选:C。
4.解:A.Ca2+、Fe3+都与CO32﹣反应,不能大量共存,故A错误;
B.Fe3+、I﹣之间发生氧化还原反应,I﹣、NO3﹣在酸性条件下发生氧化还原反应,不能大量共存,故B错误;
C.K+、Ba2+、Cl﹣、ClO﹣之间不反应,都不与Na+、OH﹣反应,能够大量共存,故C正确;
D.Al3+、HCO3﹣之间发生反应生成氢氧化铝沉淀和二氧化碳气体,不能大量共存,故D错误;
故选:C。
5.解:A.氧化铜与水不反应,也难溶于水,故A错误;
B.金属钠与氧气在点燃条件下生成过氧化钠,过氧化钠与水生成氢氧化钠和氧气,故B正确;
C.次氯酸见光分解生成盐酸和氧气,故C错误;
D.二氧化碳与氯化钙若反应,生成碳酸钙和盐酸,不符合“强酸制弱酸”原理,故D错误;
故选:B。
6.解:A.不能在容量瓶中溶解固体,应在烧杯中溶解、冷却后转移到容量瓶中定容,故A错误;
B.NaOH与苯酚反应后,与苯分层,然后分液可分离,且苯在上层,故B正确;
C.二者均与NaOH溶液反应,不能除杂,故C错误;
D.NaOH溶液与氯化铵溶液生成一水合氨,应选浓氨水与碱混合制备,故D错误;
故选:B。
7.解:A.还原性:Fe<Al,铁粉与Al2O3无法发生铝热反应,故A错误;
B.AlCl3与过量氨水生成氢氧化铝沉淀和氯化铵,不会生成偏铝酸钠,故B错误;
C.常温下Al与稀硝酸反应生成硝酸铝、NO和水,不会发生钝化,故C错误;
D.Al的活泼性较强,工业上通过电解熔融Al2O3冶炼金属铝,故D正确;
故选:D。
8.解:结合分析可知,R为C,W为O,X为Na,Y为Si,Z为S元素,
A.电子层越多离子半径越大,电子层结构相同时,核电荷数越大离子半径越小,则简单离子半径:Z>W>X,故A正确;
B.水分子之间存在氢键,导致水的沸点较高,即W的简单氢化物熔沸点比Z的简单氢化物熔沸点高,故B错误;
C.YW2为SiO2,属于原子晶体,SiO2的熔点高、硬度大,故C正确;
D.非金属性S>C>Si,则最高价氧化物对应水化物的酸性强弱顺序为:Z>R>Y,故D正确;
故选:B。
9.解:A.①电解氯化钠溶液生成氯气和氢气和氢氧化钠,离子方程式:2Cl﹣+2H2OCl2↑+H2↑+2OH﹣,故A正确;
B.②氯气与氢氧化钾反应生成氯化钾和次氯酸钾和水,离子方程式:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O,故B正确;
C.③硝酸与四氧化三铁反应生成硝酸铁和一氧化氮和水,离子方程式:3Fe3O4+28H++NO3﹣═9Fe3++NO↑+14H2O,故C正确;
D.④碱性次氯酸钾与硝酸铁反应离子方程式:2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O,故D错误。
故选:D。
10.解:A.能够吸附水中的悬浮物质,起到絮凝沉淀作用的是氢氧化铁,与K2FeO4具有强氧化性无关,故A错误;
B.上述流程反应④中,铁离子转化成K2FeO4,Fe元素化合价从+3变为+6,则每生成1molK2FeO4转移电子为3mol,故B错误;
C.当1molK2FeO4与水反应时,Fe元素化合价从+6变为+3,得到3mol电子,生成氧气的物质的量为:=0.75mol,生成O2的体积在标准状况下为:22.4L/mol×0.75mol=16.8L,故C正确;
D.K2FeO4能够将亚硝酸盐氧化为硝酸盐,铁元素化合价从+6变为+3,化合价降低3价,N元素化合价从+3变为+5,化合价升高2价,结合电子守恒可知,氧化剂与还原剂的物质的量之比为2:3,故D错误;
故选:C。
二、不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分
11.解:A.观察K的焰色反应需要透过蓝色的钴玻璃,由操作和现象不能确定是否含K+,故A错误;
B.发生强酸制取弱酸的反应,且盐酸为无氧酸,则不能由盐酸、硅酸的酸性比较非金属性,故B错误;
C.加入盐酸酸化,排除亚硫酸根离子的干扰,无白色沉淀,再加氯化钡溶液,生成白色沉淀,可知白色沉淀为硫酸钡,则原Na2SO3已被氧化,故C正确;
D.水解后在碱性溶液中检验﹣CHO,且麦芽糖、葡萄糖均含﹣CHO,则酸性溶液中加银氨溶液,水浴加热,不会出现银镜,不能说明麦芽糖水解产物不具有还原性,故D错误;
故选:C。
12.解:A.由结构可知Y的分子式为C10H10O4,故A错误;
B.连接4个不同基团的C为手性碳,则连接甲基和﹣OH的C具有手性,故B错误;
C.Y中酚﹣OH、﹣COOC﹣及水解生成的酚﹣OH均与NaOH反应,则1mol
Y与足量NaOH溶液反应,最多消耗3mol
NaOH,故C正确;
D.Z中酚﹣OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成反应,则1mol
Z与足量浓溴水反应,发生加成反应消耗3mol
Br2,故D错误;
故选:C。
13.解:A.Cl2O+H2O=2HClO,该反应中无元素化合价变化,不是氧化还原反应,故A错误;
B.装置②中盛装的试剂是饱和食盐水,用来除掉①中的挥发出的氯化氢气体,③中盛放浓硫酸,用来干燥氯气,保证进入④中试剂无水,因Cl2O易溶于水且会与水反应生成次氯酸,故B错误;
C.HgO+2Cl2═HgCl2+Cl2O△m
217
272
87
272﹣17=55
m(Cl2O)
1.1g
m(Cl2O)==1.74g,n(Cl2O)==0.02mol,故C正确;
D.通干燥空气的目的是将生成的Cl2O稀释减少爆炸危险,减少实验危险程度,避免接触还原剂等而爆炸,Cl2O与甲烷接触会发生燃烧并爆炸,所以干燥空气不能用甲烷代替,故D错误;
故选:C。
14.解:A.a点pH为3,c(H+)=1.0×10﹣3mol/L=Ka(HA),则c(A﹣)=c(HA),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(A﹣),则c(Na+)﹣c(HA)=c(OH﹣)﹣c(H+),故A正确;
B.由a→b是向一元弱酸HA中逐滴加入NaOH溶液,发生反应生成NaA,即:HA+NaOH=NaA+H2O,溶液中n(A﹣)持续增大;V=10mL时,HA与NaOH恰好完全反应生成NaA,根据A﹣+H2O?HA+OH﹣,继续加入NaOH溶液,抑制A﹣的水解,所以溶液中n(A﹣)持续增大,故B正确;
C.根据电荷守恒c(Na+)+c(H+)=c(A﹣)+c(OH﹣)可知:c(Na+)=c(A﹣)+c(OH﹣)﹣c(H+),则c(Na+)<c(A﹣)+c(OH﹣)+c(HA),故C错误;
D.V=10mL时,反应恰好生成NaA,根据物料守恒:c(Na+)=c(HA)+c(A﹣),所以c(HA)+c(A﹣)+c(Na+)=2c(Na+)=2××0.1mol/L=0.1mol/L,故D错误;
故选:AB。
15.解:A.历程中能量变化最大的是2.46eV,氮分子中氮氮三键的断裂过程发生在历程②,吸热﹣1.87eV﹣(﹣2.46eV)=0.59eV,所以N≡N断裂时不是能量变化最大的过程,故A错误;
B.②为形成过渡态的过程,③为N2解离为N的过程,以上都是吸热反应,需要在高温时进行,而⑤原子生成分子的过程,为放热过程,为了增大平衡产率,需要在低温下进行,故B正确;
C.由图可知,④过程中Ti﹣H﹣Fe﹣
N转化为Ti﹣H﹣
N﹣Fe,表示N原子由Fe区域向Ti﹣H区域传递,故C正确;
D.催化剂能改变反应历程,降低反应的活化能,但不能改变反应的始态和终态,由图知整个反应过程能量降低,仍为放热反应,故D错误;
故选:BC。
二、解答题(共5小题,满分60分)
16.解:(1)根据图象可知,pH由酸性调至11时,H3AsO3转化为H2AsO3﹣,反应的离子方程式为:H3AsO3+OH﹣=H2AsO3﹣+H2O,
故答案为:H3AsO3+OH﹣=H2AsO3﹣+H2O;
(2)通入空气可以将Na3AsO3氧化成Na3AsO4,因为砷酸盐比亚砷酸盐更难溶,所以沉砷时可以提高砷元素沉淀率,
故答案为:将溶液中的亚砷酸根氧化为砷酸根,沉砷时可以提高砷元素沉淀率;
(3)滤渣的主要成分为硫酸钙沉淀,
故答案为:硫酸钙;
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反反应:
①Ca(OH)2(s)?Ca2+(aq)+2OH﹣(aq)△H<0
②5Ca2+(aq)+OH﹣(aq)+3AsO43﹣(aq)?Ca5(AsO4)3OH(s)△H>0
高于85℃后,温度升高,反应①平衡逆向移动,c(Ca2+)下降,反应②平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,
故答案为:反应①为放热反应,高于85℃时,平衡向逆反应方向移动,c(Ca2+)减小;反应②c(Ca2+)减小是影响平衡移动的主要因素,所以反应②平衡也向逆反应方向移动,沉淀率下降;
(5)“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,反应为:H3AsO4+H2O+SO2=H3AsO3+H2SO4,
故答案为:H3AsO4+H2O+SO2=H3AsO3+H2SO4;
(6)“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,同时生成滤液2﹣﹣H2SO4,可循环使用,
故答案为:H2SO4溶液。
17.解:(1)①钒是23号元素,核外有23个电子,外围电子就是价电子,其价电子排布式为3d34s2,
故答案为:3d34s2;
②根据图知,V2O5分子中含有4个V=O双键和2个V﹣O单键,一个双键含有1个σ键和1个π键,单键均为σ键,所以V2O5分子中含有6个σ键和4个π键,σ键和π键数目之比为3:2,
故答案为:3:2;
(2)①NO3﹣中N原子价层电子对个数=3+=3且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为平面正三角形,
故答案为:平面正三角形;
②n(AgCl)=mol=0.04mol,n(配合物)=0.2mol/L×0.1L=0.02mol,根据氯原子守恒得n(AgCl)=2n(配合物),所以该配合物外界中含有两个氯离子,内界中还含有一个氯原子,所以配离子化学式为[Co(NH3)5Cl]2+,
故答案为:[Co(NH3)5Cl]2+;
(3)①ZnBr2、ZnCl2都是不含氢键的分子晶体且相对分子质量ZnBr2>ZnCl2,所以ZnBr2的熔点高于ZnCl2,
故答案为:ZnBr2、ZnCl2都是不含氢键的分子晶体且相对分子质量ZnBr2>ZnCl2;
②晶胞顶点为K+,K+个数=8×=1、面心上微粒个数=6×=3、中心上一个微粒,根据其化学式知,F﹣为面心上的微粒,所以与Zn2+最近且等距离的F﹣数为6,
故答案为:6;
③该晶胞中白色球个数=1+8×=2、黑色球个数=2+4×=4,白色球、黑色球个数之比=2:4=1:2,所以白色球表示Zn2+、黑色球表示F﹣,该晶胞体积=(a×10﹣7cm)2×(c×10﹣7cm)=a2c×10﹣21cm3,晶胞密度==g/cm3=g/cm3,
故答案为:。
18.解:(1)化合物B中含氧官能团的名称为羟基、醚键,
故答案为:羟基、醚键;
(2)反应④为硝基被还原生成氨基,则该反应的反应类型为还原反应,
故答案为:还原反应;
(3)E的一种同分异构体符合下列条件:
①能与FeCl3发生显色反应,说明含有酚羟基;
②分子中有3种不同化学环境的氢,
符合条件的结构简式为(合理即可),
故答案为:(合理即可);
(4)E与Y反应生成M同时还生成甲醇,Y(C5H8O4)的结构简式:CH3OOCCH2COOCH3,
故答案为:CH3OOCCH2COOCH3;
(5)以苯酚、为原料合成,由和发生取代反应得到,由和溴发生加成反应得到,由发生消去反应得到,由苯酚和氢气发生加成反应得到,其合成路线为,
故答案为:。
19.解:(1)用KOH调节pH至11~12的目的是:除去Fe3+,得到的滤渣为Fe(OH)3,使铬元素溶解形成CrO22﹣溶液,
故答案为:分离铁和铬,使铁形成Fe(OH)3沉淀,铬转变为CrO22﹣溶液;
(2)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2﹣氧化为CrO42﹣,同时生成水,反应离子方程式为:3H2O2+2CrO2﹣+2OH﹣=2CrO42﹣+4H2O,
故答案为:3H2O2+2CrO2﹣+2OH﹣=2CrO42﹣+4H2O;
(3)取一定量流程中的K2CrO4溶液于烧杯中,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤,故答案为:煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶;
(4)n(K2Cr2O7)=0.3000mol/L×25ml×10﹣3L/ml=7.5000×10﹣3mol,
n(Fe2+)=6×7.500×10﹣3mol=0.045mol,依据盐的化学式可知在久置的盐A中n(Al3+)=2×[0.045mol+n(Fe3+)],
加入氨水后得9.10g的干燥固体粉末中,n(Al2O3)=0.045mol+n(Fe3+),
n(Fe2O3)=[0.04500mol+n(Fe3+)]
102g/mol×[0.045mol+n(Fe3+)]+160g/mol××[0.045mol+n(Fe3+)]=9.10g
解得n(Fe3+)=0.005mol
n(Al3+)=2×[0.045mol+n(Fe3+)]=0.1000mol
n(SO42﹣)=2n(Al3+)=0.2000mol
久置的盐A中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=3×0.1mol+2×0.045mol+3×0.005mol=0.405mol
根据电荷守恒,得n(OH﹣)=3n(Al3+)+2n(Fe2+)+3n(Fe3+)﹣2n(SO42﹣)=0.405mol﹣0.4000mol=0.005mol
微粒的下标之比=个数之比=物质的量之比=0.1mol:(0.005mol+0.045mol):0.005mol:0.2000mol=20:10:1:40,
所以x=0.1,
故答案为:n(K2Cr2O7)=0.3000mol/L×25ml×10﹣3L/ml=7.5000×10﹣3mol,
n(Fe2+)=6×7.500×10﹣3mol=0.045mol,依据盐的化学式可知在久置的盐A中n(Al3+)=2×[0.045mol+n(Fe3+)],
加入氨水后得9.10g的干燥固体粉末中,n(Al2O3)=0.045mol+n(Fe3+),
n(Fe2O3)=[0.04500mol+n(Fe3+)]
102g/mol×[0.045mol+n(Fe3+)]+160g/mol××[0.045mol+n(Fe3+)]=9.10g
解得n(Fe3+)=0.005mol
n(Al3+)=2×[0.045mol+n(Fe3+)]=0.1000mol
n(SO42﹣)=2n(Al3+)=0.2000mol
久置的盐A中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=3×0.1mol+2×0.045mol+3×0.005mol=0.405mol
根据电荷守恒,得n(OH﹣)=3n(Al3+)+2n(Fe2+)+3n(Fe3+)﹣2n(SO42﹣)=0.405mol﹣0.4000mol=0.005mol
微粒的下标之比=个数之比=物质的量之比=0.1mol:(0.005mol+0.045mol):0.005mol:0.2000mol=20:10:1:40,
所以x=0.1。
20.解:(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4Li2CO3+Li2SiO3;由于升高温度平衡左移,故正反应为放热反应,
故答案为:CO2+Li4SiO4Li2CO3+Li2SiO3;放热;
(2)据图示得到化学方程式:Fe0.9O+0.1CO2=0.1C+0.3Fe3O4,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应,单次循环可生成0.1molC,
故答案为:0.1;
(3)已知反应:a.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=﹣58kJ?mol﹣1
b.CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41kJ?mol
根据盖斯定律可知,将a﹣b可得反应CO(g)+2H2(g)?CH3OH(g)△H3=△H1﹣△H2=﹣58kJ?mol﹣1=﹣(+41kJ?mol﹣1)=﹣99kJ?mol﹣1
故答案为:CO(g)+2H2(g)?CH3OH(g)△H=﹣99kJ?mol﹣1;
(4)①根据图示,CH3OH、CO2和H2在LiI、Rh+催化作用下生产CH3COOH和H2O,总反应的化学方程式为CH3OH+CO2+H2CH3COOH+H2O,
故答案为:CH3OH+CO2+H2CH3COOH+H2O;
②通过电解法由CO2制取CH3OH,碳元素化合价降低,故是二氧化碳得电子被还原的反应,故二氧化碳在阴极反应,则生成CH3OH的电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,
故答案为:CO2+6e﹣+6H+=CH3OH+H2O;
③温度超过275~300℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;300~400℃时温度升高,化学反应速率加快;
故答案为:温度升高,化学反应速率加快。
第1页(共1页)
同课章节目录
