2020-2021学年山东省临沂市高三(上)期中化学试卷(含解析)
文档属性
| 名称 | 2020-2021学年山东省临沂市高三(上)期中化学试卷(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 364.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-20 21:56:49 | ||
图片预览

文档简介
2020-2021学年山东省临沂市高三(上)期中化学试卷
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学与生产、生活密切相关。下列叙述错误的是( )
A.工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
B.海水淡化的方法有蒸馏法、离子交换法和电渗析法等
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.聚合硫酸铁[Fe2(OH)x(SO4)y]n是新型絮凝剂,可用来处理水中的悬浮物
2.下列物质的应用中,利用了氧化还原反应的是( )
A.用NH4Cl溶液除铁锈
B.用Na2S溶液除去水体中的Hg2+
C.用石灰乳脱除烟气中的SO2
D.用酸性K2Cr2O7溶液检查司机是否酒后驾车
3.NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1mol
D2比1mol
H2多2NA个质子
B.7.8g
Na2O2固体中含离子总数为0.3NA
C.1mol
HC≡CH分子中所含σ键数为5NA
D.标准状况下,2.24L
Cl2溶于水所得溶液中含氯的微粒总数为0.2NA
4.我国科学家发现了一类由Fe﹣Se﹣As﹣F﹣O组成的磁性超导材料。下列说法正确的是( )
A.Fe变成Fe2+时首先失去3d轨道电子
B.AsO3﹣的空间构型为平面正三角形
C.通过化学变化可以实现Se与Se的相互转化
D.基态F原子的核外电子有9种空间运动状态
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=13的溶液中:Na+、K+、NO3﹣、S2O32﹣
B.0.1mol?L﹣1盐酸溶液中:Na+、Al3+、SO42﹣、SiO32﹣
C.0.1mol?L﹣1KI溶液中:NH4+、Fe3+、Cl﹣、SO42﹣
D.能使甲基橙变红的溶液中:Mg2+、Ba2+、NO3﹣、HCO3﹣
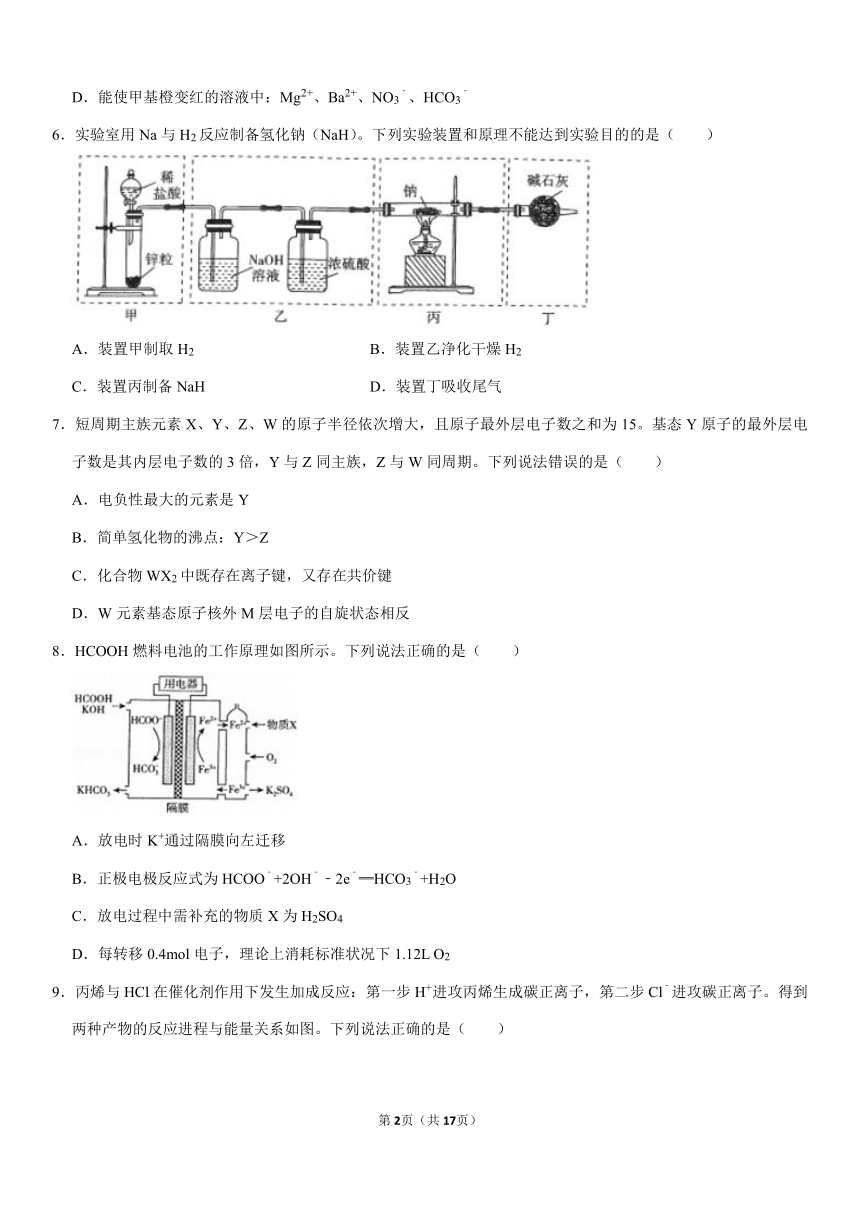
6.实验室用Na与H2反应制备氢化钠(NaH)。下列实验装置和原理不能达到实验目的的是( )
A.装置甲制取H2
B.装置乙净化干燥H2
C.装置丙制备NaH
D.装置丁吸收尾气
7.短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15。基态Y原子的最外层电子数是其内层电子数的3倍,Y与Z同主族,Z与W同周期。下列说法错误的是( )
A.电负性最大的元素是Y
B.简单氢化物的沸点:Y>Z
C.化合物WX2中既存在离子键,又存在共价键
D.W元素基态原子核外M层电子的自旋状态相反
8.HCOOH燃料电池的工作原理如图所示。下列说法正确的是( )
A.放电时K+通过隔膜向左迁移
B.正极电极反应式为HCOO﹣+2OH﹣﹣2e﹣═HCO3﹣+H2O
C.放电过程中需补充的物质X为H2SO4
D.每转移0.4mol电子,理论上消耗标准状况下1.12L
O2
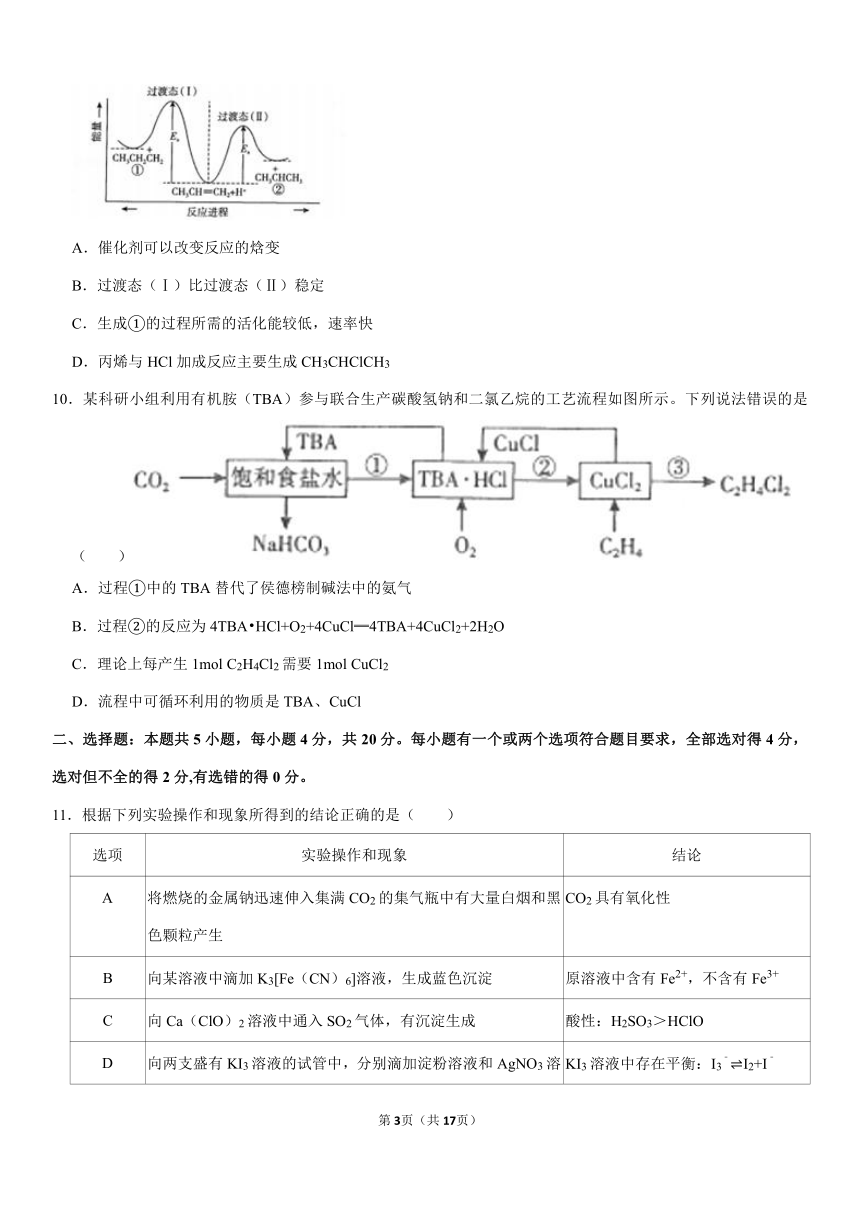
9.丙烯与HCl在催化剂作用下发生加成反应:第一步H+进攻丙烯生成碳正离子,第二步Cl﹣进攻碳正离子。得到两种产物的反应进程与能量关系如图。下列说法正确的是( )
A.催化剂可以改变反应的焓变
B.过渡态(Ⅰ)比过渡态(Ⅱ)稳定
C.生成①的过程所需的活化能较低,速率快
D.丙烯与HCl加成反应主要生成CH3CHClCH3
10.某科研小组利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。下列说法错误的是( )
A.过程①中的TBA替代了侯德榜制碱法中的氨气
B.过程②的反应为4TBA?HCl+O2+4CuCl═4TBA+4CuCl2+2H2O
C.理论上每产生1mol
C2H4Cl2需要1mol
CuCl2
D.流程中可循环利用的物质是TBA、CuCl
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
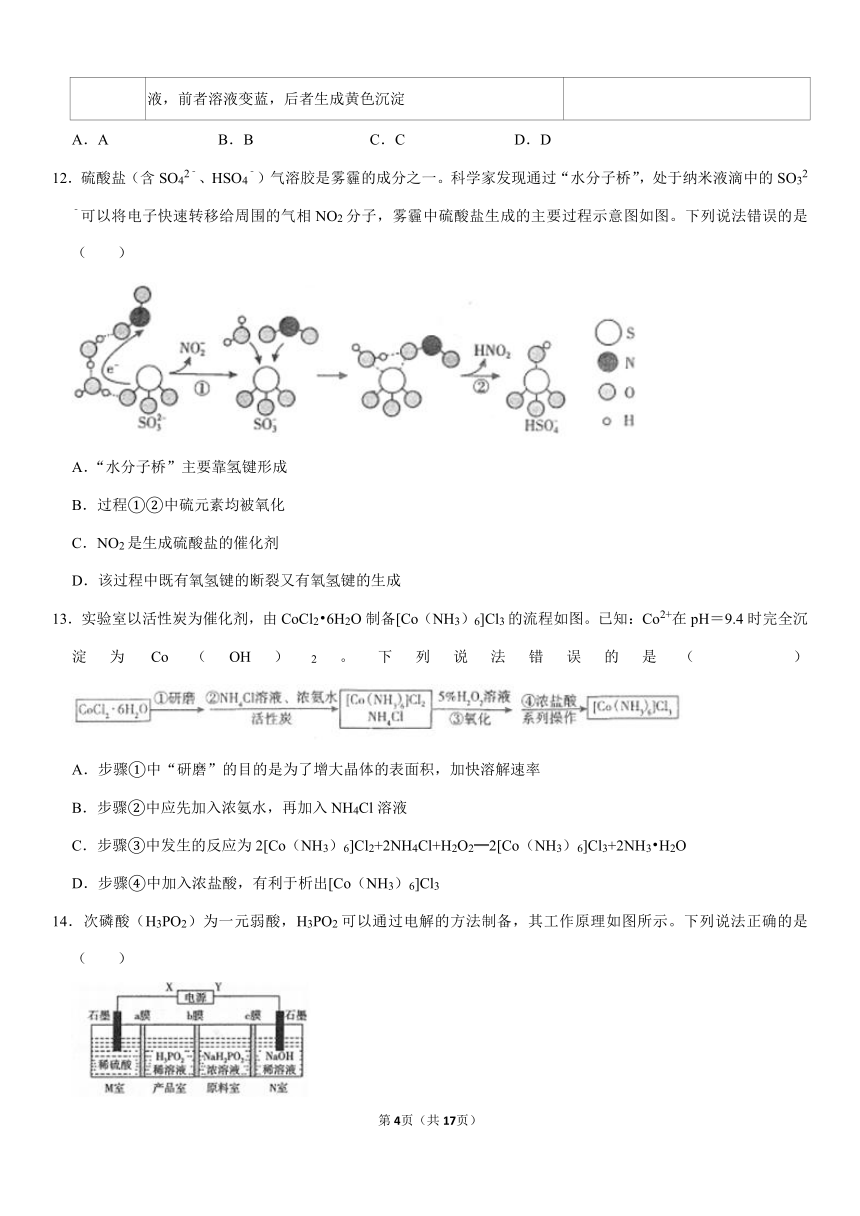
11.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
将燃烧的金属钠迅速伸入集满CO2的集气瓶中有大量白烟和黑色颗粒产生
CO2具有氧化性
B
向某溶液中滴加K3[Fe(CN)6]溶液,生成蓝色沉淀
原溶液中含有Fe2+,不含有Fe3+
C
向Ca(ClO)2溶液中通入SO2气体,有沉淀生成
酸性:H2SO3>HClO
D
向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀
KI3溶液中存在平衡:I3﹣?I2+I﹣
A.A
B.B
C.C
D.D
12.硫酸盐(含SO42﹣、HSO4﹣)气溶胶是雾霾的成分之一。科学家发现通过“水分子桥”,处于纳米液滴中的SO32﹣可以将电子快速转移给周围的气相NO2分子,雾霾中硫酸盐生成的主要过程示意图如图。下列说法错误的是( )
A.“水分子桥”主要靠氢键形成
B.过程①②中硫元素均被氧化
C.NO2是生成硫酸盐的催化剂
D.该过程中既有氧氢键的断裂又有氧氢键的生成
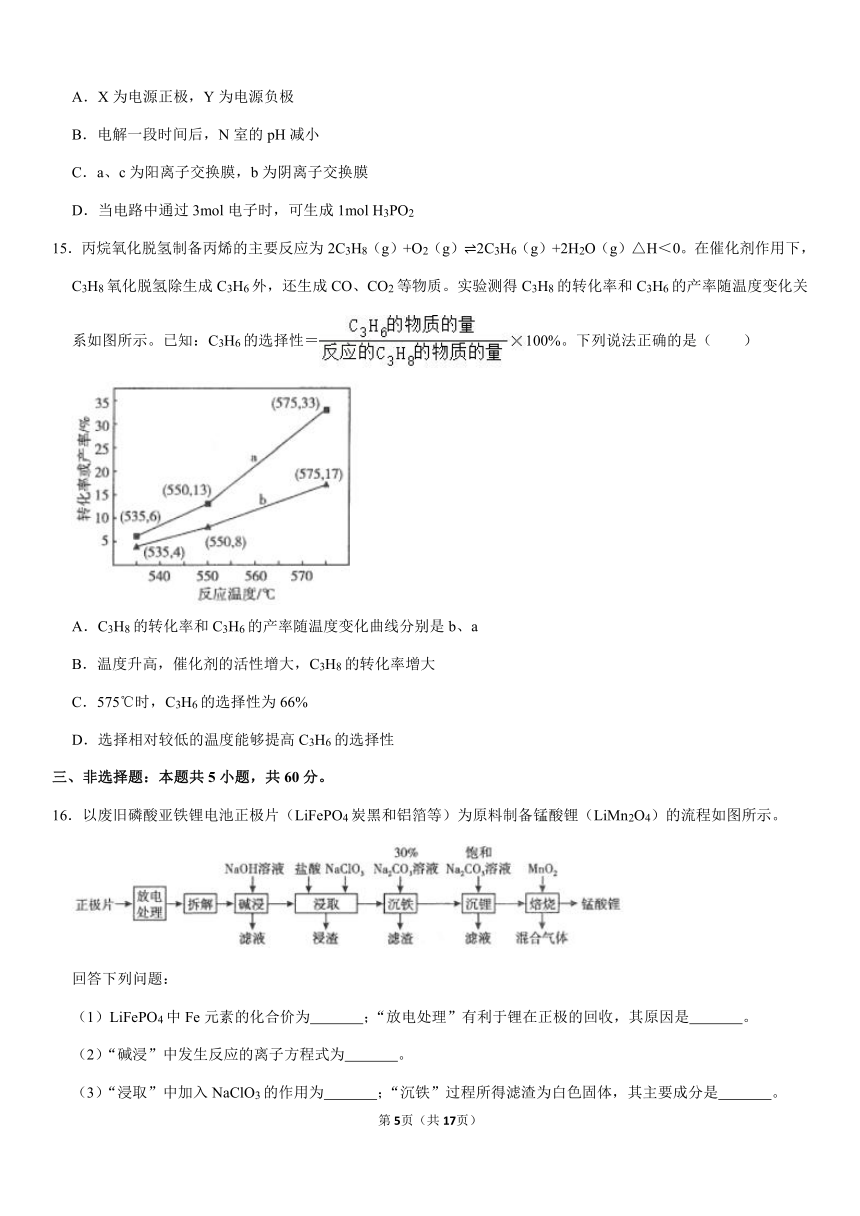
13.实验室以活性炭为催化剂,由CoCl2?6H2O制备[Co(NH3)6]Cl3的流程如图。已知:Co2+在pH=9.4时完全沉淀为Co(OH)2。下列说法错误的是( )
A.步骤①中“研磨”的目的是为了增大晶体的表面积,加快溶解速率
B.步骤②中应先加入浓氨水,再加入NH4Cl溶液
C.步骤③中发生的反应为2[Co(NH3)6]Cl2+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+2NH3?H2O
D.步骤④中加入浓盐酸,有利于析出[Co(NH3)6]Cl3
14.次磷酸(H3PO2)为一元弱酸,H3PO2可以通过电解的方法制备,其工作原理如图所示。下列说法正确的是( )
A.X为电源正极,Y为电源负极
B.电解一段时间后,N室的pH减小
C.a、c为阳离子交换膜,b为阴离子交换膜
D.当电路中通过3mol电子时,可生成1mol
H3PO2
15.丙烷氧化脱氢制备丙烯的主要反应为2C3H8(g)+O2(g)?2C3H6(g)+2H2O(g)△H<0。在催化剂作用下,C3H8氧化脱氢除生成C3H6外,还生成CO、CO2等物质。实验测得C3H8的转化率和C3H6的产率随温度变化关系如图所示。已知:C3H6的选择性=100%。下列说法正确的是( )
A.C3H8的转化率和C3H6的产率随温度变化曲线分别是b、a
B.温度升高,催化剂的活性增大,C3H8的转化率增大
C.575℃时,C3H6的选择性为66%
D.选择相对较低的温度能够提高C3H6的选择性
三、非选择题:本题共5小题,共60分。
16.以废旧磷酸亚铁锂电池正极片(LiFePO4炭黑和铝箔等)为原料制备锰酸锂(LiMn2O4)的流程如图所示。
回答下列问题:
(1)LiFePO4中Fe元素的化合价为
;“放电处理”有利于锂在正极的回收,其原因是
。
(2)“碱浸”中发生反应的离子方程式为
。
(3)“浸取”中加入NaClO3的作用为
;“沉铁”过程所得滤渣为白色固体,其主要成分是
。
(4)已知碳酸锂的分解温度为723℃。当“焙烧”温度达到515℃时,开始有CO2产生,可能的原因是
;MnO2可以利用MnSO4溶液与K2S2O8溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式
。
17.治理汽车尾气NO2是环境保护的重要课题。
(1)汽车尾气中的NO是空气中的N2在高温下燃烧生成的其反应机理如下。
A2?2A?
A?+B2?NO+B?
B?+A2?NO+A?
已知:298K时相关化学键的键能数据如下表。
化学键
O=N
N=N
N=O
键能/(kJ?mol﹣1)
498.0
946.0
630.0
①上述机理中,A2代表的是
(填“N2”或“O2”),判断的理由是
。
②N2(g)+O2(g)═2NO(g)△H=
kJ?mol﹣1。
(2)应用SCR脱硝技术除去汽车尾气中的氮氧化物,其反应原理如下。4NH3(g)+6NO═5N2(g)+6H2O(g)△H<0,450℃时,将含NO
a%(体积分数)的汽车尾气以100mL?min﹣1的流速通过盛有氨的反应器,出口气体中NO的含量变为b%(忽略体积变化),则v(NO)=
mL?min﹣1。
(3)在NO2催化脱除过程中,更多应用尿素﹣SCR技术。该技术中生成NH3的反应如下。
Ⅰ.CO(NH2)2(s)?NH3(g)+HNCO(g)△H1>0
Ⅱ.HNCO(g)+H2O(g)?NH3(g)+CO2(g)△H2<0
①一定温度下,向刚性容器中投入足量CO(NH2)2(s)和一定量的H2O(g),当上述反应达到平衡时,测得c(NH3)=pmol?L﹣1、(CO2)=qmol?L﹣1。则c(HNCO)=
mol?L﹣1(用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为
。
②体系中c(NH3)随温度、氧气浓度的变化如图所示。
温度高于1000℃时,在无氧体系中,NH3浓度减小的原因是
;1100℃以上,在有氧体系中NH3浓度接近0μL?L﹣1,理由是
。
18.K3[Fe(C2O4)3]?3H2O(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐[(NH4)2Fe(SO4)2?6H2O]制备K3[Fe(C2O4)3]?3H2O的流程如图1所示。
回答下列问题:
(1)K3[Fe(C2O4)3]中铁离子的配位数为
,其配体C2O42﹣中C原子的杂化方式为
。
(2)步骤②发生反应的化学方程式为
。
(3)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量
。(已知:常温下KHC2O4溶液的pH约为3.5)
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
。
(5)某研究小组将K3[Fe(C2O4)3]?3H2O在一定条件下加热分解,利用图2装置(可重复使用)验证所得气体产物中含有CO和CO2。
①按气流从左到右的方向,依次连接的合理顺序为
。(填装置序号)
②确认气体产物中含CO的现象为
。
19.某小组探究Cu与HNO3反应,发现有趣的现象。室温下,3mol?L﹣1的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(如图)遇铜片立即产生气泡。
回答下列问题:
(1)探究溶液B遇铜片立即发生反应的原因。
①假设1:
对该反应有催化作用。
实验验证:向溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:NO2对该反应有催化作用。
方案Ⅰ:向盛有铜片的溶液A中通入少量NO2,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴5mol?L﹣1的硝酸,没有明显变化。补充该实验的目的是
。
方案Ⅱ:向溶液B中通人氮气数分钟得溶液C。相同条件下,铜片与A、B、C三份溶液的反应速率:B>C>A,该实验能够证明假设2成立的理由是
。
③查阅资料NO2溶于水可以生成HNO2和
。
向盛有铜片的溶液A中加入
,铜片上立即产生气泡,实验证明HNO2对该反应也有催化作用。
结论:NO2和HNO2均对Cu与HNO3的反应有催化作用。
(2)试从结构角度解释NO2在金属表面得电子的能力强于NO3﹣的原因
。
(3)Cu与稀硝酸反应中HNO2参与的可能催化过程如下。将ⅱ补充完整。
ⅰ.NO3﹣+HNO2+H+═2NO2↑+H2O
ⅱ.
ⅲ.3NO2+H2O═2H++2NO3﹣+NO
(4)探究Cu(NO3)2?6H2O的性质。将一定质量的Cu(NO3)2?6H2O放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至T℃时,剩余固体质量变为原来的24.33%,则剩余固体的化学式可能为
。
20.二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知:2NaClO+(CNO)3H3═(CNO)3Cl2Na+NaOH+H2O,回答下列问题:
(1)仪器a的名称为
;装置A中制备Cl2的化学方程式为
。
(2)待装置B
(填实验现象)时,再由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是
。
(3)反应结束后,装置B中的浊液经过滤、
、干燥得粗产品。上述装置存在一处缺陷,会导致装置B中NaOH利用率降低改进的方法是
。
(4)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。反应原理:
[(CNO)3Cl2]﹣+H++2H2O═(CNO)3H3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O
I2+2S2O32﹣═S4O62﹣+2I﹣
实验步骤:准确称取mg样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用cmol?L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①该样品的有效氯含量表达式为
。(该样品的有效氯=×100%)
②下列操作将导致样品有效氯测定值偏低的是
。(填标号)
a.加入稀硫酸的量过少
b.滴定前滴定管未排气泡,滴定后气泡消失
c.锥形瓶内溶液蓝色消失后立即读数
d.读数时,滴定前平视,滴定后仰视
2020-2021学年山东省临沂市高三(上)期中化学试卷
试题解析
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.解:A.工业生产玻璃、水泥,均需用石灰石作原料,陶瓷的原料为黏土,不需要石灰石,故A错误;
B.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),海水淡化的方法有蒸馏法、离子交换法和电渗析法等,故B正确;
C.Mg比Fe活泼,当发生化学腐蚀时Mg作负极而被腐蚀,从而阻止Fe被腐蚀,属于牺牲阳极的阴极保护法,故C正确;
D.聚合硫酸铁[Fe2(OH)x(SO4)y]n是新型絮凝剂,溶于水电离产生铁离子水解生成氢氧化铁胶体,能够吸附水中固体杂质颗粒,可用来处理水中的悬浮物,故D正确;
故选:A。
2.解:A.用NH4Cl溶液除铁锈,发生复分解反应,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.用Na2S溶液除去水体中的Hg2+发生沉淀反应,没有元素的化合价变化,不发生氧化还原反应,故B不选;
C.用石灰乳脱除烟气中的SO2,发生复分解反应,没有元素的化合价变化,不发生氧化还原反应,故C不选;
D.用酸性K2Cr2O7溶液检查司机是否酒后驾车,Cr、C元素化合价发生变化,发生氧化还原反应,故D选;
故选:D。
3.解:A.1mol
D2和1mol
H2都含有2NA个质子,故A错误;
B.7.8g
Na2O2的物质的量为:=0.1mol,0.1mol过氧化钠中含有0.3mol离子,含离子总数为0.3NA,故B正确;
C.1mol
HC≡CH分子中含有3molσ键,所含σ键数为3NA,故C错误;
D.标准状况下,2.24L
Cl2的物质的量为=0.1mol,由于溶液中存在部分氯气分子,则所得溶液中含氯的微粒总数小于0.2NA,故D错误;
故选:B。
4.解:A.Fe变成Fe2+时首先失去4s能级电子,故A错误;
B.AsO3﹣中价层电子对个数=3+=3且不含孤电子对,根据价层电子对互斥理论知,该微粒空间构型为平面正三角形,故B正确;
C.Se与Se之间的转化,属于核变化,不是化学变化,故C错误;
D.s能级上1种运动状态、p能级有3种运动状态,氟原子核电荷数为9,电子排布为1s22s22p5,核外电子有5种空间运动状态,故D错误;
故选:B。
5.解:A.pH=13的溶液,溶液含有大量氢氧根离子,OH﹣与Na+、K+、NO3﹣、S2O32﹣不反应,可以大量共存,故A正确;
B.氢离子与硅酸根离子反应生成硅酸沉淀,不能大量共存,故B错误;
C.铁离子具有强的氧化性,能够氧化碘离子,二者不能大量共存,故C错误;
D.能使甲基橙变红的溶液中,含有大量氢离子,氢离子与碳酸氢根离子反应,不能大量共存,故D错误。
故选:A。
6.解:A.甲中Zn与稀盐酸反应生成氢气,故A正确;
B.乙中NaOH除去HCl,浓硫酸干燥氢气,可净化干燥氢气,故B正确;
C.丙中钠与氢气反应生成NaH,故C正确;
D.丁中碱石灰可防止空气中水蒸气进入丙中,防止NaH与水反应,故D错误;
故选:D。
7.解:结合分析可知,X为H,Y为O,Z为S,W为Mg元素,
A.四种元素中非金属性最强的为O,则电负性最大的元素是Y,故A正确;
B.水分子之间存在氢键,导致其沸点较高,即简单氢化物的沸点:Y>Z,故B正确;
C.WX2为MgH2,MgH2只含有离子键,故C错误;
D.Mg基态原子核外M层含有2个电子,根据泡利原理可知,其自旋状态相反,故D正确;
故选:C。
8.解:A.HCOOH燃料电池中,通入氧气的电极是正极,要在右侧区域产生硫酸钾,则钾离子移向右侧区域,交换膜是阳离子交换膜,即K+通过隔膜向右迁移,故A错误;
B.负极上发生失电子的氧化反应,电极反应式为HCOO﹣+2OH﹣﹣2e﹣═HCO3﹣+H2O,故B错误;
C.要在右侧区域产生硫酸钾,则钾离子移向右侧区域,硫酸根离子需要不断补充,不会经过阳离子交换膜移向左侧电极区域,放电过程中需补充的物质X为H2SO4,故C正确;
D.通入氧气的电极是正极,发生得电子的还原反应O2+4H++4e﹣=2H2O,转移0.4mol电子,理论上消耗标准状况下2.24L的氧气,故D错误;
故选:C。
9.解:A.催化剂可以改变反应历程,加快反应速率,焓变和历程无关,只和反应物、产物有关系,故A错误;
B.过渡态(Ⅱ)能量较低,则比过渡态(Ⅰ)稳定,故B错误;
C.生成②的过程所需活化能较低,则反应速率较快,故C错误;
D.活化能越低,反应越易进行,可知丙烯与HCl发生加成反应,主要生成产物CH3CHClCH3,故D正确;
故选:D。
10.解:A.侯德榜制碱法是先把氨气通入食盐水,然后向氨盐水中通二氧化碳,生产溶解度较小的碳酸氢钠,再将碳酸氢钠过滤出来,经焙烧生成碳酸钠,由图可知,过程I中的TBA替代了侯德榜制碱法中的氨气,故A正确;
B.过程②的反应为4TBA?HCl+O2+4CuCl═4TBA+4CuCl2+2H2O,实现了TBA、CuCl2的再生,故B正确;
C.由发生的反应可知存在关系式2TBA~2CuCl2~C2H4Cl2,理论上每产生1mol
C2H4Cl2需要2mol
CuCl2,故C错误;
D.由①②③可知,TBA、CuCl消耗后又生成,则可循环利用,故D正确;
故选:C。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.解:A.钠与二氧化碳反应生成碳酸钠和C,则集气瓶中有大量白烟和黑色颗粒产生,可知CO2具有氧化性,故A正确;
B.亚铁离子与K3[Fe(CN)6]溶液反应生成蓝色沉淀,由操作和现象可知溶液中含有Fe2+,不能确定是否含有Fe3+,故B错误;
C.二者发生氧化还原反应生成硫酸钙,则不能比较亚硫酸、次氯酸的酸性,故C错误;
D.分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀,可知溶液中含碘单质和碘离子,则KI3溶液中存在平衡:I3﹣?I2+I﹣,故D正确;
故选:AD。
12.解:A.两个水分子桥通过氢键分别与NO2和SO32﹣相连,故A不选;
B.过程①中SO32﹣失去一个电子变为SO3﹣,过程②中SO3﹣再失去一个电子变为HSO4﹣,因此①②中硫元素均被氧化,故B不选;
C.NO2是反应物,被还原为HNO2,不是催化剂,故C选;
D.过程②中有氧氢键的断裂和氧氢键的生成,故D不选;
故选:C。
13.解:A.①中“研磨”的目的是为了增大晶体的表面积,从而加快溶解速率,故A正确;
B.②中先加NH4Cl溶液,后加氨水,降低
c(OH﹣),防止加氨水时溶液中
c(OH﹣)过大使Co2+沉淀,故B错误;
C.③中发生氧化还原反应,Co元素的化合价升高、过氧化氢中O元素的化合价降低,反应为2[Co(NH3)6]Cl2+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+2NH3?H2O,故C正确;
D.④中加浓盐酸,增大氯离子浓度,有利于析出[Co(NH3)6]Cl3,故D正确;
故选:B。
14.解:A.由分析可知,M室为阳极室,N室是阴极室,故X为电源正极,Y为电源负极,故A正确;
B.电解一段时间后,N室为阴极室,所发生的反应为:2H2O+2e﹣=2OH﹣+H2↑,故pH增大,故B错误;
C.根据分析,H+通过a膜,Na+通过c膜,故a、c为阳离子交换膜,H2PO2﹣通过b膜,故b为阴离子交换膜,故C正确;
D.根据反应H++H2PO2﹣=H3PO2,故当电路中通过3mol电子时,可生成H3PO2,故D错误;
故选:AC。
15.解:A.在催化剂作用下,C3H8氧化脱氢除生成C3H6外,还生成CO、CO2等物质,可知C3H8的转化率大于C3H6的产率,则C3H8的转化率和C3H6的产率随温度变化曲线分别是a、b,故A错误;
B.正反应为放热反应,升高温度,转化率增大,只能与催化剂的活性有关,则可知温度升高,催化剂的活性增大,C3H8的转化率增大,故B正确;
C.575℃时,C3H8的转化率为33%,C3H6的产率为17%,设转化33molC3H8,则生成的C3H6为17mol,C3H6的选择性×100%=51.5%,故C错误;
D.535℃时,C3H6的选择性×100%=66.7%,550℃时,C3H6的选择性×100%=61.5%,575℃时,C3H6的选择性×100%=51.5%,选择相对较低的温度能够提高C3H6选择性,故D正确。
故选:BD。
三、非选择题:本题共5小题,共60分。
16.解:(1)LiFePO4中Li为+1价,P为+5价,O为﹣2价,则Fe元素的化合价为+2价,“放电处理”有利于锂在正极的回收,其原因是放电有利于Li+离子移向正极并进入正极材料,
故答案为:+2;放电有利于Li+离子移向正极并进入正极材料;
(2)铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)“浸取”中加入NaClO3的作用为将亚铁离子氧化为铁离子,“沉铁”过程所得滤渣为白色固体,其主要成分是FePO4,
故答案为:将亚铁离子氧化为铁离子;FePO4;
(4)MnO2作催化剂,降低了碳酸锂分解反应的活化能,加快碳酸锂分解,反应的离子方程式为Mn2++S2O82﹣+2H2O=MnO2↓+4H++2SO42﹣,该反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:MnO2作催化剂,降低了碳酸锂分解反应的活化能,加快碳酸锂分解;1:1;
(5)反应物为MnO2和Li2CO3,产物有LiMn2O4,说明该过程中Mn元素被还原,C元素已是最高价,不能被氧化,根据元素价态变化规律可知O元素被氧化成氧气,结合电子守恒和元素守恒可知方程式应为:4MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑,
故答案为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑。
17.解:(1)①已知O=O的键能为498.0kJ?mol﹣1,N≡N的键能为946.0kJ?mol﹣1,则O2中O=O键能比N2中N≡N键能小,更易解离为原子,故上述机理中A2代表的是O2;
故答案为:O2;O2中O=O键能比N2中N≡N键能小,更易解离为原子;
②已知N2(g)+O2(g)=2NO(g),则△H=反应物的键能和﹣生成物的键能和=(946.0kJ?mol﹣1)+(498.0kJ?mol﹣1)﹣2(630.0kJ?mol﹣1)=+184.0kJ/mol,
故答案为:+184.0;
(2)设通过时间为1min,则每通入100mL混合气体中含CO的体积为amL,出口100mL混合气体中含CO的体积为bmL,故v(CO)==(a﹣b)mL?min﹣1,
故答案为:(a﹣b);
(3)①当反应达到平衡时,测得c(NH3)=pmol?L﹣1、(CO2)=qmol?L﹣1,则
HNCO(g)+H2O(g)?NH3(g)+CO2(g)
qmol?L﹣1
qmol?L﹣1
qmol?L﹣1
CO(NH2)2(s)?NH3(g)+HNCO(g)
(p﹣q)mol?L﹣1
(p﹣q)mol?L﹣1
则c(HNCO)=(p﹣2q)mol/L,则反应Ⅰ的平衡常数K=c(NH3)×c(HNCO)=p(p﹣2q)(mol/L)2,
故答案为:(p﹣2q);p(p﹣2q);
②温度高于1000℃时,反应Ⅱ平衡逆向移动,NH3浓度减小;通过比较温度、氧气浓度对尿素水解产物浓度的影响后,发现在有氧气、1100℃以上时,体系中NH3浓度接近0μL?L﹣1,其可能原因是氨气有还原性,在高温下能被氧气氧化;
故答案为:温度升高,反应Ⅱ平衡逆向移动,NH3浓度减小;氧气在高温时将NH3氧化。
18.解:(1)K3[Fe(C2O4)3]中Fe提供空轨道,C提供孤对电子,则铁离子的配位数为6,其配体C2O42﹣中C原子形成C﹣C及C=O键,杂化方式为sp2杂化,
故答案为:6;sp2;
(2)步骤②发生反应的化学方程式为2Fe(OH)2+H2O2=2Fe(OH)3,
故答案为:2Fe(OH)2+H2O2=2Fe(OH)3;
(3)常温下KHC2O4溶液的pH约为3.5,步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量H2C2O4,
故答案为:H2C2O4;
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是洗去表面吸附的杂质,并减少溶解损耗,除去结晶体表面的水分,
故答案为:洗去表面吸附的杂质,并减少溶解损耗,除去结晶体表面的水分;
(5)①验证所得气体产物中含有CO和CO2,按气流从左到右的方向,依次连接的合理顺序为D、C、B、A、D、E,即先检验二氧化碳,再除去二氧化碳,浓硫酸干燥CO后,CO还原CuO,再选石灰水检验生成物,最后收集多余的CO,
故答案为:D、C、B、A、D、E;
②确认气体产物中含CO的现象为A中粉末由黑色变为红色,其后D中石灰水变浑浊,
故答案为:A中粉末由黑色变为红色,其后D中石灰水变浑浊。
19.解:(1)①实验来验证假设,向溶液A中加入少量硝酸铜,故假设应为Cu2+的催化作用,
故答案为:Cu2+;
②Ⅰ.实验验证NO2对该反应有催化作用,要保证唯一变量,NO2与水反应会产生硝酸,加入硝酸,排除是硝酸浓度的变化为实验的影响,
故答案为:排除通入的NO2与水反应引起硝酸浓度增大的影响;
Ⅱ.向溶液B中通人氮气数分钟得溶液C,相同条件下,铜片与A、B、C三份溶液的反应速率:B>C>A,假设2成立,NO2对该反应有催化作用,这三支试管的反应速率不同,可能因为NO2的浓度不同,考虑到通入的氮气带走了部分的NO2,
故答案为:通入的氮气可以带走溶液中的NO2,因此三份溶液中的NO2的浓度:B>C>A,反应速率随NO2浓度降低而减慢,说明NO2对该反应有催化作用;
③NO2溶于水可以生成HNO2时化合价降低,那么另一种物质N的化合价必然要升高,即生成HNO3,要证明HNO2对该反应也有催化作用,那么就要向溶液中加入亚硝酸根离子,可以加入NaNO2,
故答案为:HNO3;NaNO2;
(2)NO2有单电子,很容易得到一个电子形成更稳定的NO2﹣,NO3﹣的价层电子对为3+=3,无孤电子对,为平面正三角形结构,且带一个单位的负电荷,难以获得电子,NO2在金属表面得电子的能力强于NO3﹣,
故答案为:NO2有单电子,NO3﹣带一个单位的负电荷,难以获得电子;
(3)HNO2作催化剂,那么i步消耗,在ii步应该要生成,铜和稀硝酸生成NO,所以NO2也为中间产物,结合i、iii,第ii步发生的反应为:Cu+2NO2+2H+═Cu2,++2HNO2,
故答案为:Cu+2NO2+2H+═Cu2,++2HNO2;
(4)假设起始有1
mol
Cu(NO3)2?6H2O放人坩埚中加热,即296
g,当温度升至T℃时,剩余固体质量变为原来的24.33%,即剩余固体的质量为72
g,根据铜元素守恒可得剩余固体中含有64
g
Cu元素,所以另一种元素的质量为8
g,最有可能的是氧元素,即n(O)=0.5
mol,所以该固体的化学式为Cu2O,
故答案为:Cu2O。
20.解:(1)仪器a的名称为恒压滴液漏斗,氯酸钾是强氧化剂和浓盐酸发生氧化还原反应生成氯气、氯化钾和水,装置A中制备Cl2的化学方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,
故答案为:恒压滴液漏斗;KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)待装置B液面上方有黄绿色气体时,再由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是:使反应生成的氢氧化钠再次生成次氯酸钠,提高原料的利用率,
故答案为:液面上方有黄绿色气体;使反应生成的氢氧化钠再次生成次氯酸钠,提高原料的利用率;
(3)二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体难溶于冷水,反应结束后,装置B中的浊液经过滤、冰水洗涤、干燥得粗产品,上述装置存在一处缺陷,浓盐酸挥发出的氯化氢会和氢氧化钠发生反应,会导致装置B中NaOH利用率降低,改进的方法是:在AB装置之间加装盛有饱和食盐水的洗气瓶,
故答案为:冰水洗涤;在AB装置之间加装盛有饱和食盐水的洗气瓶;
(4)①由题目提供反应:可知:C3N3O3Cl2﹣~2HClO~2I2~4S2O32﹣
n(Na2S2O3)=V×10﹣3L×cmol?L﹣1=cV×10﹣3mol,
根据物质转换和电子得失守恒关系:得n(Cl)=0.5n(S2O32﹣)=0.5cV×10﹣3mol,
氯元素的质量:m(Cl)═0.5cV×10﹣3mol×35.5g/mol=0.5cV×35.5×10﹣3g,
根据公式×100%
计算品中的有效氯含量=×100%=,
故答案为:;
②a.如果硫酸的用量过少,则导致反应不能充分进行,产生的HClO的量偏低,最终导致实验测得的有效氯含量会偏低,故a正确;
b.滴定前滴定管未排气泡,滴定后气泡消失,读取标准溶液体积增大,c(待测)=分析,测定结果增大,故b错误;
c.锥形瓶内溶液蓝色消失后立即读数,读取标准溶液体积减少,c(待测)=分析,测定结果偏低,故c正确;
d.读数时,滴定前平视,滴定后仰视,读取标准溶液体积增大,c(待测)=分析,测定结果偏高,故d错误;
故答案为:ac。
第1页(共1页)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学与生产、生活密切相关。下列叙述错误的是( )
A.工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
B.海水淡化的方法有蒸馏法、离子交换法和电渗析法等
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.聚合硫酸铁[Fe2(OH)x(SO4)y]n是新型絮凝剂,可用来处理水中的悬浮物
2.下列物质的应用中,利用了氧化还原反应的是( )
A.用NH4Cl溶液除铁锈
B.用Na2S溶液除去水体中的Hg2+
C.用石灰乳脱除烟气中的SO2
D.用酸性K2Cr2O7溶液检查司机是否酒后驾车
3.NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1mol
D2比1mol
H2多2NA个质子
B.7.8g
Na2O2固体中含离子总数为0.3NA
C.1mol
HC≡CH分子中所含σ键数为5NA
D.标准状况下,2.24L
Cl2溶于水所得溶液中含氯的微粒总数为0.2NA
4.我国科学家发现了一类由Fe﹣Se﹣As﹣F﹣O组成的磁性超导材料。下列说法正确的是( )
A.Fe变成Fe2+时首先失去3d轨道电子
B.AsO3﹣的空间构型为平面正三角形
C.通过化学变化可以实现Se与Se的相互转化
D.基态F原子的核外电子有9种空间运动状态
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=13的溶液中:Na+、K+、NO3﹣、S2O32﹣
B.0.1mol?L﹣1盐酸溶液中:Na+、Al3+、SO42﹣、SiO32﹣
C.0.1mol?L﹣1KI溶液中:NH4+、Fe3+、Cl﹣、SO42﹣
D.能使甲基橙变红的溶液中:Mg2+、Ba2+、NO3﹣、HCO3﹣
6.实验室用Na与H2反应制备氢化钠(NaH)。下列实验装置和原理不能达到实验目的的是( )
A.装置甲制取H2
B.装置乙净化干燥H2
C.装置丙制备NaH
D.装置丁吸收尾气
7.短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15。基态Y原子的最外层电子数是其内层电子数的3倍,Y与Z同主族,Z与W同周期。下列说法错误的是( )
A.电负性最大的元素是Y
B.简单氢化物的沸点:Y>Z
C.化合物WX2中既存在离子键,又存在共价键
D.W元素基态原子核外M层电子的自旋状态相反
8.HCOOH燃料电池的工作原理如图所示。下列说法正确的是( )
A.放电时K+通过隔膜向左迁移
B.正极电极反应式为HCOO﹣+2OH﹣﹣2e﹣═HCO3﹣+H2O
C.放电过程中需补充的物质X为H2SO4
D.每转移0.4mol电子,理论上消耗标准状况下1.12L
O2
9.丙烯与HCl在催化剂作用下发生加成反应:第一步H+进攻丙烯生成碳正离子,第二步Cl﹣进攻碳正离子。得到两种产物的反应进程与能量关系如图。下列说法正确的是( )
A.催化剂可以改变反应的焓变
B.过渡态(Ⅰ)比过渡态(Ⅱ)稳定
C.生成①的过程所需的活化能较低,速率快
D.丙烯与HCl加成反应主要生成CH3CHClCH3
10.某科研小组利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。下列说法错误的是( )
A.过程①中的TBA替代了侯德榜制碱法中的氨气
B.过程②的反应为4TBA?HCl+O2+4CuCl═4TBA+4CuCl2+2H2O
C.理论上每产生1mol
C2H4Cl2需要1mol
CuCl2
D.流程中可循环利用的物质是TBA、CuCl
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
将燃烧的金属钠迅速伸入集满CO2的集气瓶中有大量白烟和黑色颗粒产生
CO2具有氧化性
B
向某溶液中滴加K3[Fe(CN)6]溶液,生成蓝色沉淀
原溶液中含有Fe2+,不含有Fe3+
C
向Ca(ClO)2溶液中通入SO2气体,有沉淀生成
酸性:H2SO3>HClO
D
向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀
KI3溶液中存在平衡:I3﹣?I2+I﹣
A.A
B.B
C.C
D.D
12.硫酸盐(含SO42﹣、HSO4﹣)气溶胶是雾霾的成分之一。科学家发现通过“水分子桥”,处于纳米液滴中的SO32﹣可以将电子快速转移给周围的气相NO2分子,雾霾中硫酸盐生成的主要过程示意图如图。下列说法错误的是( )
A.“水分子桥”主要靠氢键形成
B.过程①②中硫元素均被氧化
C.NO2是生成硫酸盐的催化剂
D.该过程中既有氧氢键的断裂又有氧氢键的生成
13.实验室以活性炭为催化剂,由CoCl2?6H2O制备[Co(NH3)6]Cl3的流程如图。已知:Co2+在pH=9.4时完全沉淀为Co(OH)2。下列说法错误的是( )
A.步骤①中“研磨”的目的是为了增大晶体的表面积,加快溶解速率
B.步骤②中应先加入浓氨水,再加入NH4Cl溶液
C.步骤③中发生的反应为2[Co(NH3)6]Cl2+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+2NH3?H2O
D.步骤④中加入浓盐酸,有利于析出[Co(NH3)6]Cl3
14.次磷酸(H3PO2)为一元弱酸,H3PO2可以通过电解的方法制备,其工作原理如图所示。下列说法正确的是( )
A.X为电源正极,Y为电源负极
B.电解一段时间后,N室的pH减小
C.a、c为阳离子交换膜,b为阴离子交换膜
D.当电路中通过3mol电子时,可生成1mol
H3PO2
15.丙烷氧化脱氢制备丙烯的主要反应为2C3H8(g)+O2(g)?2C3H6(g)+2H2O(g)△H<0。在催化剂作用下,C3H8氧化脱氢除生成C3H6外,还生成CO、CO2等物质。实验测得C3H8的转化率和C3H6的产率随温度变化关系如图所示。已知:C3H6的选择性=100%。下列说法正确的是( )
A.C3H8的转化率和C3H6的产率随温度变化曲线分别是b、a
B.温度升高,催化剂的活性增大,C3H8的转化率增大
C.575℃时,C3H6的选择性为66%
D.选择相对较低的温度能够提高C3H6的选择性
三、非选择题:本题共5小题,共60分。
16.以废旧磷酸亚铁锂电池正极片(LiFePO4炭黑和铝箔等)为原料制备锰酸锂(LiMn2O4)的流程如图所示。
回答下列问题:
(1)LiFePO4中Fe元素的化合价为
;“放电处理”有利于锂在正极的回收,其原因是
。
(2)“碱浸”中发生反应的离子方程式为
。
(3)“浸取”中加入NaClO3的作用为
;“沉铁”过程所得滤渣为白色固体,其主要成分是
。
(4)已知碳酸锂的分解温度为723℃。当“焙烧”温度达到515℃时,开始有CO2产生,可能的原因是
;MnO2可以利用MnSO4溶液与K2S2O8溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式
。
17.治理汽车尾气NO2是环境保护的重要课题。
(1)汽车尾气中的NO是空气中的N2在高温下燃烧生成的其反应机理如下。
A2?2A?
A?+B2?NO+B?
B?+A2?NO+A?
已知:298K时相关化学键的键能数据如下表。
化学键
O=N
N=N
N=O
键能/(kJ?mol﹣1)
498.0
946.0
630.0
①上述机理中,A2代表的是
(填“N2”或“O2”),判断的理由是
。
②N2(g)+O2(g)═2NO(g)△H=
kJ?mol﹣1。
(2)应用SCR脱硝技术除去汽车尾气中的氮氧化物,其反应原理如下。4NH3(g)+6NO═5N2(g)+6H2O(g)△H<0,450℃时,将含NO
a%(体积分数)的汽车尾气以100mL?min﹣1的流速通过盛有氨的反应器,出口气体中NO的含量变为b%(忽略体积变化),则v(NO)=
mL?min﹣1。
(3)在NO2催化脱除过程中,更多应用尿素﹣SCR技术。该技术中生成NH3的反应如下。
Ⅰ.CO(NH2)2(s)?NH3(g)+HNCO(g)△H1>0
Ⅱ.HNCO(g)+H2O(g)?NH3(g)+CO2(g)△H2<0
①一定温度下,向刚性容器中投入足量CO(NH2)2(s)和一定量的H2O(g),当上述反应达到平衡时,测得c(NH3)=pmol?L﹣1、(CO2)=qmol?L﹣1。则c(HNCO)=
mol?L﹣1(用含p、q的代数式表示,下同),反应Ⅰ的平衡常数为
。
②体系中c(NH3)随温度、氧气浓度的变化如图所示。
温度高于1000℃时,在无氧体系中,NH3浓度减小的原因是
;1100℃以上,在有氧体系中NH3浓度接近0μL?L﹣1,理由是
。
18.K3[Fe(C2O4)3]?3H2O(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐[(NH4)2Fe(SO4)2?6H2O]制备K3[Fe(C2O4)3]?3H2O的流程如图1所示。
回答下列问题:
(1)K3[Fe(C2O4)3]中铁离子的配位数为
,其配体C2O42﹣中C原子的杂化方式为
。
(2)步骤②发生反应的化学方程式为
。
(3)步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量
。(已知:常温下KHC2O4溶液的pH约为3.5)
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是
。
(5)某研究小组将K3[Fe(C2O4)3]?3H2O在一定条件下加热分解,利用图2装置(可重复使用)验证所得气体产物中含有CO和CO2。
①按气流从左到右的方向,依次连接的合理顺序为
。(填装置序号)
②确认气体产物中含CO的现象为
。
19.某小组探究Cu与HNO3反应,发现有趣的现象。室温下,3mol?L﹣1的稀硝酸(溶液A)遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,而溶液B(如图)遇铜片立即产生气泡。
回答下列问题:
(1)探究溶液B遇铜片立即发生反应的原因。
①假设1:
对该反应有催化作用。
实验验证:向溶液A中加入少量硝酸铜,溶液呈浅蓝色,放入铜片,没有明显变化。
结论:假设1不成立。
②假设2:NO2对该反应有催化作用。
方案Ⅰ:向盛有铜片的溶液A中通入少量NO2,铜片表面立即产生气泡,反应持续进行。有同学认为应补充对比实验:向盛有铜片的溶液A中加入几滴5mol?L﹣1的硝酸,没有明显变化。补充该实验的目的是
。
方案Ⅱ:向溶液B中通人氮气数分钟得溶液C。相同条件下,铜片与A、B、C三份溶液的反应速率:B>C>A,该实验能够证明假设2成立的理由是
。
③查阅资料NO2溶于水可以生成HNO2和
。
向盛有铜片的溶液A中加入
,铜片上立即产生气泡,实验证明HNO2对该反应也有催化作用。
结论:NO2和HNO2均对Cu与HNO3的反应有催化作用。
(2)试从结构角度解释NO2在金属表面得电子的能力强于NO3﹣的原因
。
(3)Cu与稀硝酸反应中HNO2参与的可能催化过程如下。将ⅱ补充完整。
ⅰ.NO3﹣+HNO2+H+═2NO2↑+H2O
ⅱ.
ⅲ.3NO2+H2O═2H++2NO3﹣+NO
(4)探究Cu(NO3)2?6H2O的性质。将一定质量的Cu(NO3)2?6H2O放在坩埚中加热,在不同温度阶段进行质量分析,当温度升至T℃时,剩余固体质量变为原来的24.33%,则剩余固体的化学式可能为
。
20.二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知:2NaClO+(CNO)3H3═(CNO)3Cl2Na+NaOH+H2O,回答下列问题:
(1)仪器a的名称为
;装置A中制备Cl2的化学方程式为
。
(2)待装置B
(填实验现象)时,再由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是
。
(3)反应结束后,装置B中的浊液经过滤、
、干燥得粗产品。上述装置存在一处缺陷,会导致装置B中NaOH利用率降低改进的方法是
。
(4)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。反应原理:
[(CNO)3Cl2]﹣+H++2H2O═(CNO)3H3+2HClO
HClO+2I﹣+H+═I2+Cl﹣+H2O
I2+2S2O32﹣═S4O62﹣+2I﹣
实验步骤:准确称取mg样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用cmol?L﹣1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①该样品的有效氯含量表达式为
。(该样品的有效氯=×100%)
②下列操作将导致样品有效氯测定值偏低的是
。(填标号)
a.加入稀硫酸的量过少
b.滴定前滴定管未排气泡,滴定后气泡消失
c.锥形瓶内溶液蓝色消失后立即读数
d.读数时,滴定前平视,滴定后仰视
2020-2021学年山东省临沂市高三(上)期中化学试卷
试题解析
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.解:A.工业生产玻璃、水泥,均需用石灰石作原料,陶瓷的原料为黏土,不需要石灰石,故A错误;
B.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),海水淡化的方法有蒸馏法、离子交换法和电渗析法等,故B正确;
C.Mg比Fe活泼,当发生化学腐蚀时Mg作负极而被腐蚀,从而阻止Fe被腐蚀,属于牺牲阳极的阴极保护法,故C正确;
D.聚合硫酸铁[Fe2(OH)x(SO4)y]n是新型絮凝剂,溶于水电离产生铁离子水解生成氢氧化铁胶体,能够吸附水中固体杂质颗粒,可用来处理水中的悬浮物,故D正确;
故选:A。
2.解:A.用NH4Cl溶液除铁锈,发生复分解反应,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.用Na2S溶液除去水体中的Hg2+发生沉淀反应,没有元素的化合价变化,不发生氧化还原反应,故B不选;
C.用石灰乳脱除烟气中的SO2,发生复分解反应,没有元素的化合价变化,不发生氧化还原反应,故C不选;
D.用酸性K2Cr2O7溶液检查司机是否酒后驾车,Cr、C元素化合价发生变化,发生氧化还原反应,故D选;
故选:D。
3.解:A.1mol
D2和1mol
H2都含有2NA个质子,故A错误;
B.7.8g
Na2O2的物质的量为:=0.1mol,0.1mol过氧化钠中含有0.3mol离子,含离子总数为0.3NA,故B正确;
C.1mol
HC≡CH分子中含有3molσ键,所含σ键数为3NA,故C错误;
D.标准状况下,2.24L
Cl2的物质的量为=0.1mol,由于溶液中存在部分氯气分子,则所得溶液中含氯的微粒总数小于0.2NA,故D错误;
故选:B。
4.解:A.Fe变成Fe2+时首先失去4s能级电子,故A错误;
B.AsO3﹣中价层电子对个数=3+=3且不含孤电子对,根据价层电子对互斥理论知,该微粒空间构型为平面正三角形,故B正确;
C.Se与Se之间的转化,属于核变化,不是化学变化,故C错误;
D.s能级上1种运动状态、p能级有3种运动状态,氟原子核电荷数为9,电子排布为1s22s22p5,核外电子有5种空间运动状态,故D错误;
故选:B。
5.解:A.pH=13的溶液,溶液含有大量氢氧根离子,OH﹣与Na+、K+、NO3﹣、S2O32﹣不反应,可以大量共存,故A正确;
B.氢离子与硅酸根离子反应生成硅酸沉淀,不能大量共存,故B错误;
C.铁离子具有强的氧化性,能够氧化碘离子,二者不能大量共存,故C错误;
D.能使甲基橙变红的溶液中,含有大量氢离子,氢离子与碳酸氢根离子反应,不能大量共存,故D错误。
故选:A。
6.解:A.甲中Zn与稀盐酸反应生成氢气,故A正确;
B.乙中NaOH除去HCl,浓硫酸干燥氢气,可净化干燥氢气,故B正确;
C.丙中钠与氢气反应生成NaH,故C正确;
D.丁中碱石灰可防止空气中水蒸气进入丙中,防止NaH与水反应,故D错误;
故选:D。
7.解:结合分析可知,X为H,Y为O,Z为S,W为Mg元素,
A.四种元素中非金属性最强的为O,则电负性最大的元素是Y,故A正确;
B.水分子之间存在氢键,导致其沸点较高,即简单氢化物的沸点:Y>Z,故B正确;
C.WX2为MgH2,MgH2只含有离子键,故C错误;
D.Mg基态原子核外M层含有2个电子,根据泡利原理可知,其自旋状态相反,故D正确;
故选:C。
8.解:A.HCOOH燃料电池中,通入氧气的电极是正极,要在右侧区域产生硫酸钾,则钾离子移向右侧区域,交换膜是阳离子交换膜,即K+通过隔膜向右迁移,故A错误;
B.负极上发生失电子的氧化反应,电极反应式为HCOO﹣+2OH﹣﹣2e﹣═HCO3﹣+H2O,故B错误;
C.要在右侧区域产生硫酸钾,则钾离子移向右侧区域,硫酸根离子需要不断补充,不会经过阳离子交换膜移向左侧电极区域,放电过程中需补充的物质X为H2SO4,故C正确;
D.通入氧气的电极是正极,发生得电子的还原反应O2+4H++4e﹣=2H2O,转移0.4mol电子,理论上消耗标准状况下2.24L的氧气,故D错误;
故选:C。
9.解:A.催化剂可以改变反应历程,加快反应速率,焓变和历程无关,只和反应物、产物有关系,故A错误;
B.过渡态(Ⅱ)能量较低,则比过渡态(Ⅰ)稳定,故B错误;
C.生成②的过程所需活化能较低,则反应速率较快,故C错误;
D.活化能越低,反应越易进行,可知丙烯与HCl发生加成反应,主要生成产物CH3CHClCH3,故D正确;
故选:D。
10.解:A.侯德榜制碱法是先把氨气通入食盐水,然后向氨盐水中通二氧化碳,生产溶解度较小的碳酸氢钠,再将碳酸氢钠过滤出来,经焙烧生成碳酸钠,由图可知,过程I中的TBA替代了侯德榜制碱法中的氨气,故A正确;
B.过程②的反应为4TBA?HCl+O2+4CuCl═4TBA+4CuCl2+2H2O,实现了TBA、CuCl2的再生,故B正确;
C.由发生的反应可知存在关系式2TBA~2CuCl2~C2H4Cl2,理论上每产生1mol
C2H4Cl2需要2mol
CuCl2,故C错误;
D.由①②③可知,TBA、CuCl消耗后又生成,则可循环利用,故D正确;
故选:C。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.解:A.钠与二氧化碳反应生成碳酸钠和C,则集气瓶中有大量白烟和黑色颗粒产生,可知CO2具有氧化性,故A正确;
B.亚铁离子与K3[Fe(CN)6]溶液反应生成蓝色沉淀,由操作和现象可知溶液中含有Fe2+,不能确定是否含有Fe3+,故B错误;
C.二者发生氧化还原反应生成硫酸钙,则不能比较亚硫酸、次氯酸的酸性,故C错误;
D.分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀,可知溶液中含碘单质和碘离子,则KI3溶液中存在平衡:I3﹣?I2+I﹣,故D正确;
故选:AD。
12.解:A.两个水分子桥通过氢键分别与NO2和SO32﹣相连,故A不选;
B.过程①中SO32﹣失去一个电子变为SO3﹣,过程②中SO3﹣再失去一个电子变为HSO4﹣,因此①②中硫元素均被氧化,故B不选;
C.NO2是反应物,被还原为HNO2,不是催化剂,故C选;
D.过程②中有氧氢键的断裂和氧氢键的生成,故D不选;
故选:C。
13.解:A.①中“研磨”的目的是为了增大晶体的表面积,从而加快溶解速率,故A正确;
B.②中先加NH4Cl溶液,后加氨水,降低
c(OH﹣),防止加氨水时溶液中
c(OH﹣)过大使Co2+沉淀,故B错误;
C.③中发生氧化还原反应,Co元素的化合价升高、过氧化氢中O元素的化合价降低,反应为2[Co(NH3)6]Cl2+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+2NH3?H2O,故C正确;
D.④中加浓盐酸,增大氯离子浓度,有利于析出[Co(NH3)6]Cl3,故D正确;
故选:B。
14.解:A.由分析可知,M室为阳极室,N室是阴极室,故X为电源正极,Y为电源负极,故A正确;
B.电解一段时间后,N室为阴极室,所发生的反应为:2H2O+2e﹣=2OH﹣+H2↑,故pH增大,故B错误;
C.根据分析,H+通过a膜,Na+通过c膜,故a、c为阳离子交换膜,H2PO2﹣通过b膜,故b为阴离子交换膜,故C正确;
D.根据反应H++H2PO2﹣=H3PO2,故当电路中通过3mol电子时,可生成H3PO2,故D错误;
故选:AC。
15.解:A.在催化剂作用下,C3H8氧化脱氢除生成C3H6外,还生成CO、CO2等物质,可知C3H8的转化率大于C3H6的产率,则C3H8的转化率和C3H6的产率随温度变化曲线分别是a、b,故A错误;
B.正反应为放热反应,升高温度,转化率增大,只能与催化剂的活性有关,则可知温度升高,催化剂的活性增大,C3H8的转化率增大,故B正确;
C.575℃时,C3H8的转化率为33%,C3H6的产率为17%,设转化33molC3H8,则生成的C3H6为17mol,C3H6的选择性×100%=51.5%,故C错误;
D.535℃时,C3H6的选择性×100%=66.7%,550℃时,C3H6的选择性×100%=61.5%,575℃时,C3H6的选择性×100%=51.5%,选择相对较低的温度能够提高C3H6选择性,故D正确。
故选:BD。
三、非选择题:本题共5小题,共60分。
16.解:(1)LiFePO4中Li为+1价,P为+5价,O为﹣2价,则Fe元素的化合价为+2价,“放电处理”有利于锂在正极的回收,其原因是放电有利于Li+离子移向正极并进入正极材料,
故答案为:+2;放电有利于Li+离子移向正极并进入正极材料;
(2)铝溶于氢氧化钠溶液生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3)“浸取”中加入NaClO3的作用为将亚铁离子氧化为铁离子,“沉铁”过程所得滤渣为白色固体,其主要成分是FePO4,
故答案为:将亚铁离子氧化为铁离子;FePO4;
(4)MnO2作催化剂,降低了碳酸锂分解反应的活化能,加快碳酸锂分解,反应的离子方程式为Mn2++S2O82﹣+2H2O=MnO2↓+4H++2SO42﹣,该反应中氧化剂与还原剂的物质的量之比为1:1,
故答案为:MnO2作催化剂,降低了碳酸锂分解反应的活化能,加快碳酸锂分解;1:1;
(5)反应物为MnO2和Li2CO3,产物有LiMn2O4,说明该过程中Mn元素被还原,C元素已是最高价,不能被氧化,根据元素价态变化规律可知O元素被氧化成氧气,结合电子守恒和元素守恒可知方程式应为:4MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑,
故答案为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑。
17.解:(1)①已知O=O的键能为498.0kJ?mol﹣1,N≡N的键能为946.0kJ?mol﹣1,则O2中O=O键能比N2中N≡N键能小,更易解离为原子,故上述机理中A2代表的是O2;
故答案为:O2;O2中O=O键能比N2中N≡N键能小,更易解离为原子;
②已知N2(g)+O2(g)=2NO(g),则△H=反应物的键能和﹣生成物的键能和=(946.0kJ?mol﹣1)+(498.0kJ?mol﹣1)﹣2(630.0kJ?mol﹣1)=+184.0kJ/mol,
故答案为:+184.0;
(2)设通过时间为1min,则每通入100mL混合气体中含CO的体积为amL,出口100mL混合气体中含CO的体积为bmL,故v(CO)==(a﹣b)mL?min﹣1,
故答案为:(a﹣b);
(3)①当反应达到平衡时,测得c(NH3)=pmol?L﹣1、(CO2)=qmol?L﹣1,则
HNCO(g)+H2O(g)?NH3(g)+CO2(g)
qmol?L﹣1
qmol?L﹣1
qmol?L﹣1
CO(NH2)2(s)?NH3(g)+HNCO(g)
(p﹣q)mol?L﹣1
(p﹣q)mol?L﹣1
则c(HNCO)=(p﹣2q)mol/L,则反应Ⅰ的平衡常数K=c(NH3)×c(HNCO)=p(p﹣2q)(mol/L)2,
故答案为:(p﹣2q);p(p﹣2q);
②温度高于1000℃时,反应Ⅱ平衡逆向移动,NH3浓度减小;通过比较温度、氧气浓度对尿素水解产物浓度的影响后,发现在有氧气、1100℃以上时,体系中NH3浓度接近0μL?L﹣1,其可能原因是氨气有还原性,在高温下能被氧气氧化;
故答案为:温度升高,反应Ⅱ平衡逆向移动,NH3浓度减小;氧气在高温时将NH3氧化。
18.解:(1)K3[Fe(C2O4)3]中Fe提供空轨道,C提供孤对电子,则铁离子的配位数为6,其配体C2O42﹣中C原子形成C﹣C及C=O键,杂化方式为sp2杂化,
故答案为:6;sp2;
(2)步骤②发生反应的化学方程式为2Fe(OH)2+H2O2=2Fe(OH)3,
故答案为:2Fe(OH)2+H2O2=2Fe(OH)3;
(3)常温下KHC2O4溶液的pH约为3.5,步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制溶液pH为3.0~3.5,随反应进行需加入适量H2C2O4,
故答案为:H2C2O4;
(4)得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是洗去表面吸附的杂质,并减少溶解损耗,除去结晶体表面的水分,
故答案为:洗去表面吸附的杂质,并减少溶解损耗,除去结晶体表面的水分;
(5)①验证所得气体产物中含有CO和CO2,按气流从左到右的方向,依次连接的合理顺序为D、C、B、A、D、E,即先检验二氧化碳,再除去二氧化碳,浓硫酸干燥CO后,CO还原CuO,再选石灰水检验生成物,最后收集多余的CO,
故答案为:D、C、B、A、D、E;
②确认气体产物中含CO的现象为A中粉末由黑色变为红色,其后D中石灰水变浑浊,
故答案为:A中粉末由黑色变为红色,其后D中石灰水变浑浊。
19.解:(1)①实验来验证假设,向溶液A中加入少量硝酸铜,故假设应为Cu2+的催化作用,
故答案为:Cu2+;
②Ⅰ.实验验证NO2对该反应有催化作用,要保证唯一变量,NO2与水反应会产生硝酸,加入硝酸,排除是硝酸浓度的变化为实验的影响,
故答案为:排除通入的NO2与水反应引起硝酸浓度增大的影响;
Ⅱ.向溶液B中通人氮气数分钟得溶液C,相同条件下,铜片与A、B、C三份溶液的反应速率:B>C>A,假设2成立,NO2对该反应有催化作用,这三支试管的反应速率不同,可能因为NO2的浓度不同,考虑到通入的氮气带走了部分的NO2,
故答案为:通入的氮气可以带走溶液中的NO2,因此三份溶液中的NO2的浓度:B>C>A,反应速率随NO2浓度降低而减慢,说明NO2对该反应有催化作用;
③NO2溶于水可以生成HNO2时化合价降低,那么另一种物质N的化合价必然要升高,即生成HNO3,要证明HNO2对该反应也有催化作用,那么就要向溶液中加入亚硝酸根离子,可以加入NaNO2,
故答案为:HNO3;NaNO2;
(2)NO2有单电子,很容易得到一个电子形成更稳定的NO2﹣,NO3﹣的价层电子对为3+=3,无孤电子对,为平面正三角形结构,且带一个单位的负电荷,难以获得电子,NO2在金属表面得电子的能力强于NO3﹣,
故答案为:NO2有单电子,NO3﹣带一个单位的负电荷,难以获得电子;
(3)HNO2作催化剂,那么i步消耗,在ii步应该要生成,铜和稀硝酸生成NO,所以NO2也为中间产物,结合i、iii,第ii步发生的反应为:Cu+2NO2+2H+═Cu2,++2HNO2,
故答案为:Cu+2NO2+2H+═Cu2,++2HNO2;
(4)假设起始有1
mol
Cu(NO3)2?6H2O放人坩埚中加热,即296
g,当温度升至T℃时,剩余固体质量变为原来的24.33%,即剩余固体的质量为72
g,根据铜元素守恒可得剩余固体中含有64
g
Cu元素,所以另一种元素的质量为8
g,最有可能的是氧元素,即n(O)=0.5
mol,所以该固体的化学式为Cu2O,
故答案为:Cu2O。
20.解:(1)仪器a的名称为恒压滴液漏斗,氯酸钾是强氧化剂和浓盐酸发生氧化还原反应生成氯气、氯化钾和水,装置A中制备Cl2的化学方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,
故答案为:恒压滴液漏斗;KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
(2)待装置B液面上方有黄绿色气体时,再由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是:使反应生成的氢氧化钠再次生成次氯酸钠,提高原料的利用率,
故答案为:液面上方有黄绿色气体;使反应生成的氢氧化钠再次生成次氯酸钠,提高原料的利用率;
(3)二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体难溶于冷水,反应结束后,装置B中的浊液经过滤、冰水洗涤、干燥得粗产品,上述装置存在一处缺陷,浓盐酸挥发出的氯化氢会和氢氧化钠发生反应,会导致装置B中NaOH利用率降低,改进的方法是:在AB装置之间加装盛有饱和食盐水的洗气瓶,
故答案为:冰水洗涤;在AB装置之间加装盛有饱和食盐水的洗气瓶;
(4)①由题目提供反应:可知:C3N3O3Cl2﹣~2HClO~2I2~4S2O32﹣
n(Na2S2O3)=V×10﹣3L×cmol?L﹣1=cV×10﹣3mol,
根据物质转换和电子得失守恒关系:得n(Cl)=0.5n(S2O32﹣)=0.5cV×10﹣3mol,
氯元素的质量:m(Cl)═0.5cV×10﹣3mol×35.5g/mol=0.5cV×35.5×10﹣3g,
根据公式×100%
计算品中的有效氯含量=×100%=,
故答案为:;
②a.如果硫酸的用量过少,则导致反应不能充分进行,产生的HClO的量偏低,最终导致实验测得的有效氯含量会偏低,故a正确;
b.滴定前滴定管未排气泡,滴定后气泡消失,读取标准溶液体积增大,c(待测)=分析,测定结果增大,故b错误;
c.锥形瓶内溶液蓝色消失后立即读数,读取标准溶液体积减少,c(待测)=分析,测定结果偏低,故c正确;
d.读数时,滴定前平视,滴定后仰视,读取标准溶液体积增大,c(待测)=分析,测定结果偏高,故d错误;
故答案为:ac。
第1页(共1页)
同课章节目录
