湖北省汉川市官备塘中学2020年九年级化学下册第8单元课题 2 金属的化学性质专项训练——综合填空题、实验探究题(无答案)
文档属性
| 名称 | 湖北省汉川市官备塘中学2020年九年级化学下册第8单元课题 2 金属的化学性质专项训练——综合填空题、实验探究题(无答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 486.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-20 00:00:00 | ||
图片预览



文档简介
《金属的化学性质》专项训练——综合填空题、实验探究题
1.化学就在我们身边,请用所学化学知识回答下列问题:
(1)湿衣服在阳光下比在阴凉处干得快,这是因为_____。
(2)煤炉中蓝色火焰的产生原理_____(用化学方程式表示);
(3)某饼干包装袋中用作干燥剂的是生石灰,其干燥原理是_____(用化学方程式表示);
(4)实验室制取氢气的原理_____(用化学方程式表示);
(5)在密闭容器中硫酸亚铁受热分解与CaCO3受热分解的方式相同,则硫酸亚铁受热分解反应方程式为_____。
2.请根据掌握的化学知识,解释或解决以下生活中的一些常见问题。
(1)铝的化学性质比较活泼,但却耐腐蚀的原因是_____。
(2)请从分子原子的层面上解释蔗糖在热水中比在冷水中溶解快的原因_____;
(3)“釜底抽薪”灭火原理是_____;
(4)除去铜粉中少量的锌粉所选药品为_____。
3.铜是人类最早利用的金属之一。?
(1)下列铜制品中,利用金属导热性的是?___(填字母序号)。?
A.铜质奖牌????????
B.铜导线?????
C.铜火锅?
(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为?_____?,实验中反应的现象是____
4.写出下列反应的化学方程式
(1)红磷在氧气中燃烧_______。
(2)铜与硝酸银溶液反应_______。
(3)氯酸钾和二氧化锰共热制氧气_______。
5.厉害了,我的国。近年来,我国军事、科技出现井喷形势。
(1)我国的高铁网络已经基本形成。高铁运行靠电力驱动,输电线与高铁列车通过石墨电刷连接,这主要是利用了石墨具有优良的_____性能。
(2)天舟一号货运飞船于2017年4月20日19时41分35秒在文昌航天发射中心由长征七号遥二运载火箭成功发射升空,为保障航天员的健康体魄,后勤部门为他们提供的主食是易于消化的面包、米饭等食物这些食物中主要富含_____(填一种基本营养素)。
(3)某种无人机的动力来源于锂电池,锂电池的工作原理是FePO4+Li?LiFePO4,在LePO4中锂元素显+1价,磷元素显+5价,则铁元素的化合价是_____。
(4)国产C919客机的制造中使用了第三代锂铝合金材料。已知:铯的金属活动性强于钾,则铝的金属活动性_____(填“强”或“弱”)于铯。
6.我国第一艘国产航母下水和国产大型客机C919首飞,标志着我国航海、航空事业有了重大突破,结合所学知识回答下列问题:
(1)铜运用于航母电力系统的导线是利用了铜的导电性和_____________性;
(2)大型客机大量使用的钛合金属于_______________(填“纯净物”或“混合物”);
(3)建造一艘排水量为6万吨的航母约需6万吨的特种钢材,通过高炉炼铁生产6万吨含铁98%的铁制品,需含氧化铁80%的赤铁矿石___________万吨。
(4)是航天、航空、航海、兵器和核能等高科技领域不可缺少的关键材料,比较Mn、Pd(钯)Cu三种金属的活动性顺序。
①将Mn片、Pd片、Cu片分别加入到稀盐酸中,Mn片表面有气泡产生,Pd片和Ca片没有变化,根据上述实验现象得出的结论是_________________;
②要确切得出这三种金属的活动性顺序,还需将Pd片加入到____________溶液中,观察现象。
7.金属及其金属制品对人类社会的发展有着极其重要的作用。
(1)铜锌合金的外观与黄金极为相似,市场上有一些不法分子以假乱真,祸害百姓。利用简单的化学知识,将其放入稀盐酸中,观察是否有________产生即可鉴别其真伪。
(2)铝、铁、银是日常生活中经常接触到的三种金属。对Al、Fe、Ag三种金属的活动性顺序进行探究,能达到目的的一组试剂是________(填序号)。
①Ag、FeCl2溶液、AlCl3溶液 ②Fe、AlCl3溶液、AgNO3溶液
③Ag、Fe、AlCl3溶液
金属材料在人类的生产、生活中有着十分重要的作用。
(1)多种金属可以压成薄片,抽成细丝,说明金属具有____性;
(2)实验室有打磨过的铝片、铁片和硫酸铜溶液。兴趣小组同学欲验证铝、铁和铜的活泼性顺序,进行如下操作:
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是__
__;
②__
__(请补充实验具体操作);
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应,写出该反应的化学方程式__
__;
结论:三种金属的活泼性由强到弱顺序是__
__。
9.材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:Ni+H2SO4===NiSO4+H2↑,
根据此材料及金属活动性顺序,回答下列问题:
(1)铸造硬币用到的材料是____;
(2)写出Ni与CuSO4溶液发生置换反应的化学方程式__
__。
10.镁、铁、铝在日常生活中都有较广泛的用途。如:
(1)镁在空气中燃烧时,能发出耀眼的白光,可用来制造镁闪光灯,该反应的化学方程式为__
__,该反应的基本类型是__
__;
(2)铝常用于制作炊具,主要利用它的____性。常温下铝是一种活泼的金属,但铝却有较强的抗腐蚀性,其原因是__
__。
11.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和__
__;
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是__
__;
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验:
实验序号
实验过程
实验现象
1
镁粉和铁粉分别与5%盐酸反应
镁粉产生气体快
2
铁粉和铁片分别与15%盐酸反应
铁粉产生气体快
3
铁片分别与5%盐酸和15%盐酸反应
15%盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a:__
__;
b:__
__;
c:_
__。
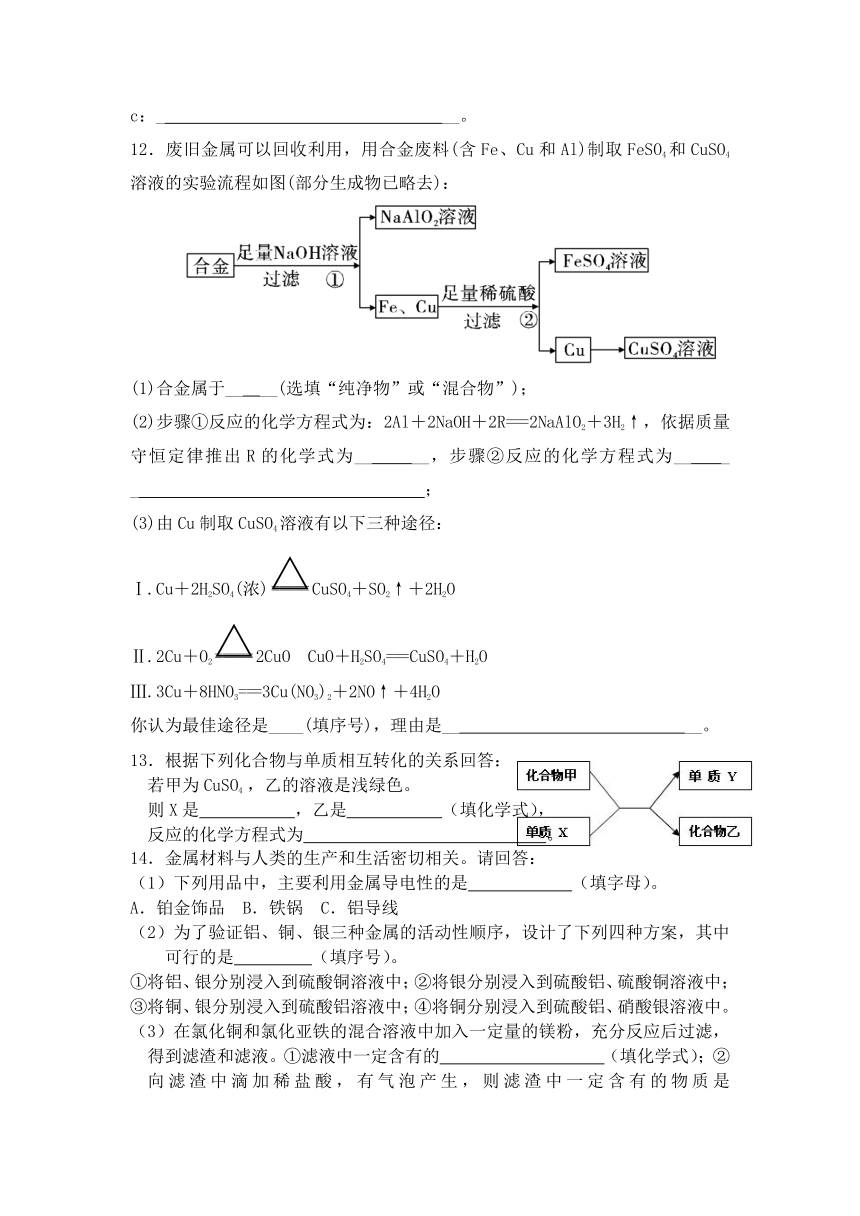
12.废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4和CuSO4溶液的实验流程如图(部分生成物已略去):
(1)合金属于__
__(选填“纯净物”或“混合物”);
(2)步骤①反应的化学方程式为:2Al+2NaOH+2R===2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为__
__,步骤②反应的化学方程式为__
_
_
;
(3)由Cu制取CuSO4溶液有以下三种途径:
Ⅰ.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O22CuO CuO+H2SO4===CuSO4+H2O
Ⅲ.3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
你认为最佳途径是____(填序号),理由是__
__。
13.根据下列化合物与单质相互转化的关系回答:
若甲为CuSO4
,乙的溶液是浅绿色。
则X是
,乙是
(填化学式),
反应的化学方程式为
。
14.金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是
(填字母)。
A.铂金饰品
B.铁锅
C.铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是
(填序号)。
①将铝、银分别浸入到硫酸铜溶液中;②将银分别浸入到硫酸铝、硫酸铜溶液中;
③将铜、银分别浸入到硫酸铝溶液中;④将铜分别浸入到硫酸铝、硝酸银溶液中。
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。①滤液中一定含有的
(填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是
(填化学式)。
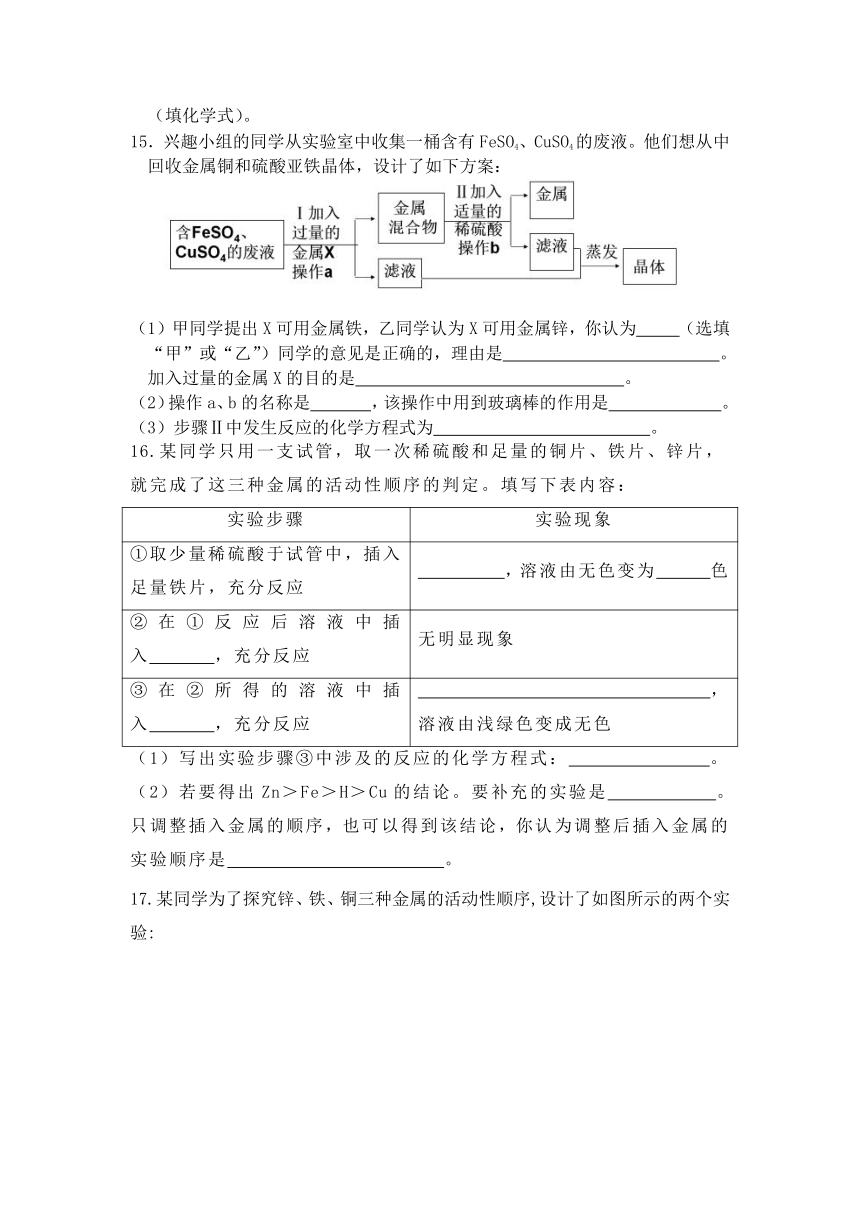
15.兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液。他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:
(1)甲同学提出X可用金属铁,乙同学认为X可用金属锌,你认为
(选填“甲”或“乙”)同学的意见是正确的,理由是
。
加入过量的金属X的目的是
。
(2)操作a、b的名称是
,该操作中用到玻璃棒的作用是
。
(3)步骤Ⅱ中发生反应的化学方程式为
。
16.某同学只用一支试管,取一次稀硫酸和足量的铜片、铁片、锌片,就完成了这三种金属的活动性顺序的判定。填写下表内容:
实验步骤
实验现象
①取少量稀硫酸于试管中,插入足量铁片,充分反应
,溶液由无色变为
色
②在①反应后溶液中插入
,充分反应
无明显现象
③在②所得的溶液中插入
,充分反应
,溶液由浅绿色变成无色
(1)写出实验步骤③中涉及的反应的化学方程式:
。
(2)若要得出Zn>Fe>H>Cu的结论。要补充的实验是
。只调整插入金属的顺序,也可以得到该结论,你认为调整后插入金属的实验顺序是
。
17.某同学为了探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
(1)实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是?????????????????__。
(2)实验二中,若出现__________________________________现象,可证明铁的活动性强于铜,该反应的化学方程式为?????????????__。
18.白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银作饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。
已知溶液B中含有一种二价金属硫酸盐,溶液D中只有一种溶质。
分析该流程,回答下列问题:
(1)固体A的化学式为________,过程Ⅱ中的实验操作名称是________。
(2)过程Ⅰ中反应的化学方程式为__?????????。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是__?????。
19.为验证锌、铁、铜三种金属的活动性顺序,丽丽和强强同学设计了不同的实验方案进行实验,都达到了实验目的。他们所用的试剂有锌片、铁片、铜片、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:
实验方案
方案一
方案二
实验
操作
一种金属放入两种溶液中
两种金属同时放入一种溶液中
(1)方案一中选择的金属是________,有关反应的化学方程式为____________
______________________。
(2)方案二中能发生反应的化学方程式是__________________________。
(3)军军同学又设计了一个新的方案,也能达到实验目的。将三种金属分别放入一种溶液中,该溶液中的溶质在物质分类上和前两位同学所用的试剂不同,他选择的溶液是__________,实验操作:_
??????_。
20.2019年12月26日合肥地铁3号线正式开通,让合肥交通正式迈入线网时代,右图为地铁列车图。回答下列问题:
(1)图中所示材料中,属于金属材料的是
钢(或钛合金)(填一种即可)塑料。
(2)冶炼钛时,将铁矿石转化为下TiCl4,TiCl4再与Na在一定条件下置换反应生成Ti,请写出后一步反应的化学方程式(不要求标出反应条件)TiCl4+4Na=Ti+4NaCl
。
(3)轨道交通的发展减轻了公共交通及私家车带来的拥堵等问题,从化学的角度来看,你认为发展轨道交通还有什么好处?
21.能源、材料和安全是人们关注的热点话题。请回答:
(1)太阳能电池路灯被越来越广泛地应用。如图所标示的路灯各主要部件中属于金属材料的是
①②⑤(填序号),电池板中用铜丝导线主要是利用了铜的导电性
。
(2)篝火晚会时为使木柴燃烧的更旺,常把木柴架空,其原理是增大木柴与空气的接触面积,促进燃烧
。
(3)恰当的安全措施能减少生命财产损失。下列措施正确的是AC
(填字母)。
A.燃气泄漏,立即关闭阀门并开窗通风
B.电器着火,立即用水浇灭
C.点燃甲烷前,先检验气体纯度
D.住房着火,立即打开所有门窗
(4)登山运动员用氢化钙(CaH2)与水反应制取氢气作为燃料,同时得到氢氧化钙。氢化钙与水反应的化学方程式为CaH2+2H2O=2H2↑+Ca(OH)2
。
22.某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题:
请你根据流程回答下列问题:
(1)操作a的名称是
过滤;
(2)步骤①中,金属X是铁
;该反应的化学方程式为Fe+CuSO4═FeSO4+Cu
;
(3)步骤②中,加入过量稀硫酸的目的是除去铜中的铁
。
23.小明为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验。请分析实验,完成填空。
(1)试管①中观察到的现象是:
铝丝的表面覆盖一层红色的物质,溶液颜色由蓝色变为无色;
(2)试管②中发生了化学反应,现象明显。该反应的化学方程式是Cu+2AgNO3═Cu(NO3)2+2Ag
;
(3)通过实验探究,Cu、Al、Ag三种金属活动性由强到弱的顺序是铝>铜>银
。
24.铁和铝是我们生活中常见的两种金属.某化学小组欲探究铁和铝的金属活动性强弱,设计如下实验方案:
(1)小组同学取来相同质量的铁、铝分别放入起始温度相同、体积也相同的10%稀盐酸中,一开始观察到的现象是铁表面有气泡,而铝无明显现象,小明于是得出与课本中相反的结论.小文同学马上提出质疑,你认为质疑的主要理由是
铝表面有一层致密的氧化铝(或未打磨金属).Al2O3+6HCl=2AlCl3+3H2O.为了达到实验目的,除了以上条件相同外,你认为还要控制2中金属的表面积或颗粒大小
相同.
(2)他们改正后重新实验,得出与课本相同的结论是铝的活动性比铁强
.请写出铁与稀盐酸反应的化学方程式Fe+2HCl=FeCl2+H2↑
.
【应用拓展】请再设计一个与上述不同的实验方案,也能得到以上相同的正确结论.
操作方法
实验现象
?
将打磨过的铝放入硫酸亚铁溶液中,观察现象
或打磨过的铁钉放入硫酸铝溶液中,观察现象
?
铝表面出现固体,溶液由浅绿色慢慢变成无色
或无明显变化
小组同学通过对生活中金属制品的观察和课本所学的知识,仍能得出同样的正确结论.你的解释是
25.为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是______;金属B是______。
(2)操作a的名称是______。
(3)写出步骤②所涉及的化学反应方程式:____________________________,
该反应的基本类型是:_______________。
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂______(填标号)。
a.硫酸铜溶液
b.氯化钠溶液
c.硝酸银溶液
26.在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
(1)一段时间后,可观察到实验Ⅱ现象是__
__;反应的化学方程式是__
__;
(2)甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁金属活动性强弱。你认为他依据的实验现象是__
__;
(3)乙和丙两位同学认为上述三个实验不能够得出四种金属活动性顺序,原因是__
__;并在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们的实验:X是金属____,Y是____溶液(写出化学式),反应的化学方程式为__
__。
27.如图实验操作流程图中的A、B、C分别是Al、Fe、Cu中的一种。请回答以下问题:
(1)A是
____,B是____(填化学式);
(2)A、B、C三种金属的活动性顺序是__
__;
(3)写出步骤①所涉及的一个化学方程式__
__;
(4)操作a的名称是
____;
(5)步骤②所发生化学反应的基本类型____(选填“化合”“分解”“置换”或“复分解”)反应。
28.某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】铁的活动性比铜强。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu;
猜想二:__
__;
猜想三:Fe>Cu>R;
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究:
主要操作
主要现象
实验结论
甲
将打磨好的R丝插入盛有硫酸铜溶液的试管中
_
__
猜想一
正确
乙
将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中
R丝表面产生气泡速率比铁丝表面产生气泡速率____(选填“快”或“慢”)
丙
将粗细相同打磨好的R丝、铁丝,分别在空气中点燃
R丝在空气中剧烈燃烧,铁丝在空气中__
__
写出铁丝在氧气中燃烧的化学方程式__
__;
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种;
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与__
__是否反应。
29.小新拿来一片黄色的金属向同学们炫耀说他捡到了黄金。小宝说他曾在网上看到过,有一种铜锌合金外观和黄金相似,常被误认为是黄金。于是他与小新开始探究。
【提出问题】这块黄色的金属是黄金还是铜锌合金?
【猜想】①小新认为是黄金;②小宝认为是铜锌合金。
【查阅资料】合金中的金属保持各自的化学性质,金在高温下不与氧气反应,锌在高温下与氧气反应生成白色固体。
【设计实验】
①小新设计的实验是截取一小片黄色的金属放在石棉网上用酒精灯加热;
②小宝设计的实验是截取一小片黄色的金属放入硝酸银溶液中。
【现象与结论】
①小新在实验中观察到黄色的金属变黑,则他的猜想______________,黑色物质是________________。
②小宝在实验中观察到的现象是____________________。
写出反应的化学方程式___________________(只写一个)。
【反思与应用】
①假如你的观点和小宝的观点相同,你还可以设计一个实验是截取一小片黄色的金属放入______中。
②你设计的实验中能观察到的现象是________________________________。
30.氢化镁(化学式为MgH2)是一种常用的焰火剂,某兴趣小组拟选用如下图装置制备氢化镁。
(查阅资料)
(1)氢化镁可用氢气与纳米级镁粉加热制得。氢化镁遇水反应生成氢氧化镁[Mg(OH)2]和氢气,并放出热量。
(2)常温下镁不与水反应,标准状况下氢气的密度为0.09g/L。
(实验步骤)
①先连接装置,再……;
②装入药品,打开分液漏斗活塞向装置中通入氢气,D处收集的气体验纯后,给C装置加热。继续通入平稳的氢气流。
③实验结束时,先停止加热,等装置冷却到室温停止通入氢气。
回答下列问题:
(1)请将步骤①中的操作补充完整____。
(2)装置A中反应的化学方程式____。A中用分液漏斗添加稀硫酸的优点是____。制得的氢化镁必须____保存。
(3)实验开始时要“先通氢气”的目的,除防止氢气遇到热的空气引起爆炸外,还有____。B装置的作用是____。
(4)实验结束同学们利用下图装置检测得到的氢化镁的纯度。取一定质量样品,如图放入Y形管一端,实验开始将Y形管倾斜,水和样品接触,共收集到氢气178ml,则样品中氢化镁的质量是____g。
(5)如果测量的结果偏大,可能的原因是____。
A.Y形管左侧的水倒入右侧排出部分气体
B.导管伸入量筒太长,未将导管拿出就读数
C.未冷却到室温就读数
D.实验前Y形管里有空气
1.化学就在我们身边,请用所学化学知识回答下列问题:
(1)湿衣服在阳光下比在阴凉处干得快,这是因为_____。
(2)煤炉中蓝色火焰的产生原理_____(用化学方程式表示);
(3)某饼干包装袋中用作干燥剂的是生石灰,其干燥原理是_____(用化学方程式表示);
(4)实验室制取氢气的原理_____(用化学方程式表示);
(5)在密闭容器中硫酸亚铁受热分解与CaCO3受热分解的方式相同,则硫酸亚铁受热分解反应方程式为_____。
2.请根据掌握的化学知识,解释或解决以下生活中的一些常见问题。
(1)铝的化学性质比较活泼,但却耐腐蚀的原因是_____。
(2)请从分子原子的层面上解释蔗糖在热水中比在冷水中溶解快的原因_____;
(3)“釜底抽薪”灭火原理是_____;
(4)除去铜粉中少量的锌粉所选药品为_____。
3.铜是人类最早利用的金属之一。?
(1)下列铜制品中,利用金属导热性的是?___(填字母序号)。?
A.铜质奖牌????????
B.铜导线?????
C.铜火锅?
(2)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为?_____?,实验中反应的现象是____
4.写出下列反应的化学方程式
(1)红磷在氧气中燃烧_______。
(2)铜与硝酸银溶液反应_______。
(3)氯酸钾和二氧化锰共热制氧气_______。
5.厉害了,我的国。近年来,我国军事、科技出现井喷形势。
(1)我国的高铁网络已经基本形成。高铁运行靠电力驱动,输电线与高铁列车通过石墨电刷连接,这主要是利用了石墨具有优良的_____性能。
(2)天舟一号货运飞船于2017年4月20日19时41分35秒在文昌航天发射中心由长征七号遥二运载火箭成功发射升空,为保障航天员的健康体魄,后勤部门为他们提供的主食是易于消化的面包、米饭等食物这些食物中主要富含_____(填一种基本营养素)。
(3)某种无人机的动力来源于锂电池,锂电池的工作原理是FePO4+Li?LiFePO4,在LePO4中锂元素显+1价,磷元素显+5价,则铁元素的化合价是_____。
(4)国产C919客机的制造中使用了第三代锂铝合金材料。已知:铯的金属活动性强于钾,则铝的金属活动性_____(填“强”或“弱”)于铯。
6.我国第一艘国产航母下水和国产大型客机C919首飞,标志着我国航海、航空事业有了重大突破,结合所学知识回答下列问题:
(1)铜运用于航母电力系统的导线是利用了铜的导电性和_____________性;
(2)大型客机大量使用的钛合金属于_______________(填“纯净物”或“混合物”);
(3)建造一艘排水量为6万吨的航母约需6万吨的特种钢材,通过高炉炼铁生产6万吨含铁98%的铁制品,需含氧化铁80%的赤铁矿石___________万吨。
(4)是航天、航空、航海、兵器和核能等高科技领域不可缺少的关键材料,比较Mn、Pd(钯)Cu三种金属的活动性顺序。
①将Mn片、Pd片、Cu片分别加入到稀盐酸中,Mn片表面有气泡产生,Pd片和Ca片没有变化,根据上述实验现象得出的结论是_________________;
②要确切得出这三种金属的活动性顺序,还需将Pd片加入到____________溶液中,观察现象。
7.金属及其金属制品对人类社会的发展有着极其重要的作用。
(1)铜锌合金的外观与黄金极为相似,市场上有一些不法分子以假乱真,祸害百姓。利用简单的化学知识,将其放入稀盐酸中,观察是否有________产生即可鉴别其真伪。
(2)铝、铁、银是日常生活中经常接触到的三种金属。对Al、Fe、Ag三种金属的活动性顺序进行探究,能达到目的的一组试剂是________(填序号)。
①Ag、FeCl2溶液、AlCl3溶液 ②Fe、AlCl3溶液、AgNO3溶液
③Ag、Fe、AlCl3溶液
金属材料在人类的生产、生活中有着十分重要的作用。
(1)多种金属可以压成薄片,抽成细丝,说明金属具有____性;
(2)实验室有打磨过的铝片、铁片和硫酸铜溶液。兴趣小组同学欲验证铝、铁和铜的活泼性顺序,进行如下操作:
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是__
__;
②__
__(请补充实验具体操作);
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应,写出该反应的化学方程式__
__;
结论:三种金属的活泼性由强到弱顺序是__
__。
9.材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:Ni+H2SO4===NiSO4+H2↑,
根据此材料及金属活动性顺序,回答下列问题:
(1)铸造硬币用到的材料是____;
(2)写出Ni与CuSO4溶液发生置换反应的化学方程式__
__。
10.镁、铁、铝在日常生活中都有较广泛的用途。如:
(1)镁在空气中燃烧时,能发出耀眼的白光,可用来制造镁闪光灯,该反应的化学方程式为__
__,该反应的基本类型是__
__;
(2)铝常用于制作炊具,主要利用它的____性。常温下铝是一种活泼的金属,但铝却有较强的抗腐蚀性,其原因是__
__。
11.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和__
__;
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是__
__;
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验:
实验序号
实验过程
实验现象
1
镁粉和铁粉分别与5%盐酸反应
镁粉产生气体快
2
铁粉和铁片分别与15%盐酸反应
铁粉产生气体快
3
铁片分别与5%盐酸和15%盐酸反应
15%盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a:__
__;
b:__
__;
c:_
__。
12.废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4和CuSO4溶液的实验流程如图(部分生成物已略去):
(1)合金属于__
__(选填“纯净物”或“混合物”);
(2)步骤①反应的化学方程式为:2Al+2NaOH+2R===2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为__
__,步骤②反应的化学方程式为__
_
_
;
(3)由Cu制取CuSO4溶液有以下三种途径:
Ⅰ.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
Ⅱ.2Cu+O22CuO CuO+H2SO4===CuSO4+H2O
Ⅲ.3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
你认为最佳途径是____(填序号),理由是__
__。
13.根据下列化合物与单质相互转化的关系回答:
若甲为CuSO4
,乙的溶液是浅绿色。
则X是
,乙是
(填化学式),
反应的化学方程式为
。
14.金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是
(填字母)。
A.铂金饰品
B.铁锅
C.铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是
(填序号)。
①将铝、银分别浸入到硫酸铜溶液中;②将银分别浸入到硫酸铝、硫酸铜溶液中;
③将铜、银分别浸入到硫酸铝溶液中;④将铜分别浸入到硫酸铝、硝酸银溶液中。
(3)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。①滤液中一定含有的
(填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是
(填化学式)。
15.兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液。他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:
(1)甲同学提出X可用金属铁,乙同学认为X可用金属锌,你认为
(选填“甲”或“乙”)同学的意见是正确的,理由是
。
加入过量的金属X的目的是
。
(2)操作a、b的名称是
,该操作中用到玻璃棒的作用是
。
(3)步骤Ⅱ中发生反应的化学方程式为
。
16.某同学只用一支试管,取一次稀硫酸和足量的铜片、铁片、锌片,就完成了这三种金属的活动性顺序的判定。填写下表内容:
实验步骤
实验现象
①取少量稀硫酸于试管中,插入足量铁片,充分反应
,溶液由无色变为
色
②在①反应后溶液中插入
,充分反应
无明显现象
③在②所得的溶液中插入
,充分反应
,溶液由浅绿色变成无色
(1)写出实验步骤③中涉及的反应的化学方程式:
。
(2)若要得出Zn>Fe>H>Cu的结论。要补充的实验是
。只调整插入金属的顺序,也可以得到该结论,你认为调整后插入金属的实验顺序是
。
17.某同学为了探究锌、铁、铜三种金属的活动性顺序,设计了如图所示的两个实验:
(1)实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是?????????????????__。
(2)实验二中,若出现__________________________________现象,可证明铁的活动性强于铜,该反应的化学方程式为?????????????__。
18.白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银作饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。
已知溶液B中含有一种二价金属硫酸盐,溶液D中只有一种溶质。
分析该流程,回答下列问题:
(1)固体A的化学式为________,过程Ⅱ中的实验操作名称是________。
(2)过程Ⅰ中反应的化学方程式为__?????????。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是__?????。
19.为验证锌、铁、铜三种金属的活动性顺序,丽丽和强强同学设计了不同的实验方案进行实验,都达到了实验目的。他们所用的试剂有锌片、铁片、铜片、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:
实验方案
方案一
方案二
实验
操作
一种金属放入两种溶液中
两种金属同时放入一种溶液中
(1)方案一中选择的金属是________,有关反应的化学方程式为____________
______________________。
(2)方案二中能发生反应的化学方程式是__________________________。
(3)军军同学又设计了一个新的方案,也能达到实验目的。将三种金属分别放入一种溶液中,该溶液中的溶质在物质分类上和前两位同学所用的试剂不同,他选择的溶液是__________,实验操作:_
??????_。
20.2019年12月26日合肥地铁3号线正式开通,让合肥交通正式迈入线网时代,右图为地铁列车图。回答下列问题:
(1)图中所示材料中,属于金属材料的是
钢(或钛合金)(填一种即可)塑料。
(2)冶炼钛时,将铁矿石转化为下TiCl4,TiCl4再与Na在一定条件下置换反应生成Ti,请写出后一步反应的化学方程式(不要求标出反应条件)TiCl4+4Na=Ti+4NaCl
。
(3)轨道交通的发展减轻了公共交通及私家车带来的拥堵等问题,从化学的角度来看,你认为发展轨道交通还有什么好处?
21.能源、材料和安全是人们关注的热点话题。请回答:
(1)太阳能电池路灯被越来越广泛地应用。如图所标示的路灯各主要部件中属于金属材料的是
①②⑤(填序号),电池板中用铜丝导线主要是利用了铜的导电性
。
(2)篝火晚会时为使木柴燃烧的更旺,常把木柴架空,其原理是增大木柴与空气的接触面积,促进燃烧
。
(3)恰当的安全措施能减少生命财产损失。下列措施正确的是AC
(填字母)。
A.燃气泄漏,立即关闭阀门并开窗通风
B.电器着火,立即用水浇灭
C.点燃甲烷前,先检验气体纯度
D.住房着火,立即打开所有门窗
(4)登山运动员用氢化钙(CaH2)与水反应制取氢气作为燃料,同时得到氢氧化钙。氢化钙与水反应的化学方程式为CaH2+2H2O=2H2↑+Ca(OH)2
。
22.某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题:
请你根据流程回答下列问题:
(1)操作a的名称是
过滤;
(2)步骤①中,金属X是铁
;该反应的化学方程式为Fe+CuSO4═FeSO4+Cu
;
(3)步骤②中,加入过量稀硫酸的目的是除去铜中的铁
。
23.小明为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验。请分析实验,完成填空。
(1)试管①中观察到的现象是:
铝丝的表面覆盖一层红色的物质,溶液颜色由蓝色变为无色;
(2)试管②中发生了化学反应,现象明显。该反应的化学方程式是Cu+2AgNO3═Cu(NO3)2+2Ag
;
(3)通过实验探究,Cu、Al、Ag三种金属活动性由强到弱的顺序是铝>铜>银
。
24.铁和铝是我们生活中常见的两种金属.某化学小组欲探究铁和铝的金属活动性强弱,设计如下实验方案:
(1)小组同学取来相同质量的铁、铝分别放入起始温度相同、体积也相同的10%稀盐酸中,一开始观察到的现象是铁表面有气泡,而铝无明显现象,小明于是得出与课本中相反的结论.小文同学马上提出质疑,你认为质疑的主要理由是
铝表面有一层致密的氧化铝(或未打磨金属).Al2O3+6HCl=2AlCl3+3H2O.为了达到实验目的,除了以上条件相同外,你认为还要控制2中金属的表面积或颗粒大小
相同.
(2)他们改正后重新实验,得出与课本相同的结论是铝的活动性比铁强
.请写出铁与稀盐酸反应的化学方程式Fe+2HCl=FeCl2+H2↑
.
【应用拓展】请再设计一个与上述不同的实验方案,也能得到以上相同的正确结论.
操作方法
实验现象
?
将打磨过的铝放入硫酸亚铁溶液中,观察现象
或打磨过的铁钉放入硫酸铝溶液中,观察现象
?
铝表面出现固体,溶液由浅绿色慢慢变成无色
或无明显变化
小组同学通过对生活中金属制品的观察和课本所学的知识,仍能得出同样的正确结论.你的解释是
25.为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是______;金属B是______。
(2)操作a的名称是______。
(3)写出步骤②所涉及的化学反应方程式:____________________________,
该反应的基本类型是:_______________。
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂______(填标号)。
a.硫酸铜溶液
b.氯化钠溶液
c.硝酸银溶液
26.在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
(1)一段时间后,可观察到实验Ⅱ现象是__
__;反应的化学方程式是__
__;
(2)甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁金属活动性强弱。你认为他依据的实验现象是__
__;
(3)乙和丙两位同学认为上述三个实验不能够得出四种金属活动性顺序,原因是__
__;并在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们的实验:X是金属____,Y是____溶液(写出化学式),反应的化学方程式为__
__。
27.如图实验操作流程图中的A、B、C分别是Al、Fe、Cu中的一种。请回答以下问题:
(1)A是
____,B是____(填化学式);
(2)A、B、C三种金属的活动性顺序是__
__;
(3)写出步骤①所涉及的一个化学方程式__
__;
(4)操作a的名称是
____;
(5)步骤②所发生化学反应的基本类型____(选填“化合”“分解”“置换”或“复分解”)反应。
28.某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】铁的活动性比铜强。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu;
猜想二:__
__;
猜想三:Fe>Cu>R;
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究:
主要操作
主要现象
实验结论
甲
将打磨好的R丝插入盛有硫酸铜溶液的试管中
_
__
猜想一
正确
乙
将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中
R丝表面产生气泡速率比铁丝表面产生气泡速率____(选填“快”或“慢”)
丙
将粗细相同打磨好的R丝、铁丝,分别在空气中点燃
R丝在空气中剧烈燃烧,铁丝在空气中__
__
写出铁丝在氧气中燃烧的化学方程式__
__;
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种;
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与__
__是否反应。
29.小新拿来一片黄色的金属向同学们炫耀说他捡到了黄金。小宝说他曾在网上看到过,有一种铜锌合金外观和黄金相似,常被误认为是黄金。于是他与小新开始探究。
【提出问题】这块黄色的金属是黄金还是铜锌合金?
【猜想】①小新认为是黄金;②小宝认为是铜锌合金。
【查阅资料】合金中的金属保持各自的化学性质,金在高温下不与氧气反应,锌在高温下与氧气反应生成白色固体。
【设计实验】
①小新设计的实验是截取一小片黄色的金属放在石棉网上用酒精灯加热;
②小宝设计的实验是截取一小片黄色的金属放入硝酸银溶液中。
【现象与结论】
①小新在实验中观察到黄色的金属变黑,则他的猜想______________,黑色物质是________________。
②小宝在实验中观察到的现象是____________________。
写出反应的化学方程式___________________(只写一个)。
【反思与应用】
①假如你的观点和小宝的观点相同,你还可以设计一个实验是截取一小片黄色的金属放入______中。
②你设计的实验中能观察到的现象是________________________________。
30.氢化镁(化学式为MgH2)是一种常用的焰火剂,某兴趣小组拟选用如下图装置制备氢化镁。
(查阅资料)
(1)氢化镁可用氢气与纳米级镁粉加热制得。氢化镁遇水反应生成氢氧化镁[Mg(OH)2]和氢气,并放出热量。
(2)常温下镁不与水反应,标准状况下氢气的密度为0.09g/L。
(实验步骤)
①先连接装置,再……;
②装入药品,打开分液漏斗活塞向装置中通入氢气,D处收集的气体验纯后,给C装置加热。继续通入平稳的氢气流。
③实验结束时,先停止加热,等装置冷却到室温停止通入氢气。
回答下列问题:
(1)请将步骤①中的操作补充完整____。
(2)装置A中反应的化学方程式____。A中用分液漏斗添加稀硫酸的优点是____。制得的氢化镁必须____保存。
(3)实验开始时要“先通氢气”的目的,除防止氢气遇到热的空气引起爆炸外,还有____。B装置的作用是____。
(4)实验结束同学们利用下图装置检测得到的氢化镁的纯度。取一定质量样品,如图放入Y形管一端,实验开始将Y形管倾斜,水和样品接触,共收集到氢气178ml,则样品中氢化镁的质量是____g。
(5)如果测量的结果偏大,可能的原因是____。
A.Y形管左侧的水倒入右侧排出部分气体
B.导管伸入量筒太长,未将导管拿出就读数
C.未冷却到室温就读数
D.实验前Y形管里有空气
同课章节目录
