重庆第八高中2020-2021学年高二上学期期中考试化学试题 含答案
文档属性
| 名称 | 重庆第八高中2020-2021学年高二上学期期中考试化学试题 含答案 |
|
|
| 格式 | docx | ||
| 文件大小 | 513.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-21 00:00:00 | ||
图片预览




文档简介
1089660012344400重庆八中2020—2021学年度(上)半期考试高2022级
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Cl 35.5 V 51 Fe 56 Cu 64
一、选择题(本大题包含25小题,每小题2分,每题只有一个选项符合要求。)
下列化学用语错误的是
A.四氯化碳的电子式: B.丙炔的分子式:C3H4
C.乙烯的结构简式:CH2=CH2 D.丙烷分子的球棍模型:
下列有机物名称正确的是
A.2-乙基丁烷 B.2-甲基-3-丁烯
C.3-甲基戊烷 D.3-丁炔
4520565258445下列装置能构成原电池的是
A. B. C. D.
下列有机物中一定属于苯的同系物的是
A.C7H8 B.false C.false D.false
下列事实能说明苯不是单双键交替结构的是
A.苯中所有原子共平面
B.苯的一氯代物只有1种
C.苯不能使酸性高锰酸钾溶液褪色
D.苯的对位二氯代物只有1种
某烯烃的化学式为C4H8,其同分异构体的数目是(不考虑顺反异构)
A.2种 B.3种 C.4种 D.5种
有甲、乙、丙三种金属,将它们放在稀硫酸中,只有乙无明显现象。若用导线将甲、丙相连后放入稀硫酸,只有丙电极上产生大量气泡,这三种金属的活动性顺序是
A.甲>丙>乙 B.甲>乙>丙 C.丙>乙>甲 D.乙>甲>丙
下列对同系物的说法正确的是
A.同系物一定具有相同的最简式
B.分子式相同的有机物一定互为同系物
C.同系物彼此在组成上相差一个或若干个CH2
D.同系物的物理性质完全相同,例如苯的同系物都难溶于水
下列物质的沸点按由高到低的顺序排列正确的是
①CH3(CH2)3CH3 ②CH3(CH2)4CH3 ③(CH3)2CHCH2CH3 ④C(CH3)4
A.②④①③ B.②①③④ C.④①③② D.③②①④
NA代表阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数为NA
B.常温常压下,1 mol甲基所含电子数为7NA
C.常温常压下,0.5mol苯乙烯中含有的碳碳双键数目为2NA
D.标准状况下,11.2L乙烷和丙烯混合物中氢原子数目为3NA
有五种物质:①乙烯、②苯、③2-丁炔、④环己烷、⑤环己烯,能与溴水反应使之褪色的是
A.①②③ B.①②④⑤ C.②③④⑤ D.①③⑤
戊烷常用作有机溶剂,下列叙述中正确的是
A.C5H12在常温下一定是液体
B.正戊烷分子中五个碳原子排列成一条直线
C.异戊烷进行一氯取代后可生成4种沸点不同的有机产物
D.新戊烷可以由烯烃与氢气加成得到
下列说法错误的是
A.电池只能将化学能转化为电能
B.废旧电池必须回收处理,防止重金属污染
C.铅蓄电池工作一段时间后进行充电时铅蓄电池负极接电源的负极
D.碱性氢氧燃料电池的能量转化效率比氢气直接燃烧效率更高
完全燃烧0.1mol两种气态烃的混合物,将燃烧产物依次通过足量浓硫酸和足量氢氧化钠溶液,称得浓硫酸增重3.6克,氢氧化钠溶液增重6.6g,则混合物中
A.一定存在CH4 B.可能存在C2H2
C.一定含有C2H4 D.可能含有C2H6
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
A.甲苯燃烧生成CO2 B.甲苯与硝酸发生反应生成TNT
C.甲苯能使酸性KMnO4溶液褪色 D.光照下甲苯与Br2在侧链上发生取代反应
3904615229870右图所示为锌铜原电池,下列叙述中正确的是
A.盐桥中阴离子向CuSO4溶液中迁移
B.外电路电流由铜片流向锌片
C.锌片是电池负极,发生还原反应
D.CuSO4溶液质量一定减小
β?月桂烯广泛存在于植物中,具有清淡的香脂香气,可作为古龙香水和消臭剂的香料。它的结构如图所示,下列有关β?月桂烯说法正确的是
falseA.它的分子式为C10H14
B.它容易挥发且易溶于水
C.它所有的碳原子一定在同一平面上
D.1mol β?月桂烯与溴水反应,最多消耗3mol Br2
下列各组物质的鉴别中,所用鉴别试剂或方法错误的是
A.甲烷和乙烯:溴水 B.苯和四氯化碳:水
C.乙烯和SO2:酸性KMnO4溶液 D.苯和甲苯:酸性KMnO4溶液
下列各组物质中,括号内为杂质,以下对应操作能达到除杂目的是
A.乙醇(水):分液
B.乙烷(乙烯):通入酸性KMnO4溶液洗气
C.乙烷(乙烯):在一定条件下通氢气
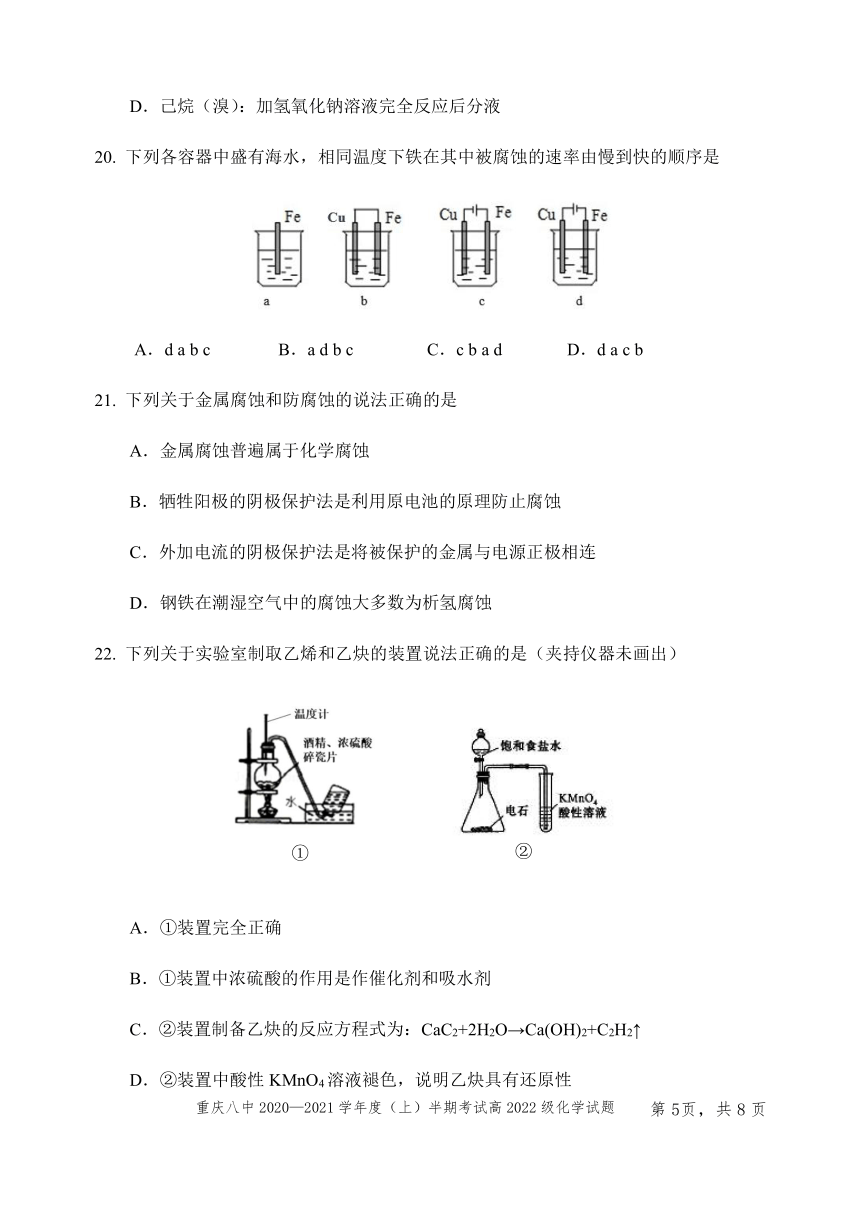
D.己烷(溴):加氢氧化钠溶液完全反应后分液
下列各容器中盛有海水,相同温度下铁在其中被腐蚀的速率由慢到快的顺序是
A.d a b c B.a d b c C.c b a d D.d a c b
下列关于金属腐蚀和防腐蚀的说法正确的是
A.金属腐蚀普遍属于化学腐蚀
B.牺牲阳极的阴极保护法是利用原电池的原理防止腐蚀
C.外加电流的阴极保护法是将被保护的金属与电源正极相连
D.钢铁在潮湿空气中的腐蚀大多数为析氢腐蚀
下列关于实验室制取乙烯和乙炔的装置说法正确的是(夹持仪器未画出)
31083251044575②
②
14058901059180①
①
A.①装置完全正确
B.①装置中浓硫酸的作用是作催化剂和吸水剂
C.②装置制备乙炔的反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑
D.②装置中酸性KMnO4溶液褪色,说明乙炔具有还原性
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是
A.Pt电极为该电池正极
3378835-352425B.外电路中,电子从NiO电极流出
C.Pt电极的电极反应为O2+ 4e-===2O2-
D.当有2.24L NO参与反应时,转移了0.2mol电子
石蜡油分解及其产物性质实验装置如图,下列说法正确的是
A.石蜡油是液态烯烃混合物
B.该实验可以证明石蜡油分解产生了乙烯
C.装置b发生的反应的基本类型是取代反应
D.实验中可观察到装置c中溶液褪色
3590290398145某新型二次电池反应原理为M+3Cn(MCl4)+4MC14-false4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
A.放电时,b极为负极
B.放电时,MCl4-向b极迁移
C.充电时,a极反应为4M2Cl7-+3e-===7MCl4-+M
D.充电时,若电路中转移0.5mol电子,则有0.5 mol Cn(MCl4)被还原
二、非选择题(本大题包含5小题,共50分。)
(10分)如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,D电极上有无色气体放出。
(1)A为电源 极。
(2)丙装置欲在铁钉上镀铜,则G电极上的反应式为 。
(3)通电一段时间后,甲中出现浑浊,甲中发生反应的化学方程式为: 。
(4)工作一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这说明Fe(OH)3胶粒带________电,在电场作用下向Y极移动。
(5)若工作一段时间后停止通电,此时,乙中E、F两极上都产生2.24L气体(标准状况),E极气体为 (填化学式),欲使溶液恢复到起始状态,可向溶液中加入____________(填序号)。
A.CuO B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(8分)A~G是几种烃的分子球棍模型,请回答下列问题[(1)-(3)填对应字母]:
(1)属于同系物的脂肪烃是 ,等质量的烃完全燃烧消耗O2最多的是 。
(2)与氯气发生取代反应,只生成两种一氯取代产物的是 。
(3)分子中共平面原子数最多的是________。
(4)写出G和浓硝酸反应生成烈性炸药的化学方程式: 。
(5)C的同系物中有顺反异构且相对分子质量最小的有机物,它的顺式结构简式为 。
2657475752475(9分)氯苯在染料、医药工业中用于制造重要有机中间体,实验室模拟液相合成法(加热装置都已略去)见下图,在三颈烧瓶中加入催化剂FeCl3及50.0mL苯,有关物质的性质如表格所示:
名称
相对分子质量
沸点/(℃)
密度/(g/mL)
苯
78
78
0.88
氯苯
112.5
132.2
1.1
邻二氯苯
147
180.4
1.3
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中空导管a的作用是 。
(2)实验需要把干燥纯净的氯气通入装有干燥苯的反应器D中制备氯苯,装置B、C中的试剂分别是 和浓硫酸,D的反应温度宜控制在70℃—80℃,不宜过高,原因为①温度过高,反应易得到二氯苯;② ,球形冷凝管的出水口是 (填“b”或“c”),d出口的尾气主要成分有 。
(3)从D中得到粗产品(氯化液),其提纯过程如下图:
①碱洗后分离出粗氯苯的操作必须使用的玻璃仪器有 。
②实验中最终得到产品为14.7g,产率为 (精确到0.1%)。
(11分)全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图,两电极均为惰性电极,为保证电池稳定运行,“隔膜”选用质子交换膜,请回答下列问题:
钒电池是以溶解于一定浓度硫酸溶液中的不同种类的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2OV2++VO2++2H+,放电时,H+由B区通过隔膜移动到A区。
(1)放电时,A为电池的 区(“正极”或“负极”),B区电解液含有的钒离子为 。
(2)充电时,a为外界电源的 极,A区溶液pH (填“增大”、“减小”或“不变”),B区发生的电极反应式为 。
(3)常温下,NaCl的溶解度为35.9g,利用钒电池电解1L饱和食盐水,当溶液pH变为13时,假设气体全部逸出并且不考虑溶液的体积变化,食盐水质量减少 g(精确到0.01),此时钒电池正极与负极区电解液质量将相差______g(假设原正极与负极区电解液质量相同)。
(12分)端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—HR—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
false
回答下列问题:
(1)①的反应类型为 ,D的化学名称为 。
(2)E的结构简式为______________________,分子中最多共线的原子有 个, E与溴水中的Br2按物质的量之比为1:2发生反应,生成物的结构有 种(不考虑立体异构)。
31407104076701748790366395357505366395(3)芳香化合物F是C的同分异构体,其分子中苯环上只有一种氢,其可能的结构简式除
外,还有________________________________________。
重庆八中2020-2021学年度(上)半期考试高2022级
化 学 试 题 答 案
一、选择题(本大题包含25小题,每小题2分,每题只有一个选项符合要求。)
1-5 ACBBC 6-10 BACBD 11-15 DCAAB 16-20 BDCDA 21-25 BCDDC
二、非选择题(本大题包含5小题,共50分。)无特殊标注为一空2分
(9分)
(1)正(1分)
(2)Cu-2e-===Cu2+
(3)MgCl2+2H2OMg(OH)2↓+H2↑+Cl2↑
(4)正(1分)
(5)O2(1分);C
(8分)
(1)ABE(1分);DF(1分)
(2)E(1分)
(3)G(1分)
(4)+3HNO3+3H2O
(5)false
(10分)
(1)平衡气压(1分)
(2)饱和NaCl溶液(1分);温度过高,苯挥发造成原料利用率低(1分); c(1分); Cl2 苯、HCl(答到Cl2、HCl即可)
(3)分液漏斗、烧杯; 23.2%
(11分)
(1)正极(1分); VO2+、VO2+
(2)正(1分);增大(1分); VO2+ +2H++e-===VO2++H2O
(3)3.65; 0.2
(12分)
(1)取代反应;苯乙炔(各1分)
(2)false;10; 2
(3)false false false false(各1分)
化学试题
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Cl 35.5 V 51 Fe 56 Cu 64
一、选择题(本大题包含25小题,每小题2分,每题只有一个选项符合要求。)
下列化学用语错误的是
A.四氯化碳的电子式: B.丙炔的分子式:C3H4
C.乙烯的结构简式:CH2=CH2 D.丙烷分子的球棍模型:
下列有机物名称正确的是
A.2-乙基丁烷 B.2-甲基-3-丁烯
C.3-甲基戊烷 D.3-丁炔
4520565258445下列装置能构成原电池的是
A. B. C. D.
下列有机物中一定属于苯的同系物的是
A.C7H8 B.false C.false D.false
下列事实能说明苯不是单双键交替结构的是
A.苯中所有原子共平面
B.苯的一氯代物只有1种
C.苯不能使酸性高锰酸钾溶液褪色
D.苯的对位二氯代物只有1种
某烯烃的化学式为C4H8,其同分异构体的数目是(不考虑顺反异构)
A.2种 B.3种 C.4种 D.5种
有甲、乙、丙三种金属,将它们放在稀硫酸中,只有乙无明显现象。若用导线将甲、丙相连后放入稀硫酸,只有丙电极上产生大量气泡,这三种金属的活动性顺序是
A.甲>丙>乙 B.甲>乙>丙 C.丙>乙>甲 D.乙>甲>丙
下列对同系物的说法正确的是
A.同系物一定具有相同的最简式
B.分子式相同的有机物一定互为同系物
C.同系物彼此在组成上相差一个或若干个CH2
D.同系物的物理性质完全相同,例如苯的同系物都难溶于水
下列物质的沸点按由高到低的顺序排列正确的是
①CH3(CH2)3CH3 ②CH3(CH2)4CH3 ③(CH3)2CHCH2CH3 ④C(CH3)4
A.②④①③ B.②①③④ C.④①③② D.③②①④
NA代表阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L四氯化碳的分子数为NA
B.常温常压下,1 mol甲基所含电子数为7NA
C.常温常压下,0.5mol苯乙烯中含有的碳碳双键数目为2NA
D.标准状况下,11.2L乙烷和丙烯混合物中氢原子数目为3NA
有五种物质:①乙烯、②苯、③2-丁炔、④环己烷、⑤环己烯,能与溴水反应使之褪色的是
A.①②③ B.①②④⑤ C.②③④⑤ D.①③⑤
戊烷常用作有机溶剂,下列叙述中正确的是
A.C5H12在常温下一定是液体
B.正戊烷分子中五个碳原子排列成一条直线
C.异戊烷进行一氯取代后可生成4种沸点不同的有机产物
D.新戊烷可以由烯烃与氢气加成得到
下列说法错误的是
A.电池只能将化学能转化为电能
B.废旧电池必须回收处理,防止重金属污染
C.铅蓄电池工作一段时间后进行充电时铅蓄电池负极接电源的负极
D.碱性氢氧燃料电池的能量转化效率比氢气直接燃烧效率更高
完全燃烧0.1mol两种气态烃的混合物,将燃烧产物依次通过足量浓硫酸和足量氢氧化钠溶液,称得浓硫酸增重3.6克,氢氧化钠溶液增重6.6g,则混合物中
A.一定存在CH4 B.可能存在C2H2
C.一定含有C2H4 D.可能含有C2H6
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
A.甲苯燃烧生成CO2 B.甲苯与硝酸发生反应生成TNT
C.甲苯能使酸性KMnO4溶液褪色 D.光照下甲苯与Br2在侧链上发生取代反应
3904615229870右图所示为锌铜原电池,下列叙述中正确的是
A.盐桥中阴离子向CuSO4溶液中迁移
B.外电路电流由铜片流向锌片
C.锌片是电池负极,发生还原反应
D.CuSO4溶液质量一定减小
β?月桂烯广泛存在于植物中,具有清淡的香脂香气,可作为古龙香水和消臭剂的香料。它的结构如图所示,下列有关β?月桂烯说法正确的是
falseA.它的分子式为C10H14
B.它容易挥发且易溶于水
C.它所有的碳原子一定在同一平面上
D.1mol β?月桂烯与溴水反应,最多消耗3mol Br2
下列各组物质的鉴别中,所用鉴别试剂或方法错误的是
A.甲烷和乙烯:溴水 B.苯和四氯化碳:水
C.乙烯和SO2:酸性KMnO4溶液 D.苯和甲苯:酸性KMnO4溶液
下列各组物质中,括号内为杂质,以下对应操作能达到除杂目的是
A.乙醇(水):分液
B.乙烷(乙烯):通入酸性KMnO4溶液洗气
C.乙烷(乙烯):在一定条件下通氢气
D.己烷(溴):加氢氧化钠溶液完全反应后分液
下列各容器中盛有海水,相同温度下铁在其中被腐蚀的速率由慢到快的顺序是
A.d a b c B.a d b c C.c b a d D.d a c b
下列关于金属腐蚀和防腐蚀的说法正确的是
A.金属腐蚀普遍属于化学腐蚀
B.牺牲阳极的阴极保护法是利用原电池的原理防止腐蚀
C.外加电流的阴极保护法是将被保护的金属与电源正极相连
D.钢铁在潮湿空气中的腐蚀大多数为析氢腐蚀
下列关于实验室制取乙烯和乙炔的装置说法正确的是(夹持仪器未画出)
31083251044575②
②
14058901059180①
①
A.①装置完全正确
B.①装置中浓硫酸的作用是作催化剂和吸水剂
C.②装置制备乙炔的反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑
D.②装置中酸性KMnO4溶液褪色,说明乙炔具有还原性
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是
A.Pt电极为该电池正极
3378835-352425B.外电路中,电子从NiO电极流出
C.Pt电极的电极反应为O2+ 4e-===2O2-
D.当有2.24L NO参与反应时,转移了0.2mol电子
石蜡油分解及其产物性质实验装置如图,下列说法正确的是
A.石蜡油是液态烯烃混合物
B.该实验可以证明石蜡油分解产生了乙烯
C.装置b发生的反应的基本类型是取代反应
D.实验中可观察到装置c中溶液褪色
3590290398145某新型二次电池反应原理为M+3Cn(MCl4)+4MC14-false4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
A.放电时,b极为负极
B.放电时,MCl4-向b极迁移
C.充电时,a极反应为4M2Cl7-+3e-===7MCl4-+M
D.充电时,若电路中转移0.5mol电子,则有0.5 mol Cn(MCl4)被还原
二、非选择题(本大题包含5小题,共50分。)
(10分)如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,D电极上有无色气体放出。
(1)A为电源 极。
(2)丙装置欲在铁钉上镀铜,则G电极上的反应式为 。
(3)通电一段时间后,甲中出现浑浊,甲中发生反应的化学方程式为: 。
(4)工作一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这说明Fe(OH)3胶粒带________电,在电场作用下向Y极移动。
(5)若工作一段时间后停止通电,此时,乙中E、F两极上都产生2.24L气体(标准状况),E极气体为 (填化学式),欲使溶液恢复到起始状态,可向溶液中加入____________(填序号)。
A.CuO B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(8分)A~G是几种烃的分子球棍模型,请回答下列问题[(1)-(3)填对应字母]:
(1)属于同系物的脂肪烃是 ,等质量的烃完全燃烧消耗O2最多的是 。
(2)与氯气发生取代反应,只生成两种一氯取代产物的是 。
(3)分子中共平面原子数最多的是________。
(4)写出G和浓硝酸反应生成烈性炸药的化学方程式: 。
(5)C的同系物中有顺反异构且相对分子质量最小的有机物,它的顺式结构简式为 。
2657475752475(9分)氯苯在染料、医药工业中用于制造重要有机中间体,实验室模拟液相合成法(加热装置都已略去)见下图,在三颈烧瓶中加入催化剂FeCl3及50.0mL苯,有关物质的性质如表格所示:
名称
相对分子质量
沸点/(℃)
密度/(g/mL)
苯
78
78
0.88
氯苯
112.5
132.2
1.1
邻二氯苯
147
180.4
1.3
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中空导管a的作用是 。
(2)实验需要把干燥纯净的氯气通入装有干燥苯的反应器D中制备氯苯,装置B、C中的试剂分别是 和浓硫酸,D的反应温度宜控制在70℃—80℃,不宜过高,原因为①温度过高,反应易得到二氯苯;② ,球形冷凝管的出水口是 (填“b”或“c”),d出口的尾气主要成分有 。
(3)从D中得到粗产品(氯化液),其提纯过程如下图:
①碱洗后分离出粗氯苯的操作必须使用的玻璃仪器有 。
②实验中最终得到产品为14.7g,产率为 (精确到0.1%)。
(11分)全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图,两电极均为惰性电极,为保证电池稳定运行,“隔膜”选用质子交换膜,请回答下列问题:
钒电池是以溶解于一定浓度硫酸溶液中的不同种类的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3+ +H2OV2++VO2++2H+,放电时,H+由B区通过隔膜移动到A区。
(1)放电时,A为电池的 区(“正极”或“负极”),B区电解液含有的钒离子为 。
(2)充电时,a为外界电源的 极,A区溶液pH (填“增大”、“减小”或“不变”),B区发生的电极反应式为 。
(3)常温下,NaCl的溶解度为35.9g,利用钒电池电解1L饱和食盐水,当溶液pH变为13时,假设气体全部逸出并且不考虑溶液的体积变化,食盐水质量减少 g(精确到0.01),此时钒电池正极与负极区电解液质量将相差______g(假设原正极与负极区电解液质量相同)。
(12分)端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—HR—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
false
回答下列问题:
(1)①的反应类型为 ,D的化学名称为 。
(2)E的结构简式为______________________,分子中最多共线的原子有 个, E与溴水中的Br2按物质的量之比为1:2发生反应,生成物的结构有 种(不考虑立体异构)。
31407104076701748790366395357505366395(3)芳香化合物F是C的同分异构体,其分子中苯环上只有一种氢,其可能的结构简式除
外,还有________________________________________。
重庆八中2020-2021学年度(上)半期考试高2022级
化 学 试 题 答 案
一、选择题(本大题包含25小题,每小题2分,每题只有一个选项符合要求。)
1-5 ACBBC 6-10 BACBD 11-15 DCAAB 16-20 BDCDA 21-25 BCDDC
二、非选择题(本大题包含5小题,共50分。)无特殊标注为一空2分
(9分)
(1)正(1分)
(2)Cu-2e-===Cu2+
(3)MgCl2+2H2OMg(OH)2↓+H2↑+Cl2↑
(4)正(1分)
(5)O2(1分);C
(8分)
(1)ABE(1分);DF(1分)
(2)E(1分)
(3)G(1分)
(4)+3HNO3+3H2O
(5)false
(10分)
(1)平衡气压(1分)
(2)饱和NaCl溶液(1分);温度过高,苯挥发造成原料利用率低(1分); c(1分); Cl2 苯、HCl(答到Cl2、HCl即可)
(3)分液漏斗、烧杯; 23.2%
(11分)
(1)正极(1分); VO2+、VO2+
(2)正(1分);增大(1分); VO2+ +2H++e-===VO2++H2O
(3)3.65; 0.2
(12分)
(1)取代反应;苯乙炔(各1分)
(2)false;10; 2
(3)false false false false(各1分)
同课章节目录
