【期末复习】人教版化学九下 第十一、十二单元检测卷 习题课件(32张PPT)
文档属性
| 名称 | 【期末复习】人教版化学九下 第十一、十二单元检测卷 习题课件(32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 323.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-22 16:16:39 | ||
图片预览










文档简介
第 十一、十二 单元检测卷
检测 内 容:第 六、七 单元
选择题
填空与简答题
实验探究题
计算题
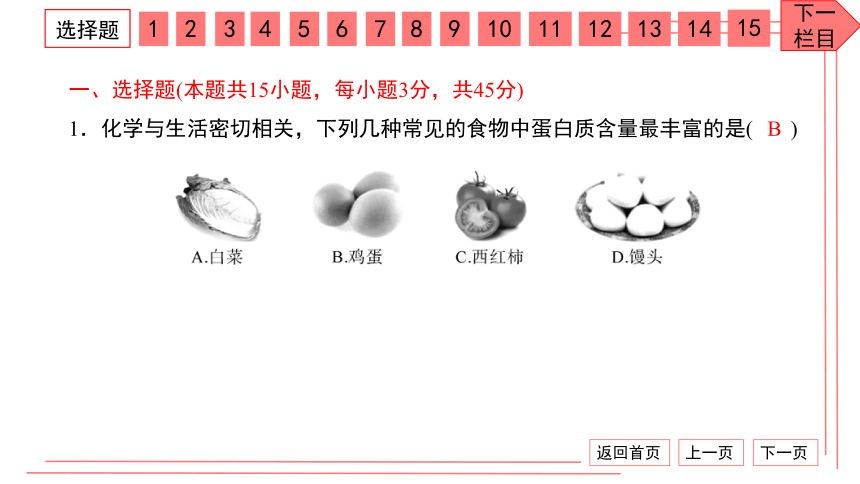
一、选择题(本题共15小题,每小题3分,共45分)
1.化学与生活密切相关,下列几种常见的食物中蛋白质含量最丰富的是( )
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
2.下列物品是用有机合成材料制成的是( )
A.橡胶手套 B.纯棉背心 C.羊毛大衣 D.不锈钢水杯
A
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
3.塑料袋自发现起,被人类在各个领域大量使用。下列有关说法错误的是
( )
A.塑料的优点是制造成本低、耐用、防水等
B.“白色污染”会破坏土壤,污染地下水源
C.用布袋代替塑料袋可减少白色污染
D.可降解塑料成本高,不提倡使用
D
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
4.人体健康离不开化学,下列说法正确的是( )
A.国家规定的食品添加剂可以随意添加,不必控制用量
B.香烟中含有尼古丁等有害物质,香烟有害健康
C.蛋白质是重要的营养物质,常吃蔬菜能补充蛋白质
D.人体缺少微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
5.下列关于“化学与生活”的认识不正确的是( )
A.成年人缺钙易造成骨质疏松
B.为提高牛奶的含氮量,可向牛奶中添加三聚氰胺
C.用聚氯乙烯塑料作食品包装袋有害健康
D.用燃烧法区别羊毛和涤纶
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
6.下列关于化肥、农药的说法中,不正确的是( )
A.硝酸钾是一种常用的复合肥料
B.通过分别加入熟石灰粉末混合、研磨的方法,不能鉴别氯化钾和硫酸铵
C.施用农药是最重要的作物保护手段
D.通过闻气味的方法,能鉴别氯化铵和碳酸氢铵
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
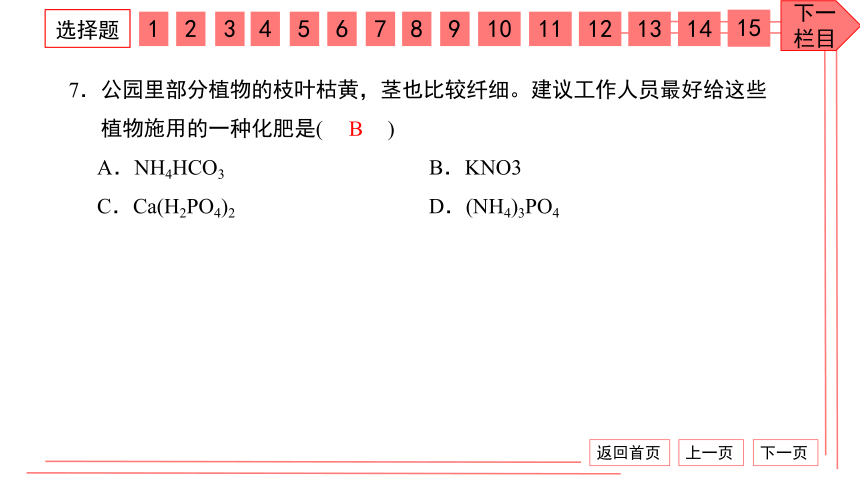
7.公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些
植物施用的一种化肥是( )
A.NH4HCO3 B.KNO3
C.Ca(H2PO4)2 D.(NH4)3PO4
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
8.下列实验步骤或检验方法正确的是( )
A.粗盐中难溶性杂质的去除,实验步骤是过滤、蒸发、计算产率
B.用氯化钠固体配制6%的氯化钠溶液,实验步骤是计算、量取、混匀
C.鉴别硝酸铵和氯化钠,可分别取固体加少量水溶解,触摸容器外壁
D.向某固体中加入稀盐酸,若有气泡产生,则该固体中一定含有碳酸盐
C
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
9.爱国科学家侯德榜先生发明了侯氏制碱法,为我国民族工业的发展做出
了杰出的贡献,该方法是将CO2和NH3通入饱和的NaCl溶液中充分反应,
其中的一步反应是NH4HCO3+NaCl===NaHCO3↓+NH4Cl,下列叙述错
误的是( )
A.该反应不符合复分解反应发生的条件
B.该反应中四种物质都是盐
C.反应后可用过滤的方法分离出NaHCO3
D.反应后的溶液中还能继续溶解NaCl
A
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
10.能将盐酸、食盐水、澄清石灰水三种溶液一次性区分开来的试剂是( )
A.Na2CO3溶液 B.CaCl2溶液
C.NaOH溶液 D.酚酞溶液
A
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
11.下列各组物质的溶液,不用其他试剂,只用观察和组内物质相互混合的
方法,不能将它们一一鉴别的是( )
A.HCl、NaOH、FeCl3、NaCl
B.Ba(OH)2、(NH4)2SO4、NH4Cl、NaCl
C.NaNO3、CaCl2、HCl、KOH
D.MgCl2、KOH、Cu(NO3)2、Na2SO4
C
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
12.下列各组离子在pH=11的水溶液中能大量共存的是( )
A.NH、NO、K+、SO B.Mg2+、Cl-、Na+、NO
C.Ba2+、CO、H+、Cl- D.K+、CO、NO、Na+
D
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
13.甲、乙、丙有如图所示的转化关系(“—”表示相连的物质之间可以发
生反应,“→”表示反应一步实现,部分物质和反应条件已略去),下列
各组物质按甲、乙、丙的顺序不符合要求的是( )
A.C、CO、O2
B.Mg、MgCl2、ZnSO4
C.Ca(OH)2、CaCl2、Na2CO3
D.BaCl2、BaCO3、H2SO4
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
14.对下列实验过程的评价,正确的是( )
A.向某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有CO
B.向某溶液中滴加BaCl2溶液,生成了不溶于稀硝酸的白色沉淀,则该溶
液中一定含有SO
C.某无色溶液滴入酚酞溶液后显红色,则该溶液不一定是碱的溶液
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶
液和稀硝酸,有白色沉淀生成,证明含有Cl-
C
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
15.除去下列各组物质中的杂质,所用试剂和方法均正确的是( )
{5940675A-B579-460E-94D1-54222C63F5DA}选项
物质
杂质
除杂质所用试剂和方法
A
H2
HCl气体
先通过足量Na2CO3溶液,再通过浓硫酸
B
KNO3溶液
AgNO3溶液
先加入过量KCl溶液,再过滤
C
KCl固体
KClO3固体
加入少量MnO2加热
D
FeSO4溶液
CuSO4溶液
先加过量Fe粉,再过滤
D
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
二、填空与简答题(本题包括4小题,共28分)
16.(6分)化学与人类生活、生产息息相关。请回答下列问题。
(1)天然气的主要成分是 。(1分)
(2)人体缺少 元素会导致甲状腺疾病。(1分)
(3)能用于改良酸性土壤的是 。(1分)
(4)用 试纸可粗略测定酸果汁的酸碱度。(1分)
(5) (填“聚乙烯”或“聚氯乙烯”)薄膜可用于食品的包装。(1分)
(6)生活中重要的调味品是 。(1分)
甲烷
碘
熟石灰
pH
聚乙烯
氯化钠
上一栏目
填空与简答题
16
17
18
19
下一栏目
17.(7分)多角度看物质,有助于加深对物质的认识。CuSO4是一种常见的盐,
请回答下列问题。
(1)CuSO4溶液显酸性,其pH (填“<”“>”或“=”)7。(1分)
(2)CuSO4可以看成是中和反应的产物,其对应的酸为 、碱为
。(均填化学式)(2分)
(3)CuSO4作为反应物,写出一个符号A+B→C+D的化学方程式:
。(2分)
(4)CuSO4作为催化剂,能加快过氧化氢的分解,其化学方程式:
。(2分)
<
H2SO4
Cu(OH)2
Fe+CuSO4===FeSO4+Cu
2H2O2 === 2H2O+O2↑
CuSO4
上一栏目
填空与简答题
16
17
18
19
下一栏目
18.(8分)化学能帮助我们更好地认识物质世界、改善生活。
(1)创新发展材料技术可推动人类社会进步。
①石墨烯可用作太阳能电池的电极,这里主要利用了石墨烯的 性;(1分)
②2019年1月3日,嫦娥四号成功着陆在月球背面,所用的SiC颗粒增强铝基
材料具有重量轻、高刚度、高耐磨、耐冲击等特点,该材料属于 (填
字母);(1分)
A.金属材料 B.复合材料 C.有机高分子材料
③基础工程建设中常用到水泥、玻璃、钢材等。钢材中添加铬、镍等元素的
目的是能 。(1分)
导电
B
改变钢的内部结构,提高钢的抗腐蚀性
上一栏目
填空与简答题
16
17
18
19
下一栏目
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含
量表:
{5940675A-B579-460E-94D1-54222C63F5DA}营养成分
含量
营养成分
含量
营养成分
含量
水分
9.9 g
淀粉
82.5 g
蛋白质
4.8 g
脂肪
0.2 g
铁元素
1.10 mg
钙元素
23.00 mg
硒元素
0.02 mg
其他
……
上一栏目
填空与简答题
16
17
18
19
下一栏目
①紫薯中能为人体提供能量的营养物质为脂肪、淀粉和 ;(1分)
②以上营养成分中 (填元素符号)是人体中含有的微量元素, (填
元素符号)摄入不足,会导致骨质疏松、佝偻病;(2分)
③在酶的作用下,淀粉先水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。
写出葡萄糖转化为乙醇的化学方程式: 。(1分)
(3)将废弃的热塑性塑料放在可回收垃圾箱中。热塑性塑料的判断方法:用酒
精灯缓缓加热装有少量塑料碎片的试管,能观察到的现象是 。
。(1分)
蛋白质
Se、Fe
Ca
塑料碎片熔化成液态
C6H12O6===2C2H5OH+2CO2↑
酶
上一栏目
填空与简答题
16
17
18
19
下一栏目
19.(7分)Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、
BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如图。
上一栏目
填空与简答题
16
17
18
19
下一栏目
(1)Ba(NO3)2中钡元素的化合价 为;流程中所涉及的氧化物是 。
(填1种即可)。(2分)
(2)BaCO3与稀HNO3反应的反应类型是 ;写出Fe2O3与稀HNO3反
应的化学方程式: 。(2分)
(3)试剂Y为 (填序号)。(1分)
①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是 。(2分)
+2价
氧化铁(或三氧化二铁、Fe2O3)
复分解反应
Fe2O3+6HNO3===2Fe(NO3)3+3H2O
②
蒸发结晶
上一栏目
填空与简答题
16
17
18
19
下一栏目
三、实验探究题(本题包括2小题,共19分)
20.(9分)化学兴趣小组的同学发现实验台上一瓶标签破损的无色溶液(标签
如图)。他们提出可能是碳酸钠、碳酸氢钠、硫酸钠、氯化钠、硝酸钠
溶液中的一种,于是决定对这瓶溶液进行实验探究。
上一栏目
实验探究题
下一栏目
20
21
【理论分析】
为了确定该溶液,他首先进行了分析,小组同学根据标签残留部分认为一定不是 ,他们的依据是 。
。(3分)
【查阅资料】
Na2CO3+HCl===NaCl+NaHCO3
Na2CO3+2HCl===2NaCl+H2O+CO2↑
NaHCO3+HCl===NaCl+H2O+CO2↑
碳酸氢钠、氯化钠、硝酸钠
该标签中钠元素右下角的
数字是2,而碳酸氢钠、氯化钠和硝酸钠化学式中钠元素右下角的数字是1
上一栏目
实验探究题
下一栏目
20
21
【活动探究】
(1)为确定其成分,小新同学设计如下方案进行探究(探究1)(2分)
{5940675A-B579-460E-94D1-54222C63F5DA}实验步骤
现象
结论
取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡
①
该溶液是Na2SO4溶液
过滤,向滤渣滴加稀盐酸
②
产生白色沉淀
沉淀不消失
上一栏目
实验探究题
下一栏目
20
21
(2)小芳认为可以设计更简单的实验方案(探究2)
{5940675A-B579-460E-94D1-54222C63F5DA}实验步骤
现象
结论
取该无色溶液少许于试管中,慢慢滴加少量的盐酸
没有气泡产生
溶液中没有碳酸钠,则该溶液是Na2SO4溶液
上一栏目
实验探究题
下一栏目
20
21
【解释】
你认为上面两位同学对实验结果的判定是否正确?请说明理由:
。
。(2分)
【实验反思】
在区别判断物质成分时,除考虑物质本身的性质外,还需考虑 。(2分)
小新同学的正确,小芳同学的错误,因为加入少量的盐酸时可能是碳酸钠
反应物的量
与盐酸反应生成氯化钠和碳酸氢钠
上一栏目
实验探究题
下一栏目
20
21
21.(10分)党的十九大提出“农业、农村、农民问题是关系国计民生的根本
性问题”。要“决胜全面建成小康社会”,就必须大力发展农业。
(1)科学保护和使用土地
当前,土壤酸化是引起土地生产潜力减退的重要原因,施用熟石灰可以改良酸性土壤。
①在种植农作物之前,首先要检测土壤的酸碱度,请写出用pH试纸检
测土壤酸碱度的操作方法: 。
。
。(2分)
向土壤中加入蒸馏水,振荡、静置,用
干净的玻璃棒蘸取上层清液滴在pH试纸上,与标准比色卡对照,
读出pH
上一栏目
实验探究题
下一栏目
20
21
②熟石灰可以改良酸性土壤的原因是 。
。(1分)
(2)正确认识和合理使用化肥
某化肥可能含有KNO3、NH4Cl、(NH4)2CO3、(NH4)2SO4中的一种或几种,为探究其成分,某同学进行如下实验。(已知:AgCl、BaSO4均是既不溶于水,也不溶于酸的白色沉淀)
熟石灰显碱性,可与土壤中的酸性
物质发生中和反应
上一栏目
实验探究题
下一栏目
20
21
【实验探究】(3分)
{5940675A-B579-460E-94D1-54222C63F5DA}实验操作步骤
实验现象
实验结论
①取少量该化肥样品和少量熟石灰放在研钵中混合研磨
含有铵根离子
②另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液;再滴加足量稀硝酸
产生白色沉淀;有气泡产生,沉淀完全溶解
有 存在
③取②所得滤液少量于试管中,滴加 .
产生白色沉淀
有NH4Cl存在
有刺激性气味产生
AgNO3溶液
(NH4)2CO3
上一栏目
实验探究题
下一栏目
20
21
【实验评价】
在步骤②中不能用氯化钡溶液代替硝酸钡溶液的原因是
。(1分)
【实验反思】
铵态氮肥不能和熟石灰混合使用,请用化学方程式表示其原因:
(只写1个)。(1分)
加入BaCl2溶液会有NH4Cl生成,干扰NH4Cl的检验
2NH4Cl+ Ca(OH)2===CaCl2+2NH3↑+2H2O
上一栏目
实验探究题
下一栏目
20
21
(3)加快实现农业现代化
农业机械化是农业现代化的基础。联合收割机等许多农用设备的工作部件主要由钢铁组成。试计算如果冶炼2 000 t含杂质2%的生铁,需要含氧化铁80%的赤铁矿石的质量是 t。(2分)
3 500
上一栏目
实验探究题
下一栏目
20
21
四、计算题(本题包括1小题,共8分)
22.(8分)取含杂质的硫酸镁样品7 g(杂质不溶于水,也不参加反应),向其中
加入一定量的氢氧化钠溶液(密度为1.06 g/cm3),恰好完全反应,得到71 g
溶质质量分数为10%的溶液。计算:
(1)样品中硫酸镁的质量;(4分)
(2)所加入的氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。(4分)
上一栏目
计算题
解:生成的硫酸钠的质量为71 g×10%=7.1 g,设硫酸镁的质量为x,氢氧化钠的质量为y,氢氧化镁的质量为z。
2NaOH+MgSO4===Na2SO4+Mg(OH)2↓
80 120 142 58
y x 7.1 g z
x=6 g,y=4 g,z=2.9 g
氢氧化钠溶液的质量为71 g+2.9 g-6 g=67.9 g
氢氧化钠溶液中溶质的质量分数为 ×100%≈5.9%
答:(1)样品中硫酸镁的质量为6 g。(2)所加入的氢氧化钠溶液中溶质的质量分数5.9%。
上一栏目
计算题
检测 内 容:第 六、七 单元
选择题
填空与简答题
实验探究题
计算题
一、选择题(本题共15小题,每小题3分,共45分)
1.化学与生活密切相关,下列几种常见的食物中蛋白质含量最丰富的是( )
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
2.下列物品是用有机合成材料制成的是( )
A.橡胶手套 B.纯棉背心 C.羊毛大衣 D.不锈钢水杯
A
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
3.塑料袋自发现起,被人类在各个领域大量使用。下列有关说法错误的是
( )
A.塑料的优点是制造成本低、耐用、防水等
B.“白色污染”会破坏土壤,污染地下水源
C.用布袋代替塑料袋可减少白色污染
D.可降解塑料成本高,不提倡使用
D
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
4.人体健康离不开化学,下列说法正确的是( )
A.国家规定的食品添加剂可以随意添加,不必控制用量
B.香烟中含有尼古丁等有害物质,香烟有害健康
C.蛋白质是重要的营养物质,常吃蔬菜能补充蛋白质
D.人体缺少微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
5.下列关于“化学与生活”的认识不正确的是( )
A.成年人缺钙易造成骨质疏松
B.为提高牛奶的含氮量,可向牛奶中添加三聚氰胺
C.用聚氯乙烯塑料作食品包装袋有害健康
D.用燃烧法区别羊毛和涤纶
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
6.下列关于化肥、农药的说法中,不正确的是( )
A.硝酸钾是一种常用的复合肥料
B.通过分别加入熟石灰粉末混合、研磨的方法,不能鉴别氯化钾和硫酸铵
C.施用农药是最重要的作物保护手段
D.通过闻气味的方法,能鉴别氯化铵和碳酸氢铵
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
7.公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些
植物施用的一种化肥是( )
A.NH4HCO3 B.KNO3
C.Ca(H2PO4)2 D.(NH4)3PO4
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
8.下列实验步骤或检验方法正确的是( )
A.粗盐中难溶性杂质的去除,实验步骤是过滤、蒸发、计算产率
B.用氯化钠固体配制6%的氯化钠溶液,实验步骤是计算、量取、混匀
C.鉴别硝酸铵和氯化钠,可分别取固体加少量水溶解,触摸容器外壁
D.向某固体中加入稀盐酸,若有气泡产生,则该固体中一定含有碳酸盐
C
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
9.爱国科学家侯德榜先生发明了侯氏制碱法,为我国民族工业的发展做出
了杰出的贡献,该方法是将CO2和NH3通入饱和的NaCl溶液中充分反应,
其中的一步反应是NH4HCO3+NaCl===NaHCO3↓+NH4Cl,下列叙述错
误的是( )
A.该反应不符合复分解反应发生的条件
B.该反应中四种物质都是盐
C.反应后可用过滤的方法分离出NaHCO3
D.反应后的溶液中还能继续溶解NaCl
A
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
10.能将盐酸、食盐水、澄清石灰水三种溶液一次性区分开来的试剂是( )
A.Na2CO3溶液 B.CaCl2溶液
C.NaOH溶液 D.酚酞溶液
A
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
11.下列各组物质的溶液,不用其他试剂,只用观察和组内物质相互混合的
方法,不能将它们一一鉴别的是( )
A.HCl、NaOH、FeCl3、NaCl
B.Ba(OH)2、(NH4)2SO4、NH4Cl、NaCl
C.NaNO3、CaCl2、HCl、KOH
D.MgCl2、KOH、Cu(NO3)2、Na2SO4
C
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
12.下列各组离子在pH=11的水溶液中能大量共存的是( )
A.NH、NO、K+、SO B.Mg2+、Cl-、Na+、NO
C.Ba2+、CO、H+、Cl- D.K+、CO、NO、Na+
D
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
13.甲、乙、丙有如图所示的转化关系(“—”表示相连的物质之间可以发
生反应,“→”表示反应一步实现,部分物质和反应条件已略去),下列
各组物质按甲、乙、丙的顺序不符合要求的是( )
A.C、CO、O2
B.Mg、MgCl2、ZnSO4
C.Ca(OH)2、CaCl2、Na2CO3
D.BaCl2、BaCO3、H2SO4
B
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
14.对下列实验过程的评价,正确的是( )
A.向某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有CO
B.向某溶液中滴加BaCl2溶液,生成了不溶于稀硝酸的白色沉淀,则该溶
液中一定含有SO
C.某无色溶液滴入酚酞溶液后显红色,则该溶液不一定是碱的溶液
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶
液和稀硝酸,有白色沉淀生成,证明含有Cl-
C
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
15.除去下列各组物质中的杂质,所用试剂和方法均正确的是( )
{5940675A-B579-460E-94D1-54222C63F5DA}选项
物质
杂质
除杂质所用试剂和方法
A
H2
HCl气体
先通过足量Na2CO3溶液,再通过浓硫酸
B
KNO3溶液
AgNO3溶液
先加入过量KCl溶液,再过滤
C
KCl固体
KClO3固体
加入少量MnO2加热
D
FeSO4溶液
CuSO4溶液
先加过量Fe粉,再过滤
D
选择题
1
2
3
4
5
6
7
8
9
10
下一
栏目
11
12
13
14
15
二、填空与简答题(本题包括4小题,共28分)
16.(6分)化学与人类生活、生产息息相关。请回答下列问题。
(1)天然气的主要成分是 。(1分)
(2)人体缺少 元素会导致甲状腺疾病。(1分)
(3)能用于改良酸性土壤的是 。(1分)
(4)用 试纸可粗略测定酸果汁的酸碱度。(1分)
(5) (填“聚乙烯”或“聚氯乙烯”)薄膜可用于食品的包装。(1分)
(6)生活中重要的调味品是 。(1分)
甲烷
碘
熟石灰
pH
聚乙烯
氯化钠
上一栏目
填空与简答题
16
17
18
19
下一栏目
17.(7分)多角度看物质,有助于加深对物质的认识。CuSO4是一种常见的盐,
请回答下列问题。
(1)CuSO4溶液显酸性,其pH (填“<”“>”或“=”)7。(1分)
(2)CuSO4可以看成是中和反应的产物,其对应的酸为 、碱为
。(均填化学式)(2分)
(3)CuSO4作为反应物,写出一个符号A+B→C+D的化学方程式:
。(2分)
(4)CuSO4作为催化剂,能加快过氧化氢的分解,其化学方程式:
。(2分)
<
H2SO4
Cu(OH)2
Fe+CuSO4===FeSO4+Cu
2H2O2 === 2H2O+O2↑
CuSO4
上一栏目
填空与简答题
16
17
18
19
下一栏目
18.(8分)化学能帮助我们更好地认识物质世界、改善生活。
(1)创新发展材料技术可推动人类社会进步。
①石墨烯可用作太阳能电池的电极,这里主要利用了石墨烯的 性;(1分)
②2019年1月3日,嫦娥四号成功着陆在月球背面,所用的SiC颗粒增强铝基
材料具有重量轻、高刚度、高耐磨、耐冲击等特点,该材料属于 (填
字母);(1分)
A.金属材料 B.复合材料 C.有机高分子材料
③基础工程建设中常用到水泥、玻璃、钢材等。钢材中添加铬、镍等元素的
目的是能 。(1分)
导电
B
改变钢的内部结构,提高钢的抗腐蚀性
上一栏目
填空与简答题
16
17
18
19
下一栏目
(2)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含
量表:
{5940675A-B579-460E-94D1-54222C63F5DA}营养成分
含量
营养成分
含量
营养成分
含量
水分
9.9 g
淀粉
82.5 g
蛋白质
4.8 g
脂肪
0.2 g
铁元素
1.10 mg
钙元素
23.00 mg
硒元素
0.02 mg
其他
……
上一栏目
填空与简答题
16
17
18
19
下一栏目
①紫薯中能为人体提供能量的营养物质为脂肪、淀粉和 ;(1分)
②以上营养成分中 (填元素符号)是人体中含有的微量元素, (填
元素符号)摄入不足,会导致骨质疏松、佝偻病;(2分)
③在酶的作用下,淀粉先水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。
写出葡萄糖转化为乙醇的化学方程式: 。(1分)
(3)将废弃的热塑性塑料放在可回收垃圾箱中。热塑性塑料的判断方法:用酒
精灯缓缓加热装有少量塑料碎片的试管,能观察到的现象是 。
。(1分)
蛋白质
Se、Fe
Ca
塑料碎片熔化成液态
C6H12O6===2C2H5OH+2CO2↑
酶
上一栏目
填空与简答题
16
17
18
19
下一栏目
19.(7分)Ba(NO3)2可用于生产信号弹、炸药等。利用钡泥(主要含有BaCO3、
BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如图。
上一栏目
填空与简答题
16
17
18
19
下一栏目
(1)Ba(NO3)2中钡元素的化合价 为;流程中所涉及的氧化物是 。
(填1种即可)。(2分)
(2)BaCO3与稀HNO3反应的反应类型是 ;写出Fe2O3与稀HNO3反
应的化学方程式: 。(2分)
(3)试剂Y为 (填序号)。(1分)
①BaCl2溶液 ②Ba(OH)2溶液 ③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是 。(2分)
+2价
氧化铁(或三氧化二铁、Fe2O3)
复分解反应
Fe2O3+6HNO3===2Fe(NO3)3+3H2O
②
蒸发结晶
上一栏目
填空与简答题
16
17
18
19
下一栏目
三、实验探究题(本题包括2小题,共19分)
20.(9分)化学兴趣小组的同学发现实验台上一瓶标签破损的无色溶液(标签
如图)。他们提出可能是碳酸钠、碳酸氢钠、硫酸钠、氯化钠、硝酸钠
溶液中的一种,于是决定对这瓶溶液进行实验探究。
上一栏目
实验探究题
下一栏目
20
21
【理论分析】
为了确定该溶液,他首先进行了分析,小组同学根据标签残留部分认为一定不是 ,他们的依据是 。
。(3分)
【查阅资料】
Na2CO3+HCl===NaCl+NaHCO3
Na2CO3+2HCl===2NaCl+H2O+CO2↑
NaHCO3+HCl===NaCl+H2O+CO2↑
碳酸氢钠、氯化钠、硝酸钠
该标签中钠元素右下角的
数字是2,而碳酸氢钠、氯化钠和硝酸钠化学式中钠元素右下角的数字是1
上一栏目
实验探究题
下一栏目
20
21
【活动探究】
(1)为确定其成分,小新同学设计如下方案进行探究(探究1)(2分)
{5940675A-B579-460E-94D1-54222C63F5DA}实验步骤
现象
结论
取该溶液少许于试管中,滴加过量的BaCl2溶液,振荡
①
该溶液是Na2SO4溶液
过滤,向滤渣滴加稀盐酸
②
产生白色沉淀
沉淀不消失
上一栏目
实验探究题
下一栏目
20
21
(2)小芳认为可以设计更简单的实验方案(探究2)
{5940675A-B579-460E-94D1-54222C63F5DA}实验步骤
现象
结论
取该无色溶液少许于试管中,慢慢滴加少量的盐酸
没有气泡产生
溶液中没有碳酸钠,则该溶液是Na2SO4溶液
上一栏目
实验探究题
下一栏目
20
21
【解释】
你认为上面两位同学对实验结果的判定是否正确?请说明理由:
。
。(2分)
【实验反思】
在区别判断物质成分时,除考虑物质本身的性质外,还需考虑 。(2分)
小新同学的正确,小芳同学的错误,因为加入少量的盐酸时可能是碳酸钠
反应物的量
与盐酸反应生成氯化钠和碳酸氢钠
上一栏目
实验探究题
下一栏目
20
21
21.(10分)党的十九大提出“农业、农村、农民问题是关系国计民生的根本
性问题”。要“决胜全面建成小康社会”,就必须大力发展农业。
(1)科学保护和使用土地
当前,土壤酸化是引起土地生产潜力减退的重要原因,施用熟石灰可以改良酸性土壤。
①在种植农作物之前,首先要检测土壤的酸碱度,请写出用pH试纸检
测土壤酸碱度的操作方法: 。
。
。(2分)
向土壤中加入蒸馏水,振荡、静置,用
干净的玻璃棒蘸取上层清液滴在pH试纸上,与标准比色卡对照,
读出pH
上一栏目
实验探究题
下一栏目
20
21
②熟石灰可以改良酸性土壤的原因是 。
。(1分)
(2)正确认识和合理使用化肥
某化肥可能含有KNO3、NH4Cl、(NH4)2CO3、(NH4)2SO4中的一种或几种,为探究其成分,某同学进行如下实验。(已知:AgCl、BaSO4均是既不溶于水,也不溶于酸的白色沉淀)
熟石灰显碱性,可与土壤中的酸性
物质发生中和反应
上一栏目
实验探究题
下一栏目
20
21
【实验探究】(3分)
{5940675A-B579-460E-94D1-54222C63F5DA}实验操作步骤
实验现象
实验结论
①取少量该化肥样品和少量熟石灰放在研钵中混合研磨
含有铵根离子
②另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液;再滴加足量稀硝酸
产生白色沉淀;有气泡产生,沉淀完全溶解
有 存在
③取②所得滤液少量于试管中,滴加 .
产生白色沉淀
有NH4Cl存在
有刺激性气味产生
AgNO3溶液
(NH4)2CO3
上一栏目
实验探究题
下一栏目
20
21
【实验评价】
在步骤②中不能用氯化钡溶液代替硝酸钡溶液的原因是
。(1分)
【实验反思】
铵态氮肥不能和熟石灰混合使用,请用化学方程式表示其原因:
(只写1个)。(1分)
加入BaCl2溶液会有NH4Cl生成,干扰NH4Cl的检验
2NH4Cl+ Ca(OH)2===CaCl2+2NH3↑+2H2O
上一栏目
实验探究题
下一栏目
20
21
(3)加快实现农业现代化
农业机械化是农业现代化的基础。联合收割机等许多农用设备的工作部件主要由钢铁组成。试计算如果冶炼2 000 t含杂质2%的生铁,需要含氧化铁80%的赤铁矿石的质量是 t。(2分)
3 500
上一栏目
实验探究题
下一栏目
20
21
四、计算题(本题包括1小题,共8分)
22.(8分)取含杂质的硫酸镁样品7 g(杂质不溶于水,也不参加反应),向其中
加入一定量的氢氧化钠溶液(密度为1.06 g/cm3),恰好完全反应,得到71 g
溶质质量分数为10%的溶液。计算:
(1)样品中硫酸镁的质量;(4分)
(2)所加入的氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)。(4分)
上一栏目
计算题
解:生成的硫酸钠的质量为71 g×10%=7.1 g,设硫酸镁的质量为x,氢氧化钠的质量为y,氢氧化镁的质量为z。
2NaOH+MgSO4===Na2SO4+Mg(OH)2↓
80 120 142 58
y x 7.1 g z
x=6 g,y=4 g,z=2.9 g
氢氧化钠溶液的质量为71 g+2.9 g-6 g=67.9 g
氢氧化钠溶液中溶质的质量分数为 ×100%≈5.9%
答:(1)样品中硫酸镁的质量为6 g。(2)所加入的氢氧化钠溶液中溶质的质量分数5.9%。
上一栏目
计算题
同课章节目录
