【期末复习】人教版化学九上 第五单元化学方程式 复习卷 习题课件 (28张PPT)
文档属性
| 名称 | 【期末复习】人教版化学九上 第五单元化学方程式 复习卷 习题课件 (28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 423.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-22 16:36:12 | ||
图片预览







文档简介
第 五 单元复习卷
复习 内 容:第 五 单元
知识梳理
考点集训
中考链接
知识点1 质量守恒定律
1.化学反应遵守质量守恒定律的根本原因:反应前后各原子的 、
和 不改变。在化学反应前后,“六不变”指的是原子的
数目、原子的种类、原子的质量、元素的 、元素的质量、物质
的总质量不变;肯定会改变的是的 种类、 的种类;可能
改变也可能不变的是分子的个数。所有的 反应都遵守质量守恒
定律。验证质量守恒定律的实验需要在 中进行。
种类
数目
质量
种类
分子
物质
化学
密闭容器
知识点
1
2
3
下一栏目
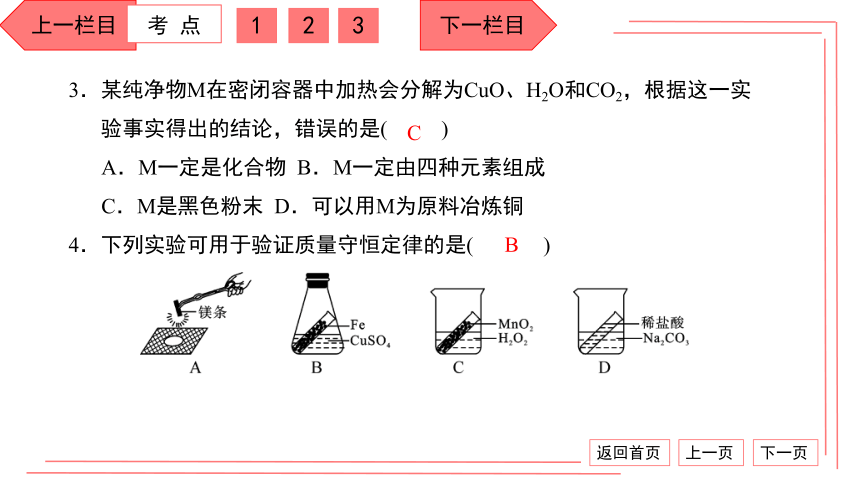
2.验证质量守恒定律实验如图所示:实验1的现象是 ,发光放热,
生成白烟,气球 。实验2的现象是铁钉表面附有红色固体、
溶液由 慢慢变为 ,反应前后物质的总质量 。如果实验
改为镁条燃烧,生成物总质量比镁条质量重,原因是 ;
若生成物总质量比镁条质量轻,可能的原因是 ;
若改用碳酸钠和稀盐酸进行实验,天平指针偏 ,原因是 。
。
红磷燃烧
先胀大后缩小
蓝色
浅绿色
不变
增加了氧元素的质量
白烟扩散到空气中或附在坩埚钳上
右
产生的二氧化碳扩散到空气中
知识点
1
2
3
下一栏目
知识点2 化学方程式书写
3.书写化学方程式的原则:一是以 为依据,不能凭空臆造事实
上不存在的物质和化学反应;二是要 ,要使反应
前后各原子的 和 保持不变。
4.化学方程式的书写步骤:①根据事实写出 和 的化
学式,用一条短线或箭头连接反应物和生成物,多种反应物或生成物之
间用“+”连接;② 化学方程式,使其遵守质量守恒定律;③注
明化学反应发生的 (点燃、加热、催化剂等),并标出生成物的
(气体、沉淀等),把短线或箭头改成等号。
客观事实
遵守质量守恒定律
种类
数目
反应物
生成物
配平
条件
状态
知识点
1
2
3
下一栏目
知识点3 化学方程式简单计算
5.利用化学方程式计算的一般步骤:①根据题意设未知量(用x,y等字母表
示);②写出反应的 ;③写出相关物质的 与
相对分子质量的乘积以及已知量、未知量;④列出 ,求未知数;
⑤简明写出答案。
化学方程式
化学计量数
比例式
知识点
1
2
3
下一栏目
考点1 质量守恒定律
1.下列变化,遵循质量守恒定律的是( )
A.镁条在空气中燃烧质量变轻 B.冰雪融化
C.水变成汽油 D.铁锭压制成铁板
2.在化学反应前后,下列各项中一定没有变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量
⑤物质的种类 ⑥原子种类
A.①③④⑤ B.①③④⑥ C.①③⑤ D.①④⑥
A
B
上一栏目
考 点
1
2
3
下一栏目
3.某纯净物M在密闭容器中加热会分解为CuO、H2O和CO2,根据这一实
验事实得出的结论,错误的是( )
A.M一定是化合物 B.M一定由四种元素组成
C.M是黑色粉末 D.可以用M为原料冶炼铜
4.下列实验可用于验证质量守恒定律的是( )
C
B
上一栏目
考 点
1
2
3
下一栏目
5.下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.50 mL水和50 mL乙醇混合后总体积小于100 mL
C.在100 g过氧化氢溶液中,含有30 g过氧化氢和70 g水
D.1.2 g碳和3.2 g氧气恰好完全反应可生成4.4 g二氧化碳
D
上一栏目
考 点
1
2
3
下一栏目
6.将4.6 g某物质在足量的氧气中燃烧,生成8.8 g二氧化碳和5.4 g水,则下
列说法中正确的是( )
A.该物质中只含碳、氢两种元素
B.该物质中含有碳、氢、氧三种元素
C.该物质中一定含碳、氢元素,可能含氧元素
D.该物质的化学式为CH4
B
上一栏目
考 点
1
2
3
下一栏目
7.中国科学家成功将二氧化碳转化为乙烯(C2H4),反应前后分子种类变化
的微观示意图如下。下列说法不正确的是( )
A.甲的相对分子质量为44
B.两种生成物均为氧化物
C.丙中碳、氢原子个数比为1∶2
D.参加反应的甲与乙的分子个数比为1∶3
B
上一栏目
考 点
1
2
3
下一栏目
8.如图是探究质量守恒定律的实验装置图,回答下列问题。
(1)该实验 (填“能”或“不能”)探究质量守恒定律,原因
是 。
(2)要用如图继续探究质量守恒定律,若药品不变,改变装置的方法是
;若装置不变,改变药品,可选用的
一组药品是 (举一例)。
不能
生成的二氧化碳逸散到空气中
反应在密闭容器中进行
铁与硫酸铜溶液
上一栏目
考 点
1
2
3
下一栏目
考点2 化学方程式书写
9.同学们对化学反应方程式:C+O2CO2有下面的四种说法,其中错误的是
( )
C
上一栏目
考 点
1
2
3
下一栏目
10.化学方程式是重要的化学用语。下列化学方程式书写正确的是( )
A.2KMnO4===K2MnO4+MnO2+O2↑
B.P+O2===P2O5
C.4Fe+3O2===2Fe2O3
D.C+O2===CO2↑
A
△
点燃
点燃
上一栏目
考 点
1
2
3
下一栏目
11.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知获
得高铁酸钠的反应为Fe2O3+mNa2O2===nNa2FeO4+Na2O,其中m、n分
别为( )
A.2 3 B.3 2 C.1 3 D.1 3
12.能正确表示化学方程式aC2H6O+bO2mCO2+nH2O中,各化学计量数之
间的关系的是( )
A.2b=n B.a+2b=m+2n
C.a+b=m+n D.3a=n
B
D
上一栏目
考 点
1
2
3
下一栏目
13.下图形象地表示某化学反应前后反应物与生成物分子及其数目的变化,
其中“ ”“ ”“ ”分别表示A、B、C三种不同的分子。
则该反应的化学方程式中A、B、C前的化学计量数之比为( )
A.6∶1∶5 B.6∶1∶2 C.2∶1∶2 D.2∶1∶5
C
上一栏目
考 点
1
2
3
下一栏目
14.配平下列方程式。
(1) Al+ Fe3O4 === Fe+ Al2O3
(2) H2+ N2====== NH3
(3) CH4+ O2=== CO2+ H2O
(4) Fe2O3+ H2SO4=== Fe2(SO4)3+ H2O
8
3
9
4
3
1
2
1
2
1
1
3
1
3
2
△
一定条件
点燃
上一栏目
考 点
1
2
3
下一栏目
15.写出下列化学方程式。
(1)铁燃烧 。
(2)磷燃烧 。
(3)过氧化氢分解 。
(4)高锰酸钾受热分解 。
(5)水通电 。
3Fe+2O2===Fe3O4
点燃
4P+5O2===2P2O5
点燃
2H2O2====== 2H2O+O2↑
MnO2
2KMnO4===K2MnO4+MnO2+O2↑
△
2H2O===2H2↑+O2↑
通电
上一栏目
考 点
1
2
3
下一栏目
16.化学变化是反应物的原子重新组合转变成生成物的过程。如图是某化学
变化过程的微观示意图。
(1)图示反应的化学方程式为 。
(2)下列关于图示反应的说法正确的是 。
A.该反应属于化合反应 B.反应前后原子的种类不变
C.反应前后分子的个数不变
(3)图示反应前后物质的质量之比为 。
B
3O2====== 2O3
一定条件
1∶1
上一栏目
考 点
1
2
3
下一栏目
考点3 化学方程式简单计算
17.利用化学方程式进行计算的依据是( )
A.化学方程式表示了一种化学反应的过程
B.化学方程式表示了反应物、生成物和反应条件
C.化学方程式表示了反应前后反应物和生成物的质量关系
D.化学方程式中,各反应物质量比等于各生成物质量比
C
上一栏目
考 点
1
2
3
下一栏目
18.已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,
生成56 g B和44 g C,则实际发生分解的A物质的质量为( )
A.12 g B.44 g C.56 g D.100 g
19.镁在氧气中燃烧生成氧化镁,这个反应中,镁、氧气、氧化镁的质量比
是( )
A.24∶32∶56 B.24∶32∶40
C.48∶32∶80 D.48∶32∶64
D
C
上一栏目
考 点
1
2
3
下一栏目
20.在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生
成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分
子质量为( )
A.9 B.12 C.18 D.36
21.在化学反应2A+B===3C+D中,A和B的相对分子质量之比为5∶1,已
知20 g A与一定量B恰好完全反应,生成5 g D,则在此反应中B和C的质
量比为( )
A.4∶19 B.3∶5 C.1∶3 D.2∶17
C
D
上一栏目
考 点
1
2
3
下一栏目
22.镁在空气中燃烧时,发生如下两个反应:3Mg+N2===Mg3N2,2Mg+O2
=== 2MgO。已知24 g镁在纯氧中完全燃烧可得40 g产物,那么24 g镁在空
气中完全燃烧所得产物的质量( )
A.等于40 g B.小于40 g C.大于40 g D.无法确定
B
点燃
点燃
上一栏目
考 点
1
2
3
下一栏目
23.小明在实验室里加热31.6 g高锰酸钾制取氧气,完全反应后剩余固体质
量为28.4 g。将剩余固体溶解、过滤、烘干后,回收二氧化锰。请计算:
(1)生成氧气的质量为3.2g。
(2)回收二氧化锰的质量。
解:设生成MnO2的质量为x。
2KMnO4===K2MnO4+MnO2+O2↑
87 32
x 3.2 g
= x=8.7 g
答:回收二氧化锰的质量为8.7 g。
△
上一栏目
考 点
1
2
3
下一栏目
24.将6.8 g含杂质的锌粒,加入盛有50.0 g过量的稀硫酸的烧杯中(杂质不溶
于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为
56.6 g。锌与硫酸反应的化学方程式为Zn+H2SO4===ZnSO4+H2↑。
试计算:
(1)生成氢气的质量。
(2)锌粒中所含锌的质量分数(精确到0.1%)。
解:(1)根据质量守恒定律可知,反应前物质的总质量与反应后物质总质量的差值6.8 g+50.0 g-56.6 g=0.2 g即为生成的氢气的质量。
上一栏目
考 点
1
2
3
下一栏目
(2)设锌粒中所含锌的质量为x。
Zn+H2SO4===ZnSO4+H2↑
65 2
x 0.2 g
= x=6.5 g
锌粒中所含锌的质量分数: ×100%=95.6%
答:锌粒中所含锌的质量分数为95.6%。
上一栏目
考 点
1
2
3
下一栏目
1.(湖南邵阳)某纯净物X在氧气中高温煅烧的化学方程式为4X+11O22Fe2O3
+8SO2,则X的化学式是( )
A.FeS B.FeSO4 C.FeS2 D.Fe2O3
2.(河南)钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一
种白色固体,它可能是( )
A.碳酸钠 B.硫酸钠 C.碳酸氢钠 D.氢氧化钠
C
A
上一栏目
中考链接
3.(山东青岛)下图是某些物质间发生化学反应的微观示意图,用“ ”和“ ”
分别表示两种元素的原子。下列化学方程式符合图示反应关系的是( )
A.2CO+O22CO2 B.N2+3H22NH3
C.C+O2CO2 D.2Mg+O22MgO
A
上一栏目
中考链接
4.(辽宁辽阳)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反
应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )
A.上表中x的值是0
B.该反应的基本反应类型是化合反应
C.乙一定是该反应的催化剂
D.丙和丁变化的质量比为14∶11
{5940675A-B579-460E-94D1-54222C63F5DA}物质
甲
乙
丙
丁
反应前质量/g
26
8
2
4
反应后质量/g
1
x
16
15
D
上一栏目
中考链接
复习 内 容:第 五 单元
知识梳理
考点集训
中考链接
知识点1 质量守恒定律
1.化学反应遵守质量守恒定律的根本原因:反应前后各原子的 、
和 不改变。在化学反应前后,“六不变”指的是原子的
数目、原子的种类、原子的质量、元素的 、元素的质量、物质
的总质量不变;肯定会改变的是的 种类、 的种类;可能
改变也可能不变的是分子的个数。所有的 反应都遵守质量守恒
定律。验证质量守恒定律的实验需要在 中进行。
种类
数目
质量
种类
分子
物质
化学
密闭容器
知识点
1
2
3
下一栏目
2.验证质量守恒定律实验如图所示:实验1的现象是 ,发光放热,
生成白烟,气球 。实验2的现象是铁钉表面附有红色固体、
溶液由 慢慢变为 ,反应前后物质的总质量 。如果实验
改为镁条燃烧,生成物总质量比镁条质量重,原因是 ;
若生成物总质量比镁条质量轻,可能的原因是 ;
若改用碳酸钠和稀盐酸进行实验,天平指针偏 ,原因是 。
。
红磷燃烧
先胀大后缩小
蓝色
浅绿色
不变
增加了氧元素的质量
白烟扩散到空气中或附在坩埚钳上
右
产生的二氧化碳扩散到空气中
知识点
1
2
3
下一栏目
知识点2 化学方程式书写
3.书写化学方程式的原则:一是以 为依据,不能凭空臆造事实
上不存在的物质和化学反应;二是要 ,要使反应
前后各原子的 和 保持不变。
4.化学方程式的书写步骤:①根据事实写出 和 的化
学式,用一条短线或箭头连接反应物和生成物,多种反应物或生成物之
间用“+”连接;② 化学方程式,使其遵守质量守恒定律;③注
明化学反应发生的 (点燃、加热、催化剂等),并标出生成物的
(气体、沉淀等),把短线或箭头改成等号。
客观事实
遵守质量守恒定律
种类
数目
反应物
生成物
配平
条件
状态
知识点
1
2
3
下一栏目
知识点3 化学方程式简单计算
5.利用化学方程式计算的一般步骤:①根据题意设未知量(用x,y等字母表
示);②写出反应的 ;③写出相关物质的 与
相对分子质量的乘积以及已知量、未知量;④列出 ,求未知数;
⑤简明写出答案。
化学方程式
化学计量数
比例式
知识点
1
2
3
下一栏目
考点1 质量守恒定律
1.下列变化,遵循质量守恒定律的是( )
A.镁条在空气中燃烧质量变轻 B.冰雪融化
C.水变成汽油 D.铁锭压制成铁板
2.在化学反应前后,下列各项中一定没有变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的总质量
⑤物质的种类 ⑥原子种类
A.①③④⑤ B.①③④⑥ C.①③⑤ D.①④⑥
A
B
上一栏目
考 点
1
2
3
下一栏目
3.某纯净物M在密闭容器中加热会分解为CuO、H2O和CO2,根据这一实
验事实得出的结论,错误的是( )
A.M一定是化合物 B.M一定由四种元素组成
C.M是黑色粉末 D.可以用M为原料冶炼铜
4.下列实验可用于验证质量守恒定律的是( )
C
B
上一栏目
考 点
1
2
3
下一栏目
5.下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.50 mL水和50 mL乙醇混合后总体积小于100 mL
C.在100 g过氧化氢溶液中,含有30 g过氧化氢和70 g水
D.1.2 g碳和3.2 g氧气恰好完全反应可生成4.4 g二氧化碳
D
上一栏目
考 点
1
2
3
下一栏目
6.将4.6 g某物质在足量的氧气中燃烧,生成8.8 g二氧化碳和5.4 g水,则下
列说法中正确的是( )
A.该物质中只含碳、氢两种元素
B.该物质中含有碳、氢、氧三种元素
C.该物质中一定含碳、氢元素,可能含氧元素
D.该物质的化学式为CH4
B
上一栏目
考 点
1
2
3
下一栏目
7.中国科学家成功将二氧化碳转化为乙烯(C2H4),反应前后分子种类变化
的微观示意图如下。下列说法不正确的是( )
A.甲的相对分子质量为44
B.两种生成物均为氧化物
C.丙中碳、氢原子个数比为1∶2
D.参加反应的甲与乙的分子个数比为1∶3
B
上一栏目
考 点
1
2
3
下一栏目
8.如图是探究质量守恒定律的实验装置图,回答下列问题。
(1)该实验 (填“能”或“不能”)探究质量守恒定律,原因
是 。
(2)要用如图继续探究质量守恒定律,若药品不变,改变装置的方法是
;若装置不变,改变药品,可选用的
一组药品是 (举一例)。
不能
生成的二氧化碳逸散到空气中
反应在密闭容器中进行
铁与硫酸铜溶液
上一栏目
考 点
1
2
3
下一栏目
考点2 化学方程式书写
9.同学们对化学反应方程式:C+O2CO2有下面的四种说法,其中错误的是
( )
C
上一栏目
考 点
1
2
3
下一栏目
10.化学方程式是重要的化学用语。下列化学方程式书写正确的是( )
A.2KMnO4===K2MnO4+MnO2+O2↑
B.P+O2===P2O5
C.4Fe+3O2===2Fe2O3
D.C+O2===CO2↑
A
△
点燃
点燃
上一栏目
考 点
1
2
3
下一栏目
11.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知获
得高铁酸钠的反应为Fe2O3+mNa2O2===nNa2FeO4+Na2O,其中m、n分
别为( )
A.2 3 B.3 2 C.1 3 D.1 3
12.能正确表示化学方程式aC2H6O+bO2mCO2+nH2O中,各化学计量数之
间的关系的是( )
A.2b=n B.a+2b=m+2n
C.a+b=m+n D.3a=n
B
D
上一栏目
考 点
1
2
3
下一栏目
13.下图形象地表示某化学反应前后反应物与生成物分子及其数目的变化,
其中“ ”“ ”“ ”分别表示A、B、C三种不同的分子。
则该反应的化学方程式中A、B、C前的化学计量数之比为( )
A.6∶1∶5 B.6∶1∶2 C.2∶1∶2 D.2∶1∶5
C
上一栏目
考 点
1
2
3
下一栏目
14.配平下列方程式。
(1) Al+ Fe3O4 === Fe+ Al2O3
(2) H2+ N2====== NH3
(3) CH4+ O2=== CO2+ H2O
(4) Fe2O3+ H2SO4=== Fe2(SO4)3+ H2O
8
3
9
4
3
1
2
1
2
1
1
3
1
3
2
△
一定条件
点燃
上一栏目
考 点
1
2
3
下一栏目
15.写出下列化学方程式。
(1)铁燃烧 。
(2)磷燃烧 。
(3)过氧化氢分解 。
(4)高锰酸钾受热分解 。
(5)水通电 。
3Fe+2O2===Fe3O4
点燃
4P+5O2===2P2O5
点燃
2H2O2====== 2H2O+O2↑
MnO2
2KMnO4===K2MnO4+MnO2+O2↑
△
2H2O===2H2↑+O2↑
通电
上一栏目
考 点
1
2
3
下一栏目
16.化学变化是反应物的原子重新组合转变成生成物的过程。如图是某化学
变化过程的微观示意图。
(1)图示反应的化学方程式为 。
(2)下列关于图示反应的说法正确的是 。
A.该反应属于化合反应 B.反应前后原子的种类不变
C.反应前后分子的个数不变
(3)图示反应前后物质的质量之比为 。
B
3O2====== 2O3
一定条件
1∶1
上一栏目
考 点
1
2
3
下一栏目
考点3 化学方程式简单计算
17.利用化学方程式进行计算的依据是( )
A.化学方程式表示了一种化学反应的过程
B.化学方程式表示了反应物、生成物和反应条件
C.化学方程式表示了反应前后反应物和生成物的质量关系
D.化学方程式中,各反应物质量比等于各生成物质量比
C
上一栏目
考 点
1
2
3
下一栏目
18.已知A物质发生分解反应生成B物质和C物质,当一定量的A反应片刻后,
生成56 g B和44 g C,则实际发生分解的A物质的质量为( )
A.12 g B.44 g C.56 g D.100 g
19.镁在氧气中燃烧生成氧化镁,这个反应中,镁、氧气、氧化镁的质量比
是( )
A.24∶32∶56 B.24∶32∶40
C.48∶32∶80 D.48∶32∶64
D
C
上一栏目
考 点
1
2
3
下一栏目
20.在化学反应A+2B===C+2D中,已知16 g A与64 g B恰好完全反应,生
成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分
子质量为( )
A.9 B.12 C.18 D.36
21.在化学反应2A+B===3C+D中,A和B的相对分子质量之比为5∶1,已
知20 g A与一定量B恰好完全反应,生成5 g D,则在此反应中B和C的质
量比为( )
A.4∶19 B.3∶5 C.1∶3 D.2∶17
C
D
上一栏目
考 点
1
2
3
下一栏目
22.镁在空气中燃烧时,发生如下两个反应:3Mg+N2===Mg3N2,2Mg+O2
=== 2MgO。已知24 g镁在纯氧中完全燃烧可得40 g产物,那么24 g镁在空
气中完全燃烧所得产物的质量( )
A.等于40 g B.小于40 g C.大于40 g D.无法确定
B
点燃
点燃
上一栏目
考 点
1
2
3
下一栏目
23.小明在实验室里加热31.6 g高锰酸钾制取氧气,完全反应后剩余固体质
量为28.4 g。将剩余固体溶解、过滤、烘干后,回收二氧化锰。请计算:
(1)生成氧气的质量为3.2g。
(2)回收二氧化锰的质量。
解:设生成MnO2的质量为x。
2KMnO4===K2MnO4+MnO2+O2↑
87 32
x 3.2 g
= x=8.7 g
答:回收二氧化锰的质量为8.7 g。
△
上一栏目
考 点
1
2
3
下一栏目
24.将6.8 g含杂质的锌粒,加入盛有50.0 g过量的稀硫酸的烧杯中(杂质不溶
于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为
56.6 g。锌与硫酸反应的化学方程式为Zn+H2SO4===ZnSO4+H2↑。
试计算:
(1)生成氢气的质量。
(2)锌粒中所含锌的质量分数(精确到0.1%)。
解:(1)根据质量守恒定律可知,反应前物质的总质量与反应后物质总质量的差值6.8 g+50.0 g-56.6 g=0.2 g即为生成的氢气的质量。
上一栏目
考 点
1
2
3
下一栏目
(2)设锌粒中所含锌的质量为x。
Zn+H2SO4===ZnSO4+H2↑
65 2
x 0.2 g
= x=6.5 g
锌粒中所含锌的质量分数: ×100%=95.6%
答:锌粒中所含锌的质量分数为95.6%。
上一栏目
考 点
1
2
3
下一栏目
1.(湖南邵阳)某纯净物X在氧气中高温煅烧的化学方程式为4X+11O22Fe2O3
+8SO2,则X的化学式是( )
A.FeS B.FeSO4 C.FeS2 D.Fe2O3
2.(河南)钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一
种白色固体,它可能是( )
A.碳酸钠 B.硫酸钠 C.碳酸氢钠 D.氢氧化钠
C
A
上一栏目
中考链接
3.(山东青岛)下图是某些物质间发生化学反应的微观示意图,用“ ”和“ ”
分别表示两种元素的原子。下列化学方程式符合图示反应关系的是( )
A.2CO+O22CO2 B.N2+3H22NH3
C.C+O2CO2 D.2Mg+O22MgO
A
上一栏目
中考链接
4.(辽宁辽阳)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反
应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )
A.上表中x的值是0
B.该反应的基本反应类型是化合反应
C.乙一定是该反应的催化剂
D.丙和丁变化的质量比为14∶11
{5940675A-B579-460E-94D1-54222C63F5DA}物质
甲
乙
丙
丁
反应前质量/g
26
8
2
4
反应后质量/g
1
x
16
15
D
上一栏目
中考链接
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
