人教版2019高一化学必修第1册第四章第二节元素周期律第1课时(共16张ppt)
文档属性
| 名称 | 人教版2019高一化学必修第1册第四章第二节元素周期律第1课时(共16张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 22:58:13 | ||
图片预览


文档简介
(共16张PPT)
第四章
物质结构
元素周期律
第二节
元素周期律
第1课时
元素周期律
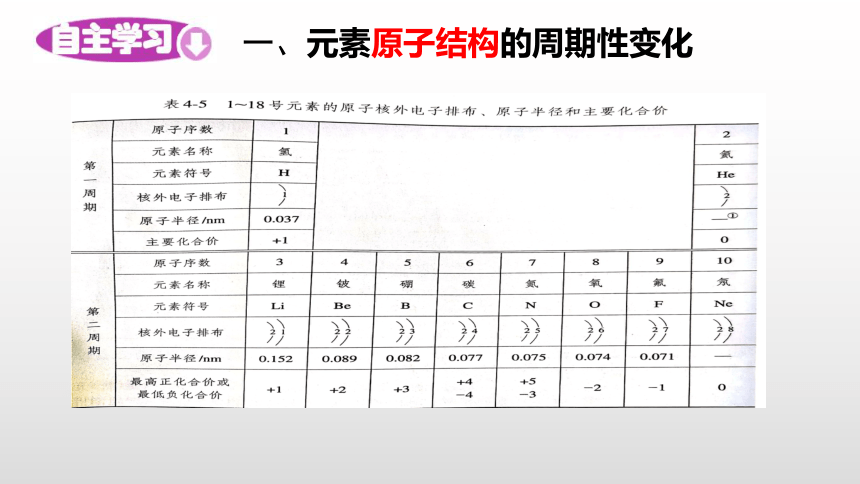
一、元素原子结构的周期性变化
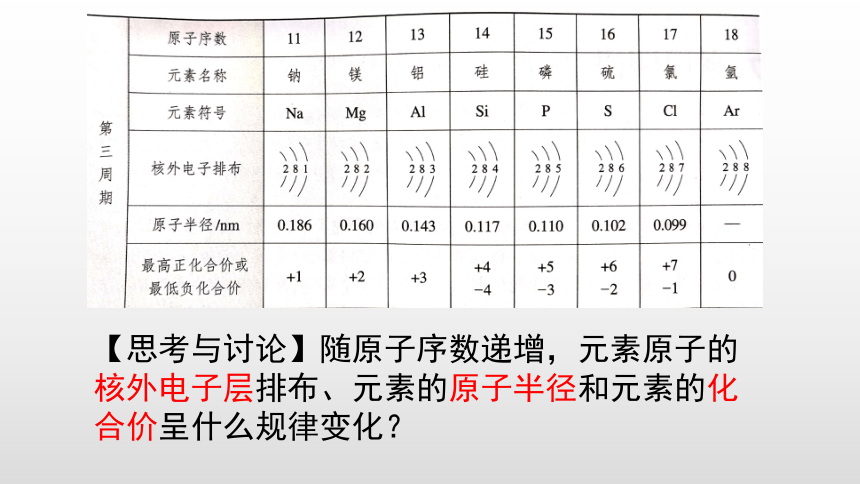
【思考与讨论】随原子序数递增,元素原子的核外电子层排布、元素的原子半径和元素的化合价呈什么规律变化?
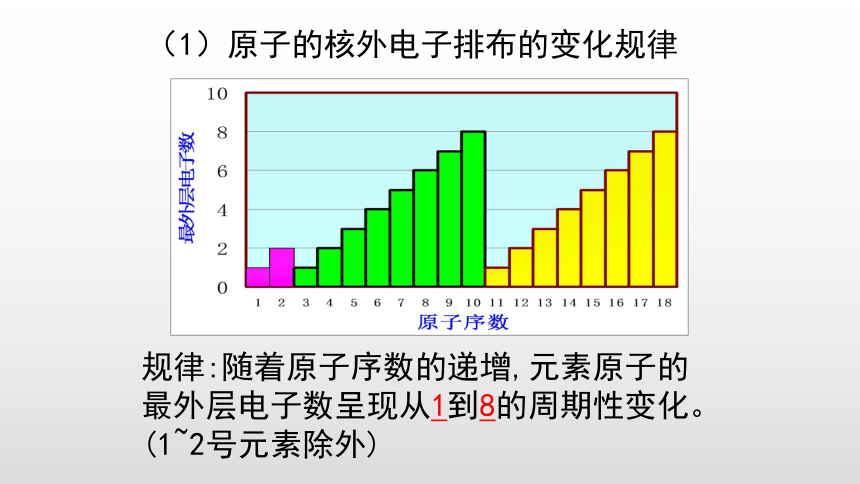
(1)原子的核外电子排布的变化规律
规律:随着原子序数的递增,元素原子的
最外层电子数呈现从1到8的周期性变化。
(1~2号元素除外)
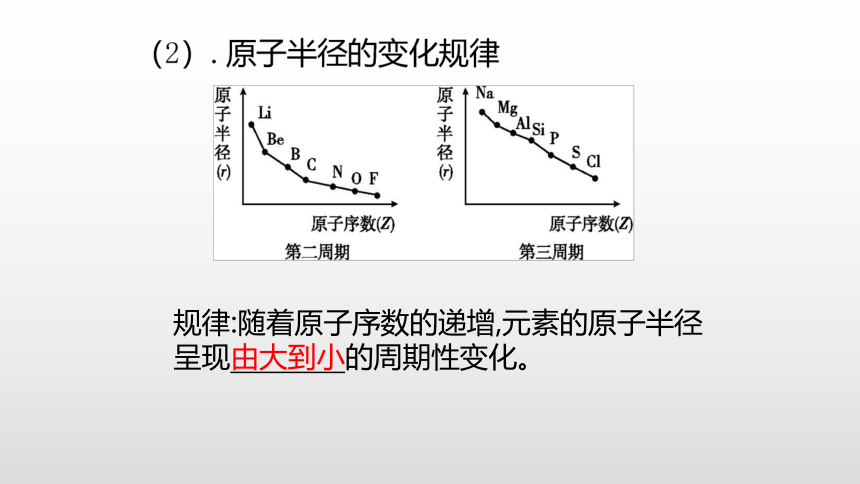
规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
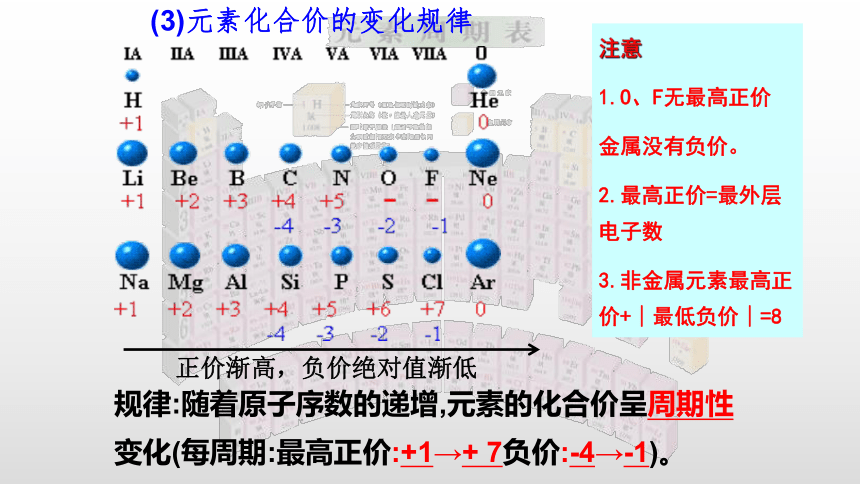
(3)元素化合价的变化规律
正价渐高,负价绝对值渐低
注意
1.O、F无最高正价
金属没有负价。
2.最高正价=最外层电子数
3.非金属元素最高正价+∣最低负价∣=8
规律:随着原子序数的递增,元素的化合价呈周期性变化(每周期:最高正价:+1→+
7负价:-4→-1)。
【结论】
随着原子序数的递增,元素原子的电子排布、
原子半径、化合价呈现周期性变化。
【思考】
元素的金属性和非金属性是否也随着原子序数的变化
呈现周期性变化呢?
【探究】
第三周期元素性质的递变
【问题探究】根据第三周期元素原子核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?
从Na→Al核电荷数增加,最外层电子数依次增加,
失电子能力减弱,金属性逐渐减弱。
【推测】
从Si→Cl核电荷数增加,最外层电子数依次增加,
得电子能力增强,非金属性逐渐增强
实验1:Mg与水反应
Mg在常温下,与水的反应无明显现象;
加热时,镁带表面有大量气泡出现,溶液变红。
现象:
方程式:
Mg
+
2H2O
=
Mg(OH)2
+H2
【结论】与钠与水反应比较,钠与水反应剧烈,
所以金属性:Na
大于
Mg.
实验2
实验
Al(OH)3中滴加
2mol/L盐酸
Al(OH)3中滴加2mol/LNaOH溶液
现象
离子方程式
化学方程式
结论
Al(OH)3溶解
Al(OH)3+3H+
═
Al
3++3H2O
Al(OH)3溶解
Al(OH)3+OH-
═
Al
O2-+2H2O
Al(OH)3+3HCl
═
AlCl3+3H2O
Al(OH)3+NaOH
═NaAlO2+2H2O
Al(OH)3既能与强酸反应又能与强碱反应生成盐和水,氢氧化铝有两性。铝虽为金属,但已表现出非金属性
实验2
【现象】生成的白色沉淀Mg(OH)2能在盐酸中溶解,但不能溶解到氢氧化钠溶液中。
【结论】Mg(OH)2是中强碱,比Al(OH)3强
金属元素性质
Na
Mg
Al
单质和水(或酸)
的反应情况
最高价氧化物对应水化物碱性
跟冷水剧
烈反应
NaOH强碱
跟沸水反应放H2;跟酸剧烈反应放H2
Mg(OH)2
中强碱
跟酸较为
迅速反应
放H2
Al(OH)3
两性
氢氧化物
结论:
金属性
Na>Mg>Al
【小结】
2.
Si、P、S、Cl的非金属性强弱比较
14Si
15P
16S
17Cl
最高价氧化物对应的水化物
酸性强弱
结论
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
强酸
(比H2SO4强)
逐渐增强
非金属性逐渐增强
【结论】
Na
Mg
Al
Si
P
S
Cl
金属性逐渐减弱,非金属性逐渐增强。
1.同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A.原子半径:X>Y>Z
B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:XD.原子序数:
XB
牛刀小试
2.
X元素最高价氧化物对应的水化物
为HXO3,它的气态氢化物为(
)
A.
HX
B.
H2X
C.
XH3
D.
XH4
C
牛刀小试
3.在下列元素中,最高正化合价数值最大的是
(
)
A.Na
B.P
C.Cl
D.Ar
C
第四章
物质结构
元素周期律
第二节
元素周期律
第1课时
元素周期律
一、元素原子结构的周期性变化
【思考与讨论】随原子序数递增,元素原子的核外电子层排布、元素的原子半径和元素的化合价呈什么规律变化?
(1)原子的核外电子排布的变化规律
规律:随着原子序数的递增,元素原子的
最外层电子数呈现从1到8的周期性变化。
(1~2号元素除外)
规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
(3)元素化合价的变化规律
正价渐高,负价绝对值渐低
注意
1.O、F无最高正价
金属没有负价。
2.最高正价=最外层电子数
3.非金属元素最高正价+∣最低负价∣=8
规律:随着原子序数的递增,元素的化合价呈周期性变化(每周期:最高正价:+1→+
7负价:-4→-1)。
【结论】
随着原子序数的递增,元素原子的电子排布、
原子半径、化合价呈现周期性变化。
【思考】
元素的金属性和非金属性是否也随着原子序数的变化
呈现周期性变化呢?
【探究】
第三周期元素性质的递变
【问题探究】根据第三周期元素原子核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?
从Na→Al核电荷数增加,最外层电子数依次增加,
失电子能力减弱,金属性逐渐减弱。
【推测】
从Si→Cl核电荷数增加,最外层电子数依次增加,
得电子能力增强,非金属性逐渐增强
实验1:Mg与水反应
Mg在常温下,与水的反应无明显现象;
加热时,镁带表面有大量气泡出现,溶液变红。
现象:
方程式:
Mg
+
2H2O
=
Mg(OH)2
+H2
【结论】与钠与水反应比较,钠与水反应剧烈,
所以金属性:Na
大于
Mg.
实验2
实验
Al(OH)3中滴加
2mol/L盐酸
Al(OH)3中滴加2mol/LNaOH溶液
现象
离子方程式
化学方程式
结论
Al(OH)3溶解
Al(OH)3+3H+
═
Al
3++3H2O
Al(OH)3溶解
Al(OH)3+OH-
═
Al
O2-+2H2O
Al(OH)3+3HCl
═
AlCl3+3H2O
Al(OH)3+NaOH
═NaAlO2+2H2O
Al(OH)3既能与强酸反应又能与强碱反应生成盐和水,氢氧化铝有两性。铝虽为金属,但已表现出非金属性
实验2
【现象】生成的白色沉淀Mg(OH)2能在盐酸中溶解,但不能溶解到氢氧化钠溶液中。
【结论】Mg(OH)2是中强碱,比Al(OH)3强
金属元素性质
Na
Mg
Al
单质和水(或酸)
的反应情况
最高价氧化物对应水化物碱性
跟冷水剧
烈反应
NaOH强碱
跟沸水反应放H2;跟酸剧烈反应放H2
Mg(OH)2
中强碱
跟酸较为
迅速反应
放H2
Al(OH)3
两性
氢氧化物
结论:
金属性
Na>Mg>Al
【小结】
2.
Si、P、S、Cl的非金属性强弱比较
14Si
15P
16S
17Cl
最高价氧化物对应的水化物
酸性强弱
结论
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
强酸
(比H2SO4强)
逐渐增强
非金属性逐渐增强
【结论】
Na
Mg
Al
Si
P
S
Cl
金属性逐渐减弱,非金属性逐渐增强。
1.同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A.原子半径:X>Y>Z
B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X
X
牛刀小试
2.
X元素最高价氧化物对应的水化物
为HXO3,它的气态氢化物为(
)
A.
HX
B.
H2X
C.
XH3
D.
XH4
C
牛刀小试
3.在下列元素中,最高正化合价数值最大的是
(
)
A.Na
B.P
C.Cl
D.Ar
C
