沪教版(上海)初中化学九年级上册 2.3 化学变化中的质量守恒-根据化学方程式的计算 课件(19张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级上册 2.3 化学变化中的质量守恒-根据化学方程式的计算 课件(19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 544.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 00:00:00 | ||
图片预览






文档简介
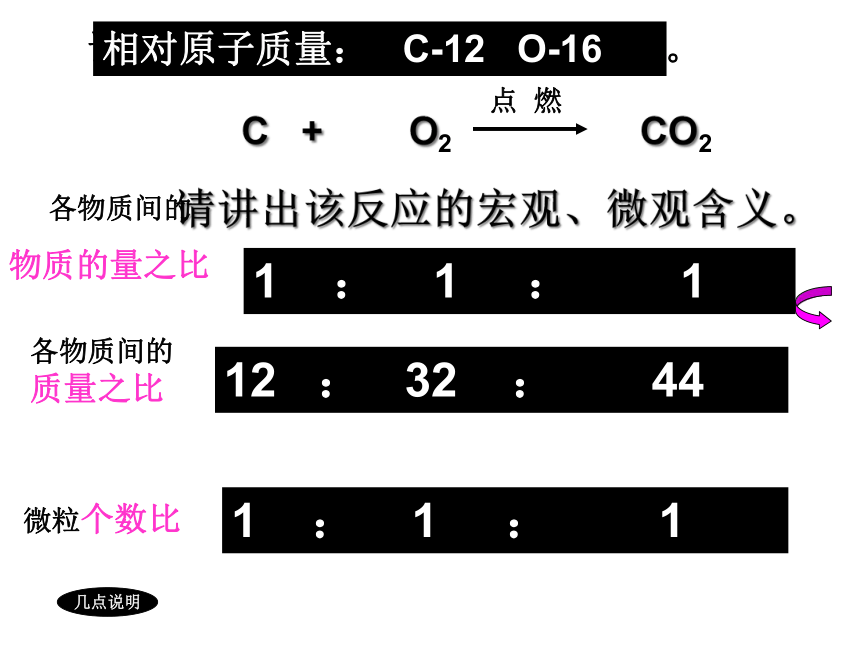
根据化学方程式的计算
请讲出该反应的宏观、微观含义。
微粒个数比
1 : 1 : 1
各物质间的质量之比
12 : 32 : 44
各物质间的
物质的量之比
1 : 1 : 1
C + O2 CO2
点 燃
几点说明
请写出木炭完全燃烧的化学方程式。
相对原子质量: C-12 O-16
1、求红磷燃烧反应中各物质间的微粒个数比、物质的量之比、质量之比。
相对原子质量 P-31 O-16 H-1 Mn-55 K-39 Cl-35.5
2、求用双氧水和二氧化锰制氧反应后生成物间的质量之比、物质的量之比 。
练 习
例1 实验室常用过氧化氢制取氧气,工业上可用电解水制得氧气。试问,每摩尔的过氧化氢和水各能得到氧气多少摩尔?
2
1
计算步骤(记在导学单p6的上面)
1、设未知量;
2、根据题意写出有关的化学方程式(必须配平);
3、根据化学方程式写出有关物质的物质的量之比及已知量、未知量;(找关系)
4、列比例式、求解;
5、简明地写上答案。
练习1 实验室用加热氯酸钾(和二氧化锰混合)来制取氧气。如有0.4mol的氯酸钾完全反应能得到氧气多少摩尔?
练习2 实验室要制得1.5 mol的氧气,需加热多少摩尔的氯酸钾固体?
例2 实验室用加热氯酸钾(和二氧化锰混合)来制取氧气。如有24.5克的氯酸钾完全反应能得到氧气多少克?
练习3 把16.25克干燥的氯酸钾和二氧化锰的混合物放到试管中加热,直到不再产生气体为止,冷却称得剩余固体质量11.45克。求混合物中氯酸钾和二氧化锰的质量分别为多少克?
质量比
4 × 31 : 5 × 32 : 2 ×142
124 :160 : 284
物质的量之比
4P + 5O2
点燃
2P2O5
微粒个数比
4 : 5 : 2
4 : 5 : 2
BACK
2H2O2
MnO2
2H2O + O2 ↑
生成物间的
质量比
生成物间的
物质的量之比
2 : 1
36 :32
9 : 8
答:每摩尔的过氧化氢能得到氧气0.5mol。
2H2O2
MnO2
2H2O + O2 ↑
2 1
1 mol x mol
2
=
1
1
x
X=0.5 (mol)
解:设每摩尔的过氧化氢能得到氧气x mol。
1
例1
答:每摩尔的水能得到氧气0.5 mol。
2H2O
通电
2H2 ↑ + O2 ↑
2 1
1 mol y mol
2
=
1
1
y
y=0.5 (mol)
解:设每摩尔的水能得到氧气y mol。
2
例1
练习1
解:设能得到氧气x mol 。
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
0.4 mol x mol
3
0.4 x
=
X=0.6 (mol)
答:0.4mol的氯酸钾完全反应能得到氧气0.6 mol 。
BACK
练习2
解:设需加热x mol的氯酸钾固体 。
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
x mol 1.5 mol
3
x 1.5
=
X=1 (mol)
答:需加热1摩尔的氯酸钾固体 。
BACK
例 2
解: n(KClO3 )= 24.5g/122.5g/mol = 0.2 (mol)
设 氯酸钾完全反应能得到氧气 x mol
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
0.2 mol x mol
3
0.2 x
=
X=0.3 (mol)
∴ m(O2)=0.3mol×32g/mol=9.6 (g )
答: 24.5克的氯酸钾完全反应能得到氧气9.6克。
BACK
练习3
解:m(O2)=16.25-11.45=4.8 (g)
n(O2 )=4.8g/32g/mol=0.15 (mol)
设 混合物中氯酸钾的物质的量为 x mol
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
X mol 0.15 mol
3
X 0.15
=
X=0.1 (mol)
m(KClO3)=0.1mol×122.5g/mol=12.25 (g )
m(MnO2)=16.25-12.25=4 (g )
答:混合物中氯酸钾和二氧化锰的质量分别为12.25克、4克。
BACK
化学方程式在 “量” 上的含义:
⑴每1mol的碳和1mol的氧气在点燃的条件下生成1mol的二氧化碳。
⑵每12份质量的碳和32份质量的氧气在
点燃的条件下生成44份质量的二氧化碳。
化学方程式的含义共有几种?
※
①微粒个数比=物质的量之比=系数之比
≠质量之比 (须配平);
②反应确定,它们的关系也随之确定。
请讲出该反应的宏观、微观含义。
微粒个数比
1 : 1 : 1
各物质间的质量之比
12 : 32 : 44
各物质间的
物质的量之比
1 : 1 : 1
C + O2 CO2
点 燃
几点说明
请写出木炭完全燃烧的化学方程式。
相对原子质量: C-12 O-16
1、求红磷燃烧反应中各物质间的微粒个数比、物质的量之比、质量之比。
相对原子质量 P-31 O-16 H-1 Mn-55 K-39 Cl-35.5
2、求用双氧水和二氧化锰制氧反应后生成物间的质量之比、物质的量之比 。
练 习
例1 实验室常用过氧化氢制取氧气,工业上可用电解水制得氧气。试问,每摩尔的过氧化氢和水各能得到氧气多少摩尔?
2
1
计算步骤(记在导学单p6的上面)
1、设未知量;
2、根据题意写出有关的化学方程式(必须配平);
3、根据化学方程式写出有关物质的物质的量之比及已知量、未知量;(找关系)
4、列比例式、求解;
5、简明地写上答案。
练习1 实验室用加热氯酸钾(和二氧化锰混合)来制取氧气。如有0.4mol的氯酸钾完全反应能得到氧气多少摩尔?
练习2 实验室要制得1.5 mol的氧气,需加热多少摩尔的氯酸钾固体?
例2 实验室用加热氯酸钾(和二氧化锰混合)来制取氧气。如有24.5克的氯酸钾完全反应能得到氧气多少克?
练习3 把16.25克干燥的氯酸钾和二氧化锰的混合物放到试管中加热,直到不再产生气体为止,冷却称得剩余固体质量11.45克。求混合物中氯酸钾和二氧化锰的质量分别为多少克?
质量比
4 × 31 : 5 × 32 : 2 ×142
124 :160 : 284
物质的量之比
4P + 5O2
点燃
2P2O5
微粒个数比
4 : 5 : 2
4 : 5 : 2
BACK
2H2O2
MnO2
2H2O + O2 ↑
生成物间的
质量比
生成物间的
物质的量之比
2 : 1
36 :32
9 : 8
答:每摩尔的过氧化氢能得到氧气0.5mol。
2H2O2
MnO2
2H2O + O2 ↑
2 1
1 mol x mol
2
=
1
1
x
X=0.5 (mol)
解:设每摩尔的过氧化氢能得到氧气x mol。
1
例1
答:每摩尔的水能得到氧气0.5 mol。
2H2O
通电
2H2 ↑ + O2 ↑
2 1
1 mol y mol
2
=
1
1
y
y=0.5 (mol)
解:设每摩尔的水能得到氧气y mol。
2
例1
练习1
解:设能得到氧气x mol 。
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
0.4 mol x mol
3
0.4 x
=
X=0.6 (mol)
答:0.4mol的氯酸钾完全反应能得到氧气0.6 mol 。
BACK
练习2
解:设需加热x mol的氯酸钾固体 。
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
x mol 1.5 mol
3
x 1.5
=
X=1 (mol)
答:需加热1摩尔的氯酸钾固体 。
BACK
例 2
解: n(KClO3 )= 24.5g/122.5g/mol = 0.2 (mol)
设 氯酸钾完全反应能得到氧气 x mol
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
0.2 mol x mol
3
0.2 x
=
X=0.3 (mol)
∴ m(O2)=0.3mol×32g/mol=9.6 (g )
答: 24.5克的氯酸钾完全反应能得到氧气9.6克。
BACK
练习3
解:m(O2)=16.25-11.45=4.8 (g)
n(O2 )=4.8g/32g/mol=0.15 (mol)
设 混合物中氯酸钾的物质的量为 x mol
2KClO3 2 KCl + 3O2 ↑
MnO2
△
2 3
X mol 0.15 mol
3
X 0.15
=
X=0.1 (mol)
m(KClO3)=0.1mol×122.5g/mol=12.25 (g )
m(MnO2)=16.25-12.25=4 (g )
答:混合物中氯酸钾和二氧化锰的质量分别为12.25克、4克。
BACK
化学方程式在 “量” 上的含义:
⑴每1mol的碳和1mol的氧气在点燃的条件下生成1mol的二氧化碳。
⑵每12份质量的碳和32份质量的氧气在
点燃的条件下生成44份质量的二氧化碳。
化学方程式的含义共有几种?
※
①微粒个数比=物质的量之比=系数之比
≠质量之比 (须配平);
②反应确定,它们的关系也随之确定。
