沪教版(上海)初中化学九年级下册 5.1 生活中的酸和碱 课件 (45张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级下册 5.1 生活中的酸和碱 课件 (45张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 14:58:47 | ||
图片预览







文档简介
生活中的酸和碱
我们已经知道,食醋呈____性,肥皂水和石灰水都呈____性。他们都是一些物质在水中的溶液,溶液有酸性和碱性之分。酸的溶液具有____性,碱的溶液具有____性。酸和碱是两类重要的化合物。
准备性练习
酸
酸
碱
碱
在日常生活中,我们会发现由许多种酸和碱就在我们身边,它们存在于食品、药品、家庭用品和大气中。还直接存在于我们的体内。
柑橘类水果——柠檬酸
在番茄汁中含有乙酸
乳类饮品中有乳酸
茶水中含有茶叶碱
生活中的酸和碱
在实验室中,经常接触的主要的酸有盐酸、硫酸、硝酸
常见的碱有氢氧化钠、氢氧化钙
酸和碱各有什么组成特征?
实验室中的酸和碱
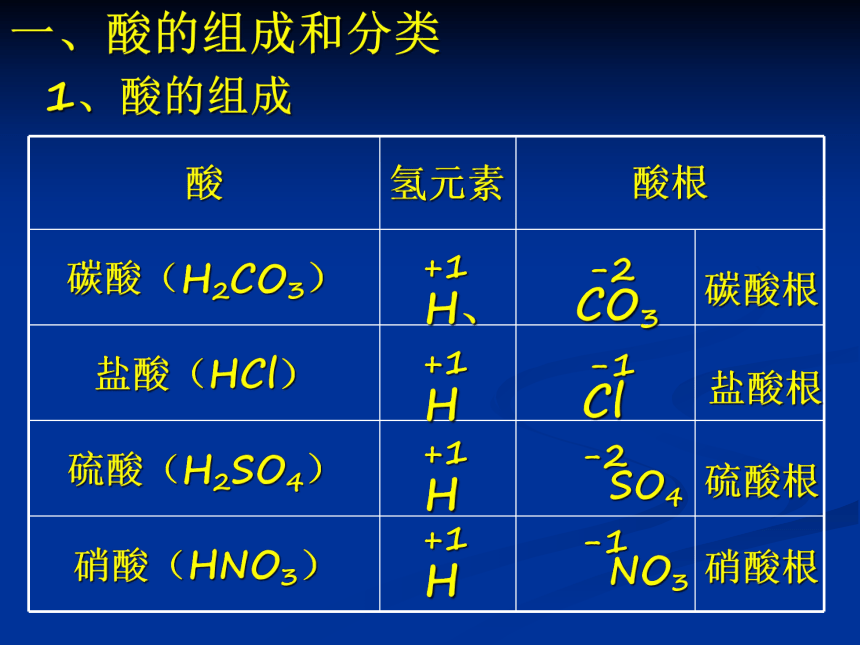
酸
氢元素
酸根
碳酸(H2CO3)
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
一、酸的组成和分类
-2
CO3
-1
Cl
-2
SO4
碳酸根
盐酸根
硫酸根
+1
H、
+1
H
+1
H
1、酸的组成
-1
NO3
硝酸根
+1
H
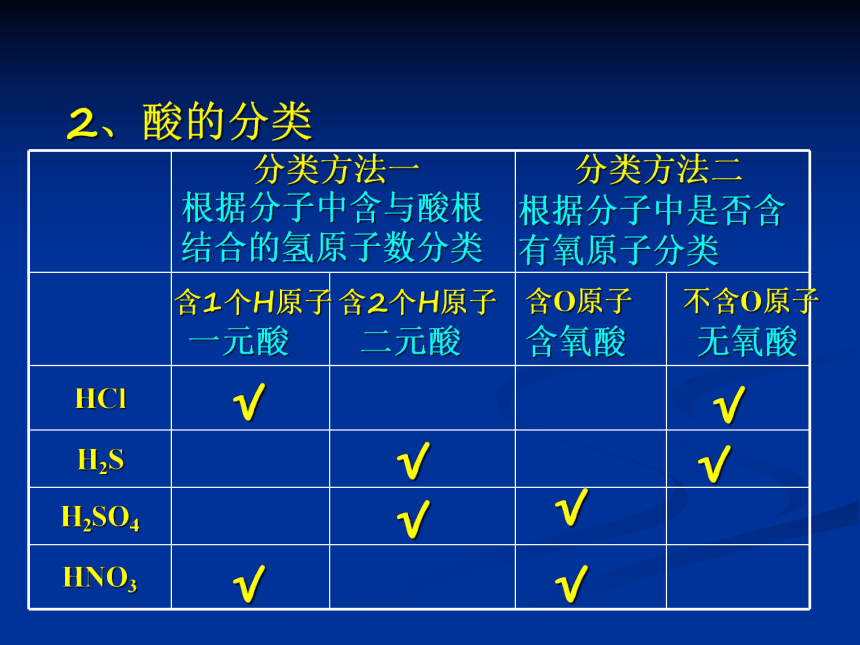
HCl
H2S
H2SO4
HNO3
√
√
√
√
√
√
√
√
根据分子中含与酸根结合的氢原子数分类
根据分子中是否含有氧原子分类
一元酸
二元酸
含氧酸
无氧酸
分类方法一
分类方法二
含1个H原子
含2个H原子
含O原子
不含O原子
2、酸的分类
从不同角度对酸进行分类
是否含有氧原子
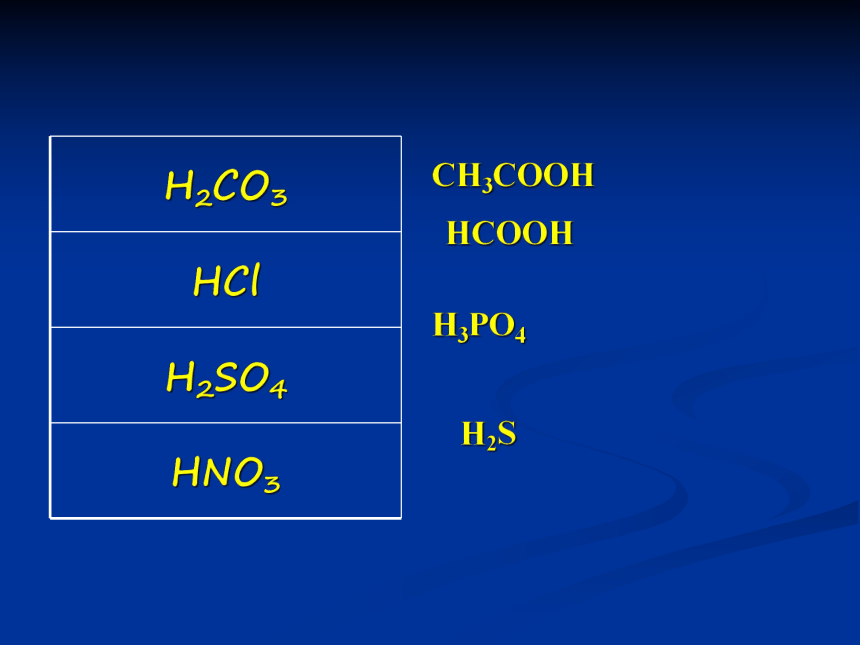
含氧酸:
无氧酸:
HNO3、 CH3COOH等
HCl、H2S等
按物质类别
有机酸:
无机酸:
HCOOH、 CH3COOH等
H2CO3、HCl等
根据分子中含与酸根结合的氢原子数分类
一元酸:
二元酸:
三元酸:
………
HCl、CH3COOH等
H2SO4、H2CO3等
H3PO4等
三、酸、碱的命名
酸
含氧酸:
无氧酸:
读作“某酸”
读作“氢某酸”
如H2SO4读作
如H2S读作
硫酸
氢硫酸
溶质为气体的无氧酸,溶质在溶于水之前称为某化某。
H2CO3
HCl
H2SO4
HNO3
CH3COOH
H3PO4
H2S
HCOOH
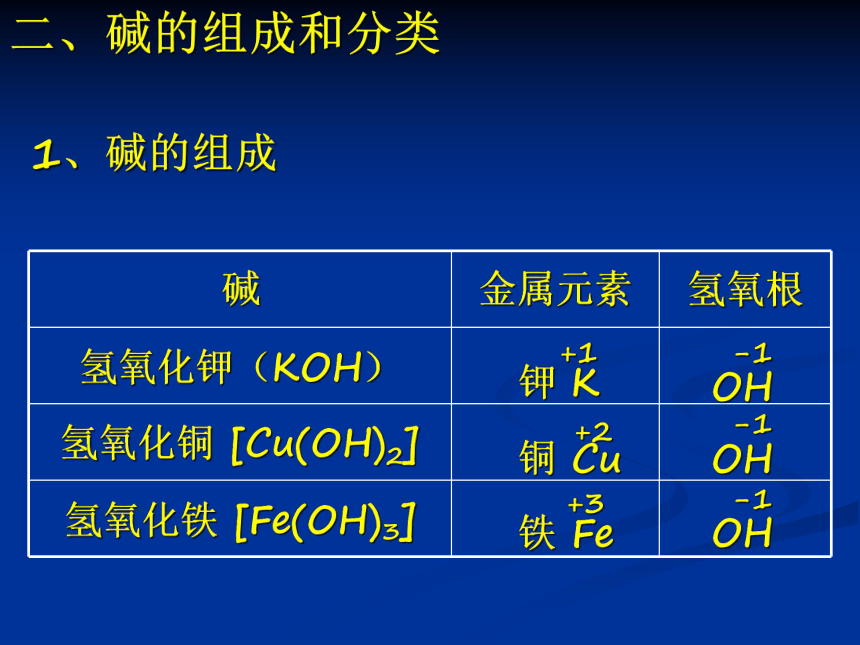
碱
金属元素
氢氧根
氢氧化钾(KOH)
氢氧化铜 [Cu(OH)2]
氢氧化铁 [Fe(OH)3]
-1
OH
+2
铜 Cu
+3
铁 Fe
-1
OH
-1
OH
+1
钾 K
1、碱的组成
二、碱的组成和分类
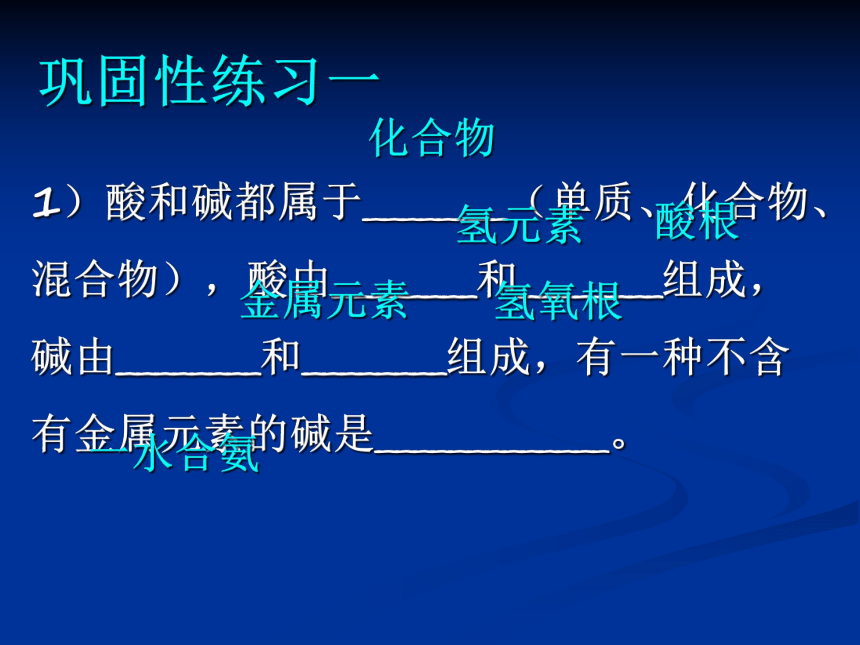
1)酸和碱都属于________(单质、化合物、混合物),酸由________和________组成,碱由________和________组成,有一种不含有金属元素的碱是_____________。
巩固性练习一
化合物
氢元素
酸根
金属元素
氢氧根
一水合氨
2)写出下列物质的化学式,并进行分类(酸或碱):
硝酸 氢氧化铜 乙酸
一水合氨 碳酸 氢氧化铁
HNO3
H2CO3
CH3COOH
NH3·H2O
Cu(OH)2
Fe(OH)3
NaOH
Cu(OH)2
Ca(OH)2
NH3·H2O
√
√
√
√
根据在水中的溶解性分类
可溶性碱
难溶性碱
分类方法
可以溶于水
难以溶于水
2、碱的分类
1)下列酸中属于无氧酸的是( )
A、碳酸 B、硫酸
C、盐酸 D、乙酸
2)下列四种碱,难溶于水的是( )
A、氢氧化钠 B、氢氧化钡
C、氢氧化铁 D、一水合氨
巩固性练习二
C
C
3)在H2SO4、HCl、H2CO3、HNO3 、 CH3COOH、H2S中,
属于有机酸的是________________,
属于一元无氧酸的是_______________,
属于二元含氧酸的是________________。
CH3COOH
HCl
H2SO4、H2CO3
从不同角度对碱进行分类
按含有氢氧根的个数
按在水中的溶解性
可溶性碱:
KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O等
难溶性碱:
Cu(OH)2、Fe(OH)3等
一元碱:
NaOH、NH3·H2O等
二元碱:
Ba(OH)2、 Cu(OH)2等
三元碱:
Fe(OH)3等
………
三、碱的命名
碱
读作“氢氧化某”
如Fe(OH)3读作
氢氧化铁
1)含氧酸一般命名为“________”,无氧酸命名为“________”。
2)在横线上填写适当的化学式、名称
硫酸______ H2SO3 _______ HNO3 _______
盐酸______ H2S ________
巩固性练习三
某酸
氢某酸
H2SO4
亚硫酸
硝酸
HCl
氢硫酸
判断正误:
①酸根都是原子团;
②酸和碱的组成中都含有氢元素;
③碱的组成中都含有金属元素。
名称
氢氧化铜
氢氧化铁
化学式
Mg(OH)2
KOH
Fe(OH)2
3)填表
Cu(OH)2
氢氧化镁
Fe(OH)3
氢氧化钾
氢氧化亚铁
1、溶液的酸碱性可用 检验:
紫色石蕊试液在酸性溶液中变 ,在碱性溶液中变 。
无色酚酞试液在酸性和溶液中 ,在碱性溶液中变 。
酸碱指示剂
红色
蓝色
不变色
红色
2.酸的定义是?从物质组成结构分析酸溶液为何都显酸性?
碱的定义是?从物质的组成结构分析碱溶液为何都显碱性?
氢氧化钠、氢氧化钙、盐酸、硫酸这四种溶
液的酸碱性如何?如何证明?
生活中因为胃酸过多而引起“泛酸”症状的病人,服用氢氧化镁或氢氧化铝等止酸剂。
蚊子和蚂蚁体内含有甲酸(也称蚁酸),被蚊子和
蚂蚁叮咬后,可以涂少许肥皂水或氨水止痒。为什么?
酸和碱能发生反应吗?
演示:
1.盐酸滴加到新制氢氧化铜中
2.盐酸溶液与氢氧化钠溶液混合
氢氧化钠与盐酸反应没有明显的现象。
蓝色沉淀溶解得到蓝色溶液
化学反应的现象:
沉淀溶解,生成气体,颜色变化 ,放出热量等
酸碱反应的探究
实验目的:
1、探究酸碱反应是吸热反应还是放热反应
2、探究酸碱反应过程中溶液的酸碱性变化情况
3、了解酸碱反应的产物
实验过程
步骤1:
在小烧杯中加入5mL10%NaOH稀溶液,插入1支温度计后,再加入5mL10%稀盐酸
记录与反思:
实验现象:温度计示数________
结论:____________________
增大
反应放热
步骤2:
在盛有5mL10%NaOH稀溶液的小烧杯中,滴加2滴无色酚酞试液,再逐滴加入10%稀盐酸,并用玻璃棒不断搅拌
记录与反思:
滴加无色酚酞试液前,溶液为______色
滴加无色酚酞试液后,溶液为______色
滴加10%稀盐酸后,溶液为______色
此实验中指示剂的作用是_______________
。
无
红
无
指示溶液酸碱性,帮助判断氢氧化钠与盐酸是否发生了反应。
步骤3:
将溶液转移至蒸发皿中加热,直至大部分水被蒸发,静置,冷却
记录与反思:
实验现象:蒸发后,__________从溶液中析出
实验结论: 。
白色固体
反应有新物质生成
写出上述反应的化学方程式:
NaOH+HCl → NaCl+H2O
HCl + NaOH → NaCl + H2O
反应原理
当胃液中过多的盐酸和止酸剂中氢氧化镁反应,生成了水和氯化镁,“泛酸”的症状消失了。请写出该反应的化学方程式:
2HCl +Mg(OH)2 → MgCl2 + 2H2O
由金属元素(或铵根)和酸根组成的化合物叫做盐
NaCl
MgCl2
课堂反馈:?
1.?下列物质之间的反应属于中和反应的是??(????)????
??A.?2NaOH+CO2 → Na2CO3+H2O?????
? B.?CaCO3+2HCl → CaCl2+H2O+CO2↑?
C.?Fe2O3+6HCl → 2FeCl3+3H20?????
? D.?2NaOH+H2SO4 → Na2SO4+2H2O??
??2、生成盐和水的反应一定属于中和反应吗?为什么????
?
?3、某公路上一装有硫酸的汽车翻了,怎么处理泼了一地的硫酸??
4、做完实验后剩余的酸性或碱性废液能否直接倒入下水道?应怎样处理?
5、正常人的头皮及毛发呈弱酸性,这可以保证我们的头皮不是太干燥,头发不易变脆、开叉。而我们用的洗发水一般呈弱碱性,护发素一般呈弱酸性,你认为正确的洗发程序是该是怎样的?为什么???
中和反应有许多应用
向土壤中撒熟石灰,可中和土壤酸性
Mg(OH)2、Al(OH)3可治疗胃酸过多
弱碱性的洗发液和弱酸性的护发液
中和反应应用:
①改良酸性土壤:熟石灰
②治疗胃酸过多:Al(OH)3、Mg(OH)2
③洗发液和护发液
④ 石油工业中利用氢氧化钠中和硫酸
巩固性练习四
在盛有氢氧化钠溶液的锥形瓶中滴加2~3滴酚酞试液,溶液由_____色变为_____色;插入一支温度计,测量温度;用胶头滴管逐滴滴加盐酸溶液,不断振荡,当溶液由_____色恰好变为_____色时,停止滴加盐酸,此时恰好完全反应。此过程中,发现温度______(填“升高”、“降低”或“不变”),说明中和反应是________反应(填“放热”或“吸热”)。写出其中的化学方程式________________________________。参加反应的物质的量之比为 。
无
红
红
无
升高
放热
HCl + NaOH → NaCl + H2O
1:1
1.中和反应的定义: 与 反应,生成
和 ,并放出 的反应,叫中和反应。
HCl + NaOH →( )+ ( )
HCl + Mg(OH)2 →( )+ ( )
2.中和反应的特点:反应过程中溶液 发生变化;产物中有 生成,放出 ;
3.生活中酸碱中和反应的应用:写出方程式
:熟石灰改良酸性土壤,中和废水中的酸
:氢氧化铝治疗胃酸过多
:用氢氧化钠精炼石油(中和其中的酸)
酸
碱
组成
组成
分类
分类
命名
命名
酸
碱
组成
组成
分类
分类
命名
命名
酸
碱
+
盐
水
+
中 和 反 应
诊断性练习
1、试管内附着不溶性碱,可用下列哪种物质洗去( )
A、NaOH B、NaCl C、HCl D、H2O
2、下列物质中,既是二元酸又是含氧酸的是( )
A、HCl B、H2SO4 C、H2O D、HNO3
3、下列各组物质的稀溶液,只能用酚酞试液及相互反
应就可鉴别出来的是( )
A、NaOH、NaCl、KOH
B、KOH、H2SO4、NaNO3
C、Ba(OH)2、NaCl、KCl
D、HNO3、H2SO4、NaNO3
A
B
B
4、用无色酚酞试液在宣纸上写字,晾干后涂上澄清石灰水,则宣纸上会出现____色的字迹。
5、硒元素具有抗衰老、抑制癌细胞的功能。它的化学性质与硫相似,元素符号为Se,对应的含氧酸的化学式为H2SeO4,这种酸应读作_______,其中Se化合价为_______。
红
硒酸
+6
在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
①方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)。
测定某NaOH溶液的pH,pH ___7(选填“大于”、“等于”或“小于”)。
将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH ,pH 小于7。
结论:稀H2SO4与NaOH溶液发生了化学反应,并且____过量。
②方案二:观察______________________________________。(根据图示实验步骤,概括方案要点)
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为_______________。
③上述两个方案在设计思想上的相同点是__________________。
④为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是___________(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度_______次。
6、用H、O、S、Ca四种元素,试组成下列各类物质(各举一例,用化学式表示):①金属氧化物________
②式量最小的氧化物________
③酸________
④碱________
盐 。
CaO
H2O
H2SO4、H2SO3、H2S
Ca(OH)2
硫酸
碳酸钙
盐酸
碳酸
氯化钠
硝酸钾、
氯酸钾
硝酸
碳酸钠
硫酸铜
氢氧化铝
氢氧化铜
氢氧化铁
氢氧化钠
氢氧化钙
我们已经知道,食醋呈____性,肥皂水和石灰水都呈____性。他们都是一些物质在水中的溶液,溶液有酸性和碱性之分。酸的溶液具有____性,碱的溶液具有____性。酸和碱是两类重要的化合物。
准备性练习
酸
酸
碱
碱
在日常生活中,我们会发现由许多种酸和碱就在我们身边,它们存在于食品、药品、家庭用品和大气中。还直接存在于我们的体内。
柑橘类水果——柠檬酸
在番茄汁中含有乙酸
乳类饮品中有乳酸
茶水中含有茶叶碱
生活中的酸和碱
在实验室中,经常接触的主要的酸有盐酸、硫酸、硝酸
常见的碱有氢氧化钠、氢氧化钙
酸和碱各有什么组成特征?
实验室中的酸和碱
酸
氢元素
酸根
碳酸(H2CO3)
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
一、酸的组成和分类
-2
CO3
-1
Cl
-2
SO4
碳酸根
盐酸根
硫酸根
+1
H、
+1
H
+1
H
1、酸的组成
-1
NO3
硝酸根
+1
H
HCl
H2S
H2SO4
HNO3
√
√
√
√
√
√
√
√
根据分子中含与酸根结合的氢原子数分类
根据分子中是否含有氧原子分类
一元酸
二元酸
含氧酸
无氧酸
分类方法一
分类方法二
含1个H原子
含2个H原子
含O原子
不含O原子
2、酸的分类
从不同角度对酸进行分类
是否含有氧原子
含氧酸:
无氧酸:
HNO3、 CH3COOH等
HCl、H2S等
按物质类别
有机酸:
无机酸:
HCOOH、 CH3COOH等
H2CO3、HCl等
根据分子中含与酸根结合的氢原子数分类
一元酸:
二元酸:
三元酸:
………
HCl、CH3COOH等
H2SO4、H2CO3等
H3PO4等
三、酸、碱的命名
酸
含氧酸:
无氧酸:
读作“某酸”
读作“氢某酸”
如H2SO4读作
如H2S读作
硫酸
氢硫酸
溶质为气体的无氧酸,溶质在溶于水之前称为某化某。
H2CO3
HCl
H2SO4
HNO3
CH3COOH
H3PO4
H2S
HCOOH
碱
金属元素
氢氧根
氢氧化钾(KOH)
氢氧化铜 [Cu(OH)2]
氢氧化铁 [Fe(OH)3]
-1
OH
+2
铜 Cu
+3
铁 Fe
-1
OH
-1
OH
+1
钾 K
1、碱的组成
二、碱的组成和分类
1)酸和碱都属于________(单质、化合物、混合物),酸由________和________组成,碱由________和________组成,有一种不含有金属元素的碱是_____________。
巩固性练习一
化合物
氢元素
酸根
金属元素
氢氧根
一水合氨
2)写出下列物质的化学式,并进行分类(酸或碱):
硝酸 氢氧化铜 乙酸
一水合氨 碳酸 氢氧化铁
HNO3
H2CO3
CH3COOH
NH3·H2O
Cu(OH)2
Fe(OH)3
NaOH
Cu(OH)2
Ca(OH)2
NH3·H2O
√
√
√
√
根据在水中的溶解性分类
可溶性碱
难溶性碱
分类方法
可以溶于水
难以溶于水
2、碱的分类
1)下列酸中属于无氧酸的是( )
A、碳酸 B、硫酸
C、盐酸 D、乙酸
2)下列四种碱,难溶于水的是( )
A、氢氧化钠 B、氢氧化钡
C、氢氧化铁 D、一水合氨
巩固性练习二
C
C
3)在H2SO4、HCl、H2CO3、HNO3 、 CH3COOH、H2S中,
属于有机酸的是________________,
属于一元无氧酸的是_______________,
属于二元含氧酸的是________________。
CH3COOH
HCl
H2SO4、H2CO3
从不同角度对碱进行分类
按含有氢氧根的个数
按在水中的溶解性
可溶性碱:
KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3·H2O等
难溶性碱:
Cu(OH)2、Fe(OH)3等
一元碱:
NaOH、NH3·H2O等
二元碱:
Ba(OH)2、 Cu(OH)2等
三元碱:
Fe(OH)3等
………
三、碱的命名
碱
读作“氢氧化某”
如Fe(OH)3读作
氢氧化铁
1)含氧酸一般命名为“________”,无氧酸命名为“________”。
2)在横线上填写适当的化学式、名称
硫酸______ H2SO3 _______ HNO3 _______
盐酸______ H2S ________
巩固性练习三
某酸
氢某酸
H2SO4
亚硫酸
硝酸
HCl
氢硫酸
判断正误:
①酸根都是原子团;
②酸和碱的组成中都含有氢元素;
③碱的组成中都含有金属元素。
名称
氢氧化铜
氢氧化铁
化学式
Mg(OH)2
KOH
Fe(OH)2
3)填表
Cu(OH)2
氢氧化镁
Fe(OH)3
氢氧化钾
氢氧化亚铁
1、溶液的酸碱性可用 检验:
紫色石蕊试液在酸性溶液中变 ,在碱性溶液中变 。
无色酚酞试液在酸性和溶液中 ,在碱性溶液中变 。
酸碱指示剂
红色
蓝色
不变色
红色
2.酸的定义是?从物质组成结构分析酸溶液为何都显酸性?
碱的定义是?从物质的组成结构分析碱溶液为何都显碱性?
氢氧化钠、氢氧化钙、盐酸、硫酸这四种溶
液的酸碱性如何?如何证明?
生活中因为胃酸过多而引起“泛酸”症状的病人,服用氢氧化镁或氢氧化铝等止酸剂。
蚊子和蚂蚁体内含有甲酸(也称蚁酸),被蚊子和
蚂蚁叮咬后,可以涂少许肥皂水或氨水止痒。为什么?
酸和碱能发生反应吗?
演示:
1.盐酸滴加到新制氢氧化铜中
2.盐酸溶液与氢氧化钠溶液混合
氢氧化钠与盐酸反应没有明显的现象。
蓝色沉淀溶解得到蓝色溶液
化学反应的现象:
沉淀溶解,生成气体,颜色变化 ,放出热量等
酸碱反应的探究
实验目的:
1、探究酸碱反应是吸热反应还是放热反应
2、探究酸碱反应过程中溶液的酸碱性变化情况
3、了解酸碱反应的产物
实验过程
步骤1:
在小烧杯中加入5mL10%NaOH稀溶液,插入1支温度计后,再加入5mL10%稀盐酸
记录与反思:
实验现象:温度计示数________
结论:____________________
增大
反应放热
步骤2:
在盛有5mL10%NaOH稀溶液的小烧杯中,滴加2滴无色酚酞试液,再逐滴加入10%稀盐酸,并用玻璃棒不断搅拌
记录与反思:
滴加无色酚酞试液前,溶液为______色
滴加无色酚酞试液后,溶液为______色
滴加10%稀盐酸后,溶液为______色
此实验中指示剂的作用是_______________
。
无
红
无
指示溶液酸碱性,帮助判断氢氧化钠与盐酸是否发生了反应。
步骤3:
将溶液转移至蒸发皿中加热,直至大部分水被蒸发,静置,冷却
记录与反思:
实验现象:蒸发后,__________从溶液中析出
实验结论: 。
白色固体
反应有新物质生成
写出上述反应的化学方程式:
NaOH+HCl → NaCl+H2O
HCl + NaOH → NaCl + H2O
反应原理
当胃液中过多的盐酸和止酸剂中氢氧化镁反应,生成了水和氯化镁,“泛酸”的症状消失了。请写出该反应的化学方程式:
2HCl +Mg(OH)2 → MgCl2 + 2H2O
由金属元素(或铵根)和酸根组成的化合物叫做盐
NaCl
MgCl2
课堂反馈:?
1.?下列物质之间的反应属于中和反应的是??(????)????
??A.?2NaOH+CO2 → Na2CO3+H2O?????
? B.?CaCO3+2HCl → CaCl2+H2O+CO2↑?
C.?Fe2O3+6HCl → 2FeCl3+3H20?????
? D.?2NaOH+H2SO4 → Na2SO4+2H2O??
??2、生成盐和水的反应一定属于中和反应吗?为什么????
?
?3、某公路上一装有硫酸的汽车翻了,怎么处理泼了一地的硫酸??
4、做完实验后剩余的酸性或碱性废液能否直接倒入下水道?应怎样处理?
5、正常人的头皮及毛发呈弱酸性,这可以保证我们的头皮不是太干燥,头发不易变脆、开叉。而我们用的洗发水一般呈弱碱性,护发素一般呈弱酸性,你认为正确的洗发程序是该是怎样的?为什么???
中和反应有许多应用
向土壤中撒熟石灰,可中和土壤酸性
Mg(OH)2、Al(OH)3可治疗胃酸过多
弱碱性的洗发液和弱酸性的护发液
中和反应应用:
①改良酸性土壤:熟石灰
②治疗胃酸过多:Al(OH)3、Mg(OH)2
③洗发液和护发液
④ 石油工业中利用氢氧化钠中和硫酸
巩固性练习四
在盛有氢氧化钠溶液的锥形瓶中滴加2~3滴酚酞试液,溶液由_____色变为_____色;插入一支温度计,测量温度;用胶头滴管逐滴滴加盐酸溶液,不断振荡,当溶液由_____色恰好变为_____色时,停止滴加盐酸,此时恰好完全反应。此过程中,发现温度______(填“升高”、“降低”或“不变”),说明中和反应是________反应(填“放热”或“吸热”)。写出其中的化学方程式________________________________。参加反应的物质的量之比为 。
无
红
红
无
升高
放热
HCl + NaOH → NaCl + H2O
1:1
1.中和反应的定义: 与 反应,生成
和 ,并放出 的反应,叫中和反应。
HCl + NaOH →( )+ ( )
HCl + Mg(OH)2 →( )+ ( )
2.中和反应的特点:反应过程中溶液 发生变化;产物中有 生成,放出 ;
3.生活中酸碱中和反应的应用:写出方程式
:熟石灰改良酸性土壤,中和废水中的酸
:氢氧化铝治疗胃酸过多
:用氢氧化钠精炼石油(中和其中的酸)
酸
碱
组成
组成
分类
分类
命名
命名
酸
碱
组成
组成
分类
分类
命名
命名
酸
碱
+
盐
水
+
中 和 反 应
诊断性练习
1、试管内附着不溶性碱,可用下列哪种物质洗去( )
A、NaOH B、NaCl C、HCl D、H2O
2、下列物质中,既是二元酸又是含氧酸的是( )
A、HCl B、H2SO4 C、H2O D、HNO3
3、下列各组物质的稀溶液,只能用酚酞试液及相互反
应就可鉴别出来的是( )
A、NaOH、NaCl、KOH
B、KOH、H2SO4、NaNO3
C、Ba(OH)2、NaCl、KCl
D、HNO3、H2SO4、NaNO3
A
B
B
4、用无色酚酞试液在宣纸上写字,晾干后涂上澄清石灰水,则宣纸上会出现____色的字迹。
5、硒元素具有抗衰老、抑制癌细胞的功能。它的化学性质与硫相似,元素符号为Se,对应的含氧酸的化学式为H2SeO4,这种酸应读作_______,其中Se化合价为_______。
红
硒酸
+6
在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
①方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)。
测定某NaOH溶液的pH,pH ___7(选填“大于”、“等于”或“小于”)。
将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH ,pH 小于7。
结论:稀H2SO4与NaOH溶液发生了化学反应,并且____过量。
②方案二:观察______________________________________。(根据图示实验步骤,概括方案要点)
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为_______________。
③上述两个方案在设计思想上的相同点是__________________。
④为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是___________(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度_______次。
6、用H、O、S、Ca四种元素,试组成下列各类物质(各举一例,用化学式表示):①金属氧化物________
②式量最小的氧化物________
③酸________
④碱________
盐 。
CaO
H2O
H2SO4、H2SO3、H2S
Ca(OH)2
硫酸
碳酸钙
盐酸
碳酸
氯化钠
硝酸钾、
氯酸钾
硝酸
碳酸钠
硫酸铜
氢氧化铝
氢氧化铜
氢氧化铁
氢氧化钠
氢氧化钙
