沪教版(上海)初中化学九年级下册 5.2.1 稀酸的化学性质 课件(24张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级下册 5.2.1 稀酸的化学性质 课件(24张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 15:18:55 | ||
图片预览







文档简介
浓盐酸的特性
浓硫酸的特性
无色 气味的液体,有 性,
在空气中易形成 .
密度
无色 味的油状液体,有强 性、
性,溶于水中 热。
密度
刺激性
挥发性
白雾
无
吸水
脱水
放
1.19g/mL
(炭化)
1
实验室有一瓶标签部分破损的浓?酸,不知是浓盐酸还是浓硫酸,你能用什么方法进行检验?
1.84g/mL
伟大领袖毛主席在这一哲学思想领域有一个精髓的概念是:
辩证法:
对立统一的规律是一个普遍规律。
浓盐酸的特性
浓硫酸的特性
无色 气味的液体,有 性,
在空气中易形成 .
密度
无色 味的油状液体,有强 性、
性,溶于水中 热。
密度
刺激性
挥发性
白雾
无
吸水
脱水
放
1.19g/mL
(炭化)
1.84g/mL
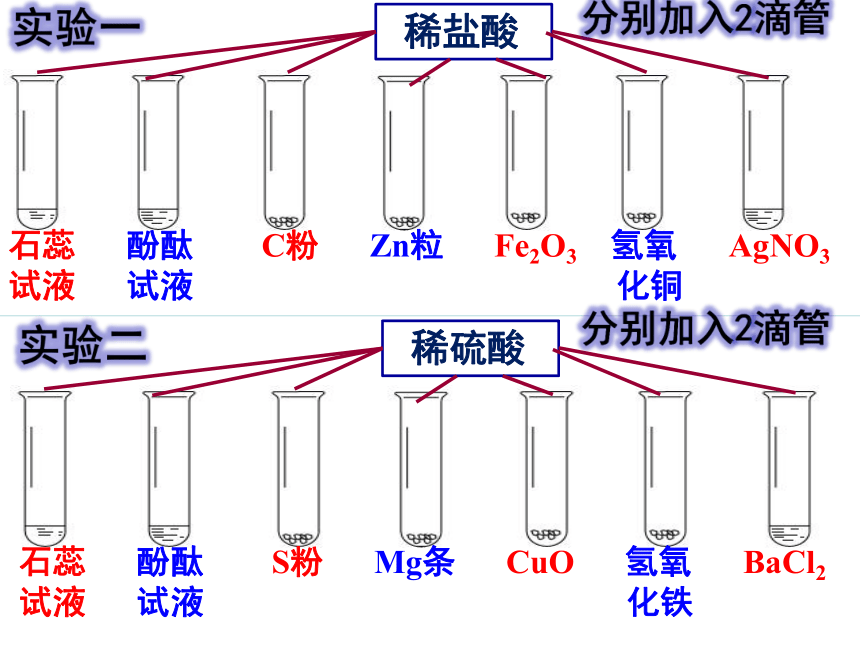
稀盐酸
石蕊 酚酞 C粉 Zn粒 Fe2O3 氢氧 AgNO3
试液 试液 化铜
稀硫酸
石蕊 酚酞 S粉 Mg条 CuO 氢氧 BaCl2
试液 试液 化铁
试管内物质
与盐酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
C粉
Zn
Fe2O3
Cu(OH)2
AgNO3
稀盐酸的化学性质研究
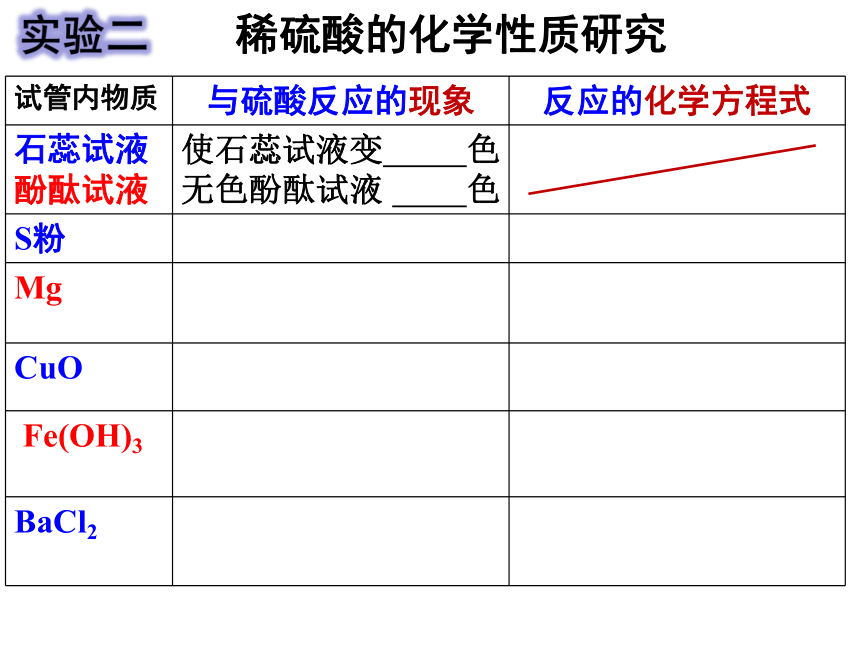
试管内物质
与硫酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
S粉
Mg
CuO
Fe(OH)3
BaCl2
稀硫酸的化学性质研究
稀盐酸
石蕊 酚酞 C粉 Zn粒 Fe2O3 氢氧 AgNO3
试液 试液 化铜
稀硫酸
石蕊 酚酞 S粉 Mg条 CuO 氢氧 BaCl2
试液 试液 化铁
试管内物质
与盐酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
C粉
Zn
Fe2O3
Cu(OH)2
AgNO3
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl +HNO3
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
稀盐酸的化学性质研究
检验稀盐酸
产生气泡
固体溶解,溶液变棕黄色。
固体溶解,溶液变蓝色。
产生白色沉淀
产生不溶于稀硝酸的白色沉淀
↓
CO2 + Ca(OH)2 → CaCO3 + H2O
↓
白色沉淀
CaCO3+ HCl →CaCl2+H2O+CO2
2
↑
试管内物质
与硫酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
S粉
Mg
CuO
Fe(OH)3
BaCl2
红
不变
Mg+H2SO4→
MgSO4+H2 ↑
BaCl2+H2SO4 →
BaSO4 + HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
稀硫酸的化学性质研究
检验稀硫酸
产生气泡
固体溶解,溶液变棕黄色。
固体溶解,溶液变蓝色
产生白色沉淀
产生不溶于稀硝酸的白色沉淀
↓
试管内物质
与盐酸反应的化学方程式
与硫酸反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
使石蕊试液变 色
无色酚酞试液 色
C粉 S粉
Zn
Mg
Fe2O3 CuO
Cu(OH)2
Fe(OH)3
AgNO3
BaCl2
红
红
不变
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl ↓ +HNO3
BaCl2+H2SO4 →
BaSO4 ↓ + HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
稀盐酸、稀硫酸的化学性质比较
检验稀盐酸
检验稀硫酸
共性
物质
类别
酸碱
指示剂
物质的分类
物质
纯净物
混合物
单 质
化合物
金属单质
非金属单质
酸
氧化物
碱
盐
多种物质组成
一种物质组成
一种元素组成的纯净物
多种元素组成的纯净物
物质类别
与盐酸反应的化学方程式
与硫酸反应的化学方程式
使石蕊试液变 色
无色酚酞试液 色
使石蕊试液变 色
无色酚酞试液 色
红
红
不变
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl ↓ +HNO3
BaCl2+H2SO4 →
BaSO4 ↓ + HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
检验稀盐酸
检验稀硫酸
石蕊试液
酚酞试液
C粉 S粉
Zn
Mg
Fe2O3
CuO
Cu(OH)2
Fe(OH)3
AgNO3
BaCl2
酸碱
指示剂
金属
单质
非金属单质
氧化物
碱
盐
稀盐酸、稀硫酸的共性
酸的通性
酸的通性
与盐酸、硫酸的反应
使石蕊试液变 色
无色酚酞试液 色
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl↓+HNO3
BaCl2+H2SO4 →
BaSO4 ↓+ HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
归纳:酸的通性
1.跟酸碱指示剂作用
2.酸+金属→
盐+氢气
3.酸+金属氧化物→
盐+水
4.酸+碱→
盐+水
5.酸+盐→
新酸+新盐
(中和反应)
碱性
穿越迷宫
小羊(指盐酸)要穿过一个险恶的迷宫,迷宫里有一些能与盐酸反应的狼会把小羊吃掉。小羊选择哪条路才不会羊入狼口,使盐酸安全走出迷宫呢?
HCl
C
CO2
NaCl
Fe2O3
Fe
S
CO2
H2SO4
NaCl
S
NaOH
H2SO4
CO2
NaCl
CaCO3
H2SO4
NaCl
C
CO2
H2SO4
入口
出口
小羊选择哪条路才不会羊入狼口呢?
并找出其他几条路中谁是狼?
酸的通性
与盐酸、硫酸的反应
使石蕊试液变 色
无色酚酞试液 色
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl↓+HNO3
BaCl2+H2SO4 →
BaSO4 ↓+ HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
归纳:酸的通性
1.跟酸碱指示剂作用
2.酸+金属→
盐+氢气
3.酸+金属氧化物→
盐+水
4.酸+碱→
盐+水
5.酸+盐→
新酸+新盐
(中和反应)
碱性
酸的通性
与盐酸、硫酸的反应
使石蕊试液变 色
无色酚酞试液 色
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl↓+HNO3
BaCl2+H2SO4 →
BaSO4 ↓+ HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
1.跟酸碱指示剂作用
2.酸+金属→
盐+氢气
3.酸+金属氧化物→
盐+水
4.酸+碱→
盐+水
5.酸+盐→
新酸+新盐
(中和反应)
碱性
食醋
食醋
(CH3COO)3Al+ H2↑
Al+ CH3COOH→
2
6
2
3
(CH3COO)2Fe+ H2↑
Fe + CH3COOH→
2
后果一:容器被腐蚀
后果二:醋酸变质;
后果三:生成的铝盐如果被人长期服用,
就会对人的大脑造成伤害,容易
得老年痴呆症。
,也就是漏了;
+2价的铁元素是组成血红蛋白的主要成分。
世界卫生组织经过严密的科学分析,认为中国的铁锅是最理想的炊具,并向全世界大力推广,其主要原因是( )
A.坚硬、耐用不易破损
B.烹饪食物中留有铁元素
C.铁制品杀菌能力强
D.传热、保温性能较好
B
市售的补血麦片中常含有微量的细小铁粉,铁粉与胃液中的盐酸反应转化为易被人体吸收的亚铁盐,其反应的化学方程式是_______________________。
Fe+ HCl→
这种麦片必须真空保存,原因是Fe在潮湿的空气中易生锈,被氧气氧化成不被人体吸收的+3价Fe的氧化物,其反应的化学方程式是_____________________。
Fe + O2 →
FeCl2+H2↑
2
Fe2O3
2
3
4
加入约5ml稀盐酸(或稀硫酸)
实验步骤
实验现象
化学方程式
在放有生锈铁钉的烧杯中,加入过量稀盐酸(或稀硫酸)。
铁钉上的铁锈逐渐____,溶液由无色变成________,过一会儿看到铁钉表面有________。
用稀酸溶液除铁锈
消失
棕黄色
气泡
Fe2O3+ HCl →
6
3
2
FeCl3+ H2O
2
FeCl2+H2↑
Fe+ HCl→
Fe2(SO4)3+ H2O
3
3
Fe2O3+ H2SO4 →
Fe+H2SO4→
FeSO4+H2 ↑
盐酸的性质
盐酸的用途
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
用于金属表面除锈
Zn+ HCl→
ZnCl2+H2↑
2
用于实验室制氢气
人体胃液中的盐酸,可帮助消化。
FeCl2+H2↑
Fe+ HCl→
2
CaCO3+2HCl→CaCl2+H2O+CO2↑
制造药物(如盐酸麻黄素、氯化锌)等
ZnO+2HCl→ ZnCl2+H2O
Zn(OH) 2+2HCl→ZnCl2+2H2O
盐酸的性质
盐酸的用途
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
用于金属表面除锈
Zn+ HCl→
ZnCl2+H2↑
2
用于实验室制氢气
人体胃液中的盐酸,可帮助消化。
FeCl2+H2↑
Fe+ HCl→
2
CaCO3+2HCl→CaCl2+H2O+CO2↑
制造药物(如盐酸麻黄素、氯化锌)等
ZnO+2HCl→ ZnCl2+H2O
Zn(OH) 2+2HCl→ZnCl2+2H2O
硫酸的性质
硫酸的用途
用于金属表面除锈
用于实验室制氢气
用于生产化肥、农药(如硫酸铜可作植物的杀菌剂)等。
Fe2O3+3H2SO4 →Fe2(SO4)3+3H2O
Zn+H2SO4→ZnSO4+H2 ↑
CuO+H2SO4 →CuSO4+H2O
Cu(OH)2 +H2SO4 →CuSO4+2H2O
浓硫酸的特性
无色 气味的液体,有 性,
在空气中易形成 .
密度
无色 味的油状液体,有强 性、
性,溶于水中 热。
密度
刺激性
挥发性
白雾
无
吸水
脱水
放
1.19g/mL
(炭化)
1
实验室有一瓶标签部分破损的浓?酸,不知是浓盐酸还是浓硫酸,你能用什么方法进行检验?
1.84g/mL
伟大领袖毛主席在这一哲学思想领域有一个精髓的概念是:
辩证法:
对立统一的规律是一个普遍规律。
浓盐酸的特性
浓硫酸的特性
无色 气味的液体,有 性,
在空气中易形成 .
密度
无色 味的油状液体,有强 性、
性,溶于水中 热。
密度
刺激性
挥发性
白雾
无
吸水
脱水
放
1.19g/mL
(炭化)
1.84g/mL
稀盐酸
石蕊 酚酞 C粉 Zn粒 Fe2O3 氢氧 AgNO3
试液 试液 化铜
稀硫酸
石蕊 酚酞 S粉 Mg条 CuO 氢氧 BaCl2
试液 试液 化铁
试管内物质
与盐酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
C粉
Zn
Fe2O3
Cu(OH)2
AgNO3
稀盐酸的化学性质研究
试管内物质
与硫酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
S粉
Mg
CuO
Fe(OH)3
BaCl2
稀硫酸的化学性质研究
稀盐酸
石蕊 酚酞 C粉 Zn粒 Fe2O3 氢氧 AgNO3
试液 试液 化铜
稀硫酸
石蕊 酚酞 S粉 Mg条 CuO 氢氧 BaCl2
试液 试液 化铁
试管内物质
与盐酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
C粉
Zn
Fe2O3
Cu(OH)2
AgNO3
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl +HNO3
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
稀盐酸的化学性质研究
检验稀盐酸
产生气泡
固体溶解,溶液变棕黄色。
固体溶解,溶液变蓝色。
产生白色沉淀
产生不溶于稀硝酸的白色沉淀
↓
CO2 + Ca(OH)2 → CaCO3 + H2O
↓
白色沉淀
CaCO3+ HCl →CaCl2+H2O+CO2
2
↑
试管内物质
与硫酸反应的现象
反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
S粉
Mg
CuO
Fe(OH)3
BaCl2
红
不变
Mg+H2SO4→
MgSO4+H2 ↑
BaCl2+H2SO4 →
BaSO4 + HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
稀硫酸的化学性质研究
检验稀硫酸
产生气泡
固体溶解,溶液变棕黄色。
固体溶解,溶液变蓝色
产生白色沉淀
产生不溶于稀硝酸的白色沉淀
↓
试管内物质
与盐酸反应的化学方程式
与硫酸反应的化学方程式
石蕊试液
酚酞试液
使石蕊试液变 色
无色酚酞试液 色
使石蕊试液变 色
无色酚酞试液 色
C粉 S粉
Zn
Mg
Fe2O3 CuO
Cu(OH)2
Fe(OH)3
AgNO3
BaCl2
红
红
不变
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl ↓ +HNO3
BaCl2+H2SO4 →
BaSO4 ↓ + HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
稀盐酸、稀硫酸的化学性质比较
检验稀盐酸
检验稀硫酸
共性
物质
类别
酸碱
指示剂
物质的分类
物质
纯净物
混合物
单 质
化合物
金属单质
非金属单质
酸
氧化物
碱
盐
多种物质组成
一种物质组成
一种元素组成的纯净物
多种元素组成的纯净物
物质类别
与盐酸反应的化学方程式
与硫酸反应的化学方程式
使石蕊试液变 色
无色酚酞试液 色
使石蕊试液变 色
无色酚酞试液 色
红
红
不变
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl ↓ +HNO3
BaCl2+H2SO4 →
BaSO4 ↓ + HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
检验稀盐酸
检验稀硫酸
石蕊试液
酚酞试液
C粉 S粉
Zn
Mg
Fe2O3
CuO
Cu(OH)2
Fe(OH)3
AgNO3
BaCl2
酸碱
指示剂
金属
单质
非金属单质
氧化物
碱
盐
稀盐酸、稀硫酸的共性
酸的通性
酸的通性
与盐酸、硫酸的反应
使石蕊试液变 色
无色酚酞试液 色
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl↓+HNO3
BaCl2+H2SO4 →
BaSO4 ↓+ HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
归纳:酸的通性
1.跟酸碱指示剂作用
2.酸+金属→
盐+氢气
3.酸+金属氧化物→
盐+水
4.酸+碱→
盐+水
5.酸+盐→
新酸+新盐
(中和反应)
碱性
穿越迷宫
小羊(指盐酸)要穿过一个险恶的迷宫,迷宫里有一些能与盐酸反应的狼会把小羊吃掉。小羊选择哪条路才不会羊入狼口,使盐酸安全走出迷宫呢?
HCl
C
CO2
NaCl
Fe2O3
Fe
S
CO2
H2SO4
NaCl
S
NaOH
H2SO4
CO2
NaCl
CaCO3
H2SO4
NaCl
C
CO2
H2SO4
入口
出口
小羊选择哪条路才不会羊入狼口呢?
并找出其他几条路中谁是狼?
酸的通性
与盐酸、硫酸的反应
使石蕊试液变 色
无色酚酞试液 色
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl↓+HNO3
BaCl2+H2SO4 →
BaSO4 ↓+ HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
归纳:酸的通性
1.跟酸碱指示剂作用
2.酸+金属→
盐+氢气
3.酸+金属氧化物→
盐+水
4.酸+碱→
盐+水
5.酸+盐→
新酸+新盐
(中和反应)
碱性
酸的通性
与盐酸、硫酸的反应
使石蕊试液变 色
无色酚酞试液 色
红
不变
Zn+ HCl→
ZnCl2+H2↑
2
Mg+H2SO4→
MgSO4+H2 ↑
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
AgNO3+HCl →
AgCl↓+HNO3
BaCl2+H2SO4 →
BaSO4 ↓+ HCl
2
CuO+H2SO4 →
CuSO4+H2O
Fe(OH)3+ H2SO4→
Fe2(SO4)3+ H2O
2
3
6
Cu(OH)2+ HCl →
CuCl2+ H2O
2
2
1.跟酸碱指示剂作用
2.酸+金属→
盐+氢气
3.酸+金属氧化物→
盐+水
4.酸+碱→
盐+水
5.酸+盐→
新酸+新盐
(中和反应)
碱性
食醋
食醋
(CH3COO)3Al+ H2↑
Al+ CH3COOH→
2
6
2
3
(CH3COO)2Fe+ H2↑
Fe + CH3COOH→
2
后果一:容器被腐蚀
后果二:醋酸变质;
后果三:生成的铝盐如果被人长期服用,
就会对人的大脑造成伤害,容易
得老年痴呆症。
,也就是漏了;
+2价的铁元素是组成血红蛋白的主要成分。
世界卫生组织经过严密的科学分析,认为中国的铁锅是最理想的炊具,并向全世界大力推广,其主要原因是( )
A.坚硬、耐用不易破损
B.烹饪食物中留有铁元素
C.铁制品杀菌能力强
D.传热、保温性能较好
B
市售的补血麦片中常含有微量的细小铁粉,铁粉与胃液中的盐酸反应转化为易被人体吸收的亚铁盐,其反应的化学方程式是_______________________。
Fe+ HCl→
这种麦片必须真空保存,原因是Fe在潮湿的空气中易生锈,被氧气氧化成不被人体吸收的+3价Fe的氧化物,其反应的化学方程式是_____________________。
Fe + O2 →
FeCl2+H2↑
2
Fe2O3
2
3
4
加入约5ml稀盐酸(或稀硫酸)
实验步骤
实验现象
化学方程式
在放有生锈铁钉的烧杯中,加入过量稀盐酸(或稀硫酸)。
铁钉上的铁锈逐渐____,溶液由无色变成________,过一会儿看到铁钉表面有________。
用稀酸溶液除铁锈
消失
棕黄色
气泡
Fe2O3+ HCl →
6
3
2
FeCl3+ H2O
2
FeCl2+H2↑
Fe+ HCl→
Fe2(SO4)3+ H2O
3
3
Fe2O3+ H2SO4 →
Fe+H2SO4→
FeSO4+H2 ↑
盐酸的性质
盐酸的用途
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
用于金属表面除锈
Zn+ HCl→
ZnCl2+H2↑
2
用于实验室制氢气
人体胃液中的盐酸,可帮助消化。
FeCl2+H2↑
Fe+ HCl→
2
CaCO3+2HCl→CaCl2+H2O+CO2↑
制造药物(如盐酸麻黄素、氯化锌)等
ZnO+2HCl→ ZnCl2+H2O
Zn(OH) 2+2HCl→ZnCl2+2H2O
盐酸的性质
盐酸的用途
Fe2O3+ HCl →
FeCl3+ H2O
6
2
3
用于金属表面除锈
Zn+ HCl→
ZnCl2+H2↑
2
用于实验室制氢气
人体胃液中的盐酸,可帮助消化。
FeCl2+H2↑
Fe+ HCl→
2
CaCO3+2HCl→CaCl2+H2O+CO2↑
制造药物(如盐酸麻黄素、氯化锌)等
ZnO+2HCl→ ZnCl2+H2O
Zn(OH) 2+2HCl→ZnCl2+2H2O
硫酸的性质
硫酸的用途
用于金属表面除锈
用于实验室制氢气
用于生产化肥、农药(如硫酸铜可作植物的杀菌剂)等。
Fe2O3+3H2SO4 →Fe2(SO4)3+3H2O
Zn+H2SO4→ZnSO4+H2 ↑
CuO+H2SO4 →CuSO4+H2O
Cu(OH)2 +H2SO4 →CuSO4+2H2O
