沪教版(上海)初中化学九年级下册 6.1 奇光异彩的金属 金属的化学性质 课件(23张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级下册 6.1 奇光异彩的金属 金属的化学性质 课件(23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 842.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 21:08:23 | ||
图片预览








文档简介
金属的化学性质
1、与氧气的反应
点燃
3Fe + 2O2 Fe3O4
点燃
2Mg+ O2 2MgO
Cu + O2
△
2CuO
2
大多数金属元素以化合态存在,金以游离态存在。
大多数金属都能与氧气反 应,但反应的难易和剧烈程度不同。
镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应, 但在高温时能与氧气反应。
金即使在高温时也不能与氧气反应。(真金不怕火炼)
活动性:镁、铝 > 铁、铜 > 金
(1)铝在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?
金属在常温下发生缓慢氧化:4Al+3O2?2Al2O3;
形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
(2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
思考:
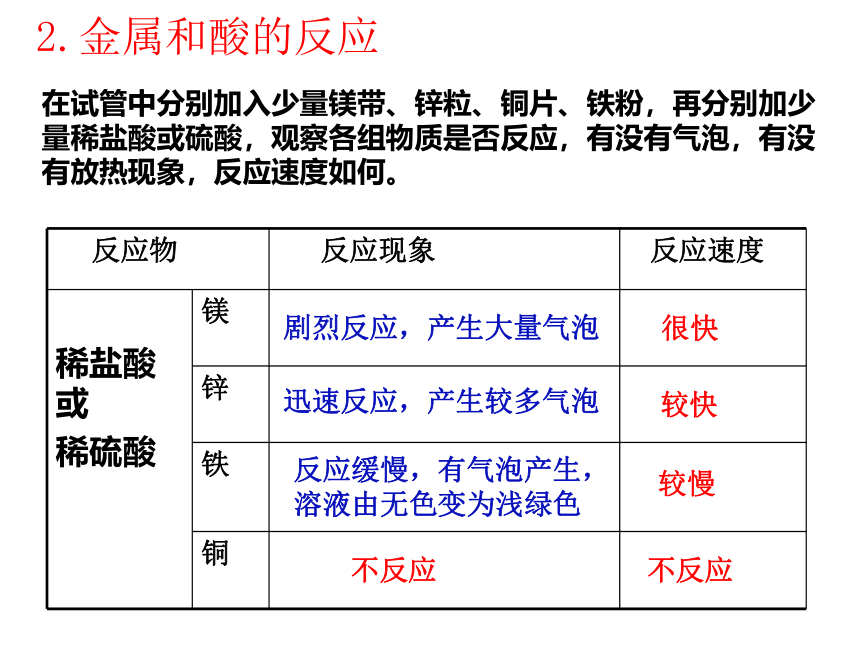
2.金属和酸的反应
在试管中分别加入少量镁带、锌粒、铜片、铁粉,再分别加少量稀盐酸或硫酸,观察各组物质是否反应,有没有气泡,有没有放热现象,反应速度如何。
反应物
反应现象
反应速度
稀盐酸或
稀硫酸
镁
锌
铁
铜
很快
较快
较慢
不反应
剧烈反应,产生大量气泡
迅速反应,产生较多气泡
反应缓慢,有气泡产生,溶液由无色变为浅绿色
不反应
铁钉和稀盐酸
镁和稀盐酸
锌和稀盐酸
铜片和稀盐酸
由此推出 ,金属活动性顺序:__________________
铁、镁、锌能和稀盐酸或稀硫酸反应时剧烈程度不同。____反应最剧烈,其次是 _____,然后是_____
镁
锌
铁
Mg > Zn > Fe > Cu
Mg + 2 HCl → MgCl2 + H2 ↑
Mg + H2SO4 → MgSO4 + H2 ↑
Zn + 2HCl → ZnCl2 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
单质 化合物 化合物 单质
置换反应:
由一种单质跟一种化合物发生反应,生成另一种单质和另一种化合物的反应。
【练习】
写出铁、铝与稀盐酸、稀硫酸反应的化学方程式。
Fe + H2SO4 ? FeSO4 + H2 ↑
Fe + 2HCl ? FeCl2 + H2 ↑
化学反应的基本类型
化合反应:A + B → AB
分解反应:AB →A + B
置换反应:A +BC →AC + B
指出下列反应的基本类型
2Mg + O2 2MgO
点燃
CuO + H2 Cu+H2O
加热
CaCO3 CaO+CO2
高温
2CuO + C 2Cu+CO2
高温
CuO+CO Cu+CO2
2Al+6HCl 2AlCl3+3H2
(化合)
(置换)
(分解)
(置换)
(置换)
【练习】
加热
活动性:
Mg > Zn > Fe >(H)> Cu
注:比较金属活动性的方法之一:
将金属放入同浓度同体积的稀盐酸或稀硫酸中
1、是否反应
2、反应剧烈程度
若反应:H前金属
若不反应:H后金属
通过上述实验,能否判断出Fe、Zn、Mg、Cu的活动性顺序?
铁丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
3、与盐溶液的反应
Fe + CuSO4 FeSO4 + Cu
Cu + 2AgNO3 Cu(NO3)2 + 2Ag
现象:铁钉表面有红色物质生成,
蓝色溶液变成浅绿色。
现象:铜丝表面覆盖一层银白色的银,
溶液由无色逐渐变成蓝色
金属活动性: Fe > Cu
金属活动性: Cu > Ag
金属活动性顺序及其应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
?
?
强 金属活动性由强逐渐减弱 弱
一、判断金属的活动性强弱。
在金属活动性顺序中,金属的位置越靠前,
它的活动性越强。
金属活动性顺序
主要应用
H 前金属为活泼金属,H 后金属为不活泼金属。
二、判断金属跟酸能否发生置换反应及其反应的快慢
A、排在氢前面的金属才能置换酸中的氢。
B、酸指盐酸和稀硫酸,不能用浓硫酸,硝酸。
C、生成的盐必须是可溶的。
1、反应条件:
金属(H前) + 酸(除HNO3,浓H2SO4) 盐 + H2
D、Fe反应只能生成亚铁(+2)盐。
三、判断金属跟盐溶液能否发生置换反应。
反应条件:
1.单质金属要排在盐中金属元素前面。
2.反应物之一盐必须是可溶性,即是溶液。
3.K Ca Na除外。
金属(前)+盐(可溶) 金属(后)+盐
4. Fe反应只能生成亚铁(+2)盐。
①与氧气反应
②活泼金属 + 酸 → 盐 + 氢气
条件 活泼金属:
酸:
③金属 + 盐→ 新金属 + 新盐
条件 金属:
盐:
总结:金属的化学性质
H前金属
稀盐酸、稀硫酸
不能为浓硫酸、硝酸
前置换后(除K、Ca、Na)
可溶
例1.下列化学方程式正确的是( )
A.Cu+2HCl?CuCl2+H2
B.2Fe+6HCl?2FeCl3+3H2
C.Zn+2HNO3 ? Zn(NO3)2+H2
D.Mg+H2SO4(稀)?MgSO4+H2
D
例2:不能由金属跟稀硫酸直接反应制得的物质是( )
MgSO4 B. FeSO4
C. CuSO4 D. Al2(SO4)3
C
例4:将锌片投入下列盐溶液反应后, 使溶液质量减轻的是( )
A. MgCl2
B. CuCl2
C. Hg (NO3)2
D. Al(NO3)3
C
例5.下列化学方程式正确的是( )
A.Cu+FeSO4 ? CuSO4+Fe B.Zn+Mg(NO3)2 ? Zn(NO3)2+Mg
C.Mg+CuSO4? MgSO4+Cu
D. Cu+2AgCl ? CuCl2+2Ag
C
例1.有A,B,C三种金属,只有C不与盐酸反应,B可以从A的盐溶液中置换出A,它们的活动性由强到弱的排列顺序是_______________
B>A>C
结论:用金属A置换金属B,若能反应,则A的活动性大于B,反之则小。
例2.要验证锌、铁、铜三种金属的活动性顺序,可选用下列哪组试剂( )
A. Cu,FeCl2,ZnCl2 B. Fe,CuSO4,ZnSO4
C. Fe,Cu,ZnCl2 D .Zn,Cu,FeSO4
B D
常用方法:(1)前、后金属,中间金属盐溶液
(2)中间金属,前后金属盐溶液
1、下列关于置换反应的说法错误的是( )
A、锌能够把硫酸中的氢气置换出来
B、置换反应生成物中只有两种物质
C、置换反应中生成物中一定有化合物
D、置换反应中反应物中一定有单质
巩固练习
A
2、下列金属放在足量同浓度、同质量的稀硫酸中,反应速度最快的是( )
A、铜片 B、镁片
C、锌片 D、铁片
3、相同质量的Mg、Fe跟足量盐酸反应,产生H2最多的是( )
A、一样多 B、Mg
C、Fe D、无法判断
B
B
4、相同物质的量的Fe、Zn跟足量盐酸反应,产生H2最多的是( )
A、一样多 B、Zn
C、 Fe D、无法判断
5、足量的铁、锌分别和质量相同、浓度相同的硫酸反应,产生氢气的质量是( )
A、一样多 B、铁最多
C、锌最多 D、无法判断
A
A
7、化学方程式书写正确的是( )
A、Fe + HCl → FeCl3 + H2↑
B、Zn + H2SO4 → ZnSO4 + H2↑
C、C + O2 → CO2
D、NaOH +H2SO4 → NaSO4 +H2O
B
8、下列溶液不能由金属与盐酸直接反应制得的是( )
A、 FeCl3溶液 B、ZnCl2溶液
C、 MgCl2溶液 D、FeCl2溶液
9、往5.6克混有少量铜粉的铁粉中加入足量硫酸,产生的H2的物质的量是( )
A、等于0.1mol B、小于0.1mol
C、大于0.1mol D、 无法确定
B
A
1、与氧气的反应
点燃
3Fe + 2O2 Fe3O4
点燃
2Mg+ O2 2MgO
Cu + O2
△
2CuO
2
大多数金属元素以化合态存在,金以游离态存在。
大多数金属都能与氧气反 应,但反应的难易和剧烈程度不同。
镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应, 但在高温时能与氧气反应。
金即使在高温时也不能与氧气反应。(真金不怕火炼)
活动性:镁、铝 > 铁、铜 > 金
(1)铝在常温下能与氧气反应,那么我们用的铝制餐具是怎么回事呢?
金属在常温下发生缓慢氧化:4Al+3O2?2Al2O3;
形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。
(2)为何不宜用钢刷来擦洗铝制餐具呢?
若用钢刷擦洗铝制品,容易把氧化薄膜除掉,从而起不到保护作用。
思考:
2.金属和酸的反应
在试管中分别加入少量镁带、锌粒、铜片、铁粉,再分别加少量稀盐酸或硫酸,观察各组物质是否反应,有没有气泡,有没有放热现象,反应速度如何。
反应物
反应现象
反应速度
稀盐酸或
稀硫酸
镁
锌
铁
铜
很快
较快
较慢
不反应
剧烈反应,产生大量气泡
迅速反应,产生较多气泡
反应缓慢,有气泡产生,溶液由无色变为浅绿色
不反应
铁钉和稀盐酸
镁和稀盐酸
锌和稀盐酸
铜片和稀盐酸
由此推出 ,金属活动性顺序:__________________
铁、镁、锌能和稀盐酸或稀硫酸反应时剧烈程度不同。____反应最剧烈,其次是 _____,然后是_____
镁
锌
铁
Mg > Zn > Fe > Cu
Mg + 2 HCl → MgCl2 + H2 ↑
Mg + H2SO4 → MgSO4 + H2 ↑
Zn + 2HCl → ZnCl2 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
单质 化合物 化合物 单质
置换反应:
由一种单质跟一种化合物发生反应,生成另一种单质和另一种化合物的反应。
【练习】
写出铁、铝与稀盐酸、稀硫酸反应的化学方程式。
Fe + H2SO4 ? FeSO4 + H2 ↑
Fe + 2HCl ? FeCl2 + H2 ↑
化学反应的基本类型
化合反应:A + B → AB
分解反应:AB →A + B
置换反应:A +BC →AC + B
指出下列反应的基本类型
2Mg + O2 2MgO
点燃
CuO + H2 Cu+H2O
加热
CaCO3 CaO+CO2
高温
2CuO + C 2Cu+CO2
高温
CuO+CO Cu+CO2
2Al+6HCl 2AlCl3+3H2
(化合)
(置换)
(分解)
(置换)
(置换)
【练习】
加热
活动性:
Mg > Zn > Fe >(H)> Cu
注:比较金属活动性的方法之一:
将金属放入同浓度同体积的稀盐酸或稀硫酸中
1、是否反应
2、反应剧烈程度
若反应:H前金属
若不反应:H后金属
通过上述实验,能否判断出Fe、Zn、Mg、Cu的活动性顺序?
铁丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
3、与盐溶液的反应
Fe + CuSO4 FeSO4 + Cu
Cu + 2AgNO3 Cu(NO3)2 + 2Ag
现象:铁钉表面有红色物质生成,
蓝色溶液变成浅绿色。
现象:铜丝表面覆盖一层银白色的银,
溶液由无色逐渐变成蓝色
金属活动性: Fe > Cu
金属活动性: Cu > Ag
金属活动性顺序及其应用
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
?
?
强 金属活动性由强逐渐减弱 弱
一、判断金属的活动性强弱。
在金属活动性顺序中,金属的位置越靠前,
它的活动性越强。
金属活动性顺序
主要应用
H 前金属为活泼金属,H 后金属为不活泼金属。
二、判断金属跟酸能否发生置换反应及其反应的快慢
A、排在氢前面的金属才能置换酸中的氢。
B、酸指盐酸和稀硫酸,不能用浓硫酸,硝酸。
C、生成的盐必须是可溶的。
1、反应条件:
金属(H前) + 酸(除HNO3,浓H2SO4) 盐 + H2
D、Fe反应只能生成亚铁(+2)盐。
三、判断金属跟盐溶液能否发生置换反应。
反应条件:
1.单质金属要排在盐中金属元素前面。
2.反应物之一盐必须是可溶性,即是溶液。
3.K Ca Na除外。
金属(前)+盐(可溶) 金属(后)+盐
4. Fe反应只能生成亚铁(+2)盐。
①与氧气反应
②活泼金属 + 酸 → 盐 + 氢气
条件 活泼金属:
酸:
③金属 + 盐→ 新金属 + 新盐
条件 金属:
盐:
总结:金属的化学性质
H前金属
稀盐酸、稀硫酸
不能为浓硫酸、硝酸
前置换后(除K、Ca、Na)
可溶
例1.下列化学方程式正确的是( )
A.Cu+2HCl?CuCl2+H2
B.2Fe+6HCl?2FeCl3+3H2
C.Zn+2HNO3 ? Zn(NO3)2+H2
D.Mg+H2SO4(稀)?MgSO4+H2
D
例2:不能由金属跟稀硫酸直接反应制得的物质是( )
MgSO4 B. FeSO4
C. CuSO4 D. Al2(SO4)3
C
例4:将锌片投入下列盐溶液反应后, 使溶液质量减轻的是( )
A. MgCl2
B. CuCl2
C. Hg (NO3)2
D. Al(NO3)3
C
例5.下列化学方程式正确的是( )
A.Cu+FeSO4 ? CuSO4+Fe B.Zn+Mg(NO3)2 ? Zn(NO3)2+Mg
C.Mg+CuSO4? MgSO4+Cu
D. Cu+2AgCl ? CuCl2+2Ag
C
例1.有A,B,C三种金属,只有C不与盐酸反应,B可以从A的盐溶液中置换出A,它们的活动性由强到弱的排列顺序是_______________
B>A>C
结论:用金属A置换金属B,若能反应,则A的活动性大于B,反之则小。
例2.要验证锌、铁、铜三种金属的活动性顺序,可选用下列哪组试剂( )
A. Cu,FeCl2,ZnCl2 B. Fe,CuSO4,ZnSO4
C. Fe,Cu,ZnCl2 D .Zn,Cu,FeSO4
B D
常用方法:(1)前、后金属,中间金属盐溶液
(2)中间金属,前后金属盐溶液
1、下列关于置换反应的说法错误的是( )
A、锌能够把硫酸中的氢气置换出来
B、置换反应生成物中只有两种物质
C、置换反应中生成物中一定有化合物
D、置换反应中反应物中一定有单质
巩固练习
A
2、下列金属放在足量同浓度、同质量的稀硫酸中,反应速度最快的是( )
A、铜片 B、镁片
C、锌片 D、铁片
3、相同质量的Mg、Fe跟足量盐酸反应,产生H2最多的是( )
A、一样多 B、Mg
C、Fe D、无法判断
B
B
4、相同物质的量的Fe、Zn跟足量盐酸反应,产生H2最多的是( )
A、一样多 B、Zn
C、 Fe D、无法判断
5、足量的铁、锌分别和质量相同、浓度相同的硫酸反应,产生氢气的质量是( )
A、一样多 B、铁最多
C、锌最多 D、无法判断
A
A
7、化学方程式书写正确的是( )
A、Fe + HCl → FeCl3 + H2↑
B、Zn + H2SO4 → ZnSO4 + H2↑
C、C + O2 → CO2
D、NaOH +H2SO4 → NaSO4 +H2O
B
8、下列溶液不能由金属与盐酸直接反应制得的是( )
A、 FeCl3溶液 B、ZnCl2溶液
C、 MgCl2溶液 D、FeCl2溶液
9、往5.6克混有少量铜粉的铁粉中加入足量硫酸,产生的H2的物质的量是( )
A、等于0.1mol B、小于0.1mol
C、大于0.1mol D、 无法确定
B
A
