沪教版(上海)初中化学九年级下册 6.1奇光异彩的金属- 金属的化学性质 课件(62张PPT)
文档属性
| 名称 | 沪教版(上海)初中化学九年级下册 6.1奇光异彩的金属- 金属的化学性质 课件(62张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-12-23 21:12:01 | ||
图片预览










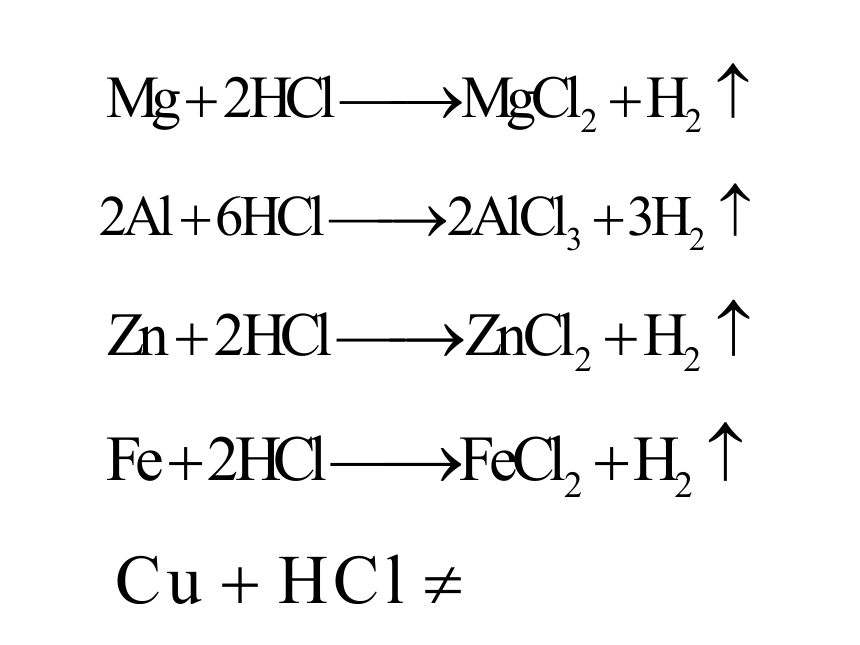
文档简介
一、金属的化学性质:
第一教时
1、金属和氧气的反应:
问题1:为什么日常生活中,铝器不用涂油漆,而铁器常常
需要涂油漆来防锈?
答:铝在空气中能与氧气反应,使其表面生成一层致密的氧化铝薄膜, 从而阻止里层的铝进一步被氧化,所以铝器本身有良好的抗腐蚀性能;而铁在潮湿的空气中易生锈,疏松的铁锈不能阻止里层的铁继续被氧化,所以铁器需要涂油漆来防锈。
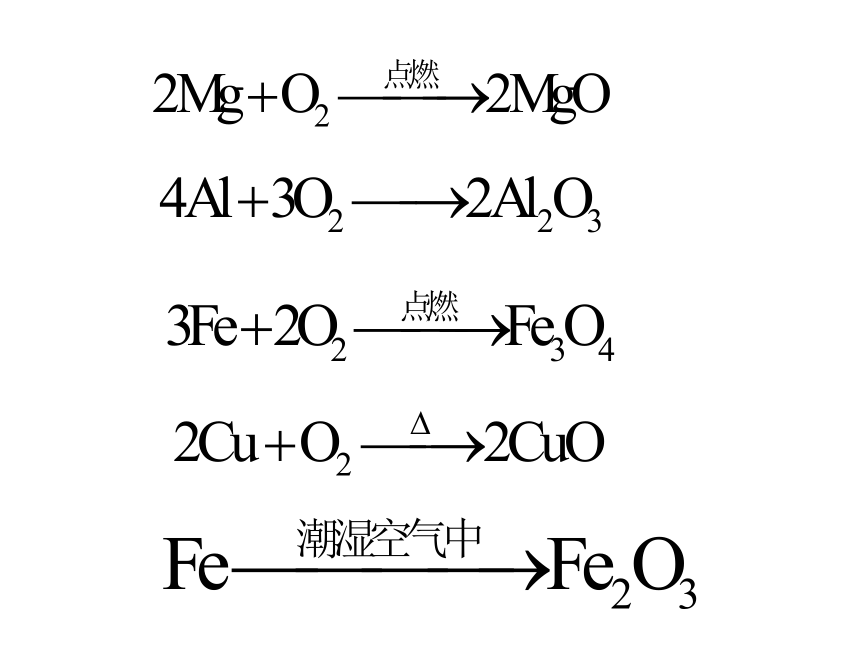
问题2:请写出下列物质与氧气反应的方程式:
Mg、Al、Fe、Cu
问题3:分析“真金不怕火炼”蕴含的化学原理。
应用:如何识别真金还是假金?
是指金那怕在高温下也很稳定,不会被空气中的氧气氧化,故其颜色也不会发生变化,并不是指高温下它不能熔化。
1、金属+氧气
小结:
金属氧化物
(化合反应)
注意:大部分金属(除金、铂外)都能与氧气反应生成金属氧化物,只是难易程度不同。
2、金属和酸的反应:(不包括浓硫酸和硝酸)
镁与盐酸
锌与盐酸
铁与盐酸
铜放入盐酸中
A:金属与稀HCl的反应
讨论:观察此图,你有何看法?
A:金属与稀HCl的反应
金属与稀HCl
化学方程式
现 象
镁与稀盐酸
铝与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
A:金属与稀HCl的反应
金属与稀HCl
现 象
镁与稀盐酸
产生大量气泡,反应最快
铝与稀盐酸
产生大量气泡,反应较快
锌与稀盐酸
产生许多气泡,反应快
铁与稀盐酸
产生少量气泡,反应较慢,溶液由无色变为浅绿色
铜与稀盐酸
无气泡产生(无明显现象)
B:金属与稀H2SO4的反应
金属与稀H2SO4
现 象
化学方程式
镁与稀硫酸
产生大量气泡,反应最快
铝与稀硫酸
产生大量气泡,反应较快
锌与稀硫酸
产生许多气泡,反应快
铁与稀硫酸
产生少量气泡,反应较慢,溶液由无色变为浅绿色
铜与稀硫酸
无明显现象
m(氢气)
t(时间)
0
若用镁,反应速度太快难以控制;若用铁反应太慢时间太长;而锌的反应速度适中,便于收集气体。
思考: 实验室制取氢气时,为什么选用的金属是锌粒而不是镁或铁?
*置换反应:
由一种单质跟一种化合物反应,生成另一种单质与另一种化合物的反应。
下列哪些反应是置换反应?
注意:有些化学反应不属于四种基本类型中的任何一种。如:
2、金属+酸
小结:
注意点:
①、反应的基本类型为---
(单质铁发生置换反应后---);
②、这里的金属指的是---,酸一般指的是---;
③、当金属与浓硫酸或硝酸反应时,生成的气体就 不是氢气,即不能发生置换反应。
盐+氢气
(置换反应)
m(氢气)
t(时间)
0
3、金属与某些盐溶液的反应:
第二教时
①、
现象:
铁片表面覆盖了一层红色的固体。
(湿法炼铜)
②、
现象:
铜丝表面覆盖了一层银白色固体,溶液由无色逐渐变为蓝色。
3、金属+盐(溶液)
小结:
新盐 + 新金属
(置换反应)
二、金属活动性顺序:
探究(1)
比较镁、锌、铁、铜的活动性强弱
前半部分
金属
稀盐酸
现象
反应的化学方程式
镁
锌
铁
铜
Cu + HCl →
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
Mg + 2HCl → MgCl2 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
金属活动性:
Mg>Zn>Fe> > Cu
﹖
H
H
探究(2)
铜、铝、银的活动性比较:
探究(2)
实 验
反应方程式
现 象
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
铜、铝、银的活动性比较:
铝与硫酸铜溶液的反应
铜与硝酸银溶液的反应
探究(2)
铜、铝、银的活动性比较:
实验
现象
反应的化学方程式
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
铝丝表面覆盖一层红色固体,溶液由蓝色逐渐变为无色。
2Al + 3CuSO4→Al2(SO4)3 + 3Cu
根据实验填写表格:
_______
Cu +2Ag NO3 →Cu(NO3)2 + 2Ag
铜丝表面覆盖一层银白色的固体,溶液由无色逐渐变为蓝色。
无明显现象
Al > Cu > Ag
思考:最后一个实验有必要吗?
下一步
Fe>Cu>Ag
铁、铜、银的活动性比较:
探究(3)
常见金属的活动性顺序: 书p33页
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强到弱
锡 铅 铂 金
金属活动性(还原性)由强到弱
Na
Mg Al Zn Fe Sn Pb
(H)
Cu Hg Ag Pt Au
1、只有排在氢前面的金属才能置换出酸(盐酸或稀硫酸)中的氢,从而产生氢气;排在氢后面的金属不能置换出酸中的氢。
2、只有排在前面的金属才能把排在它后面的金属从它们的盐溶液中置换出来。(此规律与金属与氢的相对位置无关)
K Ca
二、金属活动性顺序
主要应用:
应用注意点:
2、金属和盐反应时,反应物盐必须是可溶性的溶液,否则就不能反应;如铜与氯化银就不能反应。
1、在其它条件相同下,越活泼的金属反应越剧烈(即速度越快);但生成氢气的量的多少与活动性强弱是无关的。
应用注意点:
3、因为钾、钙、钠太活泼,所以当它们放入盐溶液中时,会先与水反应而不会把排在后面的金属置换出来;
4、如果某一种金属能把某含两种盐溶液的混合液中的金属(离子)都能置换出来,那么越是不活泼的金属越先被置换出来。
(两种金属的活动性相差越大,就越容易发生置换反应。)
如:足量的铁放入AgNO3、 Cu(NO3)2的混合溶液中,请写出先后的反应式:
如:足量的铁放入AgNO3、 Cu(NO3)2的混合溶液中,请写出先后的反应式:
(即活动性相差越大,越易发生反应。)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①
②
第三教时
即:足量的铁先把银置换出来,直到银全部被置换出来后,再把铜全部置换出来。
(即活动性相差越大,越易发生反应。)
知识应用1
知识应用2
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
知识应用2
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
典 型 习 题
1、 把一小片锌片分别放入到下列溶液中,片刻后取出,锌片质量不变的是( );锌片质量增大的是( );溶液质量增大的是( )。
A 、 CuSO4 B、 H2SO4
C 、 Al2(SO4)3 D 、 AgNO3
E 、 NaCl F 、 HCl
[思考] BF、CE的结果说明了什么?
空12行
2 、向某混合液(含2molAgNO3、 1mol Cu(NO3)2)中加入一定量的铁粉,充分反应后,请分析最终过滤后滤液和滤渣的成分。(请假设Fe为0.5mol、 1mol、 1.5mol 、2mol 、3mol 五种情况加以讨论)
典 型 习 题 分 析
1、 把一小片锌片分别放入到下列溶液中,片刻后取出,锌片质量不变的是( );锌片质量增大的是( );溶液质量增大的是( )。
A 、 CuSO4 B、 H2SO4
C 、 Al2(SO4)3 D 、 AgNO3
E 、 NaCl F 、 HCl
[思考] BF、CE的结果说明了什么?
实验说明
A 、 CuSO4 B、 H2SO4 C 、 Al2(SO4)3
D 、 AgNO3 E 、 NaCl F 、 HCl
65 64
65 216
金属质量减小,溶液质量增大。
金属质量增大,溶液质量减小。
>
<
金属质量一定减小,溶液质量增大。
65 0
同B的分析
两者质量均不变。
同C的分析
1、把一小片锌片分别放入到下列溶液中,片刻后取出,锌片质量不变的是( );锌片质量增大的是( );溶液质量增大的是( )。
A 、 CuSO4
B、 H2SO4
C 、 Al2(SO4)3
D 、 AgNO3
E 、 NaCl
F 、 HCl
[思考] BF、CE的结果说明了什么?
C、E
D
A、B、F
2 、向某混合液(含2molAgNO3、 1mol Cu(NO3)2)中加入一定量的铁粉,充分反应后,请分析最终过滤后滤液和滤渣的成分。(请假设Fe为0.5mol、 1mol、 1.5mol 、2mol 、3mol 五种情况加以讨论)
若铁足量:先进行置换银的反应,直到银全部被置换出来后,再进行置换铜的反应。
①
②
2 、向某混合液(含2molAgNO3、
1mol Cu(NO3)2)中加入一定量的铁粉:
1 : 2
1 : 1
a 、 假设0.5mol Fe:
①
②
× √ √ √
只发生①
滤渣:
滤液:
a:
a :
①
②
× × √ √
b、 假设1mol Fe:
只发生①,且恰好完成。
滤渣:
滤液:
b:
b:
①
②
× × √ √
× √ √ √
c、 假设1.5mol Fe:
两个均发生。
滤渣:
滤液:
c :
c :
①
②
d、 假设2mol Fe:
两个反应均恰好完成。
滤渣:
滤液:
× × √ √
× × √ √
d:
d:
①
②
两个均发生。
滤渣:
滤液:
√ × √ √
√ × √ √
e、 假设3mol Fe:
e:
e:
1、不管什么情况滤液和滤渣中分别一定有什么物质?为什么?
反 思
2、请设计一简单实验来证明滤渣中是否含有铁。
练习:
1、判断下列化学方程式书写正确的是( )
A、Cu+2HCl→CuCl2+H2↑
B、Zn+2HNO3→Zn(NO3)2+H2↑
C、2Fe+6HCl→2FeCl3+3H2↑
D、Mg+H2SO4→MgSO4+H2↑
D
2、向含有氯化铜、氯化锌、盐酸的溶液中撒入过量的铁粉,反应后溶液中一定有( ) 。
A、ZnCl2、HCl B、FeCl2、CuCl2
C、CuCl2、HCl D、ZnCl2、FeCl2
滤液
2、向含有氯化铜、氯化锌、盐酸的溶液中撒入过量的铁粉,
√ × √ √
√ × √ √
D
反应后溶液 中一定有( ) 。
√
3、如果用最简单的方法,证明锌、银、(H)、铜的活动性顺序,至少需要选用下列物质的 .
(1)Zn (2)Ag (3)Cu
(4)CuSO4 (5)稀硫酸
(6)AgNO3 (7)FeSO4 溶液
1. 3 .5 .6
第一教时
1、金属和氧气的反应:
问题1:为什么日常生活中,铝器不用涂油漆,而铁器常常
需要涂油漆来防锈?
答:铝在空气中能与氧气反应,使其表面生成一层致密的氧化铝薄膜, 从而阻止里层的铝进一步被氧化,所以铝器本身有良好的抗腐蚀性能;而铁在潮湿的空气中易生锈,疏松的铁锈不能阻止里层的铁继续被氧化,所以铁器需要涂油漆来防锈。
问题2:请写出下列物质与氧气反应的方程式:
Mg、Al、Fe、Cu
问题3:分析“真金不怕火炼”蕴含的化学原理。
应用:如何识别真金还是假金?
是指金那怕在高温下也很稳定,不会被空气中的氧气氧化,故其颜色也不会发生变化,并不是指高温下它不能熔化。
1、金属+氧气
小结:
金属氧化物
(化合反应)
注意:大部分金属(除金、铂外)都能与氧气反应生成金属氧化物,只是难易程度不同。
2、金属和酸的反应:(不包括浓硫酸和硝酸)
镁与盐酸
锌与盐酸
铁与盐酸
铜放入盐酸中
A:金属与稀HCl的反应
讨论:观察此图,你有何看法?
A:金属与稀HCl的反应
金属与稀HCl
化学方程式
现 象
镁与稀盐酸
铝与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
A:金属与稀HCl的反应
金属与稀HCl
现 象
镁与稀盐酸
产生大量气泡,反应最快
铝与稀盐酸
产生大量气泡,反应较快
锌与稀盐酸
产生许多气泡,反应快
铁与稀盐酸
产生少量气泡,反应较慢,溶液由无色变为浅绿色
铜与稀盐酸
无气泡产生(无明显现象)
B:金属与稀H2SO4的反应
金属与稀H2SO4
现 象
化学方程式
镁与稀硫酸
产生大量气泡,反应最快
铝与稀硫酸
产生大量气泡,反应较快
锌与稀硫酸
产生许多气泡,反应快
铁与稀硫酸
产生少量气泡,反应较慢,溶液由无色变为浅绿色
铜与稀硫酸
无明显现象
m(氢气)
t(时间)
0
若用镁,反应速度太快难以控制;若用铁反应太慢时间太长;而锌的反应速度适中,便于收集气体。
思考: 实验室制取氢气时,为什么选用的金属是锌粒而不是镁或铁?
*置换反应:
由一种单质跟一种化合物反应,生成另一种单质与另一种化合物的反应。
下列哪些反应是置换反应?
注意:有些化学反应不属于四种基本类型中的任何一种。如:
2、金属+酸
小结:
注意点:
①、反应的基本类型为---
(单质铁发生置换反应后---);
②、这里的金属指的是---,酸一般指的是---;
③、当金属与浓硫酸或硝酸反应时,生成的气体就 不是氢气,即不能发生置换反应。
盐+氢气
(置换反应)
m(氢气)
t(时间)
0
3、金属与某些盐溶液的反应:
第二教时
①、
现象:
铁片表面覆盖了一层红色的固体。
(湿法炼铜)
②、
现象:
铜丝表面覆盖了一层银白色固体,溶液由无色逐渐变为蓝色。
3、金属+盐(溶液)
小结:
新盐 + 新金属
(置换反应)
二、金属活动性顺序:
探究(1)
比较镁、锌、铁、铜的活动性强弱
前半部分
金属
稀盐酸
现象
反应的化学方程式
镁
锌
铁
铜
Cu + HCl →
放出气泡最迅速,反应最剧烈。
放出气泡速度次之,反应
较为剧烈。
放出气泡速度最慢,反应较为缓和。
不反应
Mg + 2HCl → MgCl2 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
金属活动性:
Mg>Zn>Fe> > Cu
﹖
H
H
探究(2)
铜、铝、银的活动性比较:
探究(2)
实 验
反应方程式
现 象
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
铜、铝、银的活动性比较:
铝与硫酸铜溶液的反应
铜与硝酸银溶液的反应
探究(2)
铜、铝、银的活动性比较:
实验
现象
反应的化学方程式
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
铝丝表面覆盖一层红色固体,溶液由蓝色逐渐变为无色。
2Al + 3CuSO4→Al2(SO4)3 + 3Cu
根据实验填写表格:
_______
Cu +2Ag NO3 →Cu(NO3)2 + 2Ag
铜丝表面覆盖一层银白色的固体,溶液由无色逐渐变为蓝色。
无明显现象
Al > Cu > Ag
思考:最后一个实验有必要吗?
下一步
Fe>Cu>Ag
铁、铜、银的活动性比较:
探究(3)
常见金属的活动性顺序: 书p33页
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强到弱
锡 铅 铂 金
金属活动性(还原性)由强到弱
Na
Mg Al Zn Fe Sn Pb
(H)
Cu Hg Ag Pt Au
1、只有排在氢前面的金属才能置换出酸(盐酸或稀硫酸)中的氢,从而产生氢气;排在氢后面的金属不能置换出酸中的氢。
2、只有排在前面的金属才能把排在它后面的金属从它们的盐溶液中置换出来。(此规律与金属与氢的相对位置无关)
K Ca
二、金属活动性顺序
主要应用:
应用注意点:
2、金属和盐反应时,反应物盐必须是可溶性的溶液,否则就不能反应;如铜与氯化银就不能反应。
1、在其它条件相同下,越活泼的金属反应越剧烈(即速度越快);但生成氢气的量的多少与活动性强弱是无关的。
应用注意点:
3、因为钾、钙、钠太活泼,所以当它们放入盐溶液中时,会先与水反应而不会把排在后面的金属置换出来;
4、如果某一种金属能把某含两种盐溶液的混合液中的金属(离子)都能置换出来,那么越是不活泼的金属越先被置换出来。
(两种金属的活动性相差越大,就越容易发生置换反应。)
如:足量的铁放入AgNO3、 Cu(NO3)2的混合溶液中,请写出先后的反应式:
如:足量的铁放入AgNO3、 Cu(NO3)2的混合溶液中,请写出先后的反应式:
(即活动性相差越大,越易发生反应。)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①
②
第三教时
即:足量的铁先把银置换出来,直到银全部被置换出来后,再把铜全部置换出来。
(即活动性相差越大,越易发生反应。)
知识应用1
知识应用2
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
知识应用2
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
典 型 习 题
1、 把一小片锌片分别放入到下列溶液中,片刻后取出,锌片质量不变的是( );锌片质量增大的是( );溶液质量增大的是( )。
A 、 CuSO4 B、 H2SO4
C 、 Al2(SO4)3 D 、 AgNO3
E 、 NaCl F 、 HCl
[思考] BF、CE的结果说明了什么?
空12行
2 、向某混合液(含2molAgNO3、 1mol Cu(NO3)2)中加入一定量的铁粉,充分反应后,请分析最终过滤后滤液和滤渣的成分。(请假设Fe为0.5mol、 1mol、 1.5mol 、2mol 、3mol 五种情况加以讨论)
典 型 习 题 分 析
1、 把一小片锌片分别放入到下列溶液中,片刻后取出,锌片质量不变的是( );锌片质量增大的是( );溶液质量增大的是( )。
A 、 CuSO4 B、 H2SO4
C 、 Al2(SO4)3 D 、 AgNO3
E 、 NaCl F 、 HCl
[思考] BF、CE的结果说明了什么?
实验说明
A 、 CuSO4 B、 H2SO4 C 、 Al2(SO4)3
D 、 AgNO3 E 、 NaCl F 、 HCl
65 64
65 216
金属质量减小,溶液质量增大。
金属质量增大,溶液质量减小。
>
<
金属质量一定减小,溶液质量增大。
65 0
同B的分析
两者质量均不变。
同C的分析
1、把一小片锌片分别放入到下列溶液中,片刻后取出,锌片质量不变的是( );锌片质量增大的是( );溶液质量增大的是( )。
A 、 CuSO4
B、 H2SO4
C 、 Al2(SO4)3
D 、 AgNO3
E 、 NaCl
F 、 HCl
[思考] BF、CE的结果说明了什么?
C、E
D
A、B、F
2 、向某混合液(含2molAgNO3、 1mol Cu(NO3)2)中加入一定量的铁粉,充分反应后,请分析最终过滤后滤液和滤渣的成分。(请假设Fe为0.5mol、 1mol、 1.5mol 、2mol 、3mol 五种情况加以讨论)
若铁足量:先进行置换银的反应,直到银全部被置换出来后,再进行置换铜的反应。
①
②
2 、向某混合液(含2molAgNO3、
1mol Cu(NO3)2)中加入一定量的铁粉:
1 : 2
1 : 1
a 、 假设0.5mol Fe:
①
②
× √ √ √
只发生①
滤渣:
滤液:
a:
a :
①
②
× × √ √
b、 假设1mol Fe:
只发生①,且恰好完成。
滤渣:
滤液:
b:
b:
①
②
× × √ √
× √ √ √
c、 假设1.5mol Fe:
两个均发生。
滤渣:
滤液:
c :
c :
①
②
d、 假设2mol Fe:
两个反应均恰好完成。
滤渣:
滤液:
× × √ √
× × √ √
d:
d:
①
②
两个均发生。
滤渣:
滤液:
√ × √ √
√ × √ √
e、 假设3mol Fe:
e:
e:
1、不管什么情况滤液和滤渣中分别一定有什么物质?为什么?
反 思
2、请设计一简单实验来证明滤渣中是否含有铁。
练习:
1、判断下列化学方程式书写正确的是( )
A、Cu+2HCl→CuCl2+H2↑
B、Zn+2HNO3→Zn(NO3)2+H2↑
C、2Fe+6HCl→2FeCl3+3H2↑
D、Mg+H2SO4→MgSO4+H2↑
D
2、向含有氯化铜、氯化锌、盐酸的溶液中撒入过量的铁粉,反应后溶液中一定有( ) 。
A、ZnCl2、HCl B、FeCl2、CuCl2
C、CuCl2、HCl D、ZnCl2、FeCl2
滤液
2、向含有氯化铜、氯化锌、盐酸的溶液中撒入过量的铁粉,
√ × √ √
√ × √ √
D
反应后溶液 中一定有( ) 。
√
3、如果用最简单的方法,证明锌、银、(H)、铜的活动性顺序,至少需要选用下列物质的 .
(1)Zn (2)Ag (3)Cu
(4)CuSO4 (5)稀硫酸
(6)AgNO3 (7)FeSO4 溶液
1. 3 .5 .6
